物质结构与性质 模块综合评价 (含解析)
文档属性
| 名称 | 物质结构与性质 模块综合评价 (含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 325.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-09 19:47:47 | ||
图片预览



文档简介
物质结构与性质 模块综合评价
一、 单项选择题(本题共14小题,每小题3分,共42分)
1. (2021·南通质检)高温炼铜的反应之一为2CuFeS2+O2===Cu2S+2FeS+SO2。下列有关化学用语的说法正确的是( )
A. 铜原子的核外电子排布式为[Ar]3d94s2
B. SO2分子空间结构为直线形
C. S2-的结构示意图
D. 质量数为18的氧原子可表示为O
2. (2021·驻马店期末)下列说法不正确的是( )
A. HCl分子中的共价键是s?p σ键
B. 电子云图中的小黑点表示电子在核外空间出现概率的多少
C. 在CS2分子中σ键与π键的数目之比是2∶1
D. 当镁原子由1s22s22p63s2→1s22s22p63p2时,镁原子由基态转化成激发态,这一过程中吸收能量
3. 下列各项所述的数字不是6的是( )
A. 在NaCl晶体中,与一个Na+最近的且距离相等的Cl-的个数
B. 在金刚石晶体中,最小的环上的碳原子个数
C. 在二氧化硅晶体中,最小的环上的原子个数
D. 在石墨晶体的层状结构中,最小的环上的碳原子个数
4. 下列表达方式正确的是( )
A. 24Cr的外围电子排布式:3d44s2
B. CO2的空间结构模型:
C. 基态碳原子的外围电子的轨道表示式为
D. N2的电子式:N N
5. (2021·响水中学期中)2010年诺贝尔物理学奖授予英国曼彻斯特大学科学家安德烈·海姆和康斯坦丁·诺沃肖洛夫,以表彰他们在石墨烯材料方面的卓越研究。石墨烯是目前科技研究的热点,可看作将石墨的层状结构一层一层的剥开得到的单层碳原子(结构如图所示)。将氢气加入石墨烯中开发出一种具有突破性的新材料石墨烷,下列说法中,正确的是( )
A. 石墨烯是高分子化合物
B. 石墨烯与石墨烷互为同素异形体
C. 一定条件下石墨烯可与H2发生加成反应
D. 根据结构示意图可知,石墨烯不能导电
6. (2022·苏北四市高三期末调研)短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为18,X、Z基态原子的p轨道上均有2个未成对电子,W与X位于同一主族。下列说法正确的是 ( )
A. WX2分子为极性分子
B. 元素电负性:Z>W
C. 原子半径:r(W)>r(Z)>r(Y)
D. 最高价氧化物对应水化物的酸性:Z>W
7. (2021·安阳林州一中质检)SiO2晶体的部分结构如图所示,关于该晶体下列说法错误的是( )
A. Si原子杂化类型为sp3
B. Si、O的原子个数比为1∶4
C. Si原子数目与Si—O键数目比为1∶4
D. SiO2晶体中最小环为12元环
8. (2021·厦门外国语学校月考)某物质的实验式为PtCl4·2NH3,其水溶液不导电。加入AgNO3溶液也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中,正确的是 ( )
A. 配合物中中心原子的电荷数为6 B. 该配合物可能是平面正方形结构
C. Cl-和NH3分子均与Pt4+形成配位 D. 该配合物的配位体只有NH3
9. (2022·如皋高三质量调研)前3周期主族元素X、Y、Z、W的原子序数依次增大,X是空气中含量最多的元素,基态时Y最外层电子数是次外层的四分之一,基态Z原子3p轨道上只有1个电子,W与X位于同一主族。下列说法正确的是( )
A. 原子半径:r(W)>r(Z)>r(Y)>r(X)
B. 第一电离能:I1(X)>I1(Y)>I1(Z)
C. X的简单气态氢化物分子的空间结构为平面三角形
D. 最高价氧化物对应水化物的碱性:Z>Y
10. (2022·苏州高三期末)氯元素具有多种化合价,可形成Cl-、ClO-、ClO、ClO和ClO等离子,在一定条件下能发生相互转化。在新型催化剂RuO2作用下,O2氧化HCl可获得Cl2:4HCl(g)+O2(g)===2Cl2(g)+2H2O(g) ΔH=-116 kJ·mol-1。下列有关Cl-、ClO、ClO和 ClO的说法正确的是( )
A. ClO中心原子轨道的杂化类型为sp2
B. ClO的空间结构为平面正三角形
C. ClO与 ClO的键角相等
D. Cl-提供孤电子对与Cu2+可形成 CuCl
11. (2022·扬州中学高三开学考试)氮及其化合物在生产、生活中具有广泛用途。NH3是一种重要的化工原料,主要用于化肥工业,也广泛用于硝酸、纯碱等工业;合成氨反应为N2+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。已知NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4。下列说法不正确的是( )
A. 该配合物中阴离子空间结构为正四面体形
B. 配离子为[Fe(NO)(H2O)5]2+,配位数为6
C. Fe2+被氧化为Fe3+,失去的电子位于3d轨道
D. H2O分子是含有极性键的非极性分子
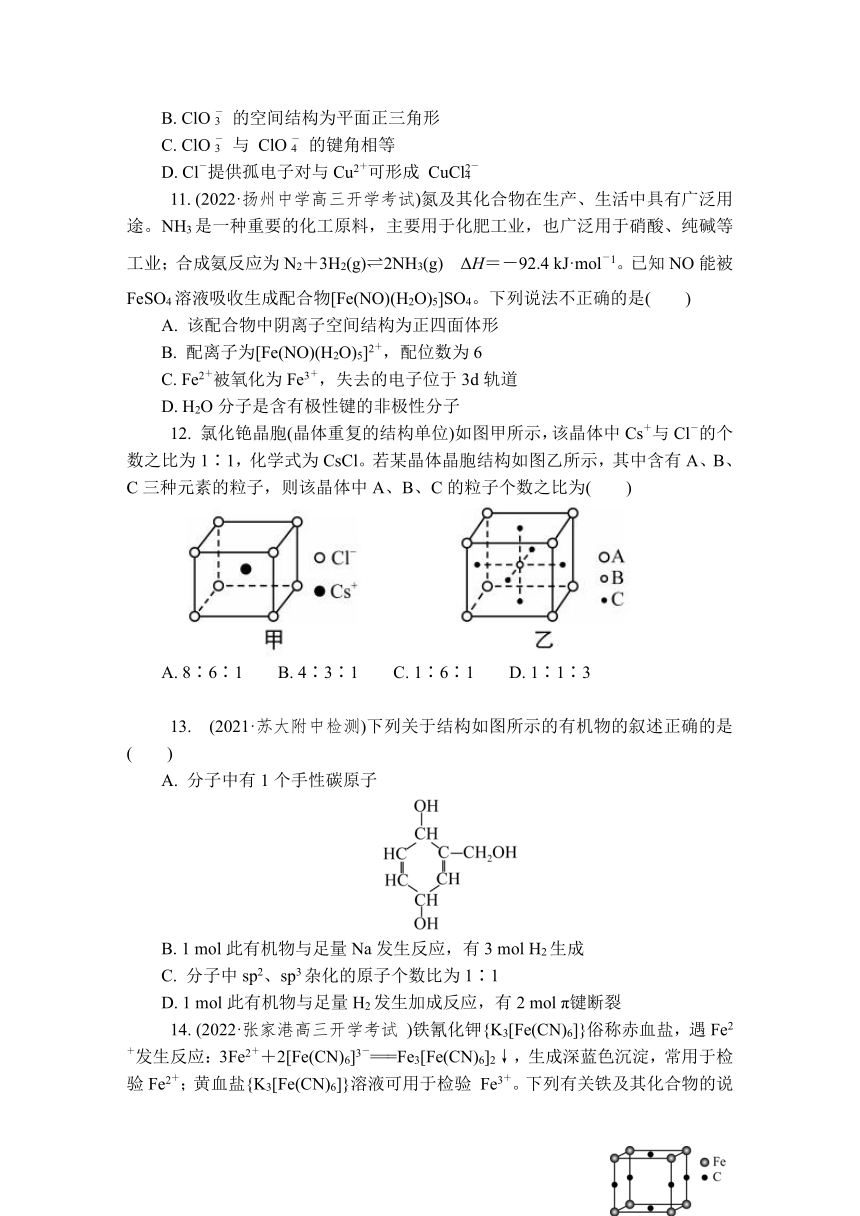
12. 氯化铯晶胞(晶体重复的结构单位)如图甲所示,该晶体中Cs+与Cl-的个数之比为1∶1,化学式为CsCl。若某晶体晶胞结构如图乙所示,其中含有A、B、C三种元素的粒子,则该晶体中A、B、C的粒子个数之比为( )
A. 8∶6∶1 B. 4∶3∶1 C. 1∶6∶1 D. 1∶1∶3
13. (2021·苏大附中检测)下列关于结构如图所示的有机物的叙述正确的是( )
A. 分子中有1个手性碳原子
B. 1 mol此有机物与足量Na发生反应,有3 mol H2生成
C. 分子中sp2、sp3杂化的原子个数比为1∶1
D. 1 mol此有机物与足量H2发生加成反应,有2 mol π键断裂
14. (2022·张家港高三开学考试 )铁氰化钾{K3[Fe(CN)6]}俗称赤血盐,遇Fe2+发生反应:3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓,生成深蓝色沉淀,常用于检验Fe2+;黄血盐{K3[Fe(CN)6]}溶液可用于检验 Fe3+。下列有关铁及其化合物的说法正确的是( )
A. Fe元素位于元素周期表的ⅦB族
B. 基态Fe2+外围电子排布式为3d54s1
C. 赤血盐中提供空轨道形成配位键的是 Fe3+
D. 若黄血盐受热分解产物之一的晶胞结构如图所示,则其化学式为Fe4C3
二、 非选择题(本题共4题,共58分)
15. (14分)(2021·东台创新高级中学检测)单晶边缘纳米催化剂技术为工业上有效利用二氧化碳提供了一条经济可行的途径,其中单晶氧化镁负载镍催化剂表现出优异的抗积碳和抗烧结性能。
(1) 基态镍原子的核外电子排布式为____________________。
(2) 氧化镁载体及镍催化反应中涉及CH4、CO2和CH3OH等物质。元素Mg、O和C的第一电离能由小到大排序为________________﹔在上述三种物质的分子中碳原子杂化类型不同于其他两种的是________,立体构型为正四面体的分子是________,三种物质中沸点最高的是CH3OH,其原因是______________________________________________________________________。
(3) Ni与CO在60~80 ℃时反应生成Ni(CO)4气体,在Ni(CO)4分子中与Ni形成配位键的原子是________,Ni(CO)4晶体类型是________。
16. (15分)(2021·木渎高级中学质检)物质的组成、结构决定着物质的性质与变化,我们必须在原子、分子层次上深入地研究物质的结构。Q、R、X、Y、W、Z六种元素的原子序数依次增大。已知:
①Q、R、X、Y均为短周期主族元素;
②Z的原子序数为29;
③W是前4周期元素中核外电子未成对电子数最多的;
④Y原子外围电子排布msnmpn(m≠n);
⑤R原子核外L层电子数为奇数;
⑥Q、X原子最外层p轨道的电子数分别为2和4。
请回答下列问题:
(1) W原子的原子结构示意图为____________。
(2) Z元素位于元素周期表________区;Z2+的核外电子排布式是______________。
(3) Q的最高价氧化物的电子式是________。
(4) Q、Y形成的最简单气态氢化物的热稳定性:________>________(填化学式)。
(5) Q、R、X三种元素的第一电离能数值由小到大的顺序为________(用元素符号填空)。
(6) 解释YQ晶体和Y晶体熔点高低的原因: ________________________________________________________________
________________________________________________________________。
(7) 六种元素中,电负性最大与最小的两种非金属元素形成的化合物是______________(填化学式)。
17. (15分)(2021·如皋中学阶段考试) 铁及其化合物在生活中有广泛应用。
(1) Fe2+基态的外围电子排布式为____________________。
(2) 实验室用Fe3+检验苯酚。苯酚分子中碳原子的杂化方式为________。
(3) 以Fe和BN为原料合成的铁氮化合物在光电子器材领域有广泛应用。
①以氨硼烷(NH3·BH3)为原料可以获得BN。氨硼烷的结构式为________(配位键用“→”表示),氨硼烷易溶于水,其主要原因是______________________________________________________________________。
②氨气是合成氨硼烷原料之一。NH3属于________(填“极性”或“非极性”)分子。
③如图为Fe与N所形成的一种化合物的基本结构单元,该化合物的化学式为________。
18. (14分)(2021·木渎高级中学质检)在5氨基四唑()中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
(1) 基态Ga原子核外电子排布式为____________; N原子的外围电子轨道表示式为________。
(2) 在1 mol 5氨基四唑中含有的σ键的数目为________。
(3) 以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构是用碳原子取代氮化钛晶胞(结构如右图)顶点的氮原子,这种碳氮化钛化合物的化学式为________________。
模块综合评价
1. D 解析:根据洪特规则,铜原子的核外电子排布式为[Ar]3d104s1,A错误;SO2价电子对数是3,有1个孤电子对,分子空间结构为V形,B错误;S2-的质子数为16,结构示意图,C错误;氧原子的质子数是8,质量数为18的氧原子可表示为8O,D正确。
2. C 解析:HCl分子中的共价键是H原子的s轨道与Cl原子的3p轨道形成的sp σ键,A正确;电子云图中的小黑点表示电子在核外空间出现概率的多少,小黑点越密,表示电子出现的频率越高,B正确;CS2的结构式是S===C===S,σ键与π键的数目之比是1∶1,C错误;当镁原子由1s22s22p63s2→1s22s22p63p2时,镁原子由基态转化成激发态,电子能量增大,这一过程中吸收能量,D正确。
3. C 解析:二氧化硅是共价晶体,其中的硅原子数目与氧原子数目之比为1∶2,空间结构中每个单元环由6个硅原子和6个氧原子组成,C符合题意。
4. C 解析:24号元素Cr的外围电子排布式为3d54s1,3d轨道半充满状态能量低、稳定,A错误;二氧化碳是直线形,而不是V形,B错误;基态碳原子外围电子排布式为2s22p2,所以外围电子的轨道表示式为,C正确;N2的电子式为N N,D错误。
5. C 解析:石墨烯是单质,A错误;石墨烷是碳氢两种元素形成的化合物,二者不属于同素异形体,B错误;将氢气加入石墨烯中开发出一种具有突破性的新材料石墨烷,C正确;石墨烯可看作将石墨的层状结构一层一层的剥开得到的单层碳原子,石墨可导电,则石墨烯也可导电,D错误。
6. A 解析:短周期主族元素X、Y、Z、W的原子序数依次增大,X、Z基态原子的p轨道上均有2个未成对电子,W与X位于同一主族,则X为O元素、Z为Si元素、W为S元素;X、Y、Z、W的原子的最外层电子数之和为18,则Y为Mg元素。二氧化硫分子中硫原子的价层电子对数为3,孤对电子对数为1,分子的空间结构为V形,则二氧化硫为极性分子,A正确;元素的非金属性越强,电负性越大,硅元素的非金属性弱于硫元素,则硅元素的电负性小于硫元素,B错误;同周期元素,从左到右原子半径依次减小,则镁、硅、硫三种原子的原子半径最大的为镁原子,C错误;元素的非金属性越强,最高价氧化物对应水化物的酸性越强,硅元素的非金属性弱于硫元素,则硅酸的酸性弱于硫酸,D错误。
7. B 解析:由二氧化硅晶体结构图可知,每个Si原子形成4个Si—O键,则Si原子杂化类型为sp3,A正确;由二氧化硅晶体结构图可知,每个硅原子周围连有四个氧原子,每个氧原子周围连有2个硅原子,Si、O原子个数比为1∶2,B错误;由二氧化硅晶体结构图可知,每个硅原子周围连有四个氧原子,则Si原子数目与Si—O键数目比为1∶4,C正确;由二氧化硅晶体结构图可知,晶体中最小环上含有6个硅原子和6个氧原子,所以最小环上的原子数为12,D正确。
8. C 解析:配合物中中心原子Pt的电荷数为+4,A错误;由于Cl-和NH3是不同的配位体,所有该配合物不可能是平面正方形结构,B错误;根据题给信息,此化合物没有电离出Cl-和NH3分子,说明Cl-和NH3分子均与Pt4+配位,C正确;此化合物没有电离出Cl-,说明Cl-也是配位体,D错误。
9. B 解析:由题干信息可知,前3周期主族元素X、Y、Z、W的原子序数依次增大,X是空气中含量最多的元素,则X为N,基态时Y最外层电子数是次外层的四分之一,即Y为Mg,基态Z原子3p轨道上只有1个电子,故Z为Al,W与X位于同一主族,故W为P,据此分析解题。根据同一周期从左往右原子半径依次减小,同一主族从上往下原子半径依次增大可知,原子半径: r(Y)>r(Z)> r(W) >r(X),A错误;根据第一电离能同一周期从左往右呈增大趋势,ⅡA与ⅢA、ⅤA与ⅥA反常,同一主族从上往下第一电离能依次减小可知,第一电离能:I1(X)>I1(Y)>I1(Z),B正确;由分析可知,X为N,X的简单气态氢化物即NH3,NH3中N原子周围的价层电子对数为=4,有1对孤电子对,故该分子的空间结构为三角锥形,C错误;最高价氧化物对应水化物的碱性与金属性一致,同一周期从左往右金属性依次减弱,故最高价氧化物对应水化物的碱性: Y > Z,D错误。
10. D 解析:ClO中Cl的价层电子对数=2+=4,有两个孤电子对,属于sp3杂化,A错误;ClO中Cl的价层电子对数=3+(7+1-2×3)=4,含有一个孤电子对,则离子的空间结构为三角锥形,B错误;ClO与ClO中价层电子对数都是4,所以都采取sp3杂化,且孤对电子数分别为1、0,则离子中相邻两个Cl—O键间键角依次增大,C错误;Cl-提供孤电子对,Cu2+中存在空轨道,Cl-与Cu2+可形成 CuCl,D正确。
11. D 解析:配合物中阴离子为硫酸根离子,硫酸根离子中硫原子的价层电子对数为4,孤对电子对数为0,离子的空间结构为正四面体形,A正确;配离子[Fe(NO)(H2O)5]2+中亚铁离子为中心离子,一氧化氮和水为配位体,配位数为6,B正确;亚铁离子的价电子排布式为3d6,失去3d轨道上一个d电子被氧化为价电子排布式为3d5的铁离子,C正确;水分子的空间结构为V形,则水分子是含有极性键的极性分子,D错误。
12. D 解析:根据晶胞的均摊法,在此晶体的晶胞中有A:8×= 1个,B:1×1 = 1个,C:6×=3个,即N(A)∶N(B)∶N(C)=1∶1∶3,D正确。
13. D 解析:手性碳原子是指连有4个互不相同的原子或原子团的碳原子,故环上两个连接羟基的碳是手性碳原子,用“*”表示为,A错误;由题干可知,该有机物中含有3个醇羟基,故1 mol此有机物与足量Na发生反应,有1.5 mol H2生成,B错误;已知分子中双键所在的4个碳原子为sp2杂化,其余碳原子和氧原子为sp3杂化,分子中sp2、sp3杂化的原子个数比为4∶6=2∶3,C错误;分子中含有2个碳碳双键,与H2加成时是碳碳双键中的π键断裂,故1 mol此有机物与足量H2发生加成反应,有2 mol π键断裂,D正确。
14. C 解析: 基态Fe外围电子排布式为 3d64s2,则Fe元素位于元素周期表的Ⅷ族,A错误;基态Fe2+外围电子排布式为3d6,B错误;赤血盐中铁呈+3价,基态Fe3+外围电子排布式为 3d5,则提供空轨道形成配位键的是Fe3+,C正确;由晶胞结构可知,Fe原子处于晶胞顶点,晶胞中含有铁原子的个数为8×=1,C原子属于棱边面心上,晶胞中含有C原子数目为4×+2×=2,则其化学式为FeC2,D错误。
15. (1)1s22s22p63s23p63d84s2或[Ar]3d84s2
(2) Mg<C<O CO2 CH4 甲醇为极性分子,且甲醇分子间能形成氢键
(3) C 分子晶体
16. (1)
(2) ds [Ar]3d9 (3) ··C··
(4) CH4 SiH4 (5) C(6) SiC和Si均为共价晶体,C原子半径比Si原子半径小,Si—C键的键长比Si—Si键长短,共价键键能大,SiC熔点高
(7) SiO2
17. (1) 3d6 (2) sp2
(3) ①NHHHBHHH 氨硼烷分子与水分子间存在氢键 ②极性 ③ Fe4N
解析:(1) 铁元素的原子序数为26,失去2个电子形成亚铁离子,根据原子核外电子排布规律可知,亚铁离子的基态核外电子排布式为1s22s22p63s23p63d6 或[Ar]3d6;(2) 苯酚分子中苯环上的6个碳原子的杂化方式为sp2杂化;(3) ①氨硼烷中氮原子具有孤电子对,硼原子具有空轨道,氮原子能提供一对共用电子对给硼原子形成配位键,则氨硼烷的结构式为NHHHBHHH;氨硼烷中氮原子能与水分子间形成氢键,则氨硼烷能溶于水;氨硼烷分子与水分子间存在氢键;②氨气分子的空间结构为三角锥形,结构不对称,属于极性分子;③由晶胞结构可知,铁原子位于顶点和面心,个数为8×+6×=4,氮原子位于体心,个数为1,则晶胞中铁原子和氮原子的数目之比为4∶1,化学式为Fe4N。
18. (1) [Ar]3d104s24p1
(2) 9NA或9×6.02×1023 (3) Ti4CN3
解析:(1) Ga原子是31号元素,位于第4周期ⅢA族,与B同族,基态核外电子排布式为[Ar]3d104s24p1 ,N原子是7号元素,最外围有5个电子,外围电子轨道表示式为;(2) 形成双键的N原子的杂化方式是sp2,形成σ三个共价单键且含有一个孤电子对的N原子的杂化方式是sp3杂化;共价单键是σ键,共价双键中有一个σ键和一个π键,所以该分子中含有9个σ键,故在1 mol 5氨基四唑中含有的σ键的数目为9NA;(3) 根据均摊法可知,该晶胞中碳原子个数=8×=1,N原子个数=6×=3,Ti原子个数=1+12×=4,所以其化学式为Ti4CN3。
一、 单项选择题(本题共14小题,每小题3分,共42分)
1. (2021·南通质检)高温炼铜的反应之一为2CuFeS2+O2===Cu2S+2FeS+SO2。下列有关化学用语的说法正确的是( )
A. 铜原子的核外电子排布式为[Ar]3d94s2
B. SO2分子空间结构为直线形
C. S2-的结构示意图
D. 质量数为18的氧原子可表示为O
2. (2021·驻马店期末)下列说法不正确的是( )
A. HCl分子中的共价键是s?p σ键
B. 电子云图中的小黑点表示电子在核外空间出现概率的多少
C. 在CS2分子中σ键与π键的数目之比是2∶1
D. 当镁原子由1s22s22p63s2→1s22s22p63p2时,镁原子由基态转化成激发态,这一过程中吸收能量
3. 下列各项所述的数字不是6的是( )
A. 在NaCl晶体中,与一个Na+最近的且距离相等的Cl-的个数
B. 在金刚石晶体中,最小的环上的碳原子个数
C. 在二氧化硅晶体中,最小的环上的原子个数
D. 在石墨晶体的层状结构中,最小的环上的碳原子个数
4. 下列表达方式正确的是( )
A. 24Cr的外围电子排布式:3d44s2
B. CO2的空间结构模型:
C. 基态碳原子的外围电子的轨道表示式为
D. N2的电子式:N N
5. (2021·响水中学期中)2010年诺贝尔物理学奖授予英国曼彻斯特大学科学家安德烈·海姆和康斯坦丁·诺沃肖洛夫,以表彰他们在石墨烯材料方面的卓越研究。石墨烯是目前科技研究的热点,可看作将石墨的层状结构一层一层的剥开得到的单层碳原子(结构如图所示)。将氢气加入石墨烯中开发出一种具有突破性的新材料石墨烷,下列说法中,正确的是( )
A. 石墨烯是高分子化合物
B. 石墨烯与石墨烷互为同素异形体
C. 一定条件下石墨烯可与H2发生加成反应
D. 根据结构示意图可知,石墨烯不能导电
6. (2022·苏北四市高三期末调研)短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为18,X、Z基态原子的p轨道上均有2个未成对电子,W与X位于同一主族。下列说法正确的是 ( )
A. WX2分子为极性分子
B. 元素电负性:Z>W
C. 原子半径:r(W)>r(Z)>r(Y)
D. 最高价氧化物对应水化物的酸性:Z>W
7. (2021·安阳林州一中质检)SiO2晶体的部分结构如图所示,关于该晶体下列说法错误的是( )
A. Si原子杂化类型为sp3
B. Si、O的原子个数比为1∶4
C. Si原子数目与Si—O键数目比为1∶4
D. SiO2晶体中最小环为12元环
8. (2021·厦门外国语学校月考)某物质的实验式为PtCl4·2NH3,其水溶液不导电。加入AgNO3溶液也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中,正确的是 ( )
A. 配合物中中心原子的电荷数为6 B. 该配合物可能是平面正方形结构
C. Cl-和NH3分子均与Pt4+形成配位 D. 该配合物的配位体只有NH3
9. (2022·如皋高三质量调研)前3周期主族元素X、Y、Z、W的原子序数依次增大,X是空气中含量最多的元素,基态时Y最外层电子数是次外层的四分之一,基态Z原子3p轨道上只有1个电子,W与X位于同一主族。下列说法正确的是( )
A. 原子半径:r(W)>r(Z)>r(Y)>r(X)
B. 第一电离能:I1(X)>I1(Y)>I1(Z)
C. X的简单气态氢化物分子的空间结构为平面三角形
D. 最高价氧化物对应水化物的碱性:Z>Y
10. (2022·苏州高三期末)氯元素具有多种化合价,可形成Cl-、ClO-、ClO、ClO和ClO等离子,在一定条件下能发生相互转化。在新型催化剂RuO2作用下,O2氧化HCl可获得Cl2:4HCl(g)+O2(g)===2Cl2(g)+2H2O(g) ΔH=-116 kJ·mol-1。下列有关Cl-、ClO、ClO和 ClO的说法正确的是( )
A. ClO中心原子轨道的杂化类型为sp2
B. ClO的空间结构为平面正三角形
C. ClO与 ClO的键角相等
D. Cl-提供孤电子对与Cu2+可形成 CuCl
11. (2022·扬州中学高三开学考试)氮及其化合物在生产、生活中具有广泛用途。NH3是一种重要的化工原料,主要用于化肥工业,也广泛用于硝酸、纯碱等工业;合成氨反应为N2+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。已知NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4。下列说法不正确的是( )
A. 该配合物中阴离子空间结构为正四面体形
B. 配离子为[Fe(NO)(H2O)5]2+,配位数为6
C. Fe2+被氧化为Fe3+,失去的电子位于3d轨道
D. H2O分子是含有极性键的非极性分子
12. 氯化铯晶胞(晶体重复的结构单位)如图甲所示,该晶体中Cs+与Cl-的个数之比为1∶1,化学式为CsCl。若某晶体晶胞结构如图乙所示,其中含有A、B、C三种元素的粒子,则该晶体中A、B、C的粒子个数之比为( )
A. 8∶6∶1 B. 4∶3∶1 C. 1∶6∶1 D. 1∶1∶3
13. (2021·苏大附中检测)下列关于结构如图所示的有机物的叙述正确的是( )
A. 分子中有1个手性碳原子
B. 1 mol此有机物与足量Na发生反应,有3 mol H2生成
C. 分子中sp2、sp3杂化的原子个数比为1∶1
D. 1 mol此有机物与足量H2发生加成反应,有2 mol π键断裂
14. (2022·张家港高三开学考试 )铁氰化钾{K3[Fe(CN)6]}俗称赤血盐,遇Fe2+发生反应:3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓,生成深蓝色沉淀,常用于检验Fe2+;黄血盐{K3[Fe(CN)6]}溶液可用于检验 Fe3+。下列有关铁及其化合物的说法正确的是( )
A. Fe元素位于元素周期表的ⅦB族
B. 基态Fe2+外围电子排布式为3d54s1
C. 赤血盐中提供空轨道形成配位键的是 Fe3+
D. 若黄血盐受热分解产物之一的晶胞结构如图所示,则其化学式为Fe4C3
二、 非选择题(本题共4题,共58分)
15. (14分)(2021·东台创新高级中学检测)单晶边缘纳米催化剂技术为工业上有效利用二氧化碳提供了一条经济可行的途径,其中单晶氧化镁负载镍催化剂表现出优异的抗积碳和抗烧结性能。
(1) 基态镍原子的核外电子排布式为____________________。
(2) 氧化镁载体及镍催化反应中涉及CH4、CO2和CH3OH等物质。元素Mg、O和C的第一电离能由小到大排序为________________﹔在上述三种物质的分子中碳原子杂化类型不同于其他两种的是________,立体构型为正四面体的分子是________,三种物质中沸点最高的是CH3OH,其原因是______________________________________________________________________。
(3) Ni与CO在60~80 ℃时反应生成Ni(CO)4气体,在Ni(CO)4分子中与Ni形成配位键的原子是________,Ni(CO)4晶体类型是________。
16. (15分)(2021·木渎高级中学质检)物质的组成、结构决定着物质的性质与变化,我们必须在原子、分子层次上深入地研究物质的结构。Q、R、X、Y、W、Z六种元素的原子序数依次增大。已知:
①Q、R、X、Y均为短周期主族元素;
②Z的原子序数为29;
③W是前4周期元素中核外电子未成对电子数最多的;
④Y原子外围电子排布msnmpn(m≠n);
⑤R原子核外L层电子数为奇数;
⑥Q、X原子最外层p轨道的电子数分别为2和4。
请回答下列问题:
(1) W原子的原子结构示意图为____________。
(2) Z元素位于元素周期表________区;Z2+的核外电子排布式是______________。
(3) Q的最高价氧化物的电子式是________。
(4) Q、Y形成的最简单气态氢化物的热稳定性:________>________(填化学式)。
(5) Q、R、X三种元素的第一电离能数值由小到大的顺序为________(用元素符号填空)。
(6) 解释YQ晶体和Y晶体熔点高低的原因: ________________________________________________________________
________________________________________________________________。
(7) 六种元素中,电负性最大与最小的两种非金属元素形成的化合物是______________(填化学式)。
17. (15分)(2021·如皋中学阶段考试) 铁及其化合物在生活中有广泛应用。
(1) Fe2+基态的外围电子排布式为____________________。
(2) 实验室用Fe3+检验苯酚。苯酚分子中碳原子的杂化方式为________。
(3) 以Fe和BN为原料合成的铁氮化合物在光电子器材领域有广泛应用。
①以氨硼烷(NH3·BH3)为原料可以获得BN。氨硼烷的结构式为________(配位键用“→”表示),氨硼烷易溶于水,其主要原因是______________________________________________________________________。
②氨气是合成氨硼烷原料之一。NH3属于________(填“极性”或“非极性”)分子。
③如图为Fe与N所形成的一种化合物的基本结构单元,该化合物的化学式为________。
18. (14分)(2021·木渎高级中学质检)在5氨基四唑()中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
(1) 基态Ga原子核外电子排布式为____________; N原子的外围电子轨道表示式为________。
(2) 在1 mol 5氨基四唑中含有的σ键的数目为________。
(3) 以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构是用碳原子取代氮化钛晶胞(结构如右图)顶点的氮原子,这种碳氮化钛化合物的化学式为________________。
模块综合评价
1. D 解析:根据洪特规则,铜原子的核外电子排布式为[Ar]3d104s1,A错误;SO2价电子对数是3,有1个孤电子对,分子空间结构为V形,B错误;S2-的质子数为16,结构示意图,C错误;氧原子的质子数是8,质量数为18的氧原子可表示为8O,D正确。
2. C 解析:HCl分子中的共价键是H原子的s轨道与Cl原子的3p轨道形成的sp σ键,A正确;电子云图中的小黑点表示电子在核外空间出现概率的多少,小黑点越密,表示电子出现的频率越高,B正确;CS2的结构式是S===C===S,σ键与π键的数目之比是1∶1,C错误;当镁原子由1s22s22p63s2→1s22s22p63p2时,镁原子由基态转化成激发态,电子能量增大,这一过程中吸收能量,D正确。
3. C 解析:二氧化硅是共价晶体,其中的硅原子数目与氧原子数目之比为1∶2,空间结构中每个单元环由6个硅原子和6个氧原子组成,C符合题意。
4. C 解析:24号元素Cr的外围电子排布式为3d54s1,3d轨道半充满状态能量低、稳定,A错误;二氧化碳是直线形,而不是V形,B错误;基态碳原子外围电子排布式为2s22p2,所以外围电子的轨道表示式为,C正确;N2的电子式为N N,D错误。
5. C 解析:石墨烯是单质,A错误;石墨烷是碳氢两种元素形成的化合物,二者不属于同素异形体,B错误;将氢气加入石墨烯中开发出一种具有突破性的新材料石墨烷,C正确;石墨烯可看作将石墨的层状结构一层一层的剥开得到的单层碳原子,石墨可导电,则石墨烯也可导电,D错误。
6. A 解析:短周期主族元素X、Y、Z、W的原子序数依次增大,X、Z基态原子的p轨道上均有2个未成对电子,W与X位于同一主族,则X为O元素、Z为Si元素、W为S元素;X、Y、Z、W的原子的最外层电子数之和为18,则Y为Mg元素。二氧化硫分子中硫原子的价层电子对数为3,孤对电子对数为1,分子的空间结构为V形,则二氧化硫为极性分子,A正确;元素的非金属性越强,电负性越大,硅元素的非金属性弱于硫元素,则硅元素的电负性小于硫元素,B错误;同周期元素,从左到右原子半径依次减小,则镁、硅、硫三种原子的原子半径最大的为镁原子,C错误;元素的非金属性越强,最高价氧化物对应水化物的酸性越强,硅元素的非金属性弱于硫元素,则硅酸的酸性弱于硫酸,D错误。
7. B 解析:由二氧化硅晶体结构图可知,每个Si原子形成4个Si—O键,则Si原子杂化类型为sp3,A正确;由二氧化硅晶体结构图可知,每个硅原子周围连有四个氧原子,每个氧原子周围连有2个硅原子,Si、O原子个数比为1∶2,B错误;由二氧化硅晶体结构图可知,每个硅原子周围连有四个氧原子,则Si原子数目与Si—O键数目比为1∶4,C正确;由二氧化硅晶体结构图可知,晶体中最小环上含有6个硅原子和6个氧原子,所以最小环上的原子数为12,D正确。
8. C 解析:配合物中中心原子Pt的电荷数为+4,A错误;由于Cl-和NH3是不同的配位体,所有该配合物不可能是平面正方形结构,B错误;根据题给信息,此化合物没有电离出Cl-和NH3分子,说明Cl-和NH3分子均与Pt4+配位,C正确;此化合物没有电离出Cl-,说明Cl-也是配位体,D错误。
9. B 解析:由题干信息可知,前3周期主族元素X、Y、Z、W的原子序数依次增大,X是空气中含量最多的元素,则X为N,基态时Y最外层电子数是次外层的四分之一,即Y为Mg,基态Z原子3p轨道上只有1个电子,故Z为Al,W与X位于同一主族,故W为P,据此分析解题。根据同一周期从左往右原子半径依次减小,同一主族从上往下原子半径依次增大可知,原子半径: r(Y)>r(Z)> r(W) >r(X),A错误;根据第一电离能同一周期从左往右呈增大趋势,ⅡA与ⅢA、ⅤA与ⅥA反常,同一主族从上往下第一电离能依次减小可知,第一电离能:I1(X)>I1(Y)>I1(Z),B正确;由分析可知,X为N,X的简单气态氢化物即NH3,NH3中N原子周围的价层电子对数为=4,有1对孤电子对,故该分子的空间结构为三角锥形,C错误;最高价氧化物对应水化物的碱性与金属性一致,同一周期从左往右金属性依次减弱,故最高价氧化物对应水化物的碱性: Y > Z,D错误。
10. D 解析:ClO中Cl的价层电子对数=2+=4,有两个孤电子对,属于sp3杂化,A错误;ClO中Cl的价层电子对数=3+(7+1-2×3)=4,含有一个孤电子对,则离子的空间结构为三角锥形,B错误;ClO与ClO中价层电子对数都是4,所以都采取sp3杂化,且孤对电子数分别为1、0,则离子中相邻两个Cl—O键间键角依次增大,C错误;Cl-提供孤电子对,Cu2+中存在空轨道,Cl-与Cu2+可形成 CuCl,D正确。
11. D 解析:配合物中阴离子为硫酸根离子,硫酸根离子中硫原子的价层电子对数为4,孤对电子对数为0,离子的空间结构为正四面体形,A正确;配离子[Fe(NO)(H2O)5]2+中亚铁离子为中心离子,一氧化氮和水为配位体,配位数为6,B正确;亚铁离子的价电子排布式为3d6,失去3d轨道上一个d电子被氧化为价电子排布式为3d5的铁离子,C正确;水分子的空间结构为V形,则水分子是含有极性键的极性分子,D错误。
12. D 解析:根据晶胞的均摊法,在此晶体的晶胞中有A:8×= 1个,B:1×1 = 1个,C:6×=3个,即N(A)∶N(B)∶N(C)=1∶1∶3,D正确。
13. D 解析:手性碳原子是指连有4个互不相同的原子或原子团的碳原子,故环上两个连接羟基的碳是手性碳原子,用“*”表示为,A错误;由题干可知,该有机物中含有3个醇羟基,故1 mol此有机物与足量Na发生反应,有1.5 mol H2生成,B错误;已知分子中双键所在的4个碳原子为sp2杂化,其余碳原子和氧原子为sp3杂化,分子中sp2、sp3杂化的原子个数比为4∶6=2∶3,C错误;分子中含有2个碳碳双键,与H2加成时是碳碳双键中的π键断裂,故1 mol此有机物与足量H2发生加成反应,有2 mol π键断裂,D正确。
14. C 解析: 基态Fe外围电子排布式为 3d64s2,则Fe元素位于元素周期表的Ⅷ族,A错误;基态Fe2+外围电子排布式为3d6,B错误;赤血盐中铁呈+3价,基态Fe3+外围电子排布式为 3d5,则提供空轨道形成配位键的是Fe3+,C正确;由晶胞结构可知,Fe原子处于晶胞顶点,晶胞中含有铁原子的个数为8×=1,C原子属于棱边面心上,晶胞中含有C原子数目为4×+2×=2,则其化学式为FeC2,D错误。
15. (1)1s22s22p63s23p63d84s2或[Ar]3d84s2
(2) Mg<C<O CO2 CH4 甲醇为极性分子,且甲醇分子间能形成氢键
(3) C 分子晶体
16. (1)
(2) ds [Ar]3d9 (3) ··C··
(4) CH4 SiH4 (5) C
(7) SiO2
17. (1) 3d6 (2) sp2
(3) ①NHHHBHHH 氨硼烷分子与水分子间存在氢键 ②极性 ③ Fe4N
解析:(1) 铁元素的原子序数为26,失去2个电子形成亚铁离子,根据原子核外电子排布规律可知,亚铁离子的基态核外电子排布式为1s22s22p63s23p63d6 或[Ar]3d6;(2) 苯酚分子中苯环上的6个碳原子的杂化方式为sp2杂化;(3) ①氨硼烷中氮原子具有孤电子对,硼原子具有空轨道,氮原子能提供一对共用电子对给硼原子形成配位键,则氨硼烷的结构式为NHHHBHHH;氨硼烷中氮原子能与水分子间形成氢键,则氨硼烷能溶于水;氨硼烷分子与水分子间存在氢键;②氨气分子的空间结构为三角锥形,结构不对称,属于极性分子;③由晶胞结构可知,铁原子位于顶点和面心,个数为8×+6×=4,氮原子位于体心,个数为1,则晶胞中铁原子和氮原子的数目之比为4∶1,化学式为Fe4N。
18. (1) [Ar]3d104s24p1
(2) 9NA或9×6.02×1023 (3) Ti4CN3
解析:(1) Ga原子是31号元素,位于第4周期ⅢA族,与B同族,基态核外电子排布式为[Ar]3d104s24p1 ,N原子是7号元素,最外围有5个电子,外围电子轨道表示式为;(2) 形成双键的N原子的杂化方式是sp2,形成σ三个共价单键且含有一个孤电子对的N原子的杂化方式是sp3杂化;共价单键是σ键,共价双键中有一个σ键和一个π键,所以该分子中含有9个σ键,故在1 mol 5氨基四唑中含有的σ键的数目为9NA;(3) 根据均摊法可知,该晶胞中碳原子个数=8×=1,N原子个数=6×=3,Ti原子个数=1+12×=4,所以其化学式为Ti4CN3。
