2022-2023学年九年级化学鲁教版(五四学制) 第二单元 常见的酸和碱 单元练习(含答案)
文档属性
| 名称 | 2022-2023学年九年级化学鲁教版(五四学制) 第二单元 常见的酸和碱 单元练习(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 418.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-10 20:45:56 | ||
图片预览



文档简介
2022-2023学年化学鲁教版(五四学制)--常见的酸和碱
一、单选题
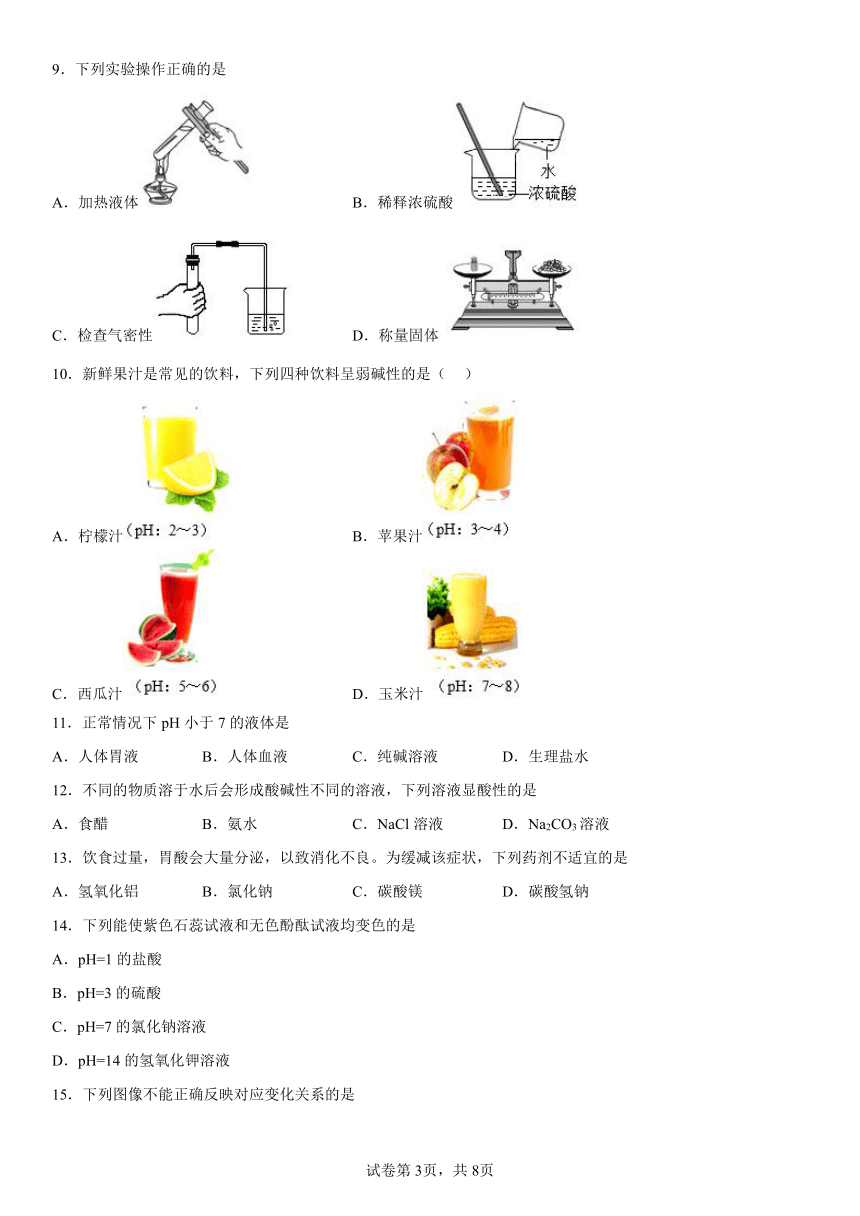
1.如图是室温下稀硫酸和氢氧化钠反应过程中的pH变化曲线。下列有关说法正确的是( )
A.图中X是氢氧化钠
B.图中a点的阴离子是OH-
C.向图中c点所示溶液中加入铁粉后,溶液中有气泡产生
D.稀硫酸与氢氧化钠溶液反应的化学方程式为:H2SO4+2NaOH═Na2SO4+H2O
2.下列溶液能使紫色石蕊溶液变成蓝色的是
A.澄清石灰水 B.NaCl溶液
C.稀硫酸 D.KNO3溶液
3.下列实验操作错误的是
A.量筒读数 B.稀释浓硫酸
C.滴加液体 D.过滤
4.下列现象从微观粒子的角度解释错误的是
选项 现象 解释
A 路过梨花园,闻到梨花香 分子在不停运动
B 100mL水与100mL酒精混合后体积小于200mL 分子之间有间隔
C 氢氧化钠溶液能导电 溶液中存在自由移动的钠离子、氢氧根离子
D 温度计水银球受热体积膨胀 温度升高汞原子体积变大
A.A B.B C.C D.D
5.有关中和反应的说法一定正确的是( )
A.反应物均须溶于水
B.有沉淀生成
C.有气体生成
D.有盐生成
6.忘盖瓶塞的氢氧化钠溶液可能变质。下表中分析与设计错误的是
选项 问题 分析与设计
A 为何变质 2NaOH + CO2 = Na2CO3 + H2O
B 是否变质 取样,加入足量稀盐酸,观察是否产生气泡
C 是否全部变质 取样,加入足量氯化钙溶液,观察产生沉淀多少
D 如何除去杂质 取样,加入适量氢氧化钙溶液,过滤
A.A B.B C.C D.D
7.下列化学方程式与客观事实相符,且书写完全正确的是
A.用过氧化氢溶液制氧气:
B.铁丝在氧气中燃烧:
C.用稀硫酸除铁锈:
D.用澄清石灰水检验二氧化碳:
8.下列各组物质的稀溶液,不需要加入其他试剂就能鉴别出来的是( )
A.FeCl3 NaCl NaOH KCl
B.CuSO4 Ba(OH)2 HCl HNO3
C.Na2SO4 BaCl2 Na2CO3 HNO3
D.Ca(OH)2 K2CO3 CaCl2 NaCl
9.下列实验操作正确的是
A.加热液体 B.稀释浓硫酸
C.检查气密性 D.称量固体
10.新鲜果汁是常见的饮料,下列四种饮料呈弱碱性的是( )
A.柠檬汁 B.苹果汁
C.西瓜汁 D.玉米汁
11.正常情况下pH小于7的液体是
A.人体胃液 B.人体血液 C.纯碱溶液 D.生理盐水
12.不同的物质溶于水后会形成酸碱性不同的溶液,下列溶液显酸性的是
A.食醋 B.氨水 C.NaCl溶液 D.Na2CO3溶液
13.饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
14.下列能使紫色石蕊试液和无色酚酞试液均变色的是
A.pH=1的盐酸
B.pH=3的硫酸
C.pH=7的氯化钠溶液
D.pH=14的氢氧化钾溶液
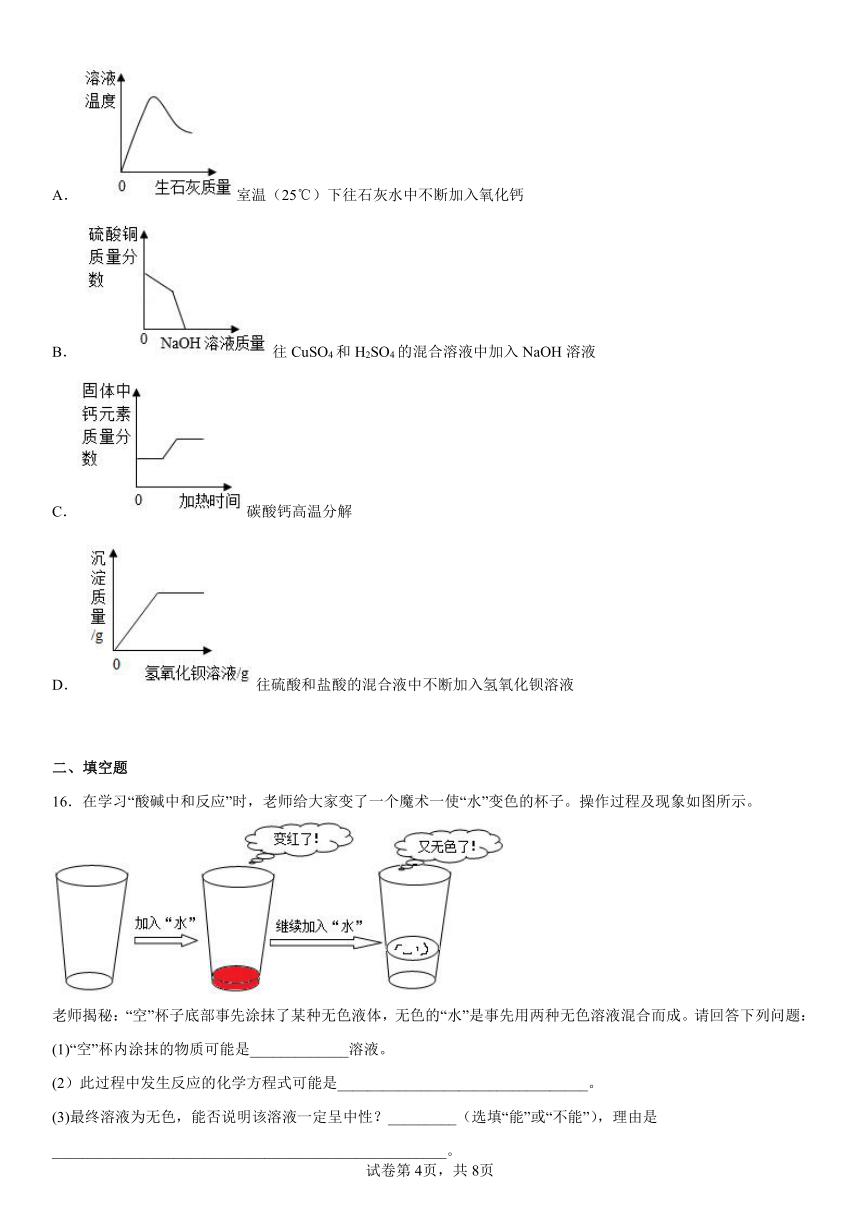
15.下列图像不能正确反映对应变化关系的是
A.室温(25℃)下往石灰水中不断加入氧化钙
B.往CuSO4和H2SO4的混合溶液中加入NaOH溶液
C.碳酸钙高温分解
D.往硫酸和盐酸的混合液中不断加入氢氧化钡溶液
二、填空题
16.在学习“酸碱中和反应”时,老师给大家变了一个魔术一使“水”变色的杯子。操作过程及现象如图所示。
老师揭秘:“空”杯子底部事先涂抹了某种无色液体,无色的“水”是事先用两种无色溶液混合而成。请回答下列问题:
(1)“空”杯内涂抹的物质可能是_____________溶液。
(2)此过程中发生反应的化学方程式可能是_________________________________。
(3)最终溶液为无色,能否说明该溶液一定呈中性?_________(选填“能”或“不能”),理由是____________________________________________________。
17.NaCl、Na2CO3、NaHCO3三种物质均属于钠盐,缘自三者都含有相同的____(用符号表示),其微粒结构示意图如图,可以推测该元素位于元素周期表中第____周期,若要鉴别 NaCl、Na2CO3这两种钠盐,下列试剂中能达到实验目的的是____(多选,填序号,完整给分)。
①无色酚酞溶液 ②稀盐酸 ③Ca(OH)2溶液 ④KCl溶液 ⑤Ca(NO3)2
18.如图表示元素的化合价与物质类别的关系,物质A-G分别由H、O、S、Ca中的一种、两种或三种元素组成。各物质均有某种组成元素的化合价与横坐标的数值对应,“→”表示物质之间的转化方向。请回答:
(1)E的化学式为___________,F的化学式为___________。
(2)A→B反应的化学方程式为___________。
(3)C→D反应的化学方程式为___________。
19.回答问题
(1)化学用语是国际通用语言,是学习化学的重要工具。按要求从氢氧化钙、氢氧化镁、硝酸钾、氢气、氧化钙中选取合适的物质,将其化学式填写在下列横线上。
①一种可燃性气体_______;
②一种金属氧化物_______
③一种难溶性的碱_______;
④一种易溶解的盐_______
(2)我国科技发展日新月异,在空间科学研究领域取得重大成果。2022年6月5日,长征二号F遥十四火箭发动机托举着乘载陈冬、刘洋、蔡旭哲三名宇航员的神舟十四号载人航天飞船再度出征。
①该运载火箭的推进剂中有液氢和液氧。试写出氢气在氧气中燃烧的化学方程式_______
②一级火箭的推进剂中还含有液态的偏二甲肼(C2H8N2)与四氧化二氮(N2O4)试计算:
a.偏二甲肼的化学式量为_______
b.偏二甲肼中碳、氢、氮三种元素的质量比为_______
c.一个四氧化二氮分子中氮、氧两种原子的个数之比为_______
③空间站的桁架的两端安装了数对大型的太阳能电池板,它们是国际空间站动力和能源的主要提供装置。在玻璃纤维中含有多种成分,其中有Na2SiO3、CaSiO3、SiO2,在上述三种物质中,硅元素表现的化合价均为_______价。
20.某同学将一朵紫色牵牛花泡在石灰水里,牵牛花很快就变成了蓝色,又将牵牛花泡在稀盐酸中,牵牛花又变成了红色,请你根据以上实验现象回答:
(1)该同学将紫色牵牛花泡在肥皂水里,牵牛花很快就变成了蓝色,据此可推断肥皂水显_____(填“酸性”或“碱性”)。
(2)该牵牛花的汁液_____(填“能”或“不能”)用作指示剂。
三、实验题
21.根据如图实验装置,回答下列问题:
(1)写出图中仪器a的名称:______,仪器b的用途:______。
(2)实验室用高锰酸钾制取并收集一瓶较纯净的氧气所需的装置为______(填字母),此反应的化学方程式为______,用______检验该气体。
(3)B、C装置均可作为实验室制取CO2的发生装置,与B相比,选用C装置的优点是______。若要收集一瓶干燥的CO2,还需要使用装置E,则E中盛放的物质为______(填物质名称)
(4)若用装置E收集H2,气体从______(填①或②)端进入。
22.实验室现有高锰酸钾、块状石灰石、稀硫酸、稀盐酸、浓盐酸、棉花以及下列仪器及装置。请你回答有关问题。
(1)仪器①的名称是______。
(2)利用上述仪器和药品制取氧气,反应的化学方程式为______,利用装置A制氧气还需改进的地方是______。在上述收集气体的装置中,不能用于收集氧气的是______(填代号)。
(3)实验室常用装置B和______(填药品名称)制取CO2,其反应的化学方程式为______。若使用装置F作为制取CO2的发生装置。与装置B比较,除了利用废物的优点外,请写出其他一个优点______,该装置使用铜丝网面不使用铁丝网盛放固体的原因是______(用化学方程式表示)。
(4)若用装置G来干燥制取的二氧化碳,则气体应从______(填“a”或“b”)口进入。
23.下图是实验室常用的实验装置,请回答下列问题。
(1)图中仪器a的名称为_______。
(2)若用装置B制取氧气,相应反应的化学方程式为_______,若用此法制备并收集干燥的氧气,则装置的连接顺序为B→_______→_______。
(3)实验室用装置A、F进行碳还原氧化铜的实验,为了检验反应的产物,装置F中应盛放的试剂是_______,反应过程中该装置内的现象为_______。
四、计算题
24.造纸厂会产生含氢氧化钠的废水,需经处理呈中性后排放。为测定此废水中氢氧化钠的质量分数,小明取40 g废水样品加入到锥形瓶中,逐滴加入10%的稀硫酸,至恰好完全反应时,消耗稀硫酸49 g。计算废水中氢氧化钠的质量分数。
25.将适量二氧化碳通入100g氢氧化钠溶液中,恰好完全反应后,得到108.8g碳酸钠溶液。请计算:
(1)参加反应的二氧化碳的质量为_______g;
(2)氢氧化钠溶液的溶质质量分数_________.
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.A
3.A
4.D
5.D
6.C
7.D
8.C
9.C
10.D
11.A
12.A
13.B
14.D
15.A
16. NaOH(或氢氧化钠) NaOH +HCl=NaCl+H2O 不能 酚酞在酸性和中性条件下均显无色
17. Na+ 三 ①②③⑤
18. CaSO4 Ca(OH)2 S+O2SO2 SO3+H2O=H2SO4
19.(1)
(2) 60 6:2:7 1:2 +4
20. 碱性 能
21. 试管 用于收集或贮存少量气体 AD 带火星的木条 可以通过分液漏斗的活塞控制液体药品的滴加速度,从而控制反应速率 浓硫酸 ②
22.(1)长颈漏斗
(2) 在试管口塞一团棉花 D
(3) 块状石灰石、稀盐酸 可以控制反应的发生和停止
(4)b
23. 锥形瓶 F D 澄清石灰水 变浑浊
24.10%
25.(1)据质量守恒定律可知反应前后物质的总质量不变,参加反应的二氧化碳质量为108.8g-100g=8.8g;
(2)设:溶液中氢氧化钠质量为x。
x=16g
氢氧化钠溶液的溶质质量分数= 。
答:(1)参加反应的二氧化碳的质量为4.4 g;
(2)氢氧化钠溶液的溶质质量分数16% 。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.如图是室温下稀硫酸和氢氧化钠反应过程中的pH变化曲线。下列有关说法正确的是( )
A.图中X是氢氧化钠
B.图中a点的阴离子是OH-
C.向图中c点所示溶液中加入铁粉后,溶液中有气泡产生
D.稀硫酸与氢氧化钠溶液反应的化学方程式为:H2SO4+2NaOH═Na2SO4+H2O
2.下列溶液能使紫色石蕊溶液变成蓝色的是
A.澄清石灰水 B.NaCl溶液
C.稀硫酸 D.KNO3溶液
3.下列实验操作错误的是
A.量筒读数 B.稀释浓硫酸
C.滴加液体 D.过滤
4.下列现象从微观粒子的角度解释错误的是
选项 现象 解释
A 路过梨花园,闻到梨花香 分子在不停运动
B 100mL水与100mL酒精混合后体积小于200mL 分子之间有间隔
C 氢氧化钠溶液能导电 溶液中存在自由移动的钠离子、氢氧根离子
D 温度计水银球受热体积膨胀 温度升高汞原子体积变大
A.A B.B C.C D.D
5.有关中和反应的说法一定正确的是( )
A.反应物均须溶于水
B.有沉淀生成
C.有气体生成
D.有盐生成
6.忘盖瓶塞的氢氧化钠溶液可能变质。下表中分析与设计错误的是
选项 问题 分析与设计
A 为何变质 2NaOH + CO2 = Na2CO3 + H2O
B 是否变质 取样,加入足量稀盐酸,观察是否产生气泡
C 是否全部变质 取样,加入足量氯化钙溶液,观察产生沉淀多少
D 如何除去杂质 取样,加入适量氢氧化钙溶液,过滤
A.A B.B C.C D.D
7.下列化学方程式与客观事实相符,且书写完全正确的是
A.用过氧化氢溶液制氧气:
B.铁丝在氧气中燃烧:
C.用稀硫酸除铁锈:
D.用澄清石灰水检验二氧化碳:
8.下列各组物质的稀溶液,不需要加入其他试剂就能鉴别出来的是( )
A.FeCl3 NaCl NaOH KCl
B.CuSO4 Ba(OH)2 HCl HNO3
C.Na2SO4 BaCl2 Na2CO3 HNO3
D.Ca(OH)2 K2CO3 CaCl2 NaCl
9.下列实验操作正确的是
A.加热液体 B.稀释浓硫酸
C.检查气密性 D.称量固体
10.新鲜果汁是常见的饮料,下列四种饮料呈弱碱性的是( )
A.柠檬汁 B.苹果汁
C.西瓜汁 D.玉米汁
11.正常情况下pH小于7的液体是
A.人体胃液 B.人体血液 C.纯碱溶液 D.生理盐水
12.不同的物质溶于水后会形成酸碱性不同的溶液,下列溶液显酸性的是
A.食醋 B.氨水 C.NaCl溶液 D.Na2CO3溶液
13.饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
14.下列能使紫色石蕊试液和无色酚酞试液均变色的是
A.pH=1的盐酸
B.pH=3的硫酸
C.pH=7的氯化钠溶液
D.pH=14的氢氧化钾溶液
15.下列图像不能正确反映对应变化关系的是
A.室温(25℃)下往石灰水中不断加入氧化钙
B.往CuSO4和H2SO4的混合溶液中加入NaOH溶液
C.碳酸钙高温分解
D.往硫酸和盐酸的混合液中不断加入氢氧化钡溶液
二、填空题
16.在学习“酸碱中和反应”时,老师给大家变了一个魔术一使“水”变色的杯子。操作过程及现象如图所示。
老师揭秘:“空”杯子底部事先涂抹了某种无色液体,无色的“水”是事先用两种无色溶液混合而成。请回答下列问题:
(1)“空”杯内涂抹的物质可能是_____________溶液。
(2)此过程中发生反应的化学方程式可能是_________________________________。
(3)最终溶液为无色,能否说明该溶液一定呈中性?_________(选填“能”或“不能”),理由是____________________________________________________。
17.NaCl、Na2CO3、NaHCO3三种物质均属于钠盐,缘自三者都含有相同的____(用符号表示),其微粒结构示意图如图,可以推测该元素位于元素周期表中第____周期,若要鉴别 NaCl、Na2CO3这两种钠盐,下列试剂中能达到实验目的的是____(多选,填序号,完整给分)。
①无色酚酞溶液 ②稀盐酸 ③Ca(OH)2溶液 ④KCl溶液 ⑤Ca(NO3)2
18.如图表示元素的化合价与物质类别的关系,物质A-G分别由H、O、S、Ca中的一种、两种或三种元素组成。各物质均有某种组成元素的化合价与横坐标的数值对应,“→”表示物质之间的转化方向。请回答:
(1)E的化学式为___________,F的化学式为___________。
(2)A→B反应的化学方程式为___________。
(3)C→D反应的化学方程式为___________。
19.回答问题
(1)化学用语是国际通用语言,是学习化学的重要工具。按要求从氢氧化钙、氢氧化镁、硝酸钾、氢气、氧化钙中选取合适的物质,将其化学式填写在下列横线上。
①一种可燃性气体_______;
②一种金属氧化物_______
③一种难溶性的碱_______;
④一种易溶解的盐_______
(2)我国科技发展日新月异,在空间科学研究领域取得重大成果。2022年6月5日,长征二号F遥十四火箭发动机托举着乘载陈冬、刘洋、蔡旭哲三名宇航员的神舟十四号载人航天飞船再度出征。
①该运载火箭的推进剂中有液氢和液氧。试写出氢气在氧气中燃烧的化学方程式_______
②一级火箭的推进剂中还含有液态的偏二甲肼(C2H8N2)与四氧化二氮(N2O4)试计算:
a.偏二甲肼的化学式量为_______
b.偏二甲肼中碳、氢、氮三种元素的质量比为_______
c.一个四氧化二氮分子中氮、氧两种原子的个数之比为_______
③空间站的桁架的两端安装了数对大型的太阳能电池板,它们是国际空间站动力和能源的主要提供装置。在玻璃纤维中含有多种成分,其中有Na2SiO3、CaSiO3、SiO2,在上述三种物质中,硅元素表现的化合价均为_______价。
20.某同学将一朵紫色牵牛花泡在石灰水里,牵牛花很快就变成了蓝色,又将牵牛花泡在稀盐酸中,牵牛花又变成了红色,请你根据以上实验现象回答:
(1)该同学将紫色牵牛花泡在肥皂水里,牵牛花很快就变成了蓝色,据此可推断肥皂水显_____(填“酸性”或“碱性”)。
(2)该牵牛花的汁液_____(填“能”或“不能”)用作指示剂。
三、实验题
21.根据如图实验装置,回答下列问题:
(1)写出图中仪器a的名称:______,仪器b的用途:______。
(2)实验室用高锰酸钾制取并收集一瓶较纯净的氧气所需的装置为______(填字母),此反应的化学方程式为______,用______检验该气体。
(3)B、C装置均可作为实验室制取CO2的发生装置,与B相比,选用C装置的优点是______。若要收集一瓶干燥的CO2,还需要使用装置E,则E中盛放的物质为______(填物质名称)
(4)若用装置E收集H2,气体从______(填①或②)端进入。
22.实验室现有高锰酸钾、块状石灰石、稀硫酸、稀盐酸、浓盐酸、棉花以及下列仪器及装置。请你回答有关问题。
(1)仪器①的名称是______。
(2)利用上述仪器和药品制取氧气,反应的化学方程式为______,利用装置A制氧气还需改进的地方是______。在上述收集气体的装置中,不能用于收集氧气的是______(填代号)。
(3)实验室常用装置B和______(填药品名称)制取CO2,其反应的化学方程式为______。若使用装置F作为制取CO2的发生装置。与装置B比较,除了利用废物的优点外,请写出其他一个优点______,该装置使用铜丝网面不使用铁丝网盛放固体的原因是______(用化学方程式表示)。
(4)若用装置G来干燥制取的二氧化碳,则气体应从______(填“a”或“b”)口进入。
23.下图是实验室常用的实验装置,请回答下列问题。
(1)图中仪器a的名称为_______。
(2)若用装置B制取氧气,相应反应的化学方程式为_______,若用此法制备并收集干燥的氧气,则装置的连接顺序为B→_______→_______。
(3)实验室用装置A、F进行碳还原氧化铜的实验,为了检验反应的产物,装置F中应盛放的试剂是_______,反应过程中该装置内的现象为_______。
四、计算题
24.造纸厂会产生含氢氧化钠的废水,需经处理呈中性后排放。为测定此废水中氢氧化钠的质量分数,小明取40 g废水样品加入到锥形瓶中,逐滴加入10%的稀硫酸,至恰好完全反应时,消耗稀硫酸49 g。计算废水中氢氧化钠的质量分数。
25.将适量二氧化碳通入100g氢氧化钠溶液中,恰好完全反应后,得到108.8g碳酸钠溶液。请计算:
(1)参加反应的二氧化碳的质量为_______g;
(2)氢氧化钠溶液的溶质质量分数_________.
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.A
3.A
4.D
5.D
6.C
7.D
8.C
9.C
10.D
11.A
12.A
13.B
14.D
15.A
16. NaOH(或氢氧化钠) NaOH +HCl=NaCl+H2O 不能 酚酞在酸性和中性条件下均显无色
17. Na+ 三 ①②③⑤
18. CaSO4 Ca(OH)2 S+O2SO2 SO3+H2O=H2SO4
19.(1)
(2) 60 6:2:7 1:2 +4
20. 碱性 能
21. 试管 用于收集或贮存少量气体 AD 带火星的木条 可以通过分液漏斗的活塞控制液体药品的滴加速度,从而控制反应速率 浓硫酸 ②
22.(1)长颈漏斗
(2) 在试管口塞一团棉花 D
(3) 块状石灰石、稀盐酸 可以控制反应的发生和停止
(4)b
23. 锥形瓶 F D 澄清石灰水 变浑浊
24.10%
25.(1)据质量守恒定律可知反应前后物质的总质量不变,参加反应的二氧化碳质量为108.8g-100g=8.8g;
(2)设:溶液中氢氧化钠质量为x。
x=16g
氢氧化钠溶液的溶质质量分数= 。
答:(1)参加反应的二氧化碳的质量为4.4 g;
(2)氢氧化钠溶液的溶质质量分数16% 。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
