1.1反应热 课件(共59张PPT) 2022-2023学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 1.1反应热 课件(共59张PPT) 2022-2023学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-06 11:58:18 | ||
图片预览







文档简介
(共59张PPT)
第一章 化学反应的热效应
第一节 反应热
教学目标
1.了解反应热的概念;能解释中和反应反应热的测定原理;能根据实验中测定并记录的数据计算反应热。
2.能从宏观和微观两个角度建构模型,并解释反应热产生的原因。
3.理解热化学方程式的意义,能正确书写热化学方程式。
4.知道燃烧热的概念;通过燃烧热的学习,认识能源在生产、生活中的重要意义。
教学重点和难点
重点:从宏观和微观两个视角认识反应热;
热化学方程式的书写。
难点:从宏观和微观两个视角认识反应热。
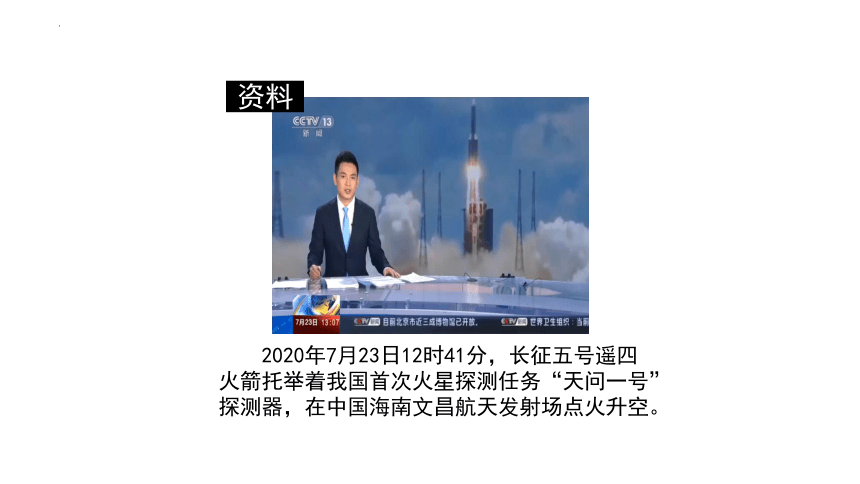
2020年7月23日12时41分,长征五号遥四火箭托举着我国首次火星探测任务“天问一号”探测器,在中国海南文昌航天发射场点火升空。
资料
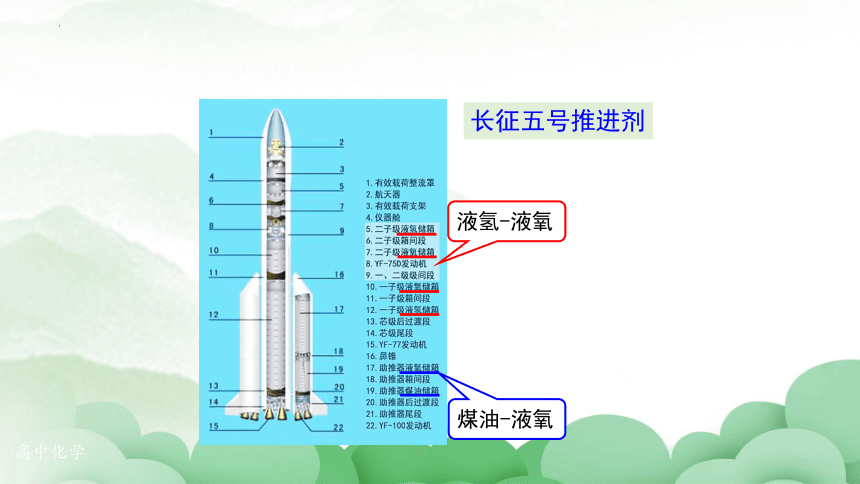
火箭推进剂
火箭发动机一般选用化学推进剂,它是由燃料和氧化剂组成的,反应后产生高温气体用于火箭推进。
液氢-液氧
煤油-液氧
长征五号推进剂
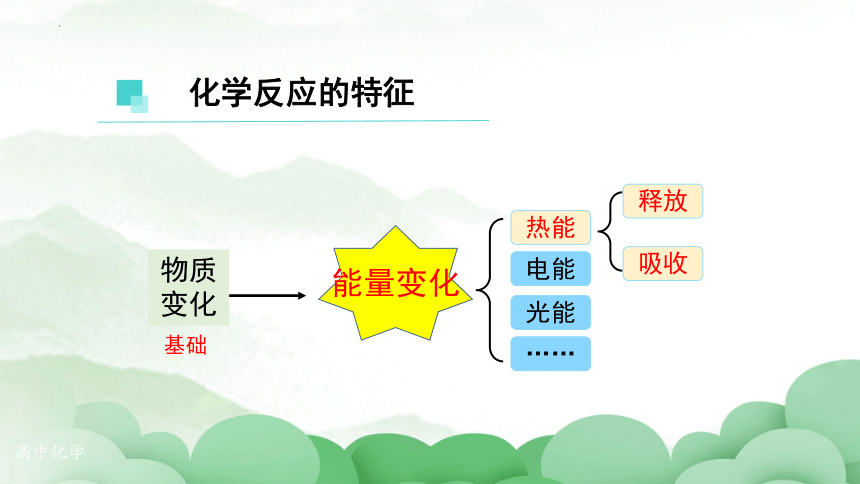
能量变化
物质
变化
基础
化学反应的特征
热能
电能
光能
……
吸收
释放
放热反应 吸热反应
大部分 (特例:C与CO2反应吸热) 大部分
(特例:NH4 NO3分解放热 )
燃烧及缓慢氧化 Ba(OH)2·8H2O与NH4Cl
酸碱中和反应 C与H2O反应、H2与CuO反应、Fe与H2O(g)反应等
金属与水或酸反应 化合反应
分解反应
化学反应
吸热反应
放热反应
温故知新
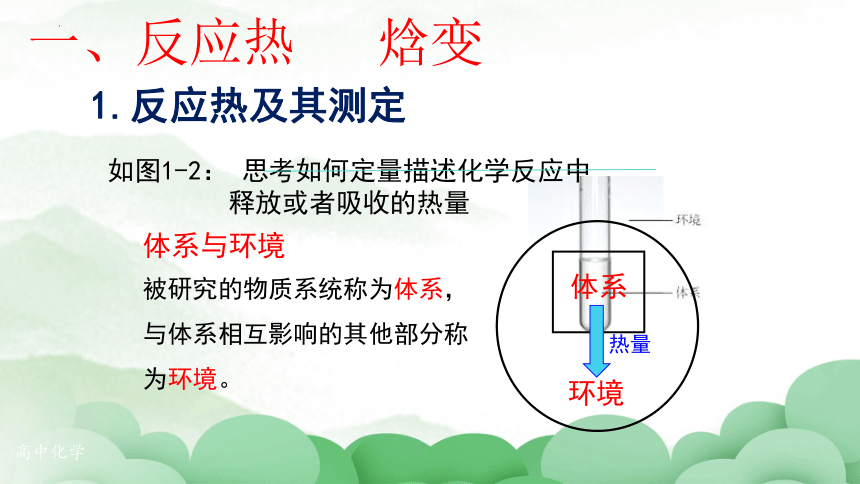
体系
环境
热量
被研究的物质系统称为体系,与体系相互影响的其他部分称为环境。
如图1-2: 思考如何定量描述化学反应中
释放或者吸收的热量
体系与环境
一、反应热 焓变
1.反应热及其测定
在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
反应热
体系
环境
如何定量描述化学反应中释放或者吸收的热量?
热量
许多反应热可以通过量热计直接测定。
保温杯式量热计
反应热的测定
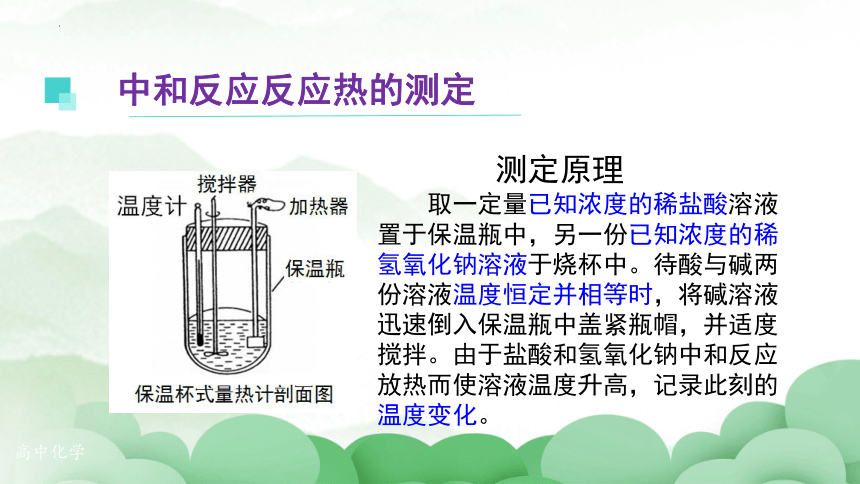
测定原理
取一定量已知浓度的稀盐酸溶液置于保温瓶中,另一份已知浓度的稀氢氧化钠溶液于烧杯中。待酸与碱两份溶液温度恒定并相等时,将碱溶液迅速倒入保温瓶中盖紧瓶帽,并适度搅拌。由于盐酸和氢氧化钠中和反应放热而使溶液温度升高,记录此刻的温度变化。
中和反应反应热的测定
测出温度的变化量(t2 -t1)
求放出的热量Q
Q = c · m ·(t2-t1)
比热容
质量
温度的变化量
保温杯式量热计
中和反应反应热的测定
思考 为了提高测定的准确度,应该采取哪些措施?
1. 使用比较精确的温度计读出温度变化;
2. 需要保温装置,保证反应过程中,不
与外界发生热交换;
3. 搅拌器搅拌,保证溶液温度均匀;
……
CONTENTS
温度 实验 次数 起始温度t1/℃ 终止温度 t2/℃ 温度差
(t2-t1)/℃
HCl NaOH 平均值 1
2
3
平均值
CONTENTS
输入文本
怎样计算呢?
计算方法:Q = mCΔt
(1)其中 Q : 中和反应放出的热量; m : 反应混合液的质量;
C :反应混合液的比热容;△t :反应前后溶液温度差;
(2)因为m = V酸 ρ酸+V碱 ρ碱 、V酸=V碱 =50 mL;而酸的浓度是0.50 mol/L 、碱的浓度是0.55 mol/L;且ρ酸=ρ碱=1 g/cm3 、C=4.18 J/(g·℃)。
所以 Q = 0.418(t2-t1)kJ。
(3)中和热计算公式:
大量实验测得,25 ℃和101 kPa下,强酸与强碱稀溶液发生中和反应生成1 mol水时,放出57.3 kJ的热量。
保温杯式量热计
中和反应反应热的结论
焓(H ):是一个与内能有关的物理量。内能受温
度、压强和物质的聚集状态等影响。
焓变( H ): H= H生成物- H反应物
单位: kJ/mol 或 kJ mol-1
等压条件下,反应热等于焓变。
2.反应热与焓变
产生
反应热
体系
内能改变
等压
反应热
(焓变)
思考 探究化学反应中为什么会有反应热?
宏观分析
放热反应
H (反应物)> H(生成物)
宏观分析
放热反应
吸热反应
H (反应物)> H(生成物)
H (反应物)< H(生成物)
H=H(生成物)- H(反应物)
放热反应
吸热反应
H
反应物
生成物
反应物
生成物
H <0
H >0
H
436 kJ/mol
H
H
H
H
键断裂,吸收能量
键形成,释放能量
436 kJ/mol
微观分析
2.反应热与焓变
436 kJ/mol
H
H
H
H
键断裂,吸收能量
键形成,释放能量
436 kJ/mol
键能:在25 ℃和101 kPa下,断开1 mol 气态分子AB(g)中的共价键,使其生成气态原子 A(g)和 B(g)所吸收的能量。
微观分析
2.反应热与焓变
CONTENTS
微观 化学反应的实质
反应物中旧化学键的断裂和生成物中新化学键的形成。
吸收436 kJ + 243 kJ=679 kJ
吸收436 kJ + 243 kJ=679 kJ
释放431 kJ/mol×2 mol=862 kJ
H= 183 kJ/mol
微观分析
H2(g) + Cl2(g) 2HCl(g) H=?
2.反应热与焓变
吸收能量679 kJ
释放能量862 kJ
H = 183 kJ/mol
H= 183 kJ/mol
化学键断裂和形成时的能量变化是化学反应中能量变化的主要原因。
想一想:实验测得与理论分析的数据接近,
说明了什么?
键能估算
实验测得
H= 184.6 kJ/mol
H2(g) + Cl2(g) 2HCl(g) H= ?
2.反应热与焓变
H(估算)=E (反应物键能)- E (生成物键能)
反应物
生成物
化学反应
键断裂
键生成
原子重新组合
吸收能量
放出能量
吸收能量 > 释放能量 吸热反应
吸收能量 < 释放能量 放热反应
算一算(1)依据信息估算2 mol H2(g) 和1 mol O2(g) 反应生成2 mol H2O(g) 的反应热 H=?
2H2
O2
4H
2O
2H2O
1 mol H2(g)中的H-H键断裂吸收436 kJ能量
1 mol O2(g)中的化学键断裂吸收498 kJ能量
形成H2O(g)中1 mol H-O键释放463.4 kJ能量
H(估算)= E (反应物键能)-E (生成物键能)
=2×436 kJ/mol+498 kJ/mol-4×463.4 kJ/mol
= 483.6 kJ/mol
2H2
O2
4H
2O
2H2O
1 mol H2(g)中的H-H键断裂吸收436 kJ能量
1 mol O2(g)中的化学键断裂吸收498 kJ能量
形成H2O(g)中1 mol H-O键释放463.4 kJ能量
2H2(g) + O2(g) 2H2O(g) H=?
算一算 拆开 1 mol H H键、1 mol N H键、1 mol N N键所需能量分别是436 kJ、391 kJ、946 kJ,则1 mol N2(g)转化为NH3(g)时的反应热是多少?
= 946 kJ/mol + 3×436 kJ/mol 6×391 kJ/mol
= 92 kJ/mol
H = E (反应物键能)- E (生成物键能)
N2(g) + 3H2(g) 2NH3 (g) H=
问题1:如何用化学用语来表示化学反应
中吸收或者释放的热量呢
热化学方程式:
表明反应所释放或吸收的热量的化学方程式。
1 mol液态H2和 mol液态O2反应生成 1mol气态H2O放出237.5 kJ的热量。
1
2
H2(l) + O2(l) H2O(g) H= 237.5 kJ/mol
1
2
二、热化学方程式
物质变化
能量变化
思考:热化学方程式与化学方程式书写有何不同
符号
( 吸收+、释放 )
H2=+241.8 kJ/mol
H2O(g)
H1= 241.8 kJ/mol
H
H2(g)+ O2(g)
1
2
H2(g) + O2(g) H2O(g) H1= 241.8 kJ/mol
1
2
1
2
H2O(g) H2(g) + O2(g) H2=+241.8 kJ/mol
H
H2O(l)
ΔH2=-285.8 kJ/mol
H2O(g)
ΔH1=-241.8 kJ/mol
H2(g)+ O2(g)
1
2
思考:如果生成的是H2O(l) ,反应热一样吗
H2(g) + O2(g) H2O(g) H1= 241.8 kJ/mol
1
2
H2(g) + O2(g) H2O(l) H2=
1
2
H2= 285.8 kJ/mol
二、热化学方程式
注意:标注状态
固体(s)、液体(l)、气体(g)、溶液(aq)
思考:如果生成的是H2O(l) ,反应热一样吗
H2(g) + O2(g) H2O(g) H1= 241.8 kJ/mol
1
2
H2(g) + O2(g) H2O(l) ΔH2=
1
2
H2= 285.8 kJ/mol
二、热化学方程式
例:常温下,1 L 1 mol/L HCl和 1 L 1 mol/L NaOH溶液恰好完全反应放出57.3 kJ的热量。
注意:标注状态
固体(s)、液体(l)、气体(g)、溶液(aq)
HCl(aq) + NaOH(aq) NaCl(aq) + H2O(l)
H= 57.3 kJ/mol
二、热化学方程式
思考:如果H2与O2消耗量增倍,反应热ΔH 一样吗
注意: 1.化学计量数不表示分子数,仅表示物质的量
(可以是整数,也可以是分数)
2. H 数值与化学计量数相对应
H2(g) + O2(g) H2O(g) H1= 241.8 kJ/mol
1
2
2H2(g) + O2(g) 2H2O(l) H2 =
H2= 483.6 kJ/mol
二、热化学方程式
注意:若为25 oC、101 kPa时可省略,其他温
度和压强必须注明。
比一比:书写热化学方程式还需要注意什么
H2(g) + I2(g) 2HI(g) H= 9.48 kJ/mol
25 oC
101kPa
H2(g) + I2(g) 2HI(g) H= 14.9 kJ/mol
100 oC
101kPa
二、热化学方程式
问题:ΔH 中的单位mol-1代表什么含义?
阅读
教材
P9
H2(g) + O2(g) H2O(g) H= 241.8 kJ/mol
1
2
任务:用结构图梳理书写热化学方程式的注意事项
热化学
方程式
符号
吸热 +
放热
数值
与化学计量
数相对应
单位
kJ/mol
固体(s)
液体(l)
气体(g)
溶液(aq)
化学计量数
与焓变数值对应
表示物质的量
(整数、分数均可)
条件
压强
温度
状态
二、热化学方程式
(1)25 ℃、101 kPa下,8 g CH4完全燃烧,放出
445.0 kJ热量;
(2)液化石油气主要成分是丙烷(C3H8),1 mol
气态丙烷在O2(g)中燃烧,生成CO2(g)和H2O(l),
放出2219.9 kJ热量;
(3)煤气的主要成分为CO和H2,常温下14 g CO完
全燃烧,放出141.5 kJ热量。
练一练:写出下列反应的热化学方程式
二、热化学方程式
查一查:你写对了吗
1
2
1
2
CH4(g) + O2(g) CO2(g) + H2O(l)
H= 445.0 kJ/mol
CH4(g) + 2O2(g) CO2(g) + 2H2O(l)
H= 890 kJ/mol
(1)25 ℃、101 kPa下,8 g CH4完全燃烧,放出
445.0 kJ热量;
二、热化学方程式
查一查:你写对了吗
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(l)
H= 2219.9 kJ/mol
(2)液化石油气主要成分是丙烷(C3H8),1 mol
气态丙烷在O2(g)中燃烧,生成CO2(g)和H2O(l),
放出2219.9 kJ热量;
二、热化学方程式
查一查:你写对了吗
CO(g) + O2(g) CO2(g) H= 283 kJ/mol
1
2
2CO(g) + O2(g) 2CO2(g) H= 566 kJ/mol
(3)煤气的主要成分为CO和H2,常温下14 g CO完
全燃烧,放出141.5 kJ热量。
二、热化学方程式
练一练:CH4可做火箭推进剂的燃料。常温下,0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量。则下列热化学方程式中正确的是
2CH4(g) + 4O2(g) 2CO2(g) + 4H2O(l) H=﹢890 kJ/mol
B . CH4 + 2O2 CO2 + 2H2O H= 890 kJ/mol
C . CH4(g) + 2O2(g) CO2(g) + 2H2O(l) H= 890 kJ/mol
D . CH4(g) + O2(g) CO2(g) + H2O(l) H= 890 kJ/mol
C
H= 445 kJ/mol
H= 1780 kJ/mol
标物质状态
1
2
1
2
二、热化学方程式
E1
E2 = 2752 kJ/mol
H1 = 534 kJ/mol
能量
N2(g) + 2H2O(g)
N2H4(g) + O2(g)
反应物
总能量
生成物
总能量
假想中间物总能量
2N (g) + 4H4(g) + 2O (g)
练一练:肼( H2N-NH2 )是一种火箭推进剂的燃料,有关化学反应的能量变化如下图所示,写出表示肼燃烧的热化学方程式。
N2H4(g) + O2(g) N2(g) + 2H2O(g)
H= 534 kJ/mol
二、热化学方程式
定义:101 kPa时,1 mol纯物质完全燃烧生成指定产物时所放出的热量,叫做该物质的燃烧热,单位为kJ/mol。
三、燃烧热
注意:碳元素变为CO2(g) 、氢元素变为H2O(l)、硫元素变为SO2(g)、氮元素变为N2(g)等 。
CO(g) + O2(g) CO2(g) H= 283 kJ/mol
1
2
2CO(g) + O2(g) 2CO2(g) H= 566 kJ/mol
H2(g) + O2(g) H2O(l) H= 285.8 kJ/mol
三、燃烧热
测定原理:将待测物质放在一个充满氧气的密封金属容器(称为氧弹)内,再将此容器置于盛有一定量水的量热计内筒中,通过点火装置使氧弹中物质燃烧,反应放出的热量会使氧弹外面的水温升高。用温度计测量水温的变化,即可计算出此反应放出的热量。
燃烧热的测量
三、燃烧热
名称 化学式 ΔH/kJ/mol 名称 化学式 ΔH/kJ/mol
石墨 C(s) 393.5 乙烷 C2H6(g) 1559.8
金刚石 C(s) 395.0 乙烯 C2H4(g) 1411.0
氢气 H2(g) 285.8 乙炔 C2H2(g) 1299.6
一氧化碳 CO(g) 283.0 乙醇 C2H5OH(l) 1366.8
甲烷 CH4(g) 890.31 丙烷 C3H8(g) 2219.9
甲醇 CH3OH(l) 726.51 苯 C6H6(l) 3267.5
某些物质的燃烧热(25 oC,101 kPa)
H2(g) + O2(g) H2O(l) H= 285.8 kJ/mol
1
2
三、燃烧热
名称 化学式 ΔH/kJ/mol 名称 化学式 ΔH/kJ/mol
石墨 C(s) 393.5 乙烷 C2H6(g) 1559.8
金刚石 C(s) 395.0 乙烯 C2H4(g) 1411.0
氢气 H2(g) 285.8 乙炔 C2H2(g) 1299.6
一氧化碳 CO(g) 283.0 乙醇 C2H5OH(l) 1366.8
甲烷 CH4(g) 890.31 丙烷 C3H8(g) 2219.9
甲醇 CH3OH(l) 726.51 苯 C6H6(l) 3267.5
某些物质的燃烧热(25 oC,101 kPa)
三、燃烧热
单位质量产生热量: ≈ 13.2 kJ/g
237.5 kJ
2 g+16 g
单位质量产生热量: ≈ 6.4 kJ/g
283 kJ
28 g+16 g
1
2
火箭推进剂燃料的选择
H2(l) + O2(l) H2O(g) H= 237.5 kJ/mol
CO(g) + O2(g) CO2 (g) H= 283 kJ/mol
1
2
优点:绿色、高能、推力大
缺点:低温贮存技术难度大;液氢密度小,燃料箱体积大
液氢-液氧推进剂
资料
火箭推进剂的选择
火箭推进剂的发展主要着眼于能量高、排烟少、污染轻三个方面。
高能推进剂是将来推进剂研究的首选;
无烟推进剂的开发、 应用更是势在必行;
污染少的推进剂将大有发展前途。
随堂训练
1、书写热化学方程式
(4)已知在100 kPa时,1mol石墨转化为金刚石要吸收1.895kJ的热能,写出该反应的热化学方程式:
。
(5)在25 ℃、101 kPa下,一定质量的氢气在1molO2(g)中完全燃烧,生成1molH2O(l),放出571.6 kJ的热量,请写出表示氢气燃烧热的热化学方程式为:
________________________________________________。
H2(g) + 1/2O2(g) = H2O(l)
C(石墨,s) C(金刚石,s)
ΔH =+1.895 kJ/mol
ΔH = -285.8 kJ/mol
小 结
热化学
方程式
物质变化
能量变化
质量守恒定律
能量守恒定律
反应体系是
吸热还是放热
反应体系吸收或
放出热量的多少
表示
遵循
定性
定量
遵循
CONTENTS
燃烧热与中和热的区别与联系
相 同 点 燃烧热 中和热
能量变化 ΔH 不 同 点 反应物的量
生成物的量
反应热 的含义
放热反应
ΔH<0 , 单位 kJ/mol
1mol可燃物
不限
不限量
H2O 1mol
1mol反应物完全燃烧时放出的热量;不同的物质燃烧热不同
酸碱中和生成1mol H2O时放出的热量,强酸强碱间的中和反应中和热大致相同,均约为57.3kJ/mol
谢谢!
第一章 化学反应的热效应
第一节 反应热
教学目标
1.了解反应热的概念;能解释中和反应反应热的测定原理;能根据实验中测定并记录的数据计算反应热。
2.能从宏观和微观两个角度建构模型,并解释反应热产生的原因。
3.理解热化学方程式的意义,能正确书写热化学方程式。
4.知道燃烧热的概念;通过燃烧热的学习,认识能源在生产、生活中的重要意义。
教学重点和难点
重点:从宏观和微观两个视角认识反应热;
热化学方程式的书写。
难点:从宏观和微观两个视角认识反应热。
2020年7月23日12时41分,长征五号遥四火箭托举着我国首次火星探测任务“天问一号”探测器,在中国海南文昌航天发射场点火升空。
资料
火箭推进剂
火箭发动机一般选用化学推进剂,它是由燃料和氧化剂组成的,反应后产生高温气体用于火箭推进。
液氢-液氧
煤油-液氧
长征五号推进剂
能量变化
物质
变化
基础
化学反应的特征
热能
电能
光能
……
吸收
释放
放热反应 吸热反应
大部分 (特例:C与CO2反应吸热) 大部分
(特例:NH4 NO3分解放热 )
燃烧及缓慢氧化 Ba(OH)2·8H2O与NH4Cl
酸碱中和反应 C与H2O反应、H2与CuO反应、Fe与H2O(g)反应等
金属与水或酸反应 化合反应
分解反应
化学反应
吸热反应
放热反应
温故知新
体系
环境
热量
被研究的物质系统称为体系,与体系相互影响的其他部分称为环境。
如图1-2: 思考如何定量描述化学反应中
释放或者吸收的热量
体系与环境
一、反应热 焓变
1.反应热及其测定
在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
反应热
体系
环境
如何定量描述化学反应中释放或者吸收的热量?
热量
许多反应热可以通过量热计直接测定。
保温杯式量热计
反应热的测定
测定原理
取一定量已知浓度的稀盐酸溶液置于保温瓶中,另一份已知浓度的稀氢氧化钠溶液于烧杯中。待酸与碱两份溶液温度恒定并相等时,将碱溶液迅速倒入保温瓶中盖紧瓶帽,并适度搅拌。由于盐酸和氢氧化钠中和反应放热而使溶液温度升高,记录此刻的温度变化。
中和反应反应热的测定
测出温度的变化量(t2 -t1)
求放出的热量Q
Q = c · m ·(t2-t1)
比热容
质量
温度的变化量
保温杯式量热计
中和反应反应热的测定
思考 为了提高测定的准确度,应该采取哪些措施?
1. 使用比较精确的温度计读出温度变化;
2. 需要保温装置,保证反应过程中,不
与外界发生热交换;
3. 搅拌器搅拌,保证溶液温度均匀;
……
CONTENTS
温度 实验 次数 起始温度t1/℃ 终止温度 t2/℃ 温度差
(t2-t1)/℃
HCl NaOH 平均值 1
2
3
平均值
CONTENTS
输入文本
怎样计算呢?
计算方法:Q = mCΔt
(1)其中 Q : 中和反应放出的热量; m : 反应混合液的质量;
C :反应混合液的比热容;△t :反应前后溶液温度差;
(2)因为m = V酸 ρ酸+V碱 ρ碱 、V酸=V碱 =50 mL;而酸的浓度是0.50 mol/L 、碱的浓度是0.55 mol/L;且ρ酸=ρ碱=1 g/cm3 、C=4.18 J/(g·℃)。
所以 Q = 0.418(t2-t1)kJ。
(3)中和热计算公式:
大量实验测得,25 ℃和101 kPa下,强酸与强碱稀溶液发生中和反应生成1 mol水时,放出57.3 kJ的热量。
保温杯式量热计
中和反应反应热的结论
焓(H ):是一个与内能有关的物理量。内能受温
度、压强和物质的聚集状态等影响。
焓变( H ): H= H生成物- H反应物
单位: kJ/mol 或 kJ mol-1
等压条件下,反应热等于焓变。
2.反应热与焓变
产生
反应热
体系
内能改变
等压
反应热
(焓变)
思考 探究化学反应中为什么会有反应热?
宏观分析
放热反应
H (反应物)> H(生成物)
宏观分析
放热反应
吸热反应
H (反应物)> H(生成物)
H (反应物)< H(生成物)
H=H(生成物)- H(反应物)
放热反应
吸热反应
H
反应物
生成物
反应物
生成物
H <0
H >0
H
436 kJ/mol
H
H
H
H
键断裂,吸收能量
键形成,释放能量
436 kJ/mol
微观分析
2.反应热与焓变
436 kJ/mol
H
H
H
H
键断裂,吸收能量
键形成,释放能量
436 kJ/mol
键能:在25 ℃和101 kPa下,断开1 mol 气态分子AB(g)中的共价键,使其生成气态原子 A(g)和 B(g)所吸收的能量。
微观分析
2.反应热与焓变
CONTENTS
微观 化学反应的实质
反应物中旧化学键的断裂和生成物中新化学键的形成。
吸收436 kJ + 243 kJ=679 kJ
吸收436 kJ + 243 kJ=679 kJ
释放431 kJ/mol×2 mol=862 kJ
H= 183 kJ/mol
微观分析
H2(g) + Cl2(g) 2HCl(g) H=?
2.反应热与焓变
吸收能量679 kJ
释放能量862 kJ
H = 183 kJ/mol
H= 183 kJ/mol
化学键断裂和形成时的能量变化是化学反应中能量变化的主要原因。
想一想:实验测得与理论分析的数据接近,
说明了什么?
键能估算
实验测得
H= 184.6 kJ/mol
H2(g) + Cl2(g) 2HCl(g) H= ?
2.反应热与焓变
H(估算)=E (反应物键能)- E (生成物键能)
反应物
生成物
化学反应
键断裂
键生成
原子重新组合
吸收能量
放出能量
吸收能量 > 释放能量 吸热反应
吸收能量 < 释放能量 放热反应
算一算(1)依据信息估算2 mol H2(g) 和1 mol O2(g) 反应生成2 mol H2O(g) 的反应热 H=?
2H2
O2
4H
2O
2H2O
1 mol H2(g)中的H-H键断裂吸收436 kJ能量
1 mol O2(g)中的化学键断裂吸收498 kJ能量
形成H2O(g)中1 mol H-O键释放463.4 kJ能量
H(估算)= E (反应物键能)-E (生成物键能)
=2×436 kJ/mol+498 kJ/mol-4×463.4 kJ/mol
= 483.6 kJ/mol
2H2
O2
4H
2O
2H2O
1 mol H2(g)中的H-H键断裂吸收436 kJ能量
1 mol O2(g)中的化学键断裂吸收498 kJ能量
形成H2O(g)中1 mol H-O键释放463.4 kJ能量
2H2(g) + O2(g) 2H2O(g) H=?
算一算 拆开 1 mol H H键、1 mol N H键、1 mol N N键所需能量分别是436 kJ、391 kJ、946 kJ,则1 mol N2(g)转化为NH3(g)时的反应热是多少?
= 946 kJ/mol + 3×436 kJ/mol 6×391 kJ/mol
= 92 kJ/mol
H = E (反应物键能)- E (生成物键能)
N2(g) + 3H2(g) 2NH3 (g) H=
问题1:如何用化学用语来表示化学反应
中吸收或者释放的热量呢
热化学方程式:
表明反应所释放或吸收的热量的化学方程式。
1 mol液态H2和 mol液态O2反应生成 1mol气态H2O放出237.5 kJ的热量。
1
2
H2(l) + O2(l) H2O(g) H= 237.5 kJ/mol
1
2
二、热化学方程式
物质变化
能量变化
思考:热化学方程式与化学方程式书写有何不同
符号
( 吸收+、释放 )
H2=+241.8 kJ/mol
H2O(g)
H1= 241.8 kJ/mol
H
H2(g)+ O2(g)
1
2
H2(g) + O2(g) H2O(g) H1= 241.8 kJ/mol
1
2
1
2
H2O(g) H2(g) + O2(g) H2=+241.8 kJ/mol
H
H2O(l)
ΔH2=-285.8 kJ/mol
H2O(g)
ΔH1=-241.8 kJ/mol
H2(g)+ O2(g)
1
2
思考:如果生成的是H2O(l) ,反应热一样吗
H2(g) + O2(g) H2O(g) H1= 241.8 kJ/mol
1
2
H2(g) + O2(g) H2O(l) H2=
1
2
H2= 285.8 kJ/mol
二、热化学方程式
注意:标注状态
固体(s)、液体(l)、气体(g)、溶液(aq)
思考:如果生成的是H2O(l) ,反应热一样吗
H2(g) + O2(g) H2O(g) H1= 241.8 kJ/mol
1
2
H2(g) + O2(g) H2O(l) ΔH2=
1
2
H2= 285.8 kJ/mol
二、热化学方程式
例:常温下,1 L 1 mol/L HCl和 1 L 1 mol/L NaOH溶液恰好完全反应放出57.3 kJ的热量。
注意:标注状态
固体(s)、液体(l)、气体(g)、溶液(aq)
HCl(aq) + NaOH(aq) NaCl(aq) + H2O(l)
H= 57.3 kJ/mol
二、热化学方程式
思考:如果H2与O2消耗量增倍,反应热ΔH 一样吗
注意: 1.化学计量数不表示分子数,仅表示物质的量
(可以是整数,也可以是分数)
2. H 数值与化学计量数相对应
H2(g) + O2(g) H2O(g) H1= 241.8 kJ/mol
1
2
2H2(g) + O2(g) 2H2O(l) H2 =
H2= 483.6 kJ/mol
二、热化学方程式
注意:若为25 oC、101 kPa时可省略,其他温
度和压强必须注明。
比一比:书写热化学方程式还需要注意什么
H2(g) + I2(g) 2HI(g) H= 9.48 kJ/mol
25 oC
101kPa
H2(g) + I2(g) 2HI(g) H= 14.9 kJ/mol
100 oC
101kPa
二、热化学方程式
问题:ΔH 中的单位mol-1代表什么含义?
阅读
教材
P9
H2(g) + O2(g) H2O(g) H= 241.8 kJ/mol
1
2
任务:用结构图梳理书写热化学方程式的注意事项
热化学
方程式
符号
吸热 +
放热
数值
与化学计量
数相对应
单位
kJ/mol
固体(s)
液体(l)
气体(g)
溶液(aq)
化学计量数
与焓变数值对应
表示物质的量
(整数、分数均可)
条件
压强
温度
状态
二、热化学方程式
(1)25 ℃、101 kPa下,8 g CH4完全燃烧,放出
445.0 kJ热量;
(2)液化石油气主要成分是丙烷(C3H8),1 mol
气态丙烷在O2(g)中燃烧,生成CO2(g)和H2O(l),
放出2219.9 kJ热量;
(3)煤气的主要成分为CO和H2,常温下14 g CO完
全燃烧,放出141.5 kJ热量。
练一练:写出下列反应的热化学方程式
二、热化学方程式
查一查:你写对了吗
1
2
1
2
CH4(g) + O2(g) CO2(g) + H2O(l)
H= 445.0 kJ/mol
CH4(g) + 2O2(g) CO2(g) + 2H2O(l)
H= 890 kJ/mol
(1)25 ℃、101 kPa下,8 g CH4完全燃烧,放出
445.0 kJ热量;
二、热化学方程式
查一查:你写对了吗
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(l)
H= 2219.9 kJ/mol
(2)液化石油气主要成分是丙烷(C3H8),1 mol
气态丙烷在O2(g)中燃烧,生成CO2(g)和H2O(l),
放出2219.9 kJ热量;
二、热化学方程式
查一查:你写对了吗
CO(g) + O2(g) CO2(g) H= 283 kJ/mol
1
2
2CO(g) + O2(g) 2CO2(g) H= 566 kJ/mol
(3)煤气的主要成分为CO和H2,常温下14 g CO完
全燃烧,放出141.5 kJ热量。
二、热化学方程式
练一练:CH4可做火箭推进剂的燃料。常温下,0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量。则下列热化学方程式中正确的是
2CH4(g) + 4O2(g) 2CO2(g) + 4H2O(l) H=﹢890 kJ/mol
B . CH4 + 2O2 CO2 + 2H2O H= 890 kJ/mol
C . CH4(g) + 2O2(g) CO2(g) + 2H2O(l) H= 890 kJ/mol
D . CH4(g) + O2(g) CO2(g) + H2O(l) H= 890 kJ/mol
C
H= 445 kJ/mol
H= 1780 kJ/mol
标物质状态
1
2
1
2
二、热化学方程式
E1
E2 = 2752 kJ/mol
H1 = 534 kJ/mol
能量
N2(g) + 2H2O(g)
N2H4(g) + O2(g)
反应物
总能量
生成物
总能量
假想中间物总能量
2N (g) + 4H4(g) + 2O (g)
练一练:肼( H2N-NH2 )是一种火箭推进剂的燃料,有关化学反应的能量变化如下图所示,写出表示肼燃烧的热化学方程式。
N2H4(g) + O2(g) N2(g) + 2H2O(g)
H= 534 kJ/mol
二、热化学方程式
定义:101 kPa时,1 mol纯物质完全燃烧生成指定产物时所放出的热量,叫做该物质的燃烧热,单位为kJ/mol。
三、燃烧热
注意:碳元素变为CO2(g) 、氢元素变为H2O(l)、硫元素变为SO2(g)、氮元素变为N2(g)等 。
CO(g) + O2(g) CO2(g) H= 283 kJ/mol
1
2
2CO(g) + O2(g) 2CO2(g) H= 566 kJ/mol
H2(g) + O2(g) H2O(l) H= 285.8 kJ/mol
三、燃烧热
测定原理:将待测物质放在一个充满氧气的密封金属容器(称为氧弹)内,再将此容器置于盛有一定量水的量热计内筒中,通过点火装置使氧弹中物质燃烧,反应放出的热量会使氧弹外面的水温升高。用温度计测量水温的变化,即可计算出此反应放出的热量。
燃烧热的测量
三、燃烧热
名称 化学式 ΔH/kJ/mol 名称 化学式 ΔH/kJ/mol
石墨 C(s) 393.5 乙烷 C2H6(g) 1559.8
金刚石 C(s) 395.0 乙烯 C2H4(g) 1411.0
氢气 H2(g) 285.8 乙炔 C2H2(g) 1299.6
一氧化碳 CO(g) 283.0 乙醇 C2H5OH(l) 1366.8
甲烷 CH4(g) 890.31 丙烷 C3H8(g) 2219.9
甲醇 CH3OH(l) 726.51 苯 C6H6(l) 3267.5
某些物质的燃烧热(25 oC,101 kPa)
H2(g) + O2(g) H2O(l) H= 285.8 kJ/mol
1
2
三、燃烧热
名称 化学式 ΔH/kJ/mol 名称 化学式 ΔH/kJ/mol
石墨 C(s) 393.5 乙烷 C2H6(g) 1559.8
金刚石 C(s) 395.0 乙烯 C2H4(g) 1411.0
氢气 H2(g) 285.8 乙炔 C2H2(g) 1299.6
一氧化碳 CO(g) 283.0 乙醇 C2H5OH(l) 1366.8
甲烷 CH4(g) 890.31 丙烷 C3H8(g) 2219.9
甲醇 CH3OH(l) 726.51 苯 C6H6(l) 3267.5
某些物质的燃烧热(25 oC,101 kPa)
三、燃烧热
单位质量产生热量: ≈ 13.2 kJ/g
237.5 kJ
2 g+16 g
单位质量产生热量: ≈ 6.4 kJ/g
283 kJ
28 g+16 g
1
2
火箭推进剂燃料的选择
H2(l) + O2(l) H2O(g) H= 237.5 kJ/mol
CO(g) + O2(g) CO2 (g) H= 283 kJ/mol
1
2
优点:绿色、高能、推力大
缺点:低温贮存技术难度大;液氢密度小,燃料箱体积大
液氢-液氧推进剂
资料
火箭推进剂的选择
火箭推进剂的发展主要着眼于能量高、排烟少、污染轻三个方面。
高能推进剂是将来推进剂研究的首选;
无烟推进剂的开发、 应用更是势在必行;
污染少的推进剂将大有发展前途。
随堂训练
1、书写热化学方程式
(4)已知在100 kPa时,1mol石墨转化为金刚石要吸收1.895kJ的热能,写出该反应的热化学方程式:
。
(5)在25 ℃、101 kPa下,一定质量的氢气在1molO2(g)中完全燃烧,生成1molH2O(l),放出571.6 kJ的热量,请写出表示氢气燃烧热的热化学方程式为:
________________________________________________。
H2(g) + 1/2O2(g) = H2O(l)
C(石墨,s) C(金刚石,s)
ΔH =+1.895 kJ/mol
ΔH = -285.8 kJ/mol
小 结
热化学
方程式
物质变化
能量变化
质量守恒定律
能量守恒定律
反应体系是
吸热还是放热
反应体系吸收或
放出热量的多少
表示
遵循
定性
定量
遵循
CONTENTS
燃烧热与中和热的区别与联系
相 同 点 燃烧热 中和热
能量变化 ΔH 不 同 点 反应物的量
生成物的量
反应热 的含义
放热反应
ΔH<0 , 单位 kJ/mol
1mol可燃物
不限
不限量
H2O 1mol
1mol反应物完全燃烧时放出的热量;不同的物质燃烧热不同
酸碱中和生成1mol H2O时放出的热量,强酸强碱间的中和反应中和热大致相同,均约为57.3kJ/mol
谢谢!
