1.1 (第二课时)热化学方程式 课件(共17张PPT)—2022-2023学年高二上学期化学选择性必修1
文档属性
| 名称 | 1.1 (第二课时)热化学方程式 课件(共17张PPT)—2022-2023学年高二上学期化学选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 251.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-01-06 11:55:50 | ||
图片预览






文档简介
(共17张PPT)
人教版(2019版) 化学
化学反应原理
第一章 化学反应的热效应
第一节 反应热
第二课时 热化学方程式
我们已经认识了反应热,那么如何在化学方程式中正确反映其热量的变化?
一、热化学方程式
H2(g) + I2 (g) ==== 2HI(g)
200℃
101kPa
ΔH =
-14.9 kJ/mol
表明反应所释放或吸收的热量的化学方程式.
含义:表示1mol气态H2与1mol气态 I2在200℃、101kPa的条件下完全反应,生成2mol气态HI时,放出14.9kJ的热量。
已知2SO2(g)+O2(g) 2SO3(g);△H=-197kJ/mol ,向密闭容器中通入2molSO2(g)和1molO2(g)发生上述反应,达到平衡后放出的热量 (大于,等于或小于)197kJ。
小于
思考
交流
与化学方程式相比,热化学方程式有哪些不同?
正确书写热化学方程式应注意哪几点?
一、热化学方程式
一、热化学方程式
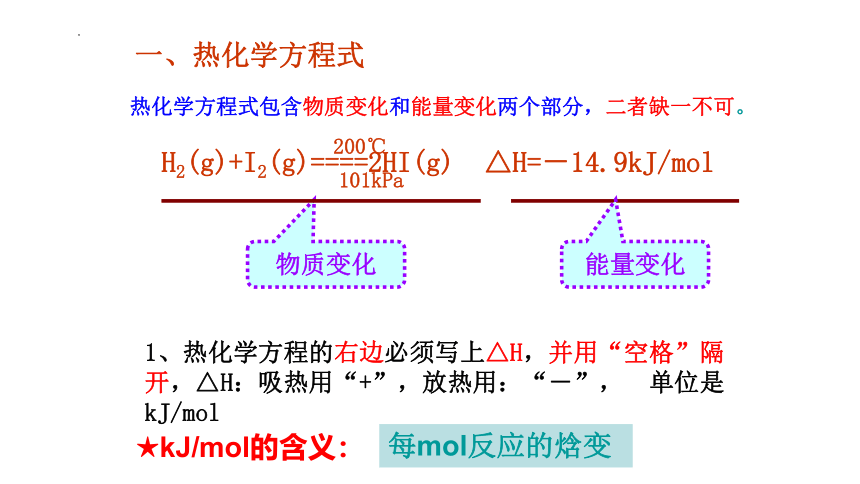
H2(g)+I2(g)====2HI(g) △H=-14.9kJ/mol
200℃
101kPa
物质变化
能量变化
1、热化学方程的右边必须写上△H,并用“空格”隔开,△H:吸热用“+”,放热用:“-”, 单位是kJ/mol
热化学方程式包含物质变化和能量变化两个部分,二者缺一不可。
★kJ/mol的含义:
每mol反应的焓变
一、热化学方程式
H2(g)+I2(g)=====2HI(g) △H=-14.9kJ/mol
200℃
101kPa
2、热化学方程式需注明温度和压强,25℃ 101kPa(常温常压)可不注.
H2(g)+ O2(g)==H2O(g) △H=-241.8kJ/mol
1
2
一、热化学方程式
3、热化学方程式需注明各物质的状态。
( 固体——s、液体——l、气体——g、溶液——aq)
注意:热化学方程式中不用“↑”和“↓”
H2(g)+ O2(g)==H2O(g) △H=-241.8kJ/mol
1
2
H2(g)+ O2(g)==H2O(l) △H=-285.8kJ/mol
1
2
对于同一物质,固态时能量最低,气态时能量最高。
冰s 水 l 水蒸气g
吸热
吸热
一、热化学方程式
4、热化学方程式中化学计量数仅表示参加反应的各物质的物质的量,可为整数或分数;
△H与系数对应成正比;
反应逆向进行,则△H数值不变,符号改变。
普通化学方程式中:宏观表示各物质的物质的量,微观表示原子分子数目,只能为整数,不能为分数。
H2(g)+ O2(g)==H2O(g) △H=-241.8kJ/mol
1
2
2H2(g)+O2(g)==2H2O(g) △H=-483.6kJ/mol
2H2O(g) == 2H2(g)+O2(g) △H=
+483.6kJ/mol
书写热化学方程式的注意点:
1、△H写在右,吸热用“+”,放热用:“-”,单位是kJ/mol;
2、注温度和压强,25℃ 101kPa(常温常压)可不注
3、标聚集状态(s、l、g、aq)
4、化学计量数仅表示物质的量,可整数可分数
5、化学计量数与△H成正比;若反应逆向进行,则△H数值不变,但符号改变;
6、 一般不写反应条件。
例1:当1mol气态H2与1mol气态Cl2反应生成2 mol气态HCl,放出184.6 kJ的热量,请写出该反应的热化学方程式。
H2(g) + Cl2(g) = 2HCl(g) H =-184.6 kJ/mol
2H2(g) + 2Cl2(g) = 4HCl(g) H =-369.2 kJ/mol
H2(g) + Cl2(g) = HCl(g) H =-92.3 kJ/mol
1
2
1
2
二、热化学方程式的书写步骤:
1、写方程
2、标状态
3、标△H(注意单位和+、-)
4、标温度和压强(常温常压可不注明)
2、1gC2H2完全燃烧生成液态水和CO2,放出49.8kJ热量,则1mol C2H2完全燃烧放出的热量为 kJ;
写出C2H2燃烧的热化学方程式:
。
1294.8
随堂练习
1、1mol N2与适量O2 反应生成NO2 ,需吸收68kJ的热量;写出热化学方程式。
N2(g) + 2O2(g) = 2NO2 (g) H = + 68 kJ/mol
C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)
△H=-1294.8KJ/mol
例3、沼气的主要成分是甲烷。0.5 mol CH4完全燃烧生成CO2和水时,放出445 kJ的热量。则下列热化学方程式中正确的是( )
A、2CH4( g ) + 4O2( g ) = 2CO2( g ) + 4H2O ( l )
ΔH = + 890 kJ/mol
B、CH4 + 2O2 = CO2 + H2O ΔH = – 890 kJ/mol
C、CH4 ( g ) + 2 O2 ( g ) = CO2 ( g ) + 2 H2O ( l )
ΔH = – 890 kJ/mol
D、 1/2CH4 ( g ) + O2 ( g ) = 1/2CO2 ( g ) + H2O ( l )
ΔH = – 890 kJ/mol
C
ΔH = – 445 kJ/mol
总结 判断热化学方程式正误“四看”:
一、方程是否配平
二、各物质的聚集状态是否正确
三、ΔH的单位和“+”“-”是否正确
四、反应热数值与计量数是否相对应。
例4、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A. H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g) ΔH=+484kJ·mol-1
A
总结:用结构图梳理书写热化学方程式的注意事项
热化学
方程式
符号
吸热 +
放热
数值
与化学计量
数相对应
单位
kJ/mol
固体(s)
液体(l)
气体(g)
溶液(aq)
化学计量数
与焓变数值对应
表示物质的量
(整数、分数均可)
条件
压强
温度
状态
1.依据事实,写出下列反应的热化学方程式。
0.5mol Cu(s)与适量O2(g)反应生成CuO(s),放出78.65kJ的热量。
2.已知:(1)1 mol N2(g)中的化学键断裂时需要吸收946kJ的能量。(2)1 mol O2(g)中的化学键断裂时需要吸收498kJ的能量。(3)1 mol NO(g)中的化学键形成时要释放632kJ的能量。请写出N2(g)与O2(g)反应生成NO(g)的热化学方程式。
Cu(s)+1/2O2(g)=CuO(s) △H=-157.3kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180kJ/mol
练习:
3.1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出硫燃烧的热化学方程式。
S(s)+O2(g)=SO2 (g) △H=-299.52kJ/mol
练习:
4.已知
(1)H2( g )+1/2O2 ( g ) = H2O ( g ) ΔH1 = akJ/mol
(2)2H2( g )+O2 ( g ) =2H2O ( g ) ΔH2 = b kJ/mol
(3) H2( g )+1/2O2 ( g ) = H2O ( l ) ΔH3 = c kJ/mol
(4) 2H2( g )+O2 ( g ) =2H2O ( l ) ΔH4 = d kJ/mol
则a、b、c、d的关系正确的是 。
A、ad>0 C、2a=b< 0 D、2c=d>0
C
比较热量大小时,只比较数值大小,无正负之分。
比较ΔH大小时要区分正负。ΔH >0 时,反应热数值越大,ΔH越大;ΔH <0时,反应热数值越大, ΔH越小。
人教版(2019版) 化学
化学反应原理
第一章 化学反应的热效应
第一节 反应热
第二课时 热化学方程式
我们已经认识了反应热,那么如何在化学方程式中正确反映其热量的变化?
一、热化学方程式
H2(g) + I2 (g) ==== 2HI(g)
200℃
101kPa
ΔH =
-14.9 kJ/mol
表明反应所释放或吸收的热量的化学方程式.
含义:表示1mol气态H2与1mol气态 I2在200℃、101kPa的条件下完全反应,生成2mol气态HI时,放出14.9kJ的热量。
已知2SO2(g)+O2(g) 2SO3(g);△H=-197kJ/mol ,向密闭容器中通入2molSO2(g)和1molO2(g)发生上述反应,达到平衡后放出的热量 (大于,等于或小于)197kJ。
小于
思考
交流
与化学方程式相比,热化学方程式有哪些不同?
正确书写热化学方程式应注意哪几点?
一、热化学方程式
一、热化学方程式
H2(g)+I2(g)====2HI(g) △H=-14.9kJ/mol
200℃
101kPa
物质变化
能量变化
1、热化学方程的右边必须写上△H,并用“空格”隔开,△H:吸热用“+”,放热用:“-”, 单位是kJ/mol
热化学方程式包含物质变化和能量变化两个部分,二者缺一不可。
★kJ/mol的含义:
每mol反应的焓变
一、热化学方程式
H2(g)+I2(g)=====2HI(g) △H=-14.9kJ/mol
200℃
101kPa
2、热化学方程式需注明温度和压强,25℃ 101kPa(常温常压)可不注.
H2(g)+ O2(g)==H2O(g) △H=-241.8kJ/mol
1
2
一、热化学方程式
3、热化学方程式需注明各物质的状态。
( 固体——s、液体——l、气体——g、溶液——aq)
注意:热化学方程式中不用“↑”和“↓”
H2(g)+ O2(g)==H2O(g) △H=-241.8kJ/mol
1
2
H2(g)+ O2(g)==H2O(l) △H=-285.8kJ/mol
1
2
对于同一物质,固态时能量最低,气态时能量最高。
冰s 水 l 水蒸气g
吸热
吸热
一、热化学方程式
4、热化学方程式中化学计量数仅表示参加反应的各物质的物质的量,可为整数或分数;
△H与系数对应成正比;
反应逆向进行,则△H数值不变,符号改变。
普通化学方程式中:宏观表示各物质的物质的量,微观表示原子分子数目,只能为整数,不能为分数。
H2(g)+ O2(g)==H2O(g) △H=-241.8kJ/mol
1
2
2H2(g)+O2(g)==2H2O(g) △H=-483.6kJ/mol
2H2O(g) == 2H2(g)+O2(g) △H=
+483.6kJ/mol
书写热化学方程式的注意点:
1、△H写在右,吸热用“+”,放热用:“-”,单位是kJ/mol;
2、注温度和压强,25℃ 101kPa(常温常压)可不注
3、标聚集状态(s、l、g、aq)
4、化学计量数仅表示物质的量,可整数可分数
5、化学计量数与△H成正比;若反应逆向进行,则△H数值不变,但符号改变;
6、 一般不写反应条件。
例1:当1mol气态H2与1mol气态Cl2反应生成2 mol气态HCl,放出184.6 kJ的热量,请写出该反应的热化学方程式。
H2(g) + Cl2(g) = 2HCl(g) H =-184.6 kJ/mol
2H2(g) + 2Cl2(g) = 4HCl(g) H =-369.2 kJ/mol
H2(g) + Cl2(g) = HCl(g) H =-92.3 kJ/mol
1
2
1
2
二、热化学方程式的书写步骤:
1、写方程
2、标状态
3、标△H(注意单位和+、-)
4、标温度和压强(常温常压可不注明)
2、1gC2H2完全燃烧生成液态水和CO2,放出49.8kJ热量,则1mol C2H2完全燃烧放出的热量为 kJ;
写出C2H2燃烧的热化学方程式:
。
1294.8
随堂练习
1、1mol N2与适量O2 反应生成NO2 ,需吸收68kJ的热量;写出热化学方程式。
N2(g) + 2O2(g) = 2NO2 (g) H = + 68 kJ/mol
C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)
△H=-1294.8KJ/mol
例3、沼气的主要成分是甲烷。0.5 mol CH4完全燃烧生成CO2和水时,放出445 kJ的热量。则下列热化学方程式中正确的是( )
A、2CH4( g ) + 4O2( g ) = 2CO2( g ) + 4H2O ( l )
ΔH = + 890 kJ/mol
B、CH4 + 2O2 = CO2 + H2O ΔH = – 890 kJ/mol
C、CH4 ( g ) + 2 O2 ( g ) = CO2 ( g ) + 2 H2O ( l )
ΔH = – 890 kJ/mol
D、 1/2CH4 ( g ) + O2 ( g ) = 1/2CO2 ( g ) + H2O ( l )
ΔH = – 890 kJ/mol
C
ΔH = – 445 kJ/mol
总结 判断热化学方程式正误“四看”:
一、方程是否配平
二、各物质的聚集状态是否正确
三、ΔH的单位和“+”“-”是否正确
四、反应热数值与计量数是否相对应。
例4、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A. H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g) ΔH=+484kJ·mol-1
A
总结:用结构图梳理书写热化学方程式的注意事项
热化学
方程式
符号
吸热 +
放热
数值
与化学计量
数相对应
单位
kJ/mol
固体(s)
液体(l)
气体(g)
溶液(aq)
化学计量数
与焓变数值对应
表示物质的量
(整数、分数均可)
条件
压强
温度
状态
1.依据事实,写出下列反应的热化学方程式。
0.5mol Cu(s)与适量O2(g)反应生成CuO(s),放出78.65kJ的热量。
2.已知:(1)1 mol N2(g)中的化学键断裂时需要吸收946kJ的能量。(2)1 mol O2(g)中的化学键断裂时需要吸收498kJ的能量。(3)1 mol NO(g)中的化学键形成时要释放632kJ的能量。请写出N2(g)与O2(g)反应生成NO(g)的热化学方程式。
Cu(s)+1/2O2(g)=CuO(s) △H=-157.3kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180kJ/mol
练习:
3.1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出硫燃烧的热化学方程式。
S(s)+O2(g)=SO2 (g) △H=-299.52kJ/mol
练习:
4.已知
(1)H2( g )+1/2O2 ( g ) = H2O ( g ) ΔH1 = akJ/mol
(2)2H2( g )+O2 ( g ) =2H2O ( g ) ΔH2 = b kJ/mol
(3) H2( g )+1/2O2 ( g ) = H2O ( l ) ΔH3 = c kJ/mol
(4) 2H2( g )+O2 ( g ) =2H2O ( l ) ΔH4 = d kJ/mol
则a、b、c、d的关系正确的是 。
A、a
C
比较热量大小时,只比较数值大小,无正负之分。
比较ΔH大小时要区分正负。ΔH >0 时,反应热数值越大,ΔH越大;ΔH <0时,反应热数值越大, ΔH越小。
