2023春高中化学选择性必修3(人教2019)第一章 有机化合物的结构特点与研究方法 章末检测试卷(一)(含答案)
文档属性
| 名称 | 2023春高中化学选择性必修3(人教2019)第一章 有机化合物的结构特点与研究方法 章末检测试卷(一)(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-11 22:09:20 | ||
图片预览




文档简介
第一章 有机化合物的结构特点与研究方法 章末检测试卷(一)
(满分:100分)
一、选择题(本题包括15小题,每小题3分,共45分。每小题只有一个选项符合题意)
1.(2022·银川检测)下列对有机化合物的分类结果正确的是( )
A.乙烯、苯、环己烷均属于不饱和烃
B.苯、环戊烷、环己烷均属于芳香烃
C.乙烯、乙炔均属于烯烃
D.均属于环烷烃
2.(2021·浙江6月选考,6)下列说法正确的是( )
A.C60和C70互为同位素
B.C2H6和C6H14互为同系物
C. CO和CO2互为同素异形体
D.CH3COOH和CH3OOCH是同一种物质
3.具有解热镇痛及消炎作用的药物“芬必得”主要成分的结构简式为,下列关于“芬必得” 主要成分的叙述错误的是( )
A.该物质的分子式为C13H18O2
B.该物质属于芳香烃
C.该物质属于羧酸类有机物
D.该物质可以发生取代反应
4.如图是立方烷的球棍模型,下列有关说法不正确的是( )
A.它的一氯代物只有一种
B.它的二氯代物有两种
C.它的核磁共振氢谱图上只有一组峰
D.它与苯乙烯(C6H5—CH==CH2)互为同分异构体
5.对于有机物A()的说法正确的是( )
A.A分子中含有8个σ键,2个π键
B.A分子中所有原子均在同一平面上
C.与互为同系物
D.质谱法无法鉴别和,核磁共振氢谱法可以
6.已知以下反应中的四种物质由三种元素组成,其中a分子的空间结构为正四面体,组成a物质的两种元素的原子序数之和小于10,组成b物质的元素为第三周期元素。下列叙述正确的是( )
A.四种分子中的化学键均是极性共价键
B.a、c分子中中心原子均采取sp3杂化
C.四种分子中既有σ键,又有π键
D.b、d分子中共价键的键能:b>d
7.下列是我国古代常见的操作方法,其中带着重号部分的操作原理与化学实验中的分离提纯方法的原理相似的是( )
① ② ③ ④
凡煮汤、欲微火,令小沸……箅渣取液 经月而出蒸烤之……终乃得酒可饮 凡渍药酒,皆须细切……便可漉出 海陆取卤,日晒火煎,煮海熬波,卤水成盐
A.过滤、蒸馏、萃取、蒸发
B.过滤、蒸发、萃取、蒸馏
C.蒸发、萃取、蒸馏、过滤
D.萃取、蒸馏、萃取、蒸发
8.下列化合物的核磁共振氢谱中吸收峰的数目不正确的是( )
A. (2组)
B. (4组)
C. (3组)
D. (4组)
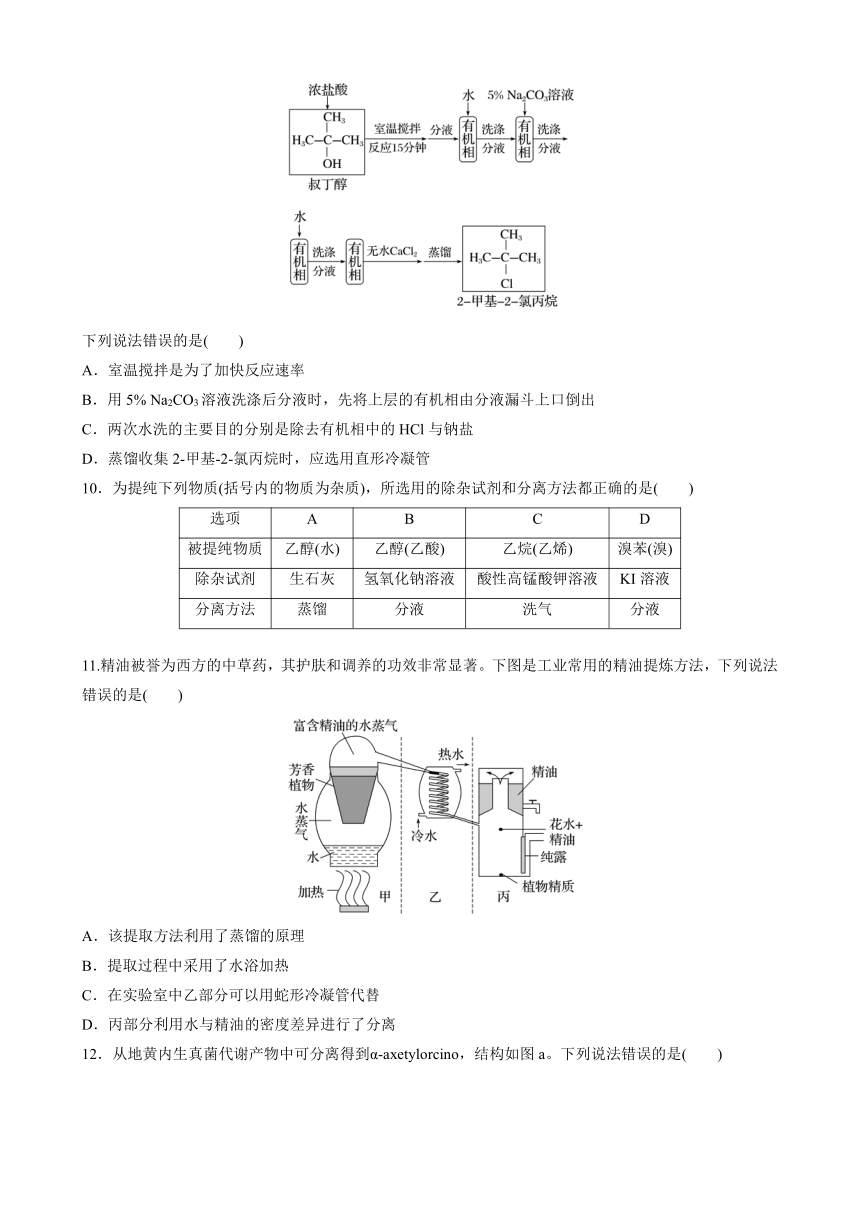
9.实验室由叔丁醇(沸点:82 ℃)与浓盐酸反应制备2 甲基 2 氯丙烷(沸点:52 ℃)的路线如下:
下列说法错误的是( )
A.室温搅拌是为了加快反应速率
B.用5% Na2CO3溶液洗涤后分液时,先将上层的有机相由分液漏斗上口倒出
C.两次水洗的主要目的分别是除去有机相中的HCl与钠盐
D.蒸馏收集2 甲基 2 氯丙烷时,应选用直形冷凝管
10.为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法都正确的是( )
选项 A B C D
被提纯物质 乙醇(水) 乙醇(乙酸) 乙烷(乙烯) 溴苯(溴)
除杂试剂 生石灰 氢氧化钠溶液 酸性高锰酸钾溶液 KI溶液
分离方法 蒸馏 分液 洗气 分液
11.精油被誉为西方的中草药,其护肤和调养的功效非常显著。下图是工业常用的精油提炼方法,下列说法错误的是( )
A.该提取方法利用了蒸馏的原理
B.提取过程中采用了水浴加热
C.在实验室中乙部分可以用蛇形冷凝管代替
D.丙部分利用水与精油的密度差异进行了分离
12.从地黄内生真菌代谢产物中可分离得到α axetylorcino,结构如图a。下列说法错误的是( )
A.α axetylorcino分子中含有三种含氧官能团
B.图b所示有机物是α axetylorcino的同分异构体
C.α axetylorcino分子中C原子的杂化方式为sp2、sp3
D.α axetylorcino属于芳香族化合物
13.某有机物结构如图所示,它的结构最多有( )
A.108种 B.72种 C.56种 D.32种
14.下列各组物质不互为同分异构体的是( )
A.和
B.和
C.CO(NH2)2和NH4CNO
D.和HCOOCH2CH2CH3
15.茴香醛可用于香料的配制和有机合成,间茴香醛的结构如图所示。下列说法正确的是( )
A.间茴香醛的分子式是C8H8O2
B.1个间茴香醛分子中有16个σ键
C.间茴香醛分子中所有碳原子不可能共平面
D.对茴香醛分子中含有3种不同化学环境的氢原子
二、非选择题(本题包括5小题,共55分)
16.(12分)现有六种有机物,请回答下列问题:
A.
B.
C.
D.
E.
F.
(1)A中含有的官能团名称为____________________、__________________。
(2)B的分子式为________________。
(3)D的一氯代物最多有________________种。
(4)上述化合物中互为同分异构体的是__________(填字母,下同);互为同系物的是________。
17.(8分)一般来说,对一种未知有机物结构的测定主要包括以下几个方面:
①确定相对分子质量;
②测定元素组成(种类和比例);
③研究该有机物的各种性质;
④确定结构。
(1)相对分子质量的确定一般利用质谱法、蒸气密度法等。某有机物A的质谱图显示其相对分子质量最大是72。组成元素的测定常采用元素分析仪,也可采用燃烧法。称取3.6 g A,在足量氧气中充分燃烧,生成物通过浓硫酸后,浓硫酸的质量增加5.4 g,剩余气体通过碱石灰,碱石灰的质量增加11 g,则有机物A的分子式为________。
(2)核磁共振谱常用氢谱或碳谱,它主要测定分子中具有不同特点的H或C的种类与比例。如对于有机物,其碳谱有四组峰,峰面积之比为2∶1∶1∶1;氢谱有四组峰,峰面积之比为1∶2∶3∶6。有机物A的碳谱有两组峰,峰面积之比为4∶1,氢谱有一组峰。试写出有机物A的结构简式:__________。
(3)有机物A的一氯代物有__________种,二氯代物有________种。
18.(12分)实验室制备苯甲醇和苯甲酸的化学原理是
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3 ℃;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,溶解度为0.34 g;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
试根据上述信息回答下列问题:
(1)操作Ⅰ的名称是________,乙醚溶液中所溶解的主要成分是________。
(2)操作Ⅱ的名称是________,产品甲是________。
(3)操作Ⅲ的名称是________,产品乙是________。
(4)如图所示,操作Ⅱ中温度计水银球上沿放置的位置应是________(填“a”“b”“c”或“d”)处,该操作中,除需蒸馏烧瓶、温度计外,还需要的玻璃仪器是_________________,收集产品甲的适宜温度为________。
19.(13分)正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
发生的反应如下:
CH3CH2CH2CH2OHCH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ 密度/(g·cm-3) 水中溶解性
正丁醇 117.2 0.810 9 微溶
正丁醛 75.7 0.801 7 微溶
实验步骤如下:
将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以下的馏分。
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77 ℃馏分,产量为2.0 g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液滴加到浓硫酸中,并说明理由:__________________________
_____________________________________________。
(2)加入沸石的作用是____________。若加热后发现未加沸石,应采取的正确方法是________________________________________________________________________。
(3)上述装置图中,仪器B的名称是____________,仪器D的名称是____________。(4)分液漏斗使用前必须进行的操作是______(填字母)。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分离水时,水在____________(填“上”或“下”)层。
(6)反应温度应保持在90~95 ℃,其原因是_______________________________________
________________________________________________________________________。
20.(10分)有机物C常用于食品行业。已知9.0 g C在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4 g和13.2 g,经检验剩余气体为O2。
(1)C分子的质谱图如图所示,从图中可知其相对分子质量是________,则C的分子式是________。
(2)C能与NaHCO3溶液发生反应,C一定含有的官能团名称是________。
(3)C分子的核磁共振氢谱有4组峰,峰面积之比是1∶1∶1∶3,则C的结构简式是________________________________________________________________________。
(4)0.1 mol C与足量Na反应,在标准状况下产生H2的体积是________L。
章末检测试卷(一)
1.D 2.B 3.B
4.B [立方烷分子中仅有1种等效氢原子,因此它的一氯代物只有一种,且核磁共振氢谱图上只有一组峰,A、C项正确;立方烷和苯乙烯的分子式均为C8H8,二者互为同分异构体,D项正确;立方烷分子中的碳原子形成正方体结构,其二氯代物的两个氯原子可分别在正方体的棱、面对角线、体对角线上,共3种,B项错误。]
5.D [结合有机物A的结构,可知A分子中含有16个σ键(C—H未标出),2个π键,A项错误;A分子中含有甲基,结合甲基的结构特征,可知所有原子不可能在同一个平面上,B项错误;与的结构不相似,一个为五元环、一个为六元环,不互为同系物,C项错误;质谱法可以测定有机物的相对分子质量,核磁共振氢谱法可以测定不同化学环境的氢原子的种数及其相对数目,和互为同分异构体,相对分子质量相等,故质谱法无法鉴别,二者分子中不同化学环境的氢原子的种数及其相对数目均不同,故核磁共振氢谱法可以鉴别,D项正确。]
6.B [a分子的空间结构为正四面体,组成a物质的两种元素的原子序数之和小于10,所以a是甲烷;组成b物质的元素为第三周期的元素,b分子是双原子分子,是氯气分子,所以该反应是甲烷与氯气在光照条件下反应生成一氯甲烷和氯化氢,c是一氯甲烷,d是氯化氢,根据此分析作答。b分子中只存在非极性共价键,故A错误;甲烷分子、一氯甲烷分子的中心原子均为sp3杂化,故B正确;四种分子中只存在σ键而没有π键,故C错误;氯原子半径大于氢原子半径,所以氯气分子中的Cl—Cl的键能小于氯化氢分子中的H—Cl的键能,故D错误。]
7.A
8.B [A项,分子中心对称,有2种不同化学环境的氢原子,吸收峰有2组,正确;B项,有5种不同化学环境的氢原子,吸收峰有5组,不正确;C项,有3种不同化学环境的氢原子,吸收峰有3组,正确;D项,该分子按中心点旋转180°后重叠,有4种不同化学环境的氢原子,吸收峰有4组,正确。]
9.B 10.A 11.B 12.B
13.B [—C5H11是戊烷去掉一个H之后形成的戊基,共8种;—C3H5Br2根据碳架异构和Br位置异构共9种,因此共8×9=72种结构。]
14.D
15.A [由间茴香醛的结构可知其分子式是C8H8O2,A正确;1个间茴香醛分子中有18个 σ键,B错误;醛基碳原子与苯环直接相连,则醛基碳原子一定与苯环在同一平面上,单键可以旋转,可使甲基碳原子与苯环在同一平面上,则间茴香醛分子中所有碳原子可能共平面,C错误;对茴香醛分子中,醛基上有1种氢原子、苯环上有4种氢原子、甲基上有1种氢原子,共有6种不同化学环境的氢原子,D错误。]
16.(1)碳碳双键 羟基 (2)C9H12O (3)4 (4)A和C
B和F
17.(1)C5H12 (2) (3)1 2
解析 (1)燃烧后产物通过浓硫酸,浓硫酸增重5.4 g,即燃烧生成的水为5.4 g,物质的量为0.3 mol,说明A中有H,物质的量为0.6 mol;通过碱石灰,增重11 g,碱石灰吸收的为CO2,则燃烧生成的CO2物质的量为0.25 mol,说明A中有C,物质的量为0.25 mol。则C原子和H原子的质量和为0.25 mol×12 g·mol-1+0.6 mol×1 g·mol-1=3.6 g,则有机物A只含C、H两种元素。质谱图显示其相对分子质量为72,3.6 g A的物质的量为0.05 mol,所以1个A分子中的碳原子数为=5,氢原子数为=12,所以A的分子式为C5H12。
(2)有机物A的碳谱有两组峰,峰面积之比为4∶1,说明A中有2种类型的碳原子,氢谱有一组峰,说明只有1种类型的氢原子,所以A的结构简式为。(3)A分子中的氢原子都是等效氢,所以只有1种一氯代物。如果分子中的2个氢原子被氯原子代替,可以是同一个碳原子上的2个氢原子被氯原子取代,也可以是不同碳原子上的氢原子被氯原子取代,所以二氯代物有2种。
18.(1)萃取、分液 苯甲醇 (2)蒸馏 苯甲醇
(3)过滤 苯甲酸 (4)b 冷凝管、酒精灯、锥形瓶、牛角管 34.8 ℃
19.(1)不能,易造成液体飞溅 (2)防止暴沸 冷却后补加 (3)分液漏斗 (直形)冷凝管 (4)c (5)下 (6)既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化
20.(1)90 C3H6O3 (2)羧基
(3) (4)2.24
解析 (1)有机物质谱图中,最右边的峰表示有机物的相对分子质量,因此该有机物的相对分子质量为90。浓H2SO4吸水,所以生成的水是5.4 g,即0.3 mol;碱石灰吸收CO2,则CO2是13.2 g,即0.3 mol。所以9.0 g C中氧原子的物质的量是=0.3 mol,所以此有机物的实验式为CH2O,又因其相对分子质量为90,所以C的分子式为C3H6O3。(2)C能与NaHCO3溶液发生反应,则C中含有官能团羧基。(3)根据氢原子的种类及个数之比可知,C的结构简式为。(4)1个C分子中含有1个羟基和1个羧基,所以0.1 mol C与足量Na反应能生成0.1 mol H2,标准状况下的体积是2.24 L。
(满分:100分)
一、选择题(本题包括15小题,每小题3分,共45分。每小题只有一个选项符合题意)
1.(2022·银川检测)下列对有机化合物的分类结果正确的是( )
A.乙烯、苯、环己烷均属于不饱和烃
B.苯、环戊烷、环己烷均属于芳香烃
C.乙烯、乙炔均属于烯烃
D.均属于环烷烃
2.(2021·浙江6月选考,6)下列说法正确的是( )
A.C60和C70互为同位素
B.C2H6和C6H14互为同系物
C. CO和CO2互为同素异形体
D.CH3COOH和CH3OOCH是同一种物质
3.具有解热镇痛及消炎作用的药物“芬必得”主要成分的结构简式为,下列关于“芬必得” 主要成分的叙述错误的是( )
A.该物质的分子式为C13H18O2
B.该物质属于芳香烃
C.该物质属于羧酸类有机物
D.该物质可以发生取代反应
4.如图是立方烷的球棍模型,下列有关说法不正确的是( )
A.它的一氯代物只有一种
B.它的二氯代物有两种
C.它的核磁共振氢谱图上只有一组峰
D.它与苯乙烯(C6H5—CH==CH2)互为同分异构体
5.对于有机物A()的说法正确的是( )
A.A分子中含有8个σ键,2个π键
B.A分子中所有原子均在同一平面上
C.与互为同系物
D.质谱法无法鉴别和,核磁共振氢谱法可以
6.已知以下反应中的四种物质由三种元素组成,其中a分子的空间结构为正四面体,组成a物质的两种元素的原子序数之和小于10,组成b物质的元素为第三周期元素。下列叙述正确的是( )
A.四种分子中的化学键均是极性共价键
B.a、c分子中中心原子均采取sp3杂化
C.四种分子中既有σ键,又有π键
D.b、d分子中共价键的键能:b>d
7.下列是我国古代常见的操作方法,其中带着重号部分的操作原理与化学实验中的分离提纯方法的原理相似的是( )
① ② ③ ④
凡煮汤、欲微火,令小沸……箅渣取液 经月而出蒸烤之……终乃得酒可饮 凡渍药酒,皆须细切……便可漉出 海陆取卤,日晒火煎,煮海熬波,卤水成盐
A.过滤、蒸馏、萃取、蒸发
B.过滤、蒸发、萃取、蒸馏
C.蒸发、萃取、蒸馏、过滤
D.萃取、蒸馏、萃取、蒸发
8.下列化合物的核磁共振氢谱中吸收峰的数目不正确的是( )
A. (2组)
B. (4组)
C. (3组)
D. (4组)
9.实验室由叔丁醇(沸点:82 ℃)与浓盐酸反应制备2 甲基 2 氯丙烷(沸点:52 ℃)的路线如下:
下列说法错误的是( )
A.室温搅拌是为了加快反应速率
B.用5% Na2CO3溶液洗涤后分液时,先将上层的有机相由分液漏斗上口倒出
C.两次水洗的主要目的分别是除去有机相中的HCl与钠盐
D.蒸馏收集2 甲基 2 氯丙烷时,应选用直形冷凝管
10.为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法都正确的是( )
选项 A B C D
被提纯物质 乙醇(水) 乙醇(乙酸) 乙烷(乙烯) 溴苯(溴)
除杂试剂 生石灰 氢氧化钠溶液 酸性高锰酸钾溶液 KI溶液
分离方法 蒸馏 分液 洗气 分液
11.精油被誉为西方的中草药,其护肤和调养的功效非常显著。下图是工业常用的精油提炼方法,下列说法错误的是( )
A.该提取方法利用了蒸馏的原理
B.提取过程中采用了水浴加热
C.在实验室中乙部分可以用蛇形冷凝管代替
D.丙部分利用水与精油的密度差异进行了分离
12.从地黄内生真菌代谢产物中可分离得到α axetylorcino,结构如图a。下列说法错误的是( )
A.α axetylorcino分子中含有三种含氧官能团
B.图b所示有机物是α axetylorcino的同分异构体
C.α axetylorcino分子中C原子的杂化方式为sp2、sp3
D.α axetylorcino属于芳香族化合物
13.某有机物结构如图所示,它的结构最多有( )
A.108种 B.72种 C.56种 D.32种
14.下列各组物质不互为同分异构体的是( )
A.和
B.和
C.CO(NH2)2和NH4CNO
D.和HCOOCH2CH2CH3
15.茴香醛可用于香料的配制和有机合成,间茴香醛的结构如图所示。下列说法正确的是( )
A.间茴香醛的分子式是C8H8O2
B.1个间茴香醛分子中有16个σ键
C.间茴香醛分子中所有碳原子不可能共平面
D.对茴香醛分子中含有3种不同化学环境的氢原子
二、非选择题(本题包括5小题,共55分)
16.(12分)现有六种有机物,请回答下列问题:
A.
B.
C.
D.
E.
F.
(1)A中含有的官能团名称为____________________、__________________。
(2)B的分子式为________________。
(3)D的一氯代物最多有________________种。
(4)上述化合物中互为同分异构体的是__________(填字母,下同);互为同系物的是________。
17.(8分)一般来说,对一种未知有机物结构的测定主要包括以下几个方面:
①确定相对分子质量;
②测定元素组成(种类和比例);
③研究该有机物的各种性质;
④确定结构。
(1)相对分子质量的确定一般利用质谱法、蒸气密度法等。某有机物A的质谱图显示其相对分子质量最大是72。组成元素的测定常采用元素分析仪,也可采用燃烧法。称取3.6 g A,在足量氧气中充分燃烧,生成物通过浓硫酸后,浓硫酸的质量增加5.4 g,剩余气体通过碱石灰,碱石灰的质量增加11 g,则有机物A的分子式为________。
(2)核磁共振谱常用氢谱或碳谱,它主要测定分子中具有不同特点的H或C的种类与比例。如对于有机物,其碳谱有四组峰,峰面积之比为2∶1∶1∶1;氢谱有四组峰,峰面积之比为1∶2∶3∶6。有机物A的碳谱有两组峰,峰面积之比为4∶1,氢谱有一组峰。试写出有机物A的结构简式:__________。
(3)有机物A的一氯代物有__________种,二氯代物有________种。
18.(12分)实验室制备苯甲醇和苯甲酸的化学原理是
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3 ℃;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,溶解度为0.34 g;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
试根据上述信息回答下列问题:
(1)操作Ⅰ的名称是________,乙醚溶液中所溶解的主要成分是________。
(2)操作Ⅱ的名称是________,产品甲是________。
(3)操作Ⅲ的名称是________,产品乙是________。
(4)如图所示,操作Ⅱ中温度计水银球上沿放置的位置应是________(填“a”“b”“c”或“d”)处,该操作中,除需蒸馏烧瓶、温度计外,还需要的玻璃仪器是_________________,收集产品甲的适宜温度为________。
19.(13分)正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
发生的反应如下:
CH3CH2CH2CH2OHCH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ 密度/(g·cm-3) 水中溶解性
正丁醇 117.2 0.810 9 微溶
正丁醛 75.7 0.801 7 微溶
实验步骤如下:
将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以下的馏分。
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77 ℃馏分,产量为2.0 g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液滴加到浓硫酸中,并说明理由:__________________________
_____________________________________________。
(2)加入沸石的作用是____________。若加热后发现未加沸石,应采取的正确方法是________________________________________________________________________。
(3)上述装置图中,仪器B的名称是____________,仪器D的名称是____________。(4)分液漏斗使用前必须进行的操作是______(填字母)。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分离水时,水在____________(填“上”或“下”)层。
(6)反应温度应保持在90~95 ℃,其原因是_______________________________________
________________________________________________________________________。
20.(10分)有机物C常用于食品行业。已知9.0 g C在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4 g和13.2 g,经检验剩余气体为O2。
(1)C分子的质谱图如图所示,从图中可知其相对分子质量是________,则C的分子式是________。
(2)C能与NaHCO3溶液发生反应,C一定含有的官能团名称是________。
(3)C分子的核磁共振氢谱有4组峰,峰面积之比是1∶1∶1∶3,则C的结构简式是________________________________________________________________________。
(4)0.1 mol C与足量Na反应,在标准状况下产生H2的体积是________L。
章末检测试卷(一)
1.D 2.B 3.B
4.B [立方烷分子中仅有1种等效氢原子,因此它的一氯代物只有一种,且核磁共振氢谱图上只有一组峰,A、C项正确;立方烷和苯乙烯的分子式均为C8H8,二者互为同分异构体,D项正确;立方烷分子中的碳原子形成正方体结构,其二氯代物的两个氯原子可分别在正方体的棱、面对角线、体对角线上,共3种,B项错误。]
5.D [结合有机物A的结构,可知A分子中含有16个σ键(C—H未标出),2个π键,A项错误;A分子中含有甲基,结合甲基的结构特征,可知所有原子不可能在同一个平面上,B项错误;与的结构不相似,一个为五元环、一个为六元环,不互为同系物,C项错误;质谱法可以测定有机物的相对分子质量,核磁共振氢谱法可以测定不同化学环境的氢原子的种数及其相对数目,和互为同分异构体,相对分子质量相等,故质谱法无法鉴别,二者分子中不同化学环境的氢原子的种数及其相对数目均不同,故核磁共振氢谱法可以鉴别,D项正确。]
6.B [a分子的空间结构为正四面体,组成a物质的两种元素的原子序数之和小于10,所以a是甲烷;组成b物质的元素为第三周期的元素,b分子是双原子分子,是氯气分子,所以该反应是甲烷与氯气在光照条件下反应生成一氯甲烷和氯化氢,c是一氯甲烷,d是氯化氢,根据此分析作答。b分子中只存在非极性共价键,故A错误;甲烷分子、一氯甲烷分子的中心原子均为sp3杂化,故B正确;四种分子中只存在σ键而没有π键,故C错误;氯原子半径大于氢原子半径,所以氯气分子中的Cl—Cl的键能小于氯化氢分子中的H—Cl的键能,故D错误。]
7.A
8.B [A项,分子中心对称,有2种不同化学环境的氢原子,吸收峰有2组,正确;B项,有5种不同化学环境的氢原子,吸收峰有5组,不正确;C项,有3种不同化学环境的氢原子,吸收峰有3组,正确;D项,该分子按中心点旋转180°后重叠,有4种不同化学环境的氢原子,吸收峰有4组,正确。]
9.B 10.A 11.B 12.B
13.B [—C5H11是戊烷去掉一个H之后形成的戊基,共8种;—C3H5Br2根据碳架异构和Br位置异构共9种,因此共8×9=72种结构。]
14.D
15.A [由间茴香醛的结构可知其分子式是C8H8O2,A正确;1个间茴香醛分子中有18个 σ键,B错误;醛基碳原子与苯环直接相连,则醛基碳原子一定与苯环在同一平面上,单键可以旋转,可使甲基碳原子与苯环在同一平面上,则间茴香醛分子中所有碳原子可能共平面,C错误;对茴香醛分子中,醛基上有1种氢原子、苯环上有4种氢原子、甲基上有1种氢原子,共有6种不同化学环境的氢原子,D错误。]
16.(1)碳碳双键 羟基 (2)C9H12O (3)4 (4)A和C
B和F
17.(1)C5H12 (2) (3)1 2
解析 (1)燃烧后产物通过浓硫酸,浓硫酸增重5.4 g,即燃烧生成的水为5.4 g,物质的量为0.3 mol,说明A中有H,物质的量为0.6 mol;通过碱石灰,增重11 g,碱石灰吸收的为CO2,则燃烧生成的CO2物质的量为0.25 mol,说明A中有C,物质的量为0.25 mol。则C原子和H原子的质量和为0.25 mol×12 g·mol-1+0.6 mol×1 g·mol-1=3.6 g,则有机物A只含C、H两种元素。质谱图显示其相对分子质量为72,3.6 g A的物质的量为0.05 mol,所以1个A分子中的碳原子数为=5,氢原子数为=12,所以A的分子式为C5H12。
(2)有机物A的碳谱有两组峰,峰面积之比为4∶1,说明A中有2种类型的碳原子,氢谱有一组峰,说明只有1种类型的氢原子,所以A的结构简式为。(3)A分子中的氢原子都是等效氢,所以只有1种一氯代物。如果分子中的2个氢原子被氯原子代替,可以是同一个碳原子上的2个氢原子被氯原子取代,也可以是不同碳原子上的氢原子被氯原子取代,所以二氯代物有2种。
18.(1)萃取、分液 苯甲醇 (2)蒸馏 苯甲醇
(3)过滤 苯甲酸 (4)b 冷凝管、酒精灯、锥形瓶、牛角管 34.8 ℃
19.(1)不能,易造成液体飞溅 (2)防止暴沸 冷却后补加 (3)分液漏斗 (直形)冷凝管 (4)c (5)下 (6)既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化
20.(1)90 C3H6O3 (2)羧基
(3) (4)2.24
解析 (1)有机物质谱图中,最右边的峰表示有机物的相对分子质量,因此该有机物的相对分子质量为90。浓H2SO4吸水,所以生成的水是5.4 g,即0.3 mol;碱石灰吸收CO2,则CO2是13.2 g,即0.3 mol。所以9.0 g C中氧原子的物质的量是=0.3 mol,所以此有机物的实验式为CH2O,又因其相对分子质量为90,所以C的分子式为C3H6O3。(2)C能与NaHCO3溶液发生反应,则C中含有官能团羧基。(3)根据氢原子的种类及个数之比可知,C的结构简式为。(4)1个C分子中含有1个羟基和1个羧基,所以0.1 mol C与足量Na反应能生成0.1 mol H2,标准状况下的体积是2.24 L。
