9.2溶解度同步练习人教版化学九年级下册(有答案)
文档属性
| 名称 | 9.2溶解度同步练习人教版化学九年级下册(有答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 120.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-11 00:00:00 | ||
图片预览




文档简介
9.2溶解度同步练习人教版化学九年级下册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列有关NaCl溶液的说法,错误的是
A.NaCl溶液是均一的、稳定的混合物
B.将植物油加入NaCl溶液中并搅拌,静置后会分层
C.NaCl饱和溶液中不能再溶解其它任何物质
D.NaCl溶液是由NaCl和水组成的
2.下图是甲乙两种物质(不考虑结晶水)的溶解度曲线,下列说法正确的是
A.a1℃时,向甲的饱和溶液,加入25g甲,再升温至a ℃,烧杯底部有5g不溶物
B.a ℃,甲的饱和溶液可以配制成10%的甲溶液500g
C.a ℃甲的溶液中溶质和溶剂的质量比一定小于1:2
D.a ℃时,将等质量的甲乙两物质的饱和溶液降温至a1℃,所得溶液中溶质质量甲等于乙
3.下图为Ca(OH)2的溶解度曲线;下表为20℃时溶解度的相对大小。下列说法正确的是( )
溶解度/g 一般称为
<0.01 难溶
0.01~1 微溶
1~10 可溶
>10 易容
A.Ca(OH)2 属于易溶物质
B.Ca(OH)2的溶解度随温度的升高而增大
C.30℃时,Ca(OH)2的饱和溶液中溶质与溶剂的质量比为3﹕20
D.70℃时Ca(OH)2的饱和溶液,降温到50℃时没有析出固体
4.下列液体去除油污效果最好的是
A.洗洁精 B.食盐水
C.白醋 D.自来水
5.如图,将红砂糖倒入一杯开水中,充分溶解。能作为判断砂糖水是饱和溶液的依据是( )
A.砂糖水颜色很深 B.砂糖水味道很甜
C.砂糖溶解得很快 D.砂糖固体有剩余
6.下列关于溶液的说法正确的是
A.溶液一定是混合物
B.饱和溶液的浓度比不饱和溶液的浓度一定大
C.医用碘酒是碘的水溶液
D.添加溶质是不饱和溶液变成饱和溶液的唯一方法
7.要想从食盐溶液中得到食盐晶体,宜采取的方法是( )
A.蒸发溶剂的方法 B.冷却热饱和溶液的方法
C.倒掉部分溶液的方法 D.升高温度的方法
8.能使气体物质溶解度增大的操作是
A.增加溶剂 B.振荡溶液 C.增大压强 D.升高温度
9.如图是MgCl2、KCl和MgSO4的溶解度曲线。下列说法错误的是( )
A.P点表示t2℃时KCl和MgSO4的溶解度相等
B.t1℃时三种物质的饱和溶液中,溶质质量分数最大的是MgCl2
C.将t2℃时的三种物质的饱和溶液分别升温至t3℃,会析出晶体的是MgSO4
D.t2℃时,将40g MgCl2加入50g水中充分搅拌,所得溶液质量为90g
10.不同温度下KNO3的溶解度如下表所示。下列说法正确的是
温度/℃ 20 30 40
溶解度/g 31.6 45.8 63.9
A.20℃时,100gKNO3饱和溶液中溶质质量为31.6g
B.30℃时,100gKNO3饱和溶液的溶质质量分数为45.8%
C.30℃时,将50gKNO3放入100g水中得到150g溶液
D.40℃时,100g水最多溶解63.9gKNO3
二、判断题
11.饱和溶液降低温度一定会析出晶体( )
12.高锰酸钾加入到汽油中后:溶解,形成紫红色溶液( )
13.搅拌不能改变物质的溶解度。( )
14.稀溶液一定是不饱和溶液( )
15.饱和溶液析出晶体后,溶液一定变稀。( )
三、填空题
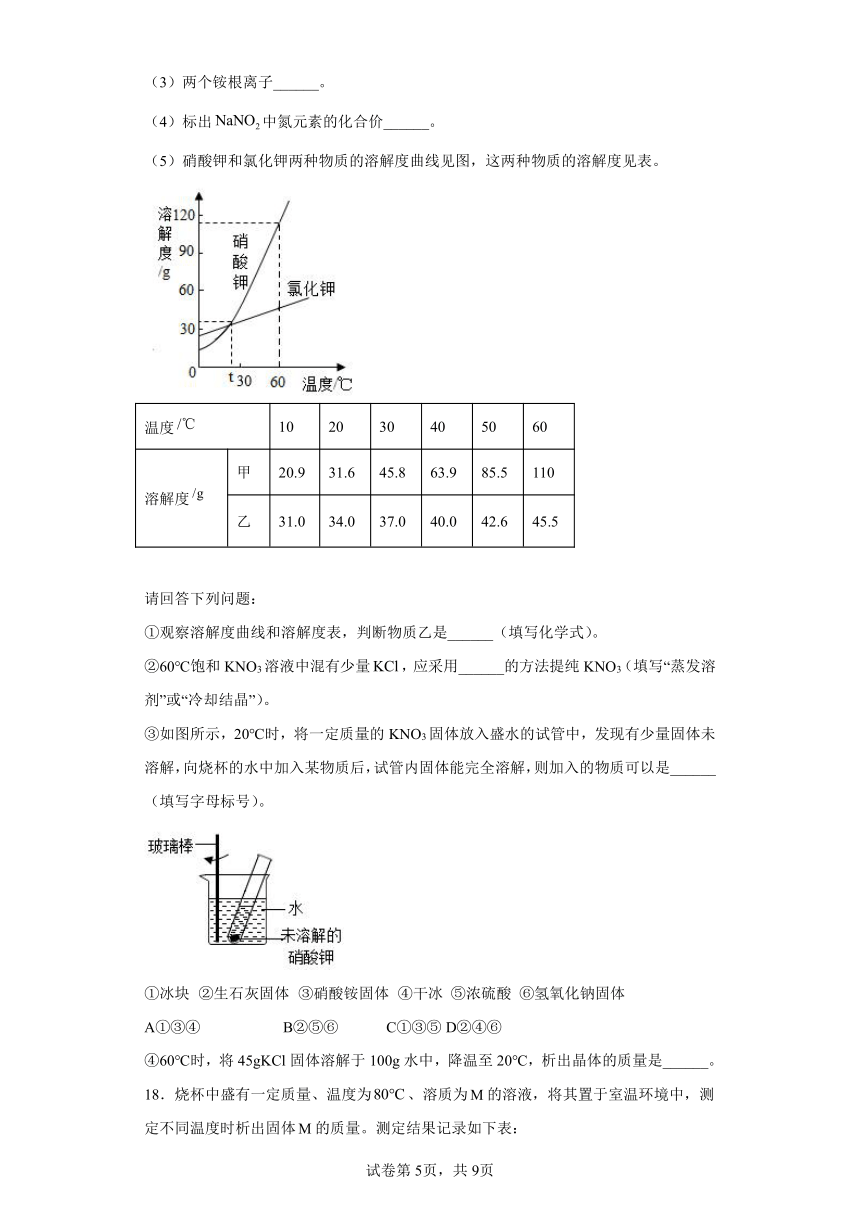
16.硝酸钾和氯化钾两种物质的溶解度曲线见下图,这两种物质的溶解度见下表。
温度/℃ 10 20 30 40 50 60
溶解度/g 甲 20.9 31.6 45.8 63.9 85.5 110
乙 31.0 34.0 37.0 40.0 42.6 45.5
请回答下列问题:
(1)观察溶解度曲线和溶解度表,判断物质乙是指________(填写化学式)。
(2)60℃时,饱和KNO3溶液中混有少量KCl,应采用________的方法提纯KNO3(填写“蒸发溶剂”或“冷却结晶”)。
(3)60℃时,分别将等质量的KNO3和KCl两种物质的饱和溶液温度降至t ℃,析出晶体的质量关系为:KNO3_____ KCl(填写“>”“=”或“<”)。
(4)如图所示,20℃时,将一定质量的KNO3固体放入盛水的试管中,发现有少量固体未溶解,向烧杯的水中加入某物质后,试管内固体能完全溶解。则加入的物质可以是_____(填写字母标号)。
①冰块 ②生石灰固体 ③硝酸铵固体 ④干冰 ⑤浓硫酸 ⑥氢氧化钠固体
A ①③④ B ②⑤⑥ C ①③⑤ D ②④⑥
(5)60 ℃时,将45g KCl固体溶解于100 g水中,降温至20 ℃,析出晶体的质量是______。
17.用化学用语填空。
(1)氯气______。
(2)75%医用酒精溶液中的溶质______。
(3)两个铵根离子______。
(4)标出中氮元素的化合价______。
(5)硝酸钾和氯化钾两种物质的溶解度曲线见图,这两种物质的溶解度见表。
温度 10 20 30 40 50 60
溶解度 甲 20.9 31.6 45.8 63.9 85.5 110
乙 31.0 34.0 37.0 40.0 42.6 45.5
请回答下列问题:
①观察溶解度曲线和溶解度表,判断物质乙是______(填写化学式)。
②60℃饱和KNO3溶液中混有少量,应采用______的方法提纯KNO3(填写“蒸发溶剂”或“冷却结晶”)。
③如图所示,20℃时,将一定质量的KNO3固体放入盛水的试管中,发现有少量固体未溶解,向烧杯的水中加入某物质后,试管内固体能完全溶解,则加入的物质可以是______(填写字母标号)。
①冰块 ②生石灰固体 ③硝酸铵固体 ④干冰 ⑤浓硫酸 ⑥氢氧化钠固体
A①③④ B②⑤⑥ C①③⑤ D②④⑥
④60℃时,将45gKCl固体溶解于100g水中,降温至20℃,析出晶体的质量是______。
18.烧杯中盛有一定质量、温度为、溶质为的溶液,将其置于室温环境中,测定不同温度时析出固体的质量。测定结果记录如下表:
溶液的温度/ 75 65 50 35 20
析出固体的质量/ 0 0 2.0 4.5 8.4
若不考虑水蒸发对实验的影响,请回答下列问题:
(1)时,该溶液是否为饱和溶液?______(选填“是”、“否”或“无法判断”)。
(2)将时接近饱和的溶液变成饱和溶液,下列方法中一定能达到目的的有______(填序号)。
①升温 ②降温 ③加溶质 ④加水 ⑤加另一种固体 ⑥恒温蒸发水 ⑦与时的饱和溶液混合
(3)分析表中的数据可知的溶解性受温度影响的情况是______。
19.R是硝酸钾或氯化铵中的一种。硝酸钾和氯化铵的溶解度曲线如图1所示.某化学兴趣小组的同学进行了如图2所示实验。
(1)t1℃时,氯化铵的溶解度为____g。
(2)①的溶液中溶质质量分数为______。
(3)根据以上信息可推出R是______(写名称或化学式均可)。
(4)关于图2中烧杯内的物质,以下几种说法正确的有_____。
A.①、②、③中,只有③中上层清液是饱和溶液
B.若使③中的固体溶解,可采用加水或升温的方法
C.①和②的溶液中,溶质质量相等
D.①的溶液中溶质质量分数一定比③的上层清液中溶质质量分数小。
20.水是一切生命体生存所必需的物质。
(1)爱护水资源,既要节约用水,也要防治水体污染,下列做法合理的是______(填标号)
A.水龙头漏水不及时更换 B.生活污水集中处理和排放
C.洗脸水冲厕所 D.农业上合理使用农药和化肥
(2)①小新同学从翠湖取回水样,用自制净水器处理,净水器中活性炭可以______(填“吸附”或“蒸馏”)水样中的异味和色素,所得的水______(填“是”或“不是”)纯水。
②向处理后的水样中加入肥皂水,振荡,观察到泡沫较少,浮渣较多,则该水样属于______(填“硬水”或“软水”)。使用硬水会给生活和生产带来许多麻烦,生活中常用______的方法降低水的硬度,
(3)NH4C1和KNO3在不同温度时的溶解度如下表,回答下列问题。
温度/℃ 20 30 40 50 60
溶解度/g NH4Cl 37.2 41.4 45.8 50.4 55.2
KNO3 31.6 45.8 63.9 85.5 110
①40℃时,NH4Cl的溶解度是______g。60℃时,向100g水中加入120gKNO3固体,所得溶液的质量是______g。
②将等质量的NH4Cl、KNO3饱和溶液分别由50℃降温至20℃,所得NH4Cl溶液中溶质的质量分数______(填“<”“=”或“>”)KNO3溶液中溶质的质量分数。
四、综合应用题
21.我们周围的气体:
根据图中的实验装置回答:
(1)仪器 a 的名称是______。
(2)B 装置中发生反应的化学方程式_______。
(3)如果用装置 C 收集 CO2,气体应从导管口______(填“b”或“c”)通入。
(4)“二氧化碳排放力争于 2030 年前达到峰值,努力争取 2060 年前实现碳中和。”这是中国应对全球气候问题作出的庄严承诺。请回答下列问题:
控制 CO2的排放,目的是为减缓______效应。加压水洗法可捕集 CO2,是因为压强增大时 CO2在水中的溶解度______。
(5)科学家已经研究出多种方式来实现二氧化碳的转化。
①固碳的另一种方法是将收集的二氧化碳和水混合后注入地下玄武岩中,最终与岩石中的矿物质作用形成固态的石头碳酸盐。这种固碳方式属于______变化(选填“物理”或“化学”)。
②我国研发的“液态太阳燃料合成技术”,甲醇(CH3OH)等液体燃料被形象地称为“液态阳光”。甲醇合成时,若碳元素全部来自于二氧化碳,则制取 10 吨甲醇需要消耗二氧化碳______吨。(二氧化碳转化成甲醇的方程式为: )
22.水是人类宝贵的资源。
(1)下列物质加入水中能形成溶液的是________(填序号,下同),能形成乳浊液的是________。
a.植物油 b.蔗糖 c.粉笔灰
(2)NaCl能溶于水,难溶于植物油;NaCl在热水中溶解的质量比在等质量的冷水中溶解的质量大。这说明,物质的溶解能力与_____________________和__________有关。
(3)净化水常用方法有沉降、过滤、吸附和蒸馏,活性炭在净水器中起到过滤和______的作用,从盐水中获得饮用水,可采取的方法是______。
23.(1)回答有关燃料的问题:
①三大矿物燃料包括:煤、石油和______;
②天然气的主要成分甲烷完全燃烧的化学方程式是______。
③燃烧发电时,将煤块粉碎成煤粉,目的是______,使燃料充分燃烧;化石燃料燃烧都会产生温室气体二氧化碳,科学家致力于研究将过多的二氧化碳和氢气在催化剂和加热的条件下反应,生成水和甲烷。该反应化学方程式为______。
(2)溶液及物质的溶解性对我们的生产生活有重要意义、如图是三种物质的溶解度曲线,请回答:
①三种物质中,______的溶解度受温度影响最大。
②80℃时硝酸钠的溶解度是______g。
③将70℃时三种物质的饱和溶液分别降温至30℃,所得溶液为不饱和溶液的是______溶液。
④硝酸钾属于复合肥料,所含营养元素有______,溶质质量分数为3%的硝酸钾溶液常用作无土栽培的营养液,配制这种营养液150kg,需要硝酸钾固体的质量______kg。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.B
3.D
4.A
5.D
6.A
7.A
8.C
9.D
10.D
11.错误
12.错误
13.√
14.错误
15.×
16. KCl 冷却结晶 > B 11g (或11.0 g,漏写单位不得分)
17. Cl2 C2H5OH KCl 冷却结晶 B 11g
18.(1)无法判断
(2)②③⑥
(3)一定量的水中,温度越高,M在水中溶解得越多
19. 40 25% 硝酸钾 BC
20.(1)BCD
(2) 吸附 不是
硬水 加热煮沸
(3) 45.8 210 >
21.(1)锥形瓶
(2)
(3)b
(4) 温室 增大
(5) 化学 13.75
22. b a 溶剂种类 温度 吸附 蒸馏
23. 天然气 CH4+2O2CO2+2H2O 增大与氧气的接触面积 CO2+4H22H2O+CH4 硝酸钾 150 硫酸铈 氮元素、钾元素 4.5
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列有关NaCl溶液的说法,错误的是
A.NaCl溶液是均一的、稳定的混合物
B.将植物油加入NaCl溶液中并搅拌,静置后会分层
C.NaCl饱和溶液中不能再溶解其它任何物质
D.NaCl溶液是由NaCl和水组成的
2.下图是甲乙两种物质(不考虑结晶水)的溶解度曲线,下列说法正确的是
A.a1℃时,向甲的饱和溶液,加入25g甲,再升温至a ℃,烧杯底部有5g不溶物
B.a ℃,甲的饱和溶液可以配制成10%的甲溶液500g
C.a ℃甲的溶液中溶质和溶剂的质量比一定小于1:2
D.a ℃时,将等质量的甲乙两物质的饱和溶液降温至a1℃,所得溶液中溶质质量甲等于乙
3.下图为Ca(OH)2的溶解度曲线;下表为20℃时溶解度的相对大小。下列说法正确的是( )
溶解度/g 一般称为
<0.01 难溶
0.01~1 微溶
1~10 可溶
>10 易容
A.Ca(OH)2 属于易溶物质
B.Ca(OH)2的溶解度随温度的升高而增大
C.30℃时,Ca(OH)2的饱和溶液中溶质与溶剂的质量比为3﹕20
D.70℃时Ca(OH)2的饱和溶液,降温到50℃时没有析出固体
4.下列液体去除油污效果最好的是
A.洗洁精 B.食盐水
C.白醋 D.自来水
5.如图,将红砂糖倒入一杯开水中,充分溶解。能作为判断砂糖水是饱和溶液的依据是( )
A.砂糖水颜色很深 B.砂糖水味道很甜
C.砂糖溶解得很快 D.砂糖固体有剩余
6.下列关于溶液的说法正确的是
A.溶液一定是混合物
B.饱和溶液的浓度比不饱和溶液的浓度一定大
C.医用碘酒是碘的水溶液
D.添加溶质是不饱和溶液变成饱和溶液的唯一方法
7.要想从食盐溶液中得到食盐晶体,宜采取的方法是( )
A.蒸发溶剂的方法 B.冷却热饱和溶液的方法
C.倒掉部分溶液的方法 D.升高温度的方法
8.能使气体物质溶解度增大的操作是
A.增加溶剂 B.振荡溶液 C.增大压强 D.升高温度
9.如图是MgCl2、KCl和MgSO4的溶解度曲线。下列说法错误的是( )
A.P点表示t2℃时KCl和MgSO4的溶解度相等
B.t1℃时三种物质的饱和溶液中,溶质质量分数最大的是MgCl2
C.将t2℃时的三种物质的饱和溶液分别升温至t3℃,会析出晶体的是MgSO4
D.t2℃时,将40g MgCl2加入50g水中充分搅拌,所得溶液质量为90g
10.不同温度下KNO3的溶解度如下表所示。下列说法正确的是
温度/℃ 20 30 40
溶解度/g 31.6 45.8 63.9
A.20℃时,100gKNO3饱和溶液中溶质质量为31.6g
B.30℃时,100gKNO3饱和溶液的溶质质量分数为45.8%
C.30℃时,将50gKNO3放入100g水中得到150g溶液
D.40℃时,100g水最多溶解63.9gKNO3
二、判断题
11.饱和溶液降低温度一定会析出晶体( )
12.高锰酸钾加入到汽油中后:溶解,形成紫红色溶液( )
13.搅拌不能改变物质的溶解度。( )
14.稀溶液一定是不饱和溶液( )
15.饱和溶液析出晶体后,溶液一定变稀。( )
三、填空题
16.硝酸钾和氯化钾两种物质的溶解度曲线见下图,这两种物质的溶解度见下表。
温度/℃ 10 20 30 40 50 60
溶解度/g 甲 20.9 31.6 45.8 63.9 85.5 110
乙 31.0 34.0 37.0 40.0 42.6 45.5
请回答下列问题:
(1)观察溶解度曲线和溶解度表,判断物质乙是指________(填写化学式)。
(2)60℃时,饱和KNO3溶液中混有少量KCl,应采用________的方法提纯KNO3(填写“蒸发溶剂”或“冷却结晶”)。
(3)60℃时,分别将等质量的KNO3和KCl两种物质的饱和溶液温度降至t ℃,析出晶体的质量关系为:KNO3_____ KCl(填写“>”“=”或“<”)。
(4)如图所示,20℃时,将一定质量的KNO3固体放入盛水的试管中,发现有少量固体未溶解,向烧杯的水中加入某物质后,试管内固体能完全溶解。则加入的物质可以是_____(填写字母标号)。
①冰块 ②生石灰固体 ③硝酸铵固体 ④干冰 ⑤浓硫酸 ⑥氢氧化钠固体
A ①③④ B ②⑤⑥ C ①③⑤ D ②④⑥
(5)60 ℃时,将45g KCl固体溶解于100 g水中,降温至20 ℃,析出晶体的质量是______。
17.用化学用语填空。
(1)氯气______。
(2)75%医用酒精溶液中的溶质______。
(3)两个铵根离子______。
(4)标出中氮元素的化合价______。
(5)硝酸钾和氯化钾两种物质的溶解度曲线见图,这两种物质的溶解度见表。
温度 10 20 30 40 50 60
溶解度 甲 20.9 31.6 45.8 63.9 85.5 110
乙 31.0 34.0 37.0 40.0 42.6 45.5
请回答下列问题:
①观察溶解度曲线和溶解度表,判断物质乙是______(填写化学式)。
②60℃饱和KNO3溶液中混有少量,应采用______的方法提纯KNO3(填写“蒸发溶剂”或“冷却结晶”)。
③如图所示,20℃时,将一定质量的KNO3固体放入盛水的试管中,发现有少量固体未溶解,向烧杯的水中加入某物质后,试管内固体能完全溶解,则加入的物质可以是______(填写字母标号)。
①冰块 ②生石灰固体 ③硝酸铵固体 ④干冰 ⑤浓硫酸 ⑥氢氧化钠固体
A①③④ B②⑤⑥ C①③⑤ D②④⑥
④60℃时,将45gKCl固体溶解于100g水中,降温至20℃,析出晶体的质量是______。
18.烧杯中盛有一定质量、温度为、溶质为的溶液,将其置于室温环境中,测定不同温度时析出固体的质量。测定结果记录如下表:
溶液的温度/ 75 65 50 35 20
析出固体的质量/ 0 0 2.0 4.5 8.4
若不考虑水蒸发对实验的影响,请回答下列问题:
(1)时,该溶液是否为饱和溶液?______(选填“是”、“否”或“无法判断”)。
(2)将时接近饱和的溶液变成饱和溶液,下列方法中一定能达到目的的有______(填序号)。
①升温 ②降温 ③加溶质 ④加水 ⑤加另一种固体 ⑥恒温蒸发水 ⑦与时的饱和溶液混合
(3)分析表中的数据可知的溶解性受温度影响的情况是______。
19.R是硝酸钾或氯化铵中的一种。硝酸钾和氯化铵的溶解度曲线如图1所示.某化学兴趣小组的同学进行了如图2所示实验。
(1)t1℃时,氯化铵的溶解度为____g。
(2)①的溶液中溶质质量分数为______。
(3)根据以上信息可推出R是______(写名称或化学式均可)。
(4)关于图2中烧杯内的物质,以下几种说法正确的有_____。
A.①、②、③中,只有③中上层清液是饱和溶液
B.若使③中的固体溶解,可采用加水或升温的方法
C.①和②的溶液中,溶质质量相等
D.①的溶液中溶质质量分数一定比③的上层清液中溶质质量分数小。
20.水是一切生命体生存所必需的物质。
(1)爱护水资源,既要节约用水,也要防治水体污染,下列做法合理的是______(填标号)
A.水龙头漏水不及时更换 B.生活污水集中处理和排放
C.洗脸水冲厕所 D.农业上合理使用农药和化肥
(2)①小新同学从翠湖取回水样,用自制净水器处理,净水器中活性炭可以______(填“吸附”或“蒸馏”)水样中的异味和色素,所得的水______(填“是”或“不是”)纯水。
②向处理后的水样中加入肥皂水,振荡,观察到泡沫较少,浮渣较多,则该水样属于______(填“硬水”或“软水”)。使用硬水会给生活和生产带来许多麻烦,生活中常用______的方法降低水的硬度,
(3)NH4C1和KNO3在不同温度时的溶解度如下表,回答下列问题。
温度/℃ 20 30 40 50 60
溶解度/g NH4Cl 37.2 41.4 45.8 50.4 55.2
KNO3 31.6 45.8 63.9 85.5 110
①40℃时,NH4Cl的溶解度是______g。60℃时,向100g水中加入120gKNO3固体,所得溶液的质量是______g。
②将等质量的NH4Cl、KNO3饱和溶液分别由50℃降温至20℃,所得NH4Cl溶液中溶质的质量分数______(填“<”“=”或“>”)KNO3溶液中溶质的质量分数。
四、综合应用题
21.我们周围的气体:
根据图中的实验装置回答:
(1)仪器 a 的名称是______。
(2)B 装置中发生反应的化学方程式_______。
(3)如果用装置 C 收集 CO2,气体应从导管口______(填“b”或“c”)通入。
(4)“二氧化碳排放力争于 2030 年前达到峰值,努力争取 2060 年前实现碳中和。”这是中国应对全球气候问题作出的庄严承诺。请回答下列问题:
控制 CO2的排放,目的是为减缓______效应。加压水洗法可捕集 CO2,是因为压强增大时 CO2在水中的溶解度______。
(5)科学家已经研究出多种方式来实现二氧化碳的转化。
①固碳的另一种方法是将收集的二氧化碳和水混合后注入地下玄武岩中,最终与岩石中的矿物质作用形成固态的石头碳酸盐。这种固碳方式属于______变化(选填“物理”或“化学”)。
②我国研发的“液态太阳燃料合成技术”,甲醇(CH3OH)等液体燃料被形象地称为“液态阳光”。甲醇合成时,若碳元素全部来自于二氧化碳,则制取 10 吨甲醇需要消耗二氧化碳______吨。(二氧化碳转化成甲醇的方程式为: )
22.水是人类宝贵的资源。
(1)下列物质加入水中能形成溶液的是________(填序号,下同),能形成乳浊液的是________。
a.植物油 b.蔗糖 c.粉笔灰
(2)NaCl能溶于水,难溶于植物油;NaCl在热水中溶解的质量比在等质量的冷水中溶解的质量大。这说明,物质的溶解能力与_____________________和__________有关。
(3)净化水常用方法有沉降、过滤、吸附和蒸馏,活性炭在净水器中起到过滤和______的作用,从盐水中获得饮用水,可采取的方法是______。
23.(1)回答有关燃料的问题:
①三大矿物燃料包括:煤、石油和______;
②天然气的主要成分甲烷完全燃烧的化学方程式是______。
③燃烧发电时,将煤块粉碎成煤粉,目的是______,使燃料充分燃烧;化石燃料燃烧都会产生温室气体二氧化碳,科学家致力于研究将过多的二氧化碳和氢气在催化剂和加热的条件下反应,生成水和甲烷。该反应化学方程式为______。
(2)溶液及物质的溶解性对我们的生产生活有重要意义、如图是三种物质的溶解度曲线,请回答:
①三种物质中,______的溶解度受温度影响最大。
②80℃时硝酸钠的溶解度是______g。
③将70℃时三种物质的饱和溶液分别降温至30℃,所得溶液为不饱和溶液的是______溶液。
④硝酸钾属于复合肥料,所含营养元素有______,溶质质量分数为3%的硝酸钾溶液常用作无土栽培的营养液,配制这种营养液150kg,需要硝酸钾固体的质量______kg。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.B
3.D
4.A
5.D
6.A
7.A
8.C
9.D
10.D
11.错误
12.错误
13.√
14.错误
15.×
16. KCl 冷却结晶 > B 11g (或11.0 g,漏写单位不得分)
17. Cl2 C2H5OH KCl 冷却结晶 B 11g
18.(1)无法判断
(2)②③⑥
(3)一定量的水中,温度越高,M在水中溶解得越多
19. 40 25% 硝酸钾 BC
20.(1)BCD
(2) 吸附 不是
硬水 加热煮沸
(3) 45.8 210 >
21.(1)锥形瓶
(2)
(3)b
(4) 温室 增大
(5) 化学 13.75
22. b a 溶剂种类 温度 吸附 蒸馏
23. 天然气 CH4+2O2CO2+2H2O 增大与氧气的接触面积 CO2+4H22H2O+CH4 硝酸钾 150 硫酸铈 氮元素、钾元素 4.5
答案第1页,共2页
答案第1页,共2页
同课章节目录
