第3节 化学方程式的书写与应用(第2课时)(课件33页)-2022-2023学年九年级化学上册精品课堂课件(沪教版)
文档属性
| 名称 | 第3节 化学方程式的书写与应用(第2课时)(课件33页)-2022-2023学年九年级化学上册精品课堂课件(沪教版) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-12 00:00:00 | ||
图片预览









文档简介
(共33张PPT)
课题1 物质的变化和性质
沪教版 化学(初中)
同步课堂
第3节 化学方程式的书写与应用
(共2课时)
1
2
已知生成物的质量求反应物的质量
3
4
已知一种反应物的质量求另一种反应物的质量
目 录 Contents
化学方程式计算的要领和关键
5
已知反应物的质量求生成物的质量
已知一种生成物的质量求另一种生成物的质量
在日常生活和工农业生产中,人们经常需要研究化学变化中物质之间的质量关系,以便更好地认识、控制和应用化学反应。例如,炼铁厂需要知道为了完成一定量铁的生产任务,需要投入多少铁矿石、多少焦炭等;实验室中制备一定量的氧气需要知道要使用多少高锰酸钾等。
依据化学方程式可以定量认识化学反应中物质之间的质量关系。
新课引入
二、依据化学方程式的计算
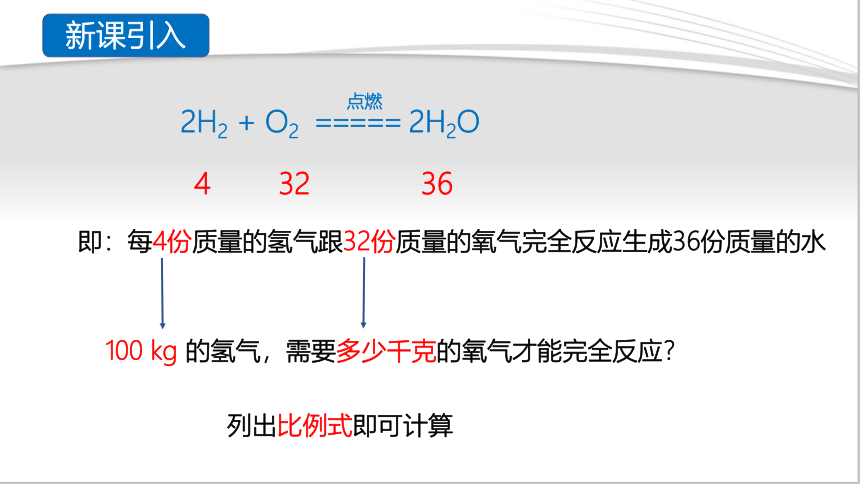
若火箭升空至少要携带100kg的液氢,充分燃烧才能获得足够的能量。假如你是长征系列火箭推进器的设计师,你会在火箭助燃仓中填充多少千克的液氧来满足这些液氢的完全燃烧?
新课引入
2H2 + O2 ===== 2H2O
点燃
即:每4份质量的氢气跟32份质量的氧气完全反应生成36份质量的水
100 kg 的氢气,需要多少千克的氧气才能完全反应?
新课引入
列出比例式即可计算
4 32 36
1.任何化学反应,反应前后都符合质量守恒定律
2.化学方程式能表示出各物质之间的质量比
这是利用化学方程式计算的依据
新课引入
相对分子质量(或相对原子总量)之比与对应的物质质量之比相等。这就是我们进行化学方程式计算的依据。在化学反应中,反应物与生成物之间的质量比是成正比例关系。因此,利用正比例关系根据化学方程式和已知的一种反应物(或生成物)的质量,可求另一种生成物(或反应物)的质量。
那么,我们如何利用化学方程式进行计算?
新课讲解
化学方程式 2H2 + O2 2H2O
各物质的相对分子质量
物质质量比为
各分子个数
2×2 2×16 2×18
4 : 32 : 36
2 : 1 : 2
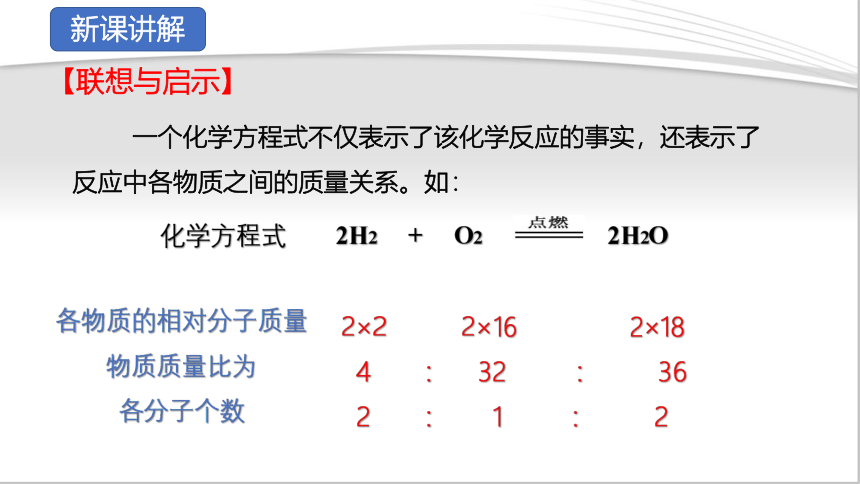
【联想与启示】
一个化学方程式不仅表示了该化学反应的事实,还表示了反应中各物质之间的质量关系。如:
新课讲解
(1)氢气在氧气中燃烧生成水的事实
(2)每2个氢气分子与1个氧气分子反应生成2个水分子,H2、 O2 、 H2O分子的个数比为 2:1:2
(3)每4份质量的氢气与32份质量的氧气完全反应生成36 份 质量的水,H2 、 O2 、 H2O质量之比为 1 :8:9
上述化学方程式表示:
新课讲解
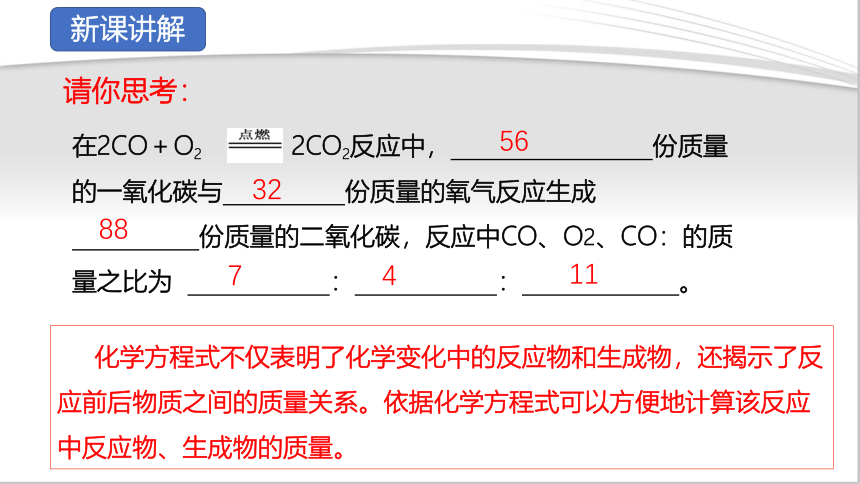
在2CO+O2 2CO2反应中, 份质量的一氧化碳与 份质量的氧气反应生成
份质量的二氧化碳,反应中CO、O2、CO:的质量之比为 : : 。
化学方程式不仅表明了化学变化中的反应物和生成物,还揭示了反应前后物质之间的质量关系。依据化学方程式可以方便地计算该反应中反应物、生成物的质量。
新课讲解
请你思考:
56
32
88
7
4
11
所以:利用比例关系根据化学方程式和已知一种物质的质量,可求出其他参加反应物或生成物的质量。
【归纳与小结】
在完全反应中,反应物与生成物之间的质量比是成比例关系。
新课讲解
例:碳酸钙与盐酸反应生成二氧化碳:
CaCO3+2HCl=CaCl2+H2O+CO2↑ 若需制备二氧化碳8.8g,至少需要碳酸钙多少克?
新课讲解
分析过程
解答格式
(1)按题意设未知数;
解:设需碳酸钙的质量为x
CaCO3+2HC1=CaCl2+H2O+CO2
(4)建立已知量和未知量的
比例关系:
(3)找出反应物和生成物的质量关系:
(2)写出题中反应的化学
方程式;
100 8.8 44 X
100:44=x:8.8g
(5)计算x,并作答
x=20g
答:至少需碳酸钙20g
新课讲解
新课讲解
工业上电解氧化铝制取金属铝的化学方程式为:
2A l2O3
通电
4Al+3O2
在解答“电解10t氧化铝最多可以生产铝多少吨”的问题时,甲乙两位同学分别采用了两种方法。
观察与思考
解法一: 设铝的质量为x
204
108
10t
x
204
10t
108
x
X=
108×10t
204
答:最多可生产5.3t铝
X=5.3t
新课讲解
2A l2O3
通电
4Al+3O2
解法二:已知电解过程中,氧化铝中的铝元素全部转化为单质,铝的质量分数为:
2×27
2×27+3×16
×100%=
53.0%
10t氧化铝中含有铝的质量:10t×53%=5.3t
答:最多可以生产5.3t的铝
新课讲解
1.设未知量时可以直接设,也可以间接设。不带单位。
2.写出方程式要注意配平,而且要注意方程式的完整,反应条件、气体和沉淀的符号要注意标明。
3.相关物质的相对分子质量写在相应化学式的下面,一定要注意用相对分子质量乘以化学式前面的系数,已知量和未知量写在相应相对分子质量的下边。
4.计算结果的小数位保留按题中要求进行,若题中没有要求,一般保留一位小数。
新课讲解
计算的注意事项
根据化学方程式进行计算的步骤
(1)设未知数 ………………设
(2)写出化学方程式并配平 ………写
(3) 标出有关物质的量
(4) 列比例式,求解 ………列
(5) 简明地写出答案 …………答
……标
上标相对分子质量
下标已知量和未知量
归纳小结
化学方程式计算的要领和关键
步骤要完整
格式要规范
得数要准确
准确书写化学方程式
代入量均指纯净物的质量
准确计算相对分子量
三个要领:
三个关键:
交流与讨论
新课讲解
交流与讨论
例题1 工业上,高温煅烧石灰石(CaCO3)可制得生石灰(CaO)和二氧化碳。如果要制取5.6t氧化钙,需要碳酸钙多少吨?
解:设制取56吨氧化钙需要碳酸钙的质量为X
CaCO3
高温
CaO + CO2↑
X
5.6t
100
56
答:制取56t氧化钙需要碳酸钙10t。
100
x
56
5.6t
=
x=10t
典例精讲
例2(2021·海南中考真题)实验室常用过氧化氢溶液在二氧化锰催化作用下分解制取氧气。若含6.8g过氧化氢的过氧化氢溶液完全分解,最多可制得氧气多少克?
【解】设最多可制得氧气的质量为x
68 32
6.8g x
x=3.2g
答:最多可制得氧气3.2g。
典例精讲
例3.(2021·广西中考真题)实验室里用8.0g粗锌与足量稀硫酸反应
制得氢气0.2g,该反应的化学方程式为
(粗锌所含的杂质不跟稀硫酸反应)。
(1)硫酸(H2SO4)中S、O元素质量比是 。
(2)列式计算粗锌中锌的质量分数。
典例精讲
【解析】(1)硫酸(H2SO4)中S、O元素质量比是(32×1):(16×4) =1:2。
(2)解:设参加反应的锌的质量为x,则有
粗锌中锌的质量分数为
×100%=81.25%;
答:粗锌中锌的质量分数为81.25%。
典例精讲
例4.(2021安徽省卷)碳酸氢钠是面点膨松剂的主要成分之一。
小芳同学研究反应2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑中NaHCO3与CO2之间
量的关系。
(1)理论计算:1.26gNaHCO3粉末与足量稀硫酸反应,计算生成CO2的质量______
(写出计算过程)。
(2)实验分析:小芳用如图装置进行实验,向盛有足量稀硫酸的锥形瓶中加入1.26g
NaHCO3粉末,完全反应至不再产生气泡。称取反应前后质量如下表,发现反应前后
质量变化值____(填“大于”、“小于”或“等于”)生成CO2质量的理论值,原因可能是____。
典例精讲
反应前 反应后
NaHCO3/g 锥形瓶+稀硫酸/g 锥形瓶+反应后溶液/g
1.26 24.59 25.36
【解析】(1)设生成CO2的质量为x。
典例精讲
答:生成CO2的质量为0.66g。
(2)根据表内数据,反应前的总质量为1.26g+24.59g=25.85g,反应后锥形瓶与固液的总质量为25.36g,质量减少为25.85g-25.36g
=0.49g,小于理论生成的质量0.66g;再根据CO2可溶于水的性质,可猜测原因是少量CO2溶于水造成。故答案为:0.66g;小于;有部分生成的CO2溶解在反应后的溶液中。
典例精讲
例5.(2020福建省卷)推广车用乙醇汽油,可以减少汽车尾气污染。
利用秸秆为原料可生产乙醇(C2H6O),其中包含葡萄糖(C6H12O6)
转化为乙醇的反应(
)。每生产2.3t乙醇,理论上参加反应的葡萄糖的质量是多少?(写出计算过程)
典例精讲
x=4.5t
答:参加反应的葡萄糖的质量为4.5t。
【解析】设参加反应的葡萄糖的质量为x。
典例精讲
达标检测
1.(2022·江西·九年级单元测试)从宇宙飞船的舱内除去CO2,可用LiOH与CO2反应:CO2+2LiOH=Li2CO3+H2O。一天内,一个人呼出1 kg CO2。为消除3名宇航员6个月的太空飞行所产生的CO2,需要LiOH的质量约为多少千克?(每月按30天计算,计算结果精确到小数点后一位)
【答案】589.1 kg
达标检测
2.(2022广西桂林二模)我国化学家侯德榜所发明的侯氏制碱法,为世界制碱事业发展做出重大贡献,其反应原理如下:NaCl + CO2 + NH3 + H2O = NaHCO3 + NH4Cl。请计算:
(1)碳酸氢钠(NaHCO3)中原子的个数比(Na:H:C:O)为__________。
(2)碳酸氢钠(NaHCO3)中钠元素的质量分数为_____。(结果保留0.1%)
(3)要生产8.4吨碳酸氢钠(NaHCO3),理论上需要氯化钠(NaCl)的质量是多少吨 (写出计算过程)
【答案】(1)1:1:1:3;(2)27.4%;(3)5.85 t。
达标检测
3.(2022·湖南株洲·中考真题)某公司需要320kg氧气作原料。若用电解水的方法制取这些氧气,请计算:
(1)消耗水的质量是多少?(写出计算过程)
(2)同时得到的氢气在足量的氯气中燃烧,生成氯化氢的质量是多少?(写出计算过程)
【答案】(1)360kg;(2)1460kg。
1.完成配套练习册;
2.课后习题3、4、5写在作业本上。
典例精讲
课题1 物质的变化和性质
沪教版 化学(初中)
同步课堂
第3节 化学方程式的书写与应用
(共2课时)
1
2
已知生成物的质量求反应物的质量
3
4
已知一种反应物的质量求另一种反应物的质量
目 录 Contents
化学方程式计算的要领和关键
5
已知反应物的质量求生成物的质量
已知一种生成物的质量求另一种生成物的质量
在日常生活和工农业生产中,人们经常需要研究化学变化中物质之间的质量关系,以便更好地认识、控制和应用化学反应。例如,炼铁厂需要知道为了完成一定量铁的生产任务,需要投入多少铁矿石、多少焦炭等;实验室中制备一定量的氧气需要知道要使用多少高锰酸钾等。
依据化学方程式可以定量认识化学反应中物质之间的质量关系。
新课引入
二、依据化学方程式的计算
若火箭升空至少要携带100kg的液氢,充分燃烧才能获得足够的能量。假如你是长征系列火箭推进器的设计师,你会在火箭助燃仓中填充多少千克的液氧来满足这些液氢的完全燃烧?
新课引入
2H2 + O2 ===== 2H2O
点燃
即:每4份质量的氢气跟32份质量的氧气完全反应生成36份质量的水
100 kg 的氢气,需要多少千克的氧气才能完全反应?
新课引入
列出比例式即可计算
4 32 36
1.任何化学反应,反应前后都符合质量守恒定律
2.化学方程式能表示出各物质之间的质量比
这是利用化学方程式计算的依据
新课引入
相对分子质量(或相对原子总量)之比与对应的物质质量之比相等。这就是我们进行化学方程式计算的依据。在化学反应中,反应物与生成物之间的质量比是成正比例关系。因此,利用正比例关系根据化学方程式和已知的一种反应物(或生成物)的质量,可求另一种生成物(或反应物)的质量。
那么,我们如何利用化学方程式进行计算?
新课讲解
化学方程式 2H2 + O2 2H2O
各物质的相对分子质量
物质质量比为
各分子个数
2×2 2×16 2×18
4 : 32 : 36
2 : 1 : 2
【联想与启示】
一个化学方程式不仅表示了该化学反应的事实,还表示了反应中各物质之间的质量关系。如:
新课讲解
(1)氢气在氧气中燃烧生成水的事实
(2)每2个氢气分子与1个氧气分子反应生成2个水分子,H2、 O2 、 H2O分子的个数比为 2:1:2
(3)每4份质量的氢气与32份质量的氧气完全反应生成36 份 质量的水,H2 、 O2 、 H2O质量之比为 1 :8:9
上述化学方程式表示:
新课讲解
在2CO+O2 2CO2反应中, 份质量的一氧化碳与 份质量的氧气反应生成
份质量的二氧化碳,反应中CO、O2、CO:的质量之比为 : : 。
化学方程式不仅表明了化学变化中的反应物和生成物,还揭示了反应前后物质之间的质量关系。依据化学方程式可以方便地计算该反应中反应物、生成物的质量。
新课讲解
请你思考:
56
32
88
7
4
11
所以:利用比例关系根据化学方程式和已知一种物质的质量,可求出其他参加反应物或生成物的质量。
【归纳与小结】
在完全反应中,反应物与生成物之间的质量比是成比例关系。
新课讲解
例:碳酸钙与盐酸反应生成二氧化碳:
CaCO3+2HCl=CaCl2+H2O+CO2↑ 若需制备二氧化碳8.8g,至少需要碳酸钙多少克?
新课讲解
分析过程
解答格式
(1)按题意设未知数;
解:设需碳酸钙的质量为x
CaCO3+2HC1=CaCl2+H2O+CO2
(4)建立已知量和未知量的
比例关系:
(3)找出反应物和生成物的质量关系:
(2)写出题中反应的化学
方程式;
100 8.8 44 X
100:44=x:8.8g
(5)计算x,并作答
x=20g
答:至少需碳酸钙20g
新课讲解
新课讲解
工业上电解氧化铝制取金属铝的化学方程式为:
2A l2O3
通电
4Al+3O2
在解答“电解10t氧化铝最多可以生产铝多少吨”的问题时,甲乙两位同学分别采用了两种方法。
观察与思考
解法一: 设铝的质量为x
204
108
10t
x
204
10t
108
x
X=
108×10t
204
答:最多可生产5.3t铝
X=5.3t
新课讲解
2A l2O3
通电
4Al+3O2
解法二:已知电解过程中,氧化铝中的铝元素全部转化为单质,铝的质量分数为:
2×27
2×27+3×16
×100%=
53.0%
10t氧化铝中含有铝的质量:10t×53%=5.3t
答:最多可以生产5.3t的铝
新课讲解
1.设未知量时可以直接设,也可以间接设。不带单位。
2.写出方程式要注意配平,而且要注意方程式的完整,反应条件、气体和沉淀的符号要注意标明。
3.相关物质的相对分子质量写在相应化学式的下面,一定要注意用相对分子质量乘以化学式前面的系数,已知量和未知量写在相应相对分子质量的下边。
4.计算结果的小数位保留按题中要求进行,若题中没有要求,一般保留一位小数。
新课讲解
计算的注意事项
根据化学方程式进行计算的步骤
(1)设未知数 ………………设
(2)写出化学方程式并配平 ………写
(3) 标出有关物质的量
(4) 列比例式,求解 ………列
(5) 简明地写出答案 …………答
……标
上标相对分子质量
下标已知量和未知量
归纳小结
化学方程式计算的要领和关键
步骤要完整
格式要规范
得数要准确
准确书写化学方程式
代入量均指纯净物的质量
准确计算相对分子量
三个要领:
三个关键:
交流与讨论
新课讲解
交流与讨论
例题1 工业上,高温煅烧石灰石(CaCO3)可制得生石灰(CaO)和二氧化碳。如果要制取5.6t氧化钙,需要碳酸钙多少吨?
解:设制取56吨氧化钙需要碳酸钙的质量为X
CaCO3
高温
CaO + CO2↑
X
5.6t
100
56
答:制取56t氧化钙需要碳酸钙10t。
100
x
56
5.6t
=
x=10t
典例精讲
例2(2021·海南中考真题)实验室常用过氧化氢溶液在二氧化锰催化作用下分解制取氧气。若含6.8g过氧化氢的过氧化氢溶液完全分解,最多可制得氧气多少克?
【解】设最多可制得氧气的质量为x
68 32
6.8g x
x=3.2g
答:最多可制得氧气3.2g。
典例精讲
例3.(2021·广西中考真题)实验室里用8.0g粗锌与足量稀硫酸反应
制得氢气0.2g,该反应的化学方程式为
(粗锌所含的杂质不跟稀硫酸反应)。
(1)硫酸(H2SO4)中S、O元素质量比是 。
(2)列式计算粗锌中锌的质量分数。
典例精讲
【解析】(1)硫酸(H2SO4)中S、O元素质量比是(32×1):(16×4) =1:2。
(2)解:设参加反应的锌的质量为x,则有
粗锌中锌的质量分数为
×100%=81.25%;
答:粗锌中锌的质量分数为81.25%。
典例精讲
例4.(2021安徽省卷)碳酸氢钠是面点膨松剂的主要成分之一。
小芳同学研究反应2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑中NaHCO3与CO2之间
量的关系。
(1)理论计算:1.26gNaHCO3粉末与足量稀硫酸反应,计算生成CO2的质量______
(写出计算过程)。
(2)实验分析:小芳用如图装置进行实验,向盛有足量稀硫酸的锥形瓶中加入1.26g
NaHCO3粉末,完全反应至不再产生气泡。称取反应前后质量如下表,发现反应前后
质量变化值____(填“大于”、“小于”或“等于”)生成CO2质量的理论值,原因可能是____。
典例精讲
反应前 反应后
NaHCO3/g 锥形瓶+稀硫酸/g 锥形瓶+反应后溶液/g
1.26 24.59 25.36
【解析】(1)设生成CO2的质量为x。
典例精讲
答:生成CO2的质量为0.66g。
(2)根据表内数据,反应前的总质量为1.26g+24.59g=25.85g,反应后锥形瓶与固液的总质量为25.36g,质量减少为25.85g-25.36g
=0.49g,小于理论生成的质量0.66g;再根据CO2可溶于水的性质,可猜测原因是少量CO2溶于水造成。故答案为:0.66g;小于;有部分生成的CO2溶解在反应后的溶液中。
典例精讲
例5.(2020福建省卷)推广车用乙醇汽油,可以减少汽车尾气污染。
利用秸秆为原料可生产乙醇(C2H6O),其中包含葡萄糖(C6H12O6)
转化为乙醇的反应(
)。每生产2.3t乙醇,理论上参加反应的葡萄糖的质量是多少?(写出计算过程)
典例精讲
x=4.5t
答:参加反应的葡萄糖的质量为4.5t。
【解析】设参加反应的葡萄糖的质量为x。
典例精讲
达标检测
1.(2022·江西·九年级单元测试)从宇宙飞船的舱内除去CO2,可用LiOH与CO2反应:CO2+2LiOH=Li2CO3+H2O。一天内,一个人呼出1 kg CO2。为消除3名宇航员6个月的太空飞行所产生的CO2,需要LiOH的质量约为多少千克?(每月按30天计算,计算结果精确到小数点后一位)
【答案】589.1 kg
达标检测
2.(2022广西桂林二模)我国化学家侯德榜所发明的侯氏制碱法,为世界制碱事业发展做出重大贡献,其反应原理如下:NaCl + CO2 + NH3 + H2O = NaHCO3 + NH4Cl。请计算:
(1)碳酸氢钠(NaHCO3)中原子的个数比(Na:H:C:O)为__________。
(2)碳酸氢钠(NaHCO3)中钠元素的质量分数为_____。(结果保留0.1%)
(3)要生产8.4吨碳酸氢钠(NaHCO3),理论上需要氯化钠(NaCl)的质量是多少吨 (写出计算过程)
【答案】(1)1:1:1:3;(2)27.4%;(3)5.85 t。
达标检测
3.(2022·湖南株洲·中考真题)某公司需要320kg氧气作原料。若用电解水的方法制取这些氧气,请计算:
(1)消耗水的质量是多少?(写出计算过程)
(2)同时得到的氢气在足量的氯气中燃烧,生成氯化氢的质量是多少?(写出计算过程)
【答案】(1)360kg;(2)1460kg。
1.完成配套练习册;
2.课后习题3、4、5写在作业本上。
典例精讲
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
