2022-2023学年化学沪教版(上海) 第三单元 走进溶液世界 单元练习(含答案)
文档属性
| 名称 | 2022-2023学年化学沪教版(上海) 第三单元 走进溶液世界 单元练习(含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 117.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-12 00:00:00 | ||
图片预览




文档简介
2022-2023学年化学沪教版(上海)---走进溶液世界
一、单选题
1.正常情况下pH小于7的液体是
A.人体胃液 B.人体血液 C.纯碱溶液 D.生理盐水
2.用如图所示装置探究CO2能否与H2O反应。滴加盐酸,待试管乙中液体变红后,将其加热至沸腾,红色不褪去。下列说法正确的是
A.甲中逸出的气体只含CO2
B.乙中液体变红,证明CO2能与水反应
C.加热后红色不褪去,说明碳酸受热不分解
D.欲达到实验目的,可将盐酸改为稀硫酸
3.化学与生活息息相关。下列生活中常见的物质属于纯净物的是
A.矿泉水 B.河水 C.苏打水 D.蒸馏水
4.下列关于水净化过程中常用方法的说法正确的是( )
A.明矾可以促进水中悬浮物的沉降
B.过滤能除去天然水中的所有杂质
C.活性炭的吸附作用可使海水转化成淡水
D.过滤或加热均能使硬水转化成软水
5.下列饮料中,不属于溶液的是
A.汽水 B.白酒
C.酸奶 D.苏打水
6.实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致结果偏大的是
A.氯化钠固体中含有杂质 B.用量筒量取水时仰视读数
C.加水溶解固体时有水洒出 D.配制好的溶液装瓶中时有少量洒出
7.下列关于溶液的说法正确的是
A.溶液一定是无色透明的液体
B.饱和溶液降温后都有溶质结晶析出
C.碘酒溶液中,碘是溶质,酒精是溶剂
D.水加入蔗糖后形成溶液,导电性明显增强
8.不同的物质溶于水后会形成酸碱性不同的溶液,下列溶液显酸性的是
A.食醋 B.氨水 C.NaCl溶液 D.Na2CO3溶液
9.下列图像不能正确反映对应变化关系的是
A. 等体积等浓度的稀盐酸分别与足量铁粉和镁粉反应
B. 向一定量氢氧化钠溶液中逐滴加入稀硫酸
C. 向一定量硫酸铜溶液中加入过量铁粉
D. 加热一定量高锰酸钾固体制氧气
10.某同学配制100g质量分数为11%的葡萄糖溶液,下列操作会导致所配溶液浓度偏高的是
A.用托盘天平称葡萄糖时,砝码放在左盘 B.转移葡萄糖时,纸上有少量残留
C.用量筒量取水时,俯视液面 D.配好溶液装入试剂瓶时,有少量洒出
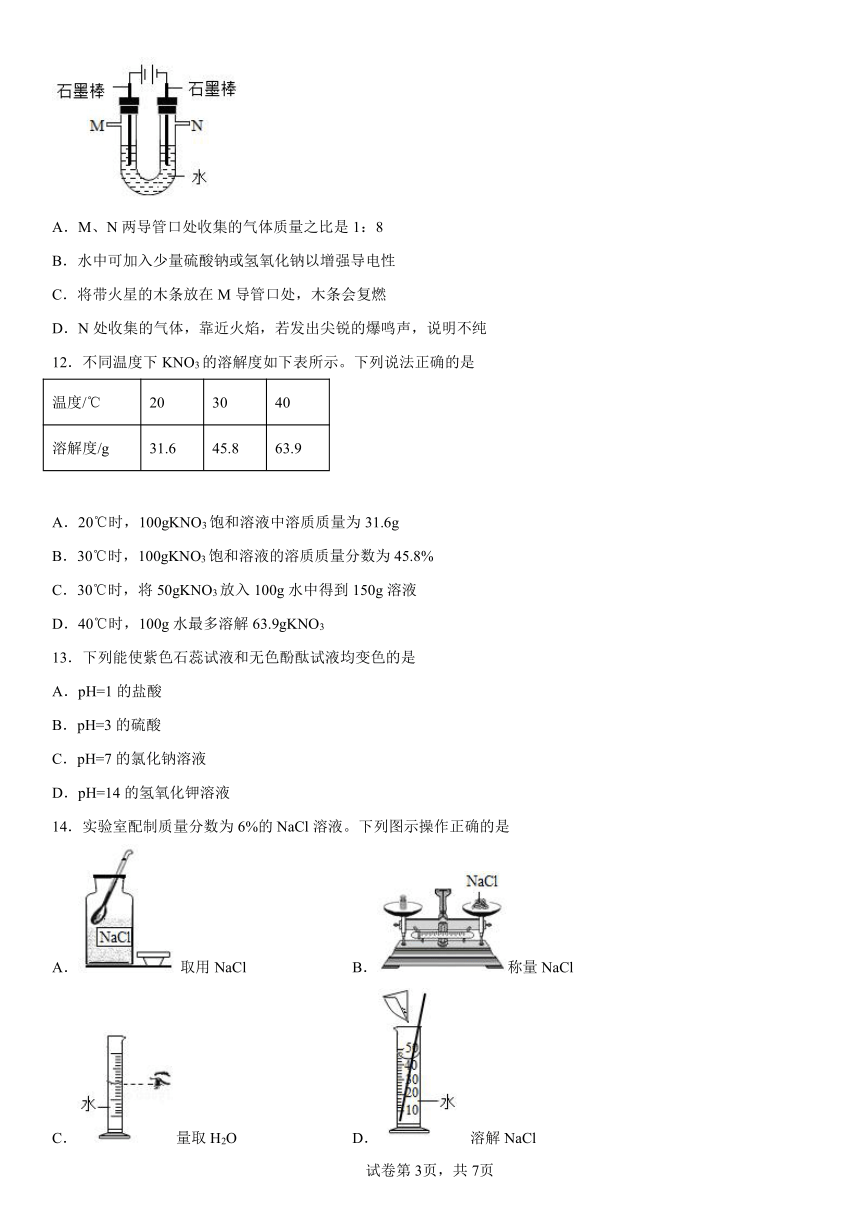
11.用如图所示装置电解水,下列说法错误的是
A.M、N两导管口处收集的气体质量之比是1:8
B.水中可加入少量硫酸钠或氢氧化钠以增强导电性
C.将带火星的木条放在M导管口处,木条会复燃
D.N处收集的气体,靠近火焰,若发出尖锐的爆鸣声,说明不纯
12.不同温度下KNO3的溶解度如下表所示。下列说法正确的是
温度/℃ 20 30 40
溶解度/g 31.6 45.8 63.9
A.20℃时,100gKNO3饱和溶液中溶质质量为31.6g
B.30℃时,100gKNO3饱和溶液的溶质质量分数为45.8%
C.30℃时,将50gKNO3放入100g水中得到150g溶液
D.40℃时,100g水最多溶解63.9gKNO3
13.下列能使紫色石蕊试液和无色酚酞试液均变色的是
A.pH=1的盐酸
B.pH=3的硫酸
C.pH=7的氯化钠溶液
D.pH=14的氢氧化钾溶液
14.实验室配制质量分数为6%的NaCl溶液。下列图示操作正确的是
A.取用NaCl B.称量NaCl
C.量取H2O D.溶解NaCl
15.广州北部水厂采用了先进的超滤膜净水技术,超滤膜能有效去除水中的悬浮物、藻类、细菌等不溶性杂质。关于水的净化,下列说法不正确的是
A.加入明矾能促进水中悬浮杂质沉降
B.活性炭可除去水中异味
C.超滤膜可降低水的硬度
D.自来水属于混合物
二、填空题
16.(1)实验室可通过电解水制得氢气和氧气。电解时需要接通__________(填“交流”或“直流”)电源,有氢气生成的电极接电源的____________(填“正”或“负”)极。待反应结束时,理论上生成氢气和氧气的体积比为_______________________。
(2)可用__________区分硬水和软水。蒸馏水是净化程度较高的水,实验室制取蒸馏水时,需要在烧瓶中加入几粒沸石,其作用是______________________。
(3)下列有利于保护水资源的是_____________(填标号)。
A 农业上提倡使用农家肥,禁止使用化肥和农药
B 城市生活废水经处理达标后排放
C 园林浇灌改大水漫灌为喷灌、滴灌
(4)下列各种物质中属于纯净物的是____________(填标号)。
A 苏打水 B 稀盐酸 C 果汁 D 雨水 E 水
17.水是生命之源。
(1)对于沉淀、过滤、吸附、蒸馏等净化水的操作,相对净化程度最高的是_______;
(2)下图是电解水的示意图,图中与电池负极相连的试管内收集到的气体是_______;
(3)生活中我们常用_______区分硬水和软水;
(4)保护水资源是每个公民应尽的责任和义务,下列防治水体污染的措施正确的有_______(填序号)。
①大量使用含磷洗衣粉 ②农业上禁止使用农药和化肥
③生活污水集中处理达标后再排放 ④工业上应用新技术、新工艺减少污染物的产生
18.如图是硝酸钾(KNO3)和氯化钾(KC1)的溶解度曲线,请回答下列问题。
(1)10℃时,KNO3和KCl的溶解度大小关系是:KNO3________KCl(填“>”“<”或“=”)。
(2)60℃时,将120g KNO3固体放入100g水中,充分溶解后,所得溶液的质量为________g。
(3)KNO3中混有少量的KCl,可用______________的方法提纯KNO3。
(4)据题图,下列有关说法正确的是______________。
a.KCl的不饱和溶液只能采用蒸发溶剂的方法才可变成饱和溶液
b.60℃时,KNO3溶液的溶质质量分数一定比KCl溶液的大
c.将60℃时KNO3和KC1两种溶液分别降温至10℃,析出晶体较多的是KNO3溶液
d.60℃时,从KNO3和KC1两种饱和溶液中获得等质量晶体,蒸发水较多的是KC1溶液
19.水是一种宝贵的自然资源,自来水厂的净水流程如下:
回答下列问题:
(1)吸附池内常用__吸附色素和异味。
(2)自来水厂常用氯气杀菌消毒,在此过程中发生了反应,HClO中氯元素的化合价为___。
(3)某同学取自来水于试管中,加入适量___,振荡,发现有较多浮渣产生,说明该自来水属于硬水。
(4)在日常生活中,常采用_____的方法降低水的硬度。
(5)下列实验能证明水是由氢元素和氧元素组成的是______(填字母序号)。
A 氢气在氧气中燃烧 B 水的蒸发
C 水的电解 D 水的净化
20.某同学将一朵紫色牵牛花泡在石灰水里,牵牛花很快就变成了蓝色,又将牵牛花泡在稀盐酸中,牵牛花又变成了红色,请你根据以上实验现象回答:
(1)该同学将紫色牵牛花泡在肥皂水里,牵牛花很快就变成了蓝色,据此可推断肥皂水显_____(填“酸性”或“碱性”)。
(2)该牵牛花的汁液_____(填“能”或“不能”)用作指示剂。
三、推断题
21.物质王国举行一场趣味投球赛,场上“队员”位置及传球路线如图所示,每一种物质代表一位队员,只有能发生物质转化的“队员”之间才能完成一次传接球。已知常温下A和B都是无色液体,且组成元素相同,C是无色气体,D的状态和其他物质不同,C转化为D的反应过程中有火星四射的现象。请回答下列问题。
(1)物质D的化学式是_____。
(2)写出物质C的一种用途:________。
(3)物质A→B的反应的文字(或符号)表达式是__________________________________。
(4)图中共涉及3个化学反应,反应____(填字母)的基本反应类型与另外两个反应不同。
A ① B ② C ③
四、流程题
22.食盐是人类生存的必需品,盐在自然界中无处不在。人们很早就发现,从海里,盐湖里、盐井里和盐矿里,都能够开采出食盐。
(1)《汉代古火井碑序》记载:“诸葛丞相躬莅视察,改进技法,刳斑竹以导气(气指沼气),引井火以煮盐”,请写出文中涉及到的化学反应的化学方程式:_________。
(2)通过晾晒海水可以得到粗盐和卤水,上图为海水提取粗盐的过程,在结晶池中,继续风吹日晒,海水会变成食盐的_____溶液(填“饱和”或“不饱和”)。析出粗盐后,母液中氯化钠的溶质质量分数____(填“变大”、“变小”或“不变”)。
(3)氯化钠和硝酸钾在不同温度下的溶解度如下表所示。请根据下表回答:
温度/℃ 20 30 40 50 60 70 80
溶解度/g NaCl 36.0 36.3 36.6 37.0 37.3 37.8 38.4
KNO3 31.6 45.5 63.9 85.5 110 138 169
①60℃将100gKNO3溶解在100g水中,然后降温到40℃,降温后析出固体的质量是________g。
②KNO3和NaCl溶解度相等的温度范围是________。
③如下图所示,要使试管中有晶体析出,加入的试剂A是__________。
A.生石灰 B.氢氧化钠 C.硝酸铵固体 D.氯化钠固体
五、计算题
23.将氯酸钾与二氧化锰的混合粉末28.5g加热到不再产生氧气为止,得到固体残留物18.9g。再将固体残留物加入到134.1g水里充分溶解后,滤去不溶物二氧化锰,得到滤液(滤液损失不计)。
(1)生成氧气的化学方程式是______。
(2)生成氧气的质量为______g。
(3)根据氧气的质量列出求氯化钾质量(x)的比例式______。
(4)最终所得滤液中溶质氯化钾的质量分数是______。
24.实验室配制了 50 g 溶质质量分数为 8%的氢氧化钠溶液,将上述配制好的溶液分成 5 份,向其中一份中加入稀硫酸,随着稀硫酸的滴加,溶液的温度变化如图所示。试回答:
(1)C 点溶液中的阴离子是______。
(2)恰好完全反应时所得溶液中溶质的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.D
3.D
4.A
5.C
6.C
7.C
8.A
9.B
10.C
11.A
12.D
13.D
14.C
15.C
16. 直流 负 2:1 肥皂水 防止暴沸 B、C E
17.(1)蒸馏
(2)H2
(3)肥皂水
(4)④③
18.< 210g 冷却结晶 d
19. 活性炭 +1 肥皂水 煮沸 AC
20. 碱性 能
21. Fe3O4 供给动植物呼吸等 C
22.(1)
(2) 饱和 不变
(3) 36.1 20℃—30℃ NH4NO3
23.(1);(2)9.6;(3);(4)10%
24.(1)SO42-
(2)参加反应的氢氧化钠的质量:,恰好完全反应时所得溶液的质量:+20g=30g;
设反应后所得溶液中溶质的质量分数为x
x≈4.7 3%
答:恰好完全反应时所得溶液中溶质的质量分数为4.7 3%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.正常情况下pH小于7的液体是
A.人体胃液 B.人体血液 C.纯碱溶液 D.生理盐水
2.用如图所示装置探究CO2能否与H2O反应。滴加盐酸,待试管乙中液体变红后,将其加热至沸腾,红色不褪去。下列说法正确的是
A.甲中逸出的气体只含CO2
B.乙中液体变红,证明CO2能与水反应
C.加热后红色不褪去,说明碳酸受热不分解
D.欲达到实验目的,可将盐酸改为稀硫酸
3.化学与生活息息相关。下列生活中常见的物质属于纯净物的是
A.矿泉水 B.河水 C.苏打水 D.蒸馏水
4.下列关于水净化过程中常用方法的说法正确的是( )
A.明矾可以促进水中悬浮物的沉降
B.过滤能除去天然水中的所有杂质
C.活性炭的吸附作用可使海水转化成淡水
D.过滤或加热均能使硬水转化成软水
5.下列饮料中,不属于溶液的是
A.汽水 B.白酒
C.酸奶 D.苏打水
6.实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致结果偏大的是
A.氯化钠固体中含有杂质 B.用量筒量取水时仰视读数
C.加水溶解固体时有水洒出 D.配制好的溶液装瓶中时有少量洒出
7.下列关于溶液的说法正确的是
A.溶液一定是无色透明的液体
B.饱和溶液降温后都有溶质结晶析出
C.碘酒溶液中,碘是溶质,酒精是溶剂
D.水加入蔗糖后形成溶液,导电性明显增强
8.不同的物质溶于水后会形成酸碱性不同的溶液,下列溶液显酸性的是
A.食醋 B.氨水 C.NaCl溶液 D.Na2CO3溶液
9.下列图像不能正确反映对应变化关系的是
A. 等体积等浓度的稀盐酸分别与足量铁粉和镁粉反应
B. 向一定量氢氧化钠溶液中逐滴加入稀硫酸
C. 向一定量硫酸铜溶液中加入过量铁粉
D. 加热一定量高锰酸钾固体制氧气
10.某同学配制100g质量分数为11%的葡萄糖溶液,下列操作会导致所配溶液浓度偏高的是
A.用托盘天平称葡萄糖时,砝码放在左盘 B.转移葡萄糖时,纸上有少量残留
C.用量筒量取水时,俯视液面 D.配好溶液装入试剂瓶时,有少量洒出
11.用如图所示装置电解水,下列说法错误的是
A.M、N两导管口处收集的气体质量之比是1:8
B.水中可加入少量硫酸钠或氢氧化钠以增强导电性
C.将带火星的木条放在M导管口处,木条会复燃
D.N处收集的气体,靠近火焰,若发出尖锐的爆鸣声,说明不纯
12.不同温度下KNO3的溶解度如下表所示。下列说法正确的是
温度/℃ 20 30 40
溶解度/g 31.6 45.8 63.9
A.20℃时,100gKNO3饱和溶液中溶质质量为31.6g
B.30℃时,100gKNO3饱和溶液的溶质质量分数为45.8%
C.30℃时,将50gKNO3放入100g水中得到150g溶液
D.40℃时,100g水最多溶解63.9gKNO3
13.下列能使紫色石蕊试液和无色酚酞试液均变色的是
A.pH=1的盐酸
B.pH=3的硫酸
C.pH=7的氯化钠溶液
D.pH=14的氢氧化钾溶液
14.实验室配制质量分数为6%的NaCl溶液。下列图示操作正确的是
A.取用NaCl B.称量NaCl
C.量取H2O D.溶解NaCl
15.广州北部水厂采用了先进的超滤膜净水技术,超滤膜能有效去除水中的悬浮物、藻类、细菌等不溶性杂质。关于水的净化,下列说法不正确的是
A.加入明矾能促进水中悬浮杂质沉降
B.活性炭可除去水中异味
C.超滤膜可降低水的硬度
D.自来水属于混合物
二、填空题
16.(1)实验室可通过电解水制得氢气和氧气。电解时需要接通__________(填“交流”或“直流”)电源,有氢气生成的电极接电源的____________(填“正”或“负”)极。待反应结束时,理论上生成氢气和氧气的体积比为_______________________。
(2)可用__________区分硬水和软水。蒸馏水是净化程度较高的水,实验室制取蒸馏水时,需要在烧瓶中加入几粒沸石,其作用是______________________。
(3)下列有利于保护水资源的是_____________(填标号)。
A 农业上提倡使用农家肥,禁止使用化肥和农药
B 城市生活废水经处理达标后排放
C 园林浇灌改大水漫灌为喷灌、滴灌
(4)下列各种物质中属于纯净物的是____________(填标号)。
A 苏打水 B 稀盐酸 C 果汁 D 雨水 E 水
17.水是生命之源。
(1)对于沉淀、过滤、吸附、蒸馏等净化水的操作,相对净化程度最高的是_______;
(2)下图是电解水的示意图,图中与电池负极相连的试管内收集到的气体是_______;
(3)生活中我们常用_______区分硬水和软水;
(4)保护水资源是每个公民应尽的责任和义务,下列防治水体污染的措施正确的有_______(填序号)。
①大量使用含磷洗衣粉 ②农业上禁止使用农药和化肥
③生活污水集中处理达标后再排放 ④工业上应用新技术、新工艺减少污染物的产生
18.如图是硝酸钾(KNO3)和氯化钾(KC1)的溶解度曲线,请回答下列问题。
(1)10℃时,KNO3和KCl的溶解度大小关系是:KNO3________KCl(填“>”“<”或“=”)。
(2)60℃时,将120g KNO3固体放入100g水中,充分溶解后,所得溶液的质量为________g。
(3)KNO3中混有少量的KCl,可用______________的方法提纯KNO3。
(4)据题图,下列有关说法正确的是______________。
a.KCl的不饱和溶液只能采用蒸发溶剂的方法才可变成饱和溶液
b.60℃时,KNO3溶液的溶质质量分数一定比KCl溶液的大
c.将60℃时KNO3和KC1两种溶液分别降温至10℃,析出晶体较多的是KNO3溶液
d.60℃时,从KNO3和KC1两种饱和溶液中获得等质量晶体,蒸发水较多的是KC1溶液
19.水是一种宝贵的自然资源,自来水厂的净水流程如下:
回答下列问题:
(1)吸附池内常用__吸附色素和异味。
(2)自来水厂常用氯气杀菌消毒,在此过程中发生了反应,HClO中氯元素的化合价为___。
(3)某同学取自来水于试管中,加入适量___,振荡,发现有较多浮渣产生,说明该自来水属于硬水。
(4)在日常生活中,常采用_____的方法降低水的硬度。
(5)下列实验能证明水是由氢元素和氧元素组成的是______(填字母序号)。
A 氢气在氧气中燃烧 B 水的蒸发
C 水的电解 D 水的净化
20.某同学将一朵紫色牵牛花泡在石灰水里,牵牛花很快就变成了蓝色,又将牵牛花泡在稀盐酸中,牵牛花又变成了红色,请你根据以上实验现象回答:
(1)该同学将紫色牵牛花泡在肥皂水里,牵牛花很快就变成了蓝色,据此可推断肥皂水显_____(填“酸性”或“碱性”)。
(2)该牵牛花的汁液_____(填“能”或“不能”)用作指示剂。
三、推断题
21.物质王国举行一场趣味投球赛,场上“队员”位置及传球路线如图所示,每一种物质代表一位队员,只有能发生物质转化的“队员”之间才能完成一次传接球。已知常温下A和B都是无色液体,且组成元素相同,C是无色气体,D的状态和其他物质不同,C转化为D的反应过程中有火星四射的现象。请回答下列问题。
(1)物质D的化学式是_____。
(2)写出物质C的一种用途:________。
(3)物质A→B的反应的文字(或符号)表达式是__________________________________。
(4)图中共涉及3个化学反应,反应____(填字母)的基本反应类型与另外两个反应不同。
A ① B ② C ③
四、流程题
22.食盐是人类生存的必需品,盐在自然界中无处不在。人们很早就发现,从海里,盐湖里、盐井里和盐矿里,都能够开采出食盐。
(1)《汉代古火井碑序》记载:“诸葛丞相躬莅视察,改进技法,刳斑竹以导气(气指沼气),引井火以煮盐”,请写出文中涉及到的化学反应的化学方程式:_________。
(2)通过晾晒海水可以得到粗盐和卤水,上图为海水提取粗盐的过程,在结晶池中,继续风吹日晒,海水会变成食盐的_____溶液(填“饱和”或“不饱和”)。析出粗盐后,母液中氯化钠的溶质质量分数____(填“变大”、“变小”或“不变”)。
(3)氯化钠和硝酸钾在不同温度下的溶解度如下表所示。请根据下表回答:
温度/℃ 20 30 40 50 60 70 80
溶解度/g NaCl 36.0 36.3 36.6 37.0 37.3 37.8 38.4
KNO3 31.6 45.5 63.9 85.5 110 138 169
①60℃将100gKNO3溶解在100g水中,然后降温到40℃,降温后析出固体的质量是________g。
②KNO3和NaCl溶解度相等的温度范围是________。
③如下图所示,要使试管中有晶体析出,加入的试剂A是__________。
A.生石灰 B.氢氧化钠 C.硝酸铵固体 D.氯化钠固体
五、计算题
23.将氯酸钾与二氧化锰的混合粉末28.5g加热到不再产生氧气为止,得到固体残留物18.9g。再将固体残留物加入到134.1g水里充分溶解后,滤去不溶物二氧化锰,得到滤液(滤液损失不计)。
(1)生成氧气的化学方程式是______。
(2)生成氧气的质量为______g。
(3)根据氧气的质量列出求氯化钾质量(x)的比例式______。
(4)最终所得滤液中溶质氯化钾的质量分数是______。
24.实验室配制了 50 g 溶质质量分数为 8%的氢氧化钠溶液,将上述配制好的溶液分成 5 份,向其中一份中加入稀硫酸,随着稀硫酸的滴加,溶液的温度变化如图所示。试回答:
(1)C 点溶液中的阴离子是______。
(2)恰好完全反应时所得溶液中溶质的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.D
3.D
4.A
5.C
6.C
7.C
8.A
9.B
10.C
11.A
12.D
13.D
14.C
15.C
16. 直流 负 2:1 肥皂水 防止暴沸 B、C E
17.(1)蒸馏
(2)H2
(3)肥皂水
(4)④③
18.< 210g 冷却结晶 d
19. 活性炭 +1 肥皂水 煮沸 AC
20. 碱性 能
21. Fe3O4 供给动植物呼吸等 C
22.(1)
(2) 饱和 不变
(3) 36.1 20℃—30℃ NH4NO3
23.(1);(2)9.6;(3);(4)10%
24.(1)SO42-
(2)参加反应的氢氧化钠的质量:,恰好完全反应时所得溶液的质量:+20g=30g;
设反应后所得溶液中溶质的质量分数为x
x≈4.7 3%
答:恰好完全反应时所得溶液中溶质的质量分数为4.7 3%。
答案第1页,共2页
答案第1页,共2页
