2022-2023学年八年级化学人教版(五四学制) 第五单元 化学方程式 单元练习(含答案)
文档属性
| 名称 | 2022-2023学年八年级化学人教版(五四学制) 第五单元 化学方程式 单元练习(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 188.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-12 18:40:49 | ||
图片预览




文档简介
2022-2023学年化学人教版(五四学制)--化学方程式
一、单选题
1.大多数动植物呼吸作用时发生反应:,动植物利用该反应释放的能量维持生命活动。X的化学式为
A.C6H12 B.C6H12O C.C6H12O6 D.C6H12O8
2.2022年4月29日《科技日报》报道“我国科学家实现二氧化碳到葡萄糖和油脂的“人工合成”,合成过程中的一个反应微观示意图如下,有关说法正确的是
A.反应前后分子的种类不变
B.反应前后共有三种氧化物
C.丙物质由8个原子构成
D.反应中甲和丁的分子个数比是2∶1
3.把一定质量的甲、乙、丙、丁四种物质放入密闭容器中,在一定条件下反应一段时间后,测得各物质的质量如下表所示,下列说法正确的是
物质 甲 乙 丙 丁
反应前的质量/g 7 10 28 37
反应后的质量/g 14 10 33 x
A.x的值是25 B.乙一定是催化剂
C.甲和丁都是反应物 D.反应中,甲与丙发生改变的质量比是14:33
4.某反应的微观示意图如下,有关说法正确的是
A.此反应遵守质量守恒定律 B.参加反应的各物质分子个数比为1:1
C.反应前后分子数目不变 D.此反应的生成物为混合物
5.在反应 中,28gA与一定质量的B恰好完全反应,生成88gC。若C、D的相对分子质量之比为22:9,则A与B的相对分子质量之比为
A.7:8
B.8:7
C.7:24
D.24:7
6.“绿色化学”要求原料物质中所有的原子完全被利用,全部转入期望的产品中,即原子利用率为100%。一定条件下,CO和H2可以按照不同比例反应,只生成一种产物就能实现“绿色化学”,这种产物不可能是
A.甲醛(CH2O)
B.甲醇(CH4O)
C.乙醇(C2H6O)
D.乙酸(C2H4O2)
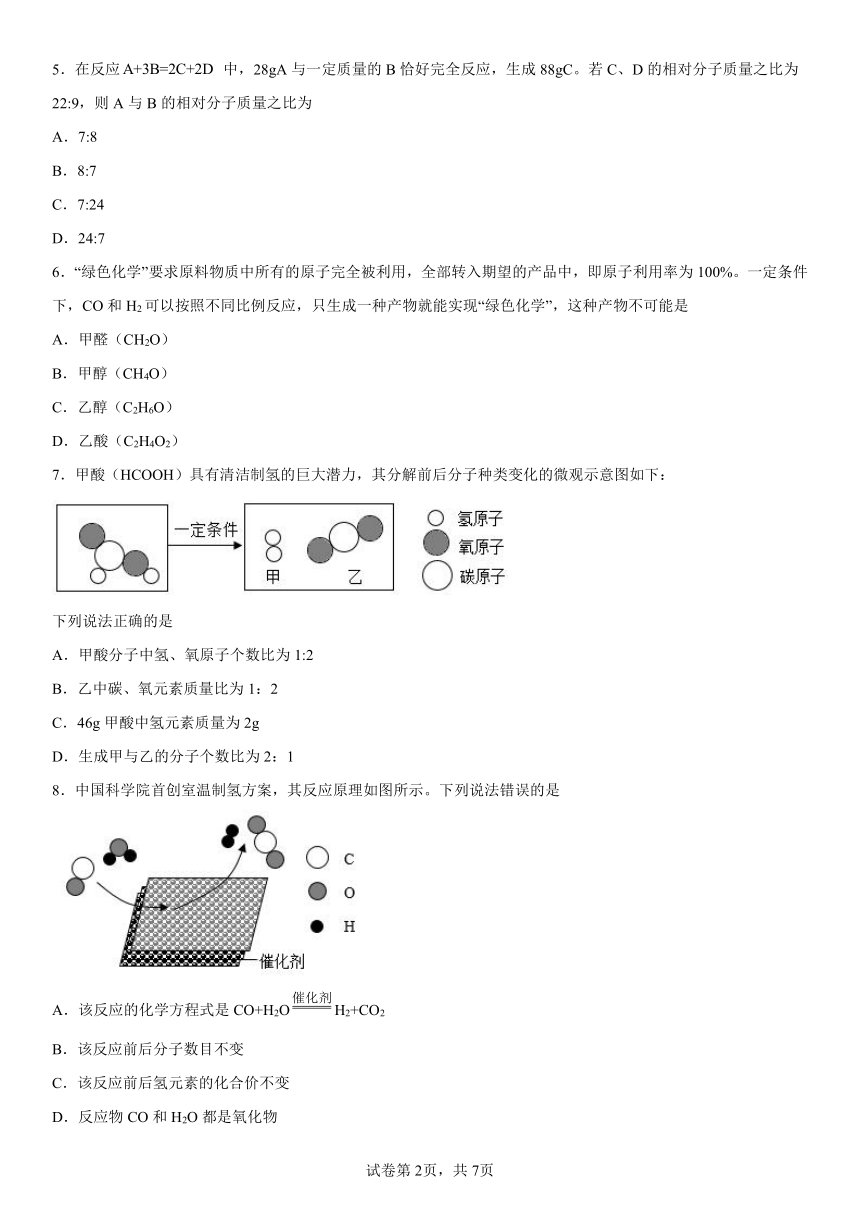
7.甲酸(HCOOH)具有清洁制氢的巨大潜力,其分解前后分子种类变化的微观示意图如下:
下列说法正确的是
A.甲酸分子中氢、氧原子个数比为1:2
B.乙中碳、氧元素质量比为1:2
C.46g甲酸中氢元素质量为2g
D.生成甲与乙的分子个数比为2:1
8.中国科学院首创室温制氢方案,其反应原理如图所示。下列说法错误的是
A.该反应的化学方程式是CO+H2OH2+CO2
B.该反应前后分子数目不变
C.该反应前后氢元素的化合价不变
D.反应物CO和H2O都是氧化物
9.氢气与四氯化硅反应制取硅的化学方程式为:,其中X的化学式是
A.Cl2
B.H2O
C.HCl
D.SiH4
10.一定质量的某化合物完全燃烧,需要3.2g氧气,生成4.4g二氧化碳和1.8g水。下列判断错误的是
A.该化合物的质量为3.0g
B.该化合物一定含有碳、氢、氧三种元素
C.该化合物中碳、氢、氧的原子个数比为2:4:1
D.该化合物中碳元素的质量分数是40%
11.载入航天器中处理CO2的一种方法为 ,X的化学式为
A.Li B.Li2O C.Li2CO3 D.LiOH
12.甲、乙、丙、丁四种物质在一定条件下充分混合,此时各物质的质量分数如图1所示。一段时间后,各物质的质量分数如图2所示。下列说法正确的是
A.丁是反应物 B.x的值为20
C.乙是此化学反应的催化剂 D.生成38g甲,需消耗60g丁
13.红磷在空气中燃烧化学方程式中2P+5O2P2O5指出其中错误是
A.反应条件应改为燃烧 B.氧气应改为“↑”
C.没有配平化学方程式 D.五氧化二磷应改为“↓”
14.氯碱工业是以电解食盐水为基础的基本化学工业,电解食盐水不可能生成的是
A.H2 B.Cl2 C.NaOH D.NaNO3
15.某密闭容器中只有乙、丙、丁三种物质,在一定条件下发生了一个化学反应,容器中乙、丙、丁的质量随甲的质量变化情况如图所示。下列说法错误的是
A.a的值为12
B.丁属于化合物
C.当丁为5g时,容器中乙的质量为11g
D.当甲为2g时,容器中丙与丁的质量之比为12:5
二、填空题
16.实验室制取氯气的化学方程式为:MnO2+4HCl(浓)MnCl2+Cl2↑+2X,请写出X的化学式_____。
17.宏观、微观和符号之间建立联系是学习化学的重要思维方法。下图是某汽车尾气处理过程中发生的一个反应,请回答下列问题。
(1)图示中的物质,属于单质的是________(填化学式);
(2)该反应中,参加反应的X与生成的Y的分子个数最简整数比是____________;
(3)该反应前后,化合价发生了变化的元素是__________(填元素符号),该元素在图示相关物质中的最低化合价是_______。
18.某工厂将矿物燃料燃烧产生的废气中的SO2收集起来,既可以生产稀硫酸,又能制备氢气。其反应过程如下图所示:
(1)写出反应器中发生化学反应的方程式_______。
(2)反应器中S元素的化合价变化为+4→_______。
(3)膜反应器中发生的是分解反应,则X的化学式是_______。
19.硫在氧气中燃烧的化学方程式是:S+O2SO2.这个式子不仅表明了反应物是_______,生成物是______,反应条件是______,还表示了参与反应的各物质之间的质量关系,即在点燃条件下,每______份质量的硫 ______份质量的氧气恰好完全反应生成______份质量的二氧化硫.
20.质量守恒定律是帮助我们学习和认识化学反应实质的重要理论。
(1)下列表述正确的是______。
A 蜡烛燃烧后质量减少,说明质量守恒定律不 是普遍规律
B 每32g S和32g完全反应后,生成64g
C 在化学反应中一定有:
(2)有机化合物R与足量氧气置于密闭容器中充分反应生成和,实验测得反应前后物质的质量如下表。
R O2
反应前质量/g 46 128 0 0
反应后质量/g 0 32 54
则______;已知参加反应的物质R与氧气的分子个数之比为1:3,则R的相对分子质量是______。
三、实验题
21.某化学兴趣小组的同学分别设计四个实验用于验证质量守恒定律如图所示:
(1)实验A中,发生化学反应的化学方程式为_____,小气球的作用是_____。
(2)实验B中,反应前天平平衡,然后将稀盐酸倒入烧杯中与石灰石小块充分反应后再称量,观察到反应后天平不平衡,天平指针向_____偏转,其原因是_____。
(3)如图C所示的小实验。在一根用细铜丝吊着的长玻璃棒两端分别绕上10cm长的粗铜线,并使玻璃棒保持水平。然后,用酒精灯给左边一端铜丝加热1-2分钟。冷却后,他们观察到的现象是:①_____②_____。其原因是_____。
(4)如图D所示的小实验。先在托盘天平上称量一小段洁净的镁条的质量,在空气中点燃后再称量燃烧产物的质量。观察到反应后天平不平衡,其原因是_____。
(5)在四个实验中,是否有不遵循质量守恒定律的反应?_____,请从原子的角度分析质量守恒的原因_____。
22.质量守恒定律具有非常重要的价值和意义。
将下列A、B、C装置分别放在装置D天平上,用砝码平衡。然后取下锥形瓶,将锥形瓶倾斜,使液体药品与固体药品接触,一段时间后再把锥形瓶放在天平上。
(1)①以上实验能验证质量守恒定律的是_______(填字母)。
②选一个实验,写出能证明“质量守恒定律”的实验现象___;并写出相应反应的化学方程式____。
(2)以上实验中,选一个不能验证质量守恒定律的实验,解释原因_______。
23.请仔细观察下图,是测定化学反应前后质量变化的情况的实验,用以验证质量守恒定律。试回答:
(1)实验A中锥形瓶底部预先铺一层薄薄的细沙的目的_______。
(2)实验A中观察到锥形瓶内红磷燃烧,产生大量的_______,气球的现象是_______,装置放回天平后天平_______(填“平衡”“向左偏”“向右偏”),可用于验证质量守恒定律。
(3)上述三个反应前后容器中物质的总质量不相等的是____,符合质量守恒定律的是____(均填实验装置序号)
(4)实验B中,最终天平不平衡的原因是碳酸钠和盐酸反应生成的_______气体逸散空气中,最终没有称量到所有生成物的总质量。
(5)从微观角度分析化学变化遵守质量守恒定律的原因是:_______。
(6)该同学实验后反思:在探究化学反应前后物质的总质量是否发生改变时,对于有气体参加或有气体生成的反应一定要在_______装置中进行。
四、计算题
24.高铁酸钠(Na2FeO4)是一种高效多功能水处理剂,工业上常采用次氯酸钠(NaClO)氧化法生产,反应原理用化学方程式表示为:3NaClO+2Fe(NO3) 3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O
(1)次氯酸钠(NaClO) 中Cl元素的化合价为_____;
(2)高铁酸钠(Na2FeO4)中铁元素和氧元素的质量比为_____ (填最简比);
(3)现要制得830kg含杂质20%的高铁酸钠,至少需要次氯酸钠的质量是多少_________?(列式计算)
25.高温煅烧含杂质10%的石灰石(主要成分为CaCO3)100吨,可得生石灰( CaO)多少吨?
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.A
4.A
5.A
6.C
7.C
8.C
9.C
10.C
11.C
12.A
13.C
14.D
15.D
16.H2O
17. N2 2:3 N -3
18.
+6 H2
19. 硫和氧气 二氧化硫 点燃 32 32 64
20. B 88 46
21. 4P+5O22P2O5 平衡气压,防止橡皮塞飞出 右 碳酸钙和稀盐酸反应生成的二氧化碳逸出 左边一端铜丝变黑色 玻璃棒a端下降,b端上升 加热条件下铜和氧气反应生成了氧化铜 镁和氧气反应生成了氧化镁 否 反应前后原子种类、质量和总个数都不变
22.(1) B 银白色铁钉表面析出红色固体,溶液由蓝色变为浅绿色,天平读数不变 Fe+CuSO4=FeSO4+Cu
(2)A实验:反应生成氧气,气球鼓起,浮力增大,天平读数变小;C实验:反应产物二氧化碳逸出锥形瓶,未被称量,天平读数变小
23.(1)防止红磷燃烧时放热炸裂瓶底
(2) 白烟 先膨胀后缩小 平衡
(3) B ABC
(4)CO2
(5)化学反应前后,原子的种类、数目、质量不变
(6)密闭
24.(1) +1 (2) 7:8 (3)447kg
25.50.4
答案第1页,共2页
答案第1页,共2页
一、单选题
1.大多数动植物呼吸作用时发生反应:,动植物利用该反应释放的能量维持生命活动。X的化学式为
A.C6H12 B.C6H12O C.C6H12O6 D.C6H12O8
2.2022年4月29日《科技日报》报道“我国科学家实现二氧化碳到葡萄糖和油脂的“人工合成”,合成过程中的一个反应微观示意图如下,有关说法正确的是
A.反应前后分子的种类不变
B.反应前后共有三种氧化物
C.丙物质由8个原子构成
D.反应中甲和丁的分子个数比是2∶1
3.把一定质量的甲、乙、丙、丁四种物质放入密闭容器中,在一定条件下反应一段时间后,测得各物质的质量如下表所示,下列说法正确的是
物质 甲 乙 丙 丁
反应前的质量/g 7 10 28 37
反应后的质量/g 14 10 33 x
A.x的值是25 B.乙一定是催化剂
C.甲和丁都是反应物 D.反应中,甲与丙发生改变的质量比是14:33
4.某反应的微观示意图如下,有关说法正确的是
A.此反应遵守质量守恒定律 B.参加反应的各物质分子个数比为1:1
C.反应前后分子数目不变 D.此反应的生成物为混合物
5.在反应 中,28gA与一定质量的B恰好完全反应,生成88gC。若C、D的相对分子质量之比为22:9,则A与B的相对分子质量之比为
A.7:8
B.8:7
C.7:24
D.24:7
6.“绿色化学”要求原料物质中所有的原子完全被利用,全部转入期望的产品中,即原子利用率为100%。一定条件下,CO和H2可以按照不同比例反应,只生成一种产物就能实现“绿色化学”,这种产物不可能是
A.甲醛(CH2O)
B.甲醇(CH4O)
C.乙醇(C2H6O)
D.乙酸(C2H4O2)
7.甲酸(HCOOH)具有清洁制氢的巨大潜力,其分解前后分子种类变化的微观示意图如下:
下列说法正确的是
A.甲酸分子中氢、氧原子个数比为1:2
B.乙中碳、氧元素质量比为1:2
C.46g甲酸中氢元素质量为2g
D.生成甲与乙的分子个数比为2:1
8.中国科学院首创室温制氢方案,其反应原理如图所示。下列说法错误的是
A.该反应的化学方程式是CO+H2OH2+CO2
B.该反应前后分子数目不变
C.该反应前后氢元素的化合价不变
D.反应物CO和H2O都是氧化物
9.氢气与四氯化硅反应制取硅的化学方程式为:,其中X的化学式是
A.Cl2
B.H2O
C.HCl
D.SiH4
10.一定质量的某化合物完全燃烧,需要3.2g氧气,生成4.4g二氧化碳和1.8g水。下列判断错误的是
A.该化合物的质量为3.0g
B.该化合物一定含有碳、氢、氧三种元素
C.该化合物中碳、氢、氧的原子个数比为2:4:1
D.该化合物中碳元素的质量分数是40%
11.载入航天器中处理CO2的一种方法为 ,X的化学式为
A.Li B.Li2O C.Li2CO3 D.LiOH
12.甲、乙、丙、丁四种物质在一定条件下充分混合,此时各物质的质量分数如图1所示。一段时间后,各物质的质量分数如图2所示。下列说法正确的是
A.丁是反应物 B.x的值为20
C.乙是此化学反应的催化剂 D.生成38g甲,需消耗60g丁
13.红磷在空气中燃烧化学方程式中2P+5O2P2O5指出其中错误是
A.反应条件应改为燃烧 B.氧气应改为“↑”
C.没有配平化学方程式 D.五氧化二磷应改为“↓”
14.氯碱工业是以电解食盐水为基础的基本化学工业,电解食盐水不可能生成的是
A.H2 B.Cl2 C.NaOH D.NaNO3
15.某密闭容器中只有乙、丙、丁三种物质,在一定条件下发生了一个化学反应,容器中乙、丙、丁的质量随甲的质量变化情况如图所示。下列说法错误的是
A.a的值为12
B.丁属于化合物
C.当丁为5g时,容器中乙的质量为11g
D.当甲为2g时,容器中丙与丁的质量之比为12:5
二、填空题
16.实验室制取氯气的化学方程式为:MnO2+4HCl(浓)MnCl2+Cl2↑+2X,请写出X的化学式_____。
17.宏观、微观和符号之间建立联系是学习化学的重要思维方法。下图是某汽车尾气处理过程中发生的一个反应,请回答下列问题。
(1)图示中的物质,属于单质的是________(填化学式);
(2)该反应中,参加反应的X与生成的Y的分子个数最简整数比是____________;
(3)该反应前后,化合价发生了变化的元素是__________(填元素符号),该元素在图示相关物质中的最低化合价是_______。
18.某工厂将矿物燃料燃烧产生的废气中的SO2收集起来,既可以生产稀硫酸,又能制备氢气。其反应过程如下图所示:
(1)写出反应器中发生化学反应的方程式_______。
(2)反应器中S元素的化合价变化为+4→_______。
(3)膜反应器中发生的是分解反应,则X的化学式是_______。
19.硫在氧气中燃烧的化学方程式是:S+O2SO2.这个式子不仅表明了反应物是_______,生成物是______,反应条件是______,还表示了参与反应的各物质之间的质量关系,即在点燃条件下,每______份质量的硫 ______份质量的氧气恰好完全反应生成______份质量的二氧化硫.
20.质量守恒定律是帮助我们学习和认识化学反应实质的重要理论。
(1)下列表述正确的是______。
A 蜡烛燃烧后质量减少,说明质量守恒定律不 是普遍规律
B 每32g S和32g完全反应后,生成64g
C 在化学反应中一定有:
(2)有机化合物R与足量氧气置于密闭容器中充分反应生成和,实验测得反应前后物质的质量如下表。
R O2
反应前质量/g 46 128 0 0
反应后质量/g 0 32 54
则______;已知参加反应的物质R与氧气的分子个数之比为1:3,则R的相对分子质量是______。
三、实验题
21.某化学兴趣小组的同学分别设计四个实验用于验证质量守恒定律如图所示:
(1)实验A中,发生化学反应的化学方程式为_____,小气球的作用是_____。
(2)实验B中,反应前天平平衡,然后将稀盐酸倒入烧杯中与石灰石小块充分反应后再称量,观察到反应后天平不平衡,天平指针向_____偏转,其原因是_____。
(3)如图C所示的小实验。在一根用细铜丝吊着的长玻璃棒两端分别绕上10cm长的粗铜线,并使玻璃棒保持水平。然后,用酒精灯给左边一端铜丝加热1-2分钟。冷却后,他们观察到的现象是:①_____②_____。其原因是_____。
(4)如图D所示的小实验。先在托盘天平上称量一小段洁净的镁条的质量,在空气中点燃后再称量燃烧产物的质量。观察到反应后天平不平衡,其原因是_____。
(5)在四个实验中,是否有不遵循质量守恒定律的反应?_____,请从原子的角度分析质量守恒的原因_____。
22.质量守恒定律具有非常重要的价值和意义。
将下列A、B、C装置分别放在装置D天平上,用砝码平衡。然后取下锥形瓶,将锥形瓶倾斜,使液体药品与固体药品接触,一段时间后再把锥形瓶放在天平上。
(1)①以上实验能验证质量守恒定律的是_______(填字母)。
②选一个实验,写出能证明“质量守恒定律”的实验现象___;并写出相应反应的化学方程式____。
(2)以上实验中,选一个不能验证质量守恒定律的实验,解释原因_______。
23.请仔细观察下图,是测定化学反应前后质量变化的情况的实验,用以验证质量守恒定律。试回答:
(1)实验A中锥形瓶底部预先铺一层薄薄的细沙的目的_______。
(2)实验A中观察到锥形瓶内红磷燃烧,产生大量的_______,气球的现象是_______,装置放回天平后天平_______(填“平衡”“向左偏”“向右偏”),可用于验证质量守恒定律。
(3)上述三个反应前后容器中物质的总质量不相等的是____,符合质量守恒定律的是____(均填实验装置序号)
(4)实验B中,最终天平不平衡的原因是碳酸钠和盐酸反应生成的_______气体逸散空气中,最终没有称量到所有生成物的总质量。
(5)从微观角度分析化学变化遵守质量守恒定律的原因是:_______。
(6)该同学实验后反思:在探究化学反应前后物质的总质量是否发生改变时,对于有气体参加或有气体生成的反应一定要在_______装置中进行。
四、计算题
24.高铁酸钠(Na2FeO4)是一种高效多功能水处理剂,工业上常采用次氯酸钠(NaClO)氧化法生产,反应原理用化学方程式表示为:3NaClO+2Fe(NO3) 3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O
(1)次氯酸钠(NaClO) 中Cl元素的化合价为_____;
(2)高铁酸钠(Na2FeO4)中铁元素和氧元素的质量比为_____ (填最简比);
(3)现要制得830kg含杂质20%的高铁酸钠,至少需要次氯酸钠的质量是多少_________?(列式计算)
25.高温煅烧含杂质10%的石灰石(主要成分为CaCO3)100吨,可得生石灰( CaO)多少吨?
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.A
4.A
5.A
6.C
7.C
8.C
9.C
10.C
11.C
12.A
13.C
14.D
15.D
16.H2O
17. N2 2:3 N -3
18.
+6 H2
19. 硫和氧气 二氧化硫 点燃 32 32 64
20. B 88 46
21. 4P+5O22P2O5 平衡气压,防止橡皮塞飞出 右 碳酸钙和稀盐酸反应生成的二氧化碳逸出 左边一端铜丝变黑色 玻璃棒a端下降,b端上升 加热条件下铜和氧气反应生成了氧化铜 镁和氧气反应生成了氧化镁 否 反应前后原子种类、质量和总个数都不变
22.(1) B 银白色铁钉表面析出红色固体,溶液由蓝色变为浅绿色,天平读数不变 Fe+CuSO4=FeSO4+Cu
(2)A实验:反应生成氧气,气球鼓起,浮力增大,天平读数变小;C实验:反应产物二氧化碳逸出锥形瓶,未被称量,天平读数变小
23.(1)防止红磷燃烧时放热炸裂瓶底
(2) 白烟 先膨胀后缩小 平衡
(3) B ABC
(4)CO2
(5)化学反应前后,原子的种类、数目、质量不变
(6)密闭
24.(1) +1 (2) 7:8 (3)447kg
25.50.4
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的构成
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题1 质量守恒定律
- 课题2 如何正确书写化学方程式
- 课题3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动3 燃烧的条件
- 旧版目录
- 第五单元 物质组成的表示
- 课题2 燃料和热量
- 课题3 使用燃料对环境的影响
