第二节 海水“晒盐”课件 -2022-2023学年(鲁教版)九年级化学下册同步精品课堂(共29张PPT)
文档属性
| 名称 | 第二节 海水“晒盐”课件 -2022-2023学年(鲁教版)九年级化学下册同步精品课堂(共29张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-13 07:18:05 | ||
图片预览








文档简介
(共29张PPT)
第二节 海水“晒盐”
第八单元 海水中的化学
PART
01
PART
02
知道蒸发结晶是海水晒盐的基本原理
了解食盐的用途和工业上精制食盐的方法
学习目标
从海水中提取食盐的方法主要是“盐田法”这是一种古老的而至今仍广泛沿用的方法。使用该法。需要在气候温和,光照充足的地区选择大片平坦的海边滩涂,构建盐田。
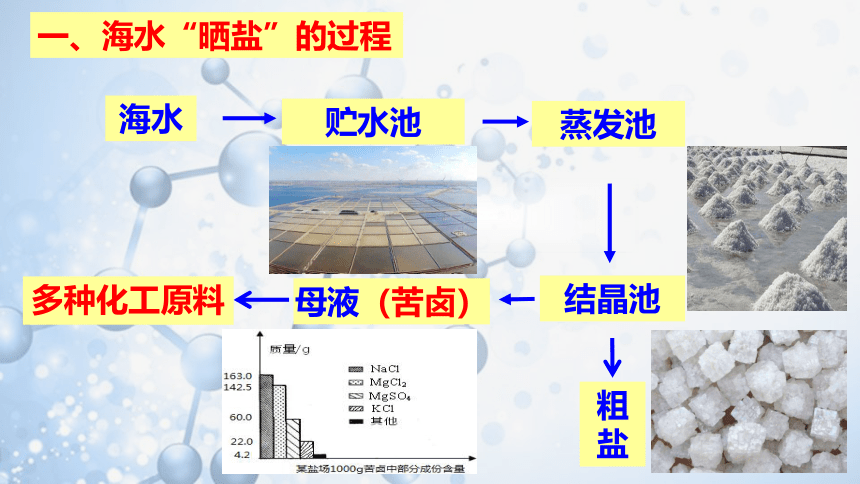
海水
贮水池
蒸发池
结晶池
粗盐
母液(苦卤)
多种化工原料
一、海水“晒盐”的过程
饱和溶液的配制与蒸发结晶
实验过程:
1.量取20mL蒸馏水,倒入小烧杯中。称取10g食盐晶体,先取一半(约5g)加入小烧杯中,充分搅拌,观察食盐是否全部溶解。
有未溶解的食盐晶体存在,且量不再减少。
再将剩余食盐晶体加入小烧杯中,充分搅拌,观察食盐是否全部溶解。
活动天地
2.取小烧杯中的上层清液少许,滴在洁净的玻璃片上。用电吹风向玻璃片上的溶液吹热风,观察现象。
玻璃片上有固体析出
结论:在一定的温度下,一定量的溶剂里(通常指水),某 物质不能无限制溶解。
问题:
1.怎样判断食盐溶液是否达到饱和状态?
2.从获得饱和食盐溶液的方法来看,本实验与海水 “晒盐”有什么不同?
观察在一定温度下,溶液中是否有未溶解的氯化钠固体。如有,且固体的量不再减少,那么这种溶液就是该温度下氯化钠的饱和溶液。
本实验是向一定量的水中不断加入溶质,而海水“晒盐”是蒸发溶剂的方法。
3.你认为哪些自然条件有利于海水“晒盐”?
气候温和,光照充足,降雨量少,大片平坦海边滩涂。
蒸发结晶
海水“晒盐”是海水经日晒、风吹等,使溶剂不断减少,溶质的质量分数逐渐增大,直至形成饱和溶液,继而析出晶体,这便是蒸发结晶。
粗盐的成分
主要成分: 氯化钠
杂质:
不溶性杂质:泥沙
可溶性杂质:
氯化镁、
氯化钙、
硫酸钠等
二、粗盐的提纯
问题:
1.使用什么方法可将粗盐中的泥沙除去?
2.除去泥沙后,再怎样操作才能得到食盐晶体?
氯化钠溶于水,泥沙不溶于水,先溶解再过滤
加热蒸发水分,使食盐结晶,即蒸发结晶
2.实验仪器:量筒(10mL)、胶头滴管、小烧杯、托盘天平、药匙、玻璃棒、酒精灯、蒸发皿、漏斗、铁架台(附铁圈)、滤纸
重结晶法提纯粗盐
活动与探究
1.实验用品:蒸馏水、粗盐
3.实验步骤:
(2)过滤
一贴:
二低:
三靠:
滤纸紧贴漏斗壁
滤纸边缘略低于漏斗边缘
滤液边缘略低于滤纸边缘
烧杯口紧靠玻璃棒
玻璃棒下端轻轻斜靠三层滤纸处
漏斗管口下端紧靠烧杯内壁
(1)溶解
用玻璃棒搅拌,加快溶解
问题:
分析过滤后滤液仍然浑浊的原因?
a.液面高于滤纸的边缘
b.滤纸破损
c.接收滤液的烧杯内有固体不溶物
(3)蒸发
把所得澄清滤液倒入蒸发皿,把蒸发皿放在铁架台的铁圈上,用酒精灯加热,同时用玻璃棒不断搅拌滤液,以防液滴飞溅,待蒸发皿中出现较多固体时,停止加热。利用蒸发皿的余热使滤液蒸干。
问题:何时停止加热?
待蒸发皿中出现较多固体时,停止加热。
问题:粗盐的提纯过程中用到几次玻璃棒,分别起何作用?
三次
溶解时起搅拌加速溶解的作用;
过滤时起引流滤液的作用;
蒸发时起搅拌作用以防止局部温度过高液滴飞溅。
1.用什么试剂除去Ca2+、Mg2+、SO42-?
2.所用试剂只有过量才能除净这些杂质,你能设计一个合理的顺序逐一除杂吗?
BaCl2溶液、NaOH溶液、Na2CO3溶液和稀盐酸。
利用重结晶法能将粗盐中的不溶性杂质和部分可溶性杂质除去,但是得到的食盐中仍含有可溶性杂质CaCl2、MgCl2、Na2SO4等。工业上是利用化学方法将它们除去而得到精盐的。
BaCl2溶液、NaOH溶液、Na2CO3溶液三种试剂的添加顺序:
方案一:BaCl2溶液、Na2CO3溶液、NaOH溶液、
方案二:BaCl2溶液、NaOH溶液、Na2CO3溶液
方案二:NaOH溶液、BaCl2溶液、Na2CO3溶液
成功的关键:Na2CO3必须在 BaCl2之后加入
除杂过程: (依次加入在 过量的BaCl2、 NaOH 、Na2CO3;过滤之后加稀盐酸)
过量BaCl2溶液
除SO42-
过量NaOH溶液
除Mg2+
过量Na2CO3溶液
除Ca2+ 、 Ba2+
过滤
除泥沙及沉淀
适量盐酸
除CO32-、OH-
精制食盐水
粗盐水
除去可溶性杂质的微观过程:
有关反应的化学方程式:
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
2NaOH + MgCl2 = 2NaCl + Mg(OH) 2 ↓
CaCl2 + Na2CO3 =2NaCl + CaCO3 ↓
BaCl2 + Na2CO3 = 2NaCl + BaCO3 ↓
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
NaOH + HCl = NaCl + H2O
食盐的用途
1.食盐是制取盐酸、烧碱、纯碱等的化工原料
2.食盐水农业选种
3.食盐是重要的调味品和食品添加剂
4.配制生理食盐水
典型例题
知识点一:海水“晒盐”
【典例1】下列关于海水“晒盐”原理的分析,正确的
是( )
A.利用阳光照射使海水升温得到食盐
B.利用海风降温析出食盐晶体
C.利用阳光和风力使水分蒸发得到食盐
D.利用海水在阳光下发生分解反应制得食盐
C
知识点二:粗盐提纯
【典例2】(2022岳阳)小文同学做粗盐(含难溶性杂质)提纯的实验并计算精盐产率,如图是部分操作示意图,请回答:
(1)操作②过滤后,溶液仍然浑浊,可能的原因是 (填写一条);
(2)操作③中玻璃棒搅拌的目的是 ;
(3)图示中正确的操作顺序为 (填序号);
(4)操作①溶解过程中有部分液体溅出,会使所得精盐的产率 (填“偏高”、“偏低”或“无影响”)。
滤纸破损
加速溶解
④①②③
偏低
课堂达标
1. (2022江西)合理使用食品添加剂可成就美食,维护健康。下列食品添加剂与其作用不相符的是( )
A. 食盐—调味剂 B. 蔗糖—甜味剂
C. 碳酸钙—预防骨质疏松 D. 小苏打—预防甲状腺肿大
2. (2022苏州)粗盐初步提纯实验中,有关装置和操作正确的是( )
D
B
3. (2022绵阳)下列实验方案不能达到实验目的的是( )
A. A B. B C. C D. D
C
选项 实验目 实验方案
A 检验硬水与软水 取样,分别加肥皂水振荡,观察产生泡沫的情况
B 鉴别化肥NH4Cl和K2SO4 取样,分别加入熟石灰,混合研磨后闻气味
C 检验久置的NaOH是否变质 取样,加水溶解,滴加酚酞溶液观察 否变红
D 除去粗盐中的难溶性杂质 进行溶解、沉淀、过滤、蒸发、结晶等操作
4. (2022绥化)海水晒盐得到粗盐,粗盐中除含有泥沙外,还含有氯化镁、氯化钙、硫酸钠等多种可溶性杂质要提纯粗盐得到精盐。提纯的过程需要以下操作步骤:
①加入过量氢氧化钠溶液 ②加入过量碳酸钠溶液
③加入过量氯化钡溶液 ④加入过量稀盐酸
⑤过滤 ⑥蒸发结晶
则正确的操作顺序是( )
A.③①②④⑥⑤ B.②①③⑤④⑥
C.①③②⑤④⑥ D.①②④③⑥⑤
C
5. (2022梧州)二氧化氯(ClO2)是一种常用的消毒剂,工业以粗盐水(含少量Ca2+、Mg2+、 等杂质离子)为原料生产ClO2,工艺流程如图8所示。
(1)除去粗盐中的难溶性杂质的步骤是溶解、________。
(2)“精制”中,用下列药品除去杂质离子,请写出一组合理的添加顺序
____ (填序号)。
①Na2CO3 ②BaCl2 ③NaOH
(3)“精制”最后应加入适量盐酸,其目的是除去溶液中的______ (填离子符号)。
(4)电解池中发生的主要化学反应方程式为_________________。
(5)生产过程中能循环利用的物质X是________(填化学式)。
过滤
③②①或②③①或②①③
CO32- 、OH-
NaCl+3H2O通电NaClO3+3H2↑
NaCl
6. (2022恩施州)某同学利用含MgCl2、Na2SO4、CaCl2杂质的粗盐,配制一定溶质质量分数的氯化钠溶液,他设计了如下实验流程,请结合物质溶解性表,回答下列问题.部分物质在水中的溶解性表(右图)
(1)步骤二中使用的三种试剂为:
①Na2CO3溶液②BaCl2溶液③NaOH溶液,
依次加入试剂的顺序为 (序号)。
(2)步骤二中加入足量NaOH溶液发生反应的化学方程
式 。
(3)若经过滤,滤液仍浑浊的原因可能是 (填序号)。
①滤纸破损 ②液面高于滤纸边缘 ③仪器不干净
(4)步骤三操作X的名称是 。用经X操作后得到的6 g NaCl固体,配制溶质质量分数为6%的氯化钠溶液,所需水的质量为 g。
2NaOH + MgCl2 = 2NaCl + Mg(OH) 2 ↓
②①③或②③①或③②①
①②③
蒸发
阴离子 阳离子 OH﹣ SO42﹣ CO32﹣
Ba2+ 溶 不溶 不溶
Ca2+ 微溶 微溶 不溶
Mg2+ 不溶 溶 微溶
94
课堂小结
1.可通过蒸发结晶的方法从海水中得到食盐
2.结晶分为蒸发结晶和降温结晶
第二节 海水“晒盐”
第八单元 海水中的化学
PART
01
PART
02
知道蒸发结晶是海水晒盐的基本原理
了解食盐的用途和工业上精制食盐的方法
学习目标
从海水中提取食盐的方法主要是“盐田法”这是一种古老的而至今仍广泛沿用的方法。使用该法。需要在气候温和,光照充足的地区选择大片平坦的海边滩涂,构建盐田。
海水
贮水池
蒸发池
结晶池
粗盐
母液(苦卤)
多种化工原料
一、海水“晒盐”的过程
饱和溶液的配制与蒸发结晶
实验过程:
1.量取20mL蒸馏水,倒入小烧杯中。称取10g食盐晶体,先取一半(约5g)加入小烧杯中,充分搅拌,观察食盐是否全部溶解。
有未溶解的食盐晶体存在,且量不再减少。
再将剩余食盐晶体加入小烧杯中,充分搅拌,观察食盐是否全部溶解。
活动天地
2.取小烧杯中的上层清液少许,滴在洁净的玻璃片上。用电吹风向玻璃片上的溶液吹热风,观察现象。
玻璃片上有固体析出
结论:在一定的温度下,一定量的溶剂里(通常指水),某 物质不能无限制溶解。
问题:
1.怎样判断食盐溶液是否达到饱和状态?
2.从获得饱和食盐溶液的方法来看,本实验与海水 “晒盐”有什么不同?
观察在一定温度下,溶液中是否有未溶解的氯化钠固体。如有,且固体的量不再减少,那么这种溶液就是该温度下氯化钠的饱和溶液。
本实验是向一定量的水中不断加入溶质,而海水“晒盐”是蒸发溶剂的方法。
3.你认为哪些自然条件有利于海水“晒盐”?
气候温和,光照充足,降雨量少,大片平坦海边滩涂。
蒸发结晶
海水“晒盐”是海水经日晒、风吹等,使溶剂不断减少,溶质的质量分数逐渐增大,直至形成饱和溶液,继而析出晶体,这便是蒸发结晶。
粗盐的成分
主要成分: 氯化钠
杂质:
不溶性杂质:泥沙
可溶性杂质:
氯化镁、
氯化钙、
硫酸钠等
二、粗盐的提纯
问题:
1.使用什么方法可将粗盐中的泥沙除去?
2.除去泥沙后,再怎样操作才能得到食盐晶体?
氯化钠溶于水,泥沙不溶于水,先溶解再过滤
加热蒸发水分,使食盐结晶,即蒸发结晶
2.实验仪器:量筒(10mL)、胶头滴管、小烧杯、托盘天平、药匙、玻璃棒、酒精灯、蒸发皿、漏斗、铁架台(附铁圈)、滤纸
重结晶法提纯粗盐
活动与探究
1.实验用品:蒸馏水、粗盐
3.实验步骤:
(2)过滤
一贴:
二低:
三靠:
滤纸紧贴漏斗壁
滤纸边缘略低于漏斗边缘
滤液边缘略低于滤纸边缘
烧杯口紧靠玻璃棒
玻璃棒下端轻轻斜靠三层滤纸处
漏斗管口下端紧靠烧杯内壁
(1)溶解
用玻璃棒搅拌,加快溶解
问题:
分析过滤后滤液仍然浑浊的原因?
a.液面高于滤纸的边缘
b.滤纸破损
c.接收滤液的烧杯内有固体不溶物
(3)蒸发
把所得澄清滤液倒入蒸发皿,把蒸发皿放在铁架台的铁圈上,用酒精灯加热,同时用玻璃棒不断搅拌滤液,以防液滴飞溅,待蒸发皿中出现较多固体时,停止加热。利用蒸发皿的余热使滤液蒸干。
问题:何时停止加热?
待蒸发皿中出现较多固体时,停止加热。
问题:粗盐的提纯过程中用到几次玻璃棒,分别起何作用?
三次
溶解时起搅拌加速溶解的作用;
过滤时起引流滤液的作用;
蒸发时起搅拌作用以防止局部温度过高液滴飞溅。
1.用什么试剂除去Ca2+、Mg2+、SO42-?
2.所用试剂只有过量才能除净这些杂质,你能设计一个合理的顺序逐一除杂吗?
BaCl2溶液、NaOH溶液、Na2CO3溶液和稀盐酸。
利用重结晶法能将粗盐中的不溶性杂质和部分可溶性杂质除去,但是得到的食盐中仍含有可溶性杂质CaCl2、MgCl2、Na2SO4等。工业上是利用化学方法将它们除去而得到精盐的。
BaCl2溶液、NaOH溶液、Na2CO3溶液三种试剂的添加顺序:
方案一:BaCl2溶液、Na2CO3溶液、NaOH溶液、
方案二:BaCl2溶液、NaOH溶液、Na2CO3溶液
方案二:NaOH溶液、BaCl2溶液、Na2CO3溶液
成功的关键:Na2CO3必须在 BaCl2之后加入
除杂过程: (依次加入在 过量的BaCl2、 NaOH 、Na2CO3;过滤之后加稀盐酸)
过量BaCl2溶液
除SO42-
过量NaOH溶液
除Mg2+
过量Na2CO3溶液
除Ca2+ 、 Ba2+
过滤
除泥沙及沉淀
适量盐酸
除CO32-、OH-
精制食盐水
粗盐水
除去可溶性杂质的微观过程:
有关反应的化学方程式:
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
2NaOH + MgCl2 = 2NaCl + Mg(OH) 2 ↓
CaCl2 + Na2CO3 =2NaCl + CaCO3 ↓
BaCl2 + Na2CO3 = 2NaCl + BaCO3 ↓
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
NaOH + HCl = NaCl + H2O
食盐的用途
1.食盐是制取盐酸、烧碱、纯碱等的化工原料
2.食盐水农业选种
3.食盐是重要的调味品和食品添加剂
4.配制生理食盐水
典型例题
知识点一:海水“晒盐”
【典例1】下列关于海水“晒盐”原理的分析,正确的
是( )
A.利用阳光照射使海水升温得到食盐
B.利用海风降温析出食盐晶体
C.利用阳光和风力使水分蒸发得到食盐
D.利用海水在阳光下发生分解反应制得食盐
C
知识点二:粗盐提纯
【典例2】(2022岳阳)小文同学做粗盐(含难溶性杂质)提纯的实验并计算精盐产率,如图是部分操作示意图,请回答:
(1)操作②过滤后,溶液仍然浑浊,可能的原因是 (填写一条);
(2)操作③中玻璃棒搅拌的目的是 ;
(3)图示中正确的操作顺序为 (填序号);
(4)操作①溶解过程中有部分液体溅出,会使所得精盐的产率 (填“偏高”、“偏低”或“无影响”)。
滤纸破损
加速溶解
④①②③
偏低
课堂达标
1. (2022江西)合理使用食品添加剂可成就美食,维护健康。下列食品添加剂与其作用不相符的是( )
A. 食盐—调味剂 B. 蔗糖—甜味剂
C. 碳酸钙—预防骨质疏松 D. 小苏打—预防甲状腺肿大
2. (2022苏州)粗盐初步提纯实验中,有关装置和操作正确的是( )
D
B
3. (2022绵阳)下列实验方案不能达到实验目的的是( )
A. A B. B C. C D. D
C
选项 实验目 实验方案
A 检验硬水与软水 取样,分别加肥皂水振荡,观察产生泡沫的情况
B 鉴别化肥NH4Cl和K2SO4 取样,分别加入熟石灰,混合研磨后闻气味
C 检验久置的NaOH是否变质 取样,加水溶解,滴加酚酞溶液观察 否变红
D 除去粗盐中的难溶性杂质 进行溶解、沉淀、过滤、蒸发、结晶等操作
4. (2022绥化)海水晒盐得到粗盐,粗盐中除含有泥沙外,还含有氯化镁、氯化钙、硫酸钠等多种可溶性杂质要提纯粗盐得到精盐。提纯的过程需要以下操作步骤:
①加入过量氢氧化钠溶液 ②加入过量碳酸钠溶液
③加入过量氯化钡溶液 ④加入过量稀盐酸
⑤过滤 ⑥蒸发结晶
则正确的操作顺序是( )
A.③①②④⑥⑤ B.②①③⑤④⑥
C.①③②⑤④⑥ D.①②④③⑥⑤
C
5. (2022梧州)二氧化氯(ClO2)是一种常用的消毒剂,工业以粗盐水(含少量Ca2+、Mg2+、 等杂质离子)为原料生产ClO2,工艺流程如图8所示。
(1)除去粗盐中的难溶性杂质的步骤是溶解、________。
(2)“精制”中,用下列药品除去杂质离子,请写出一组合理的添加顺序
____ (填序号)。
①Na2CO3 ②BaCl2 ③NaOH
(3)“精制”最后应加入适量盐酸,其目的是除去溶液中的______ (填离子符号)。
(4)电解池中发生的主要化学反应方程式为_________________。
(5)生产过程中能循环利用的物质X是________(填化学式)。
过滤
③②①或②③①或②①③
CO32- 、OH-
NaCl+3H2O通电NaClO3+3H2↑
NaCl
6. (2022恩施州)某同学利用含MgCl2、Na2SO4、CaCl2杂质的粗盐,配制一定溶质质量分数的氯化钠溶液,他设计了如下实验流程,请结合物质溶解性表,回答下列问题.部分物质在水中的溶解性表(右图)
(1)步骤二中使用的三种试剂为:
①Na2CO3溶液②BaCl2溶液③NaOH溶液,
依次加入试剂的顺序为 (序号)。
(2)步骤二中加入足量NaOH溶液发生反应的化学方程
式 。
(3)若经过滤,滤液仍浑浊的原因可能是 (填序号)。
①滤纸破损 ②液面高于滤纸边缘 ③仪器不干净
(4)步骤三操作X的名称是 。用经X操作后得到的6 g NaCl固体,配制溶质质量分数为6%的氯化钠溶液,所需水的质量为 g。
2NaOH + MgCl2 = 2NaCl + Mg(OH) 2 ↓
②①③或②③①或③②①
①②③
蒸发
阴离子 阳离子 OH﹣ SO42﹣ CO32﹣
Ba2+ 溶 不溶 不溶
Ca2+ 微溶 微溶 不溶
Mg2+ 不溶 溶 微溶
94
课堂小结
1.可通过蒸发结晶的方法从海水中得到食盐
2.结晶分为蒸发结晶和降温结晶
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
