6-2 元素(二)(课件 33PPT)
文档属性
| 名称 | 6-2 元素(二)(课件 33PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-12-13 00:00:00 | ||
图片预览








文档简介
(共33张PPT)
§ 6-2 元素(二)
——相对原子质量、元素周期表
华师大版八年级上册
复 习:
1、什么是元素?不同元素之间的本质区别是什么?
2、已知元素可分为哪两类?
3、原子结构是怎样的?原子质量主要取决于什么微粒?
原子由原子核和核外电子构成;原子核由质子和中子构成。原子质量主要取决于原子核。
元素是具有相同质子数的同一类原子的总称。不同元素之间的本质区别是质子数不同。
自然界中的元素可分为金属元素和非金属元素两大类。
一、相对原子质量
原子的质量很小,由实验测得:
一个氢原子的质量约为 。
一个碳原子的质量约为 。
一个氧原子的质量约为 。
显然,用这样小的数字来表述原子的质量,书写、记忆与进行计算都很不方便的。 因此国际上统一采用原子的相对质量。
一个水分子的质量为2.991×10-26千克;
一个一氧化碳分子的质量为4.65×10-26千克。
我们把一种质子数和中子数均为6的碳原子碳-12作为比较标准,把它的相对原子质量定为12,以其原子质量的1/12作为基准,计算其他原子的相对质量,得到的数值便是这种原子的相对原子质量。
一、相对原子质量
例题: 已知1个碳-12原子的质量为 ,一个氢原子的质量为 ,则它的相对原子质量为多少?
1个氢原子的实际质量
氢原子的相对原子质量=
1个碳-12原子的实际质量×
1
-
12
1.67×10-27 kg
= ≈1
1.993×10-26 kg×
1
-
12
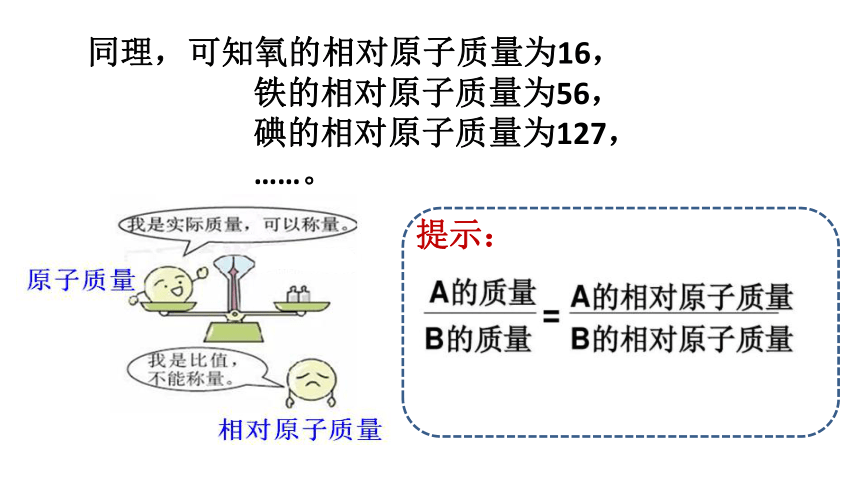
同理,可知氧的相对原子质量为16,
铁的相对原子质量为56,
碘的相对原子质量为127,
……。
提示:
1. 相对原子质量不等于原子的实际质量;
2.原子的实际质量单位为千克;
3.相对原子质量只是一个比值,所以没有单位;
4.相对原子质量虽不是原子的实际质量,但能反映出原子实际质量的相对大小。
原子的相对质量越大,其实际质量也越大。
原子的实际质量越大,它的相对原子质量也越大。
注意
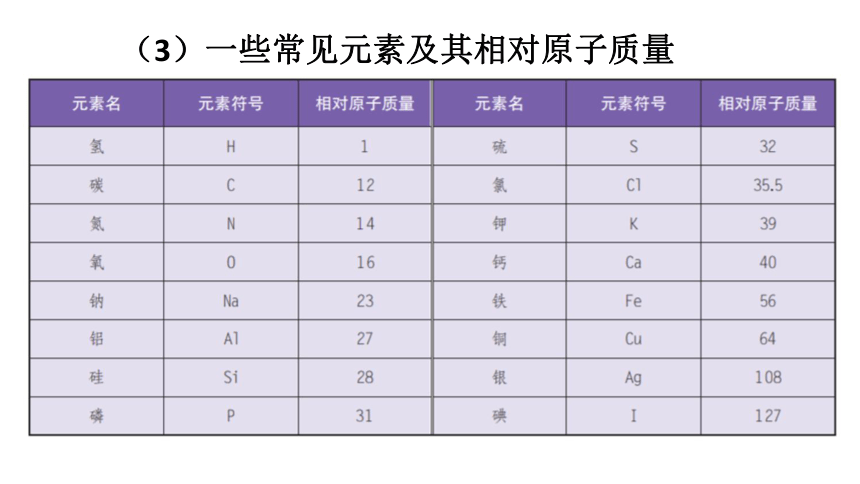
(3)一些常见元素及其相对原子质量
元素名 元素符号 相对原子质量 元素名 元素符号 相对原子质量
氢 氯
碳 钾
氮 钙
氧 铁
钠 铜
镁 锌
铝 银
硫 钡
H
1
C
12
N
14
O
16
Na
23
Mg
24
Al
27
S
32
Cl
35.5
K
39
Ca
40
Fe
56
Cu
64
Zn
65
Ag
108
Ba
137
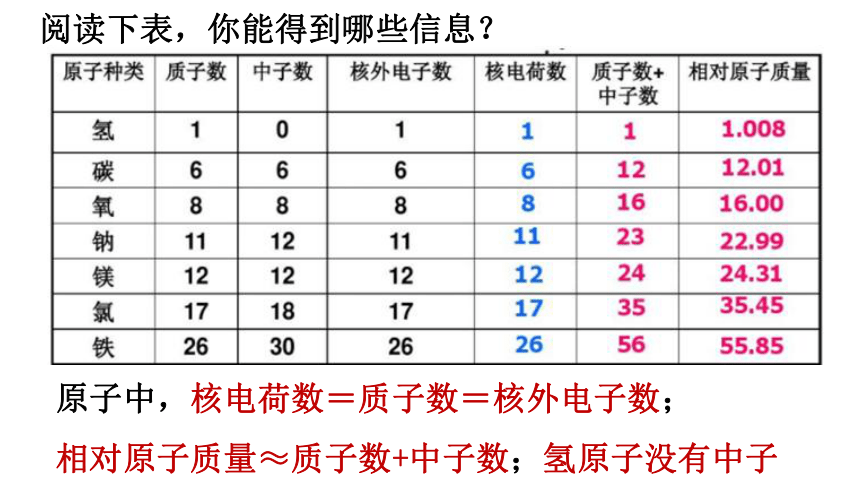
阅读下表,你能得到哪些信息?
原子中,核电荷数=质子数=核外电子数;
相对原子质量≈质子数+中子数;氢原子没有中子
填一填
原子 名称 核电荷数 质子数 中子数 电子数 相对原子质量
氢 1 0
氦 2 2
氮 7 14
氧 8 16
硫 16 32
铁 26 30
1
1
1
2
2
4
7
7
7
8
8
8
16
16
16
26
26
56
相对分子质量
分子的质量就是各原子的质量总和。
相对分子质量等于各原子的相对原子质量的总和。
CO2的相对分子质量
=
12+16×2
=
44
O2的相对分子质量
=
16×2
=
32
自然界中有很多周而复始的现象,例如一年四季,12个月,52周,每周都以周日开始,周六结尾,这种周期性变化规律可以用日历表示。
那么,元素之间是否也有规律呢,能否用一张图表表示呢?
1869年,俄国化学家门捷列夫在总结前人的科研成果和他本人大量的科学实践的基础上,发现当时已知的 63种元素,如按原子量的大小由小到大排列,同时又根据元素性质对其进行分类,元素的物理性质和化学性质呈现周期性的变化规律,他把这个规律叫做化学元素周期律,并且编制了第一张体现化学元素周期律的元素周期表。
元素周期律:门捷列夫按原子量的大小由小到大排列,并根据元素性质进行分类,元素的物理性质和化学性质呈现周期性的变化规律。
俄国化学家门捷列夫发现了元素周期律,并编制了元素周期表。
①每个横行称为一个周期,每个纵列称为一个族,共7个周期、16个族;
②每个周期中的元素性质有规律地变化,当一个周期结束后,下一个周期又重复开始。每个族中的元素性质相近,例如,第Ⅰ族除氢元素外,都是典型的金属元素。第Ⅶ族都是典型的非金属元素;
③底色区别金属元素与非金属元素:底色蓝色表示非金属元素,底色为淡蓝色表示金属元素;金属元素位于元素周期表的左下方,非金属元素位于元素周期表的右上方 。
(2)元素周期表的结构:
七个周期
18纵(16族)
周期:金属—>非金属—>稀有气体
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
非金属区
金属区
零
族
元
素
横行:周期数=电子层数
周 期
1
2
3
纵列:族序数=最外层电子数
ⅠA
0
ⅡA ⅢA Ⅳ A ⅤA ⅥA ⅦA
02
原子序数
=质子数
=核电荷数
周期:越向右原子序数越大
族:越向下原子序数越大,化学性质相似
8 O
氧
16.00
原子序数
元素名称
相对原子质量
元素符号
原子序数= 核电荷数=质子数 =核外电子数
元素周期表中每一格放置一种元素,标有原子序数、元素符号、元素名称与相对原子质量等。
质子数相同的一类原子置于同一格中,如氢元素的三种原子(氕、氘、氚)虽然中子数不同,但质子数相同,因此在元素周期表中处于同一位置,这三种氢原子互为同位素。
原子序数实际是原子的核电荷数(即质子数),按照元素的原子序数从小到大排列,能更好地揭示元素性质呈现周期性变化规律的本质。
元素周期表是元素性质的总结,反映了元素的自然分类。它使人们研究数以千万计的物质及其错综复杂的化学现象有了头绪,为人类认识自然界提供了重要的工具。
(3)元素周期表的作用:
1. 如图,是元素周期表中硫元素的信息示意图,对图中信息理解错误的是( )
A. 质子数为16
B. 原子序数为16
C. 属于金属元素
D. 相对原子质量为32.066
C
2、已知某原子的原子序数为56,相对原子质量是137,则下列说法正确的是( )
A.核外电子数为81 B.中子数为81
C.核电荷数为81 D.质子数为81
B
解析: 相对原子质量=质子数+中子数
3.一种有趣的钟表式元素周期表如图所示,下列关于时针所对应的元素说法中正确的是( )
A.2:00对应的元素不是稀有气体元素
B.10:00对应的元素易形成化合物
C.9:00对应元素的离子符号为F+
D.该钟表的整点时间小时数与该元素的质子数相等
D
4.具有相同质子数和不同中子数的同一元素的不同原子互称同位素。氘和氚是核聚变的原料,已知氘、氚原子核内都只有1个质子,但含不同数目的中子,聚变发生后,氘、氚原子核转变为氦原子核。根据以上叙述,下列说法正确的是 ( )
A.氘和氚与氢的原子序数不同
B.氘原子和氚原子是氢的不同元素
C.氘原子和氚原子是氢的两种同位素
D.氘原子和氚原子的相对原子质量相同
C
5.如图是元素周期表的一部分,下列有关说法
正确的是 ( )
A.钠的原子核带22个单位正电荷
B.钙的元素符号为Ga
C.钾的核电荷数是19
D.钠的相对原子质量约是23g
C
6. 下列各图若为元素周期表的一部分(表中数字为原子序数),其中正确的是( )
A. B.
C. D.
2 3 4
11
19 20
2
10 11
17 18
3
10 11 12
19
6
14
32 33
D
7、如图所示为元素周期表的一部分,A~E代表五种不同元素。下列说法中,不正确的是( )
A.B、C同周期
B.A、D同族
C.原子序数:C>B
D.核电荷数:A=E
D
8、认真分析测定相对原子质量的示意图,推断A原子的相对原子质量约为( )
A.12 B.16 C.5 D.10
B
9. 主族元素在周期表中的位置取决于元素原子的( )
相对原子质量和核外电子数
相对原子质量和最外层电子数
电子层数和最外层电子数
电子层数和次外层电子数
C
解析:周期数=电子层数,族序数=最外层电子数。
10、下面是元素周期表的一部分,下列说法正确的是
( )
A.锂是非金属元素
B.氯原子的相对原子质量为35.45kg
C.硫的核外电子数为16
D.氟原子的中子数为9
C
§ 6-2 元素(二)
——相对原子质量、元素周期表
华师大版八年级上册
复 习:
1、什么是元素?不同元素之间的本质区别是什么?
2、已知元素可分为哪两类?
3、原子结构是怎样的?原子质量主要取决于什么微粒?
原子由原子核和核外电子构成;原子核由质子和中子构成。原子质量主要取决于原子核。
元素是具有相同质子数的同一类原子的总称。不同元素之间的本质区别是质子数不同。
自然界中的元素可分为金属元素和非金属元素两大类。
一、相对原子质量
原子的质量很小,由实验测得:
一个氢原子的质量约为 。
一个碳原子的质量约为 。
一个氧原子的质量约为 。
显然,用这样小的数字来表述原子的质量,书写、记忆与进行计算都很不方便的。 因此国际上统一采用原子的相对质量。
一个水分子的质量为2.991×10-26千克;
一个一氧化碳分子的质量为4.65×10-26千克。
我们把一种质子数和中子数均为6的碳原子碳-12作为比较标准,把它的相对原子质量定为12,以其原子质量的1/12作为基准,计算其他原子的相对质量,得到的数值便是这种原子的相对原子质量。
一、相对原子质量
例题: 已知1个碳-12原子的质量为 ,一个氢原子的质量为 ,则它的相对原子质量为多少?
1个氢原子的实际质量
氢原子的相对原子质量=
1个碳-12原子的实际质量×
1
-
12
1.67×10-27 kg
= ≈1
1.993×10-26 kg×
1
-
12
同理,可知氧的相对原子质量为16,
铁的相对原子质量为56,
碘的相对原子质量为127,
……。
提示:
1. 相对原子质量不等于原子的实际质量;
2.原子的实际质量单位为千克;
3.相对原子质量只是一个比值,所以没有单位;
4.相对原子质量虽不是原子的实际质量,但能反映出原子实际质量的相对大小。
原子的相对质量越大,其实际质量也越大。
原子的实际质量越大,它的相对原子质量也越大。
注意
(3)一些常见元素及其相对原子质量
元素名 元素符号 相对原子质量 元素名 元素符号 相对原子质量
氢 氯
碳 钾
氮 钙
氧 铁
钠 铜
镁 锌
铝 银
硫 钡
H
1
C
12
N
14
O
16
Na
23
Mg
24
Al
27
S
32
Cl
35.5
K
39
Ca
40
Fe
56
Cu
64
Zn
65
Ag
108
Ba
137
阅读下表,你能得到哪些信息?
原子中,核电荷数=质子数=核外电子数;
相对原子质量≈质子数+中子数;氢原子没有中子
填一填
原子 名称 核电荷数 质子数 中子数 电子数 相对原子质量
氢 1 0
氦 2 2
氮 7 14
氧 8 16
硫 16 32
铁 26 30
1
1
1
2
2
4
7
7
7
8
8
8
16
16
16
26
26
56
相对分子质量
分子的质量就是各原子的质量总和。
相对分子质量等于各原子的相对原子质量的总和。
CO2的相对分子质量
=
12+16×2
=
44
O2的相对分子质量
=
16×2
=
32
自然界中有很多周而复始的现象,例如一年四季,12个月,52周,每周都以周日开始,周六结尾,这种周期性变化规律可以用日历表示。
那么,元素之间是否也有规律呢,能否用一张图表表示呢?
1869年,俄国化学家门捷列夫在总结前人的科研成果和他本人大量的科学实践的基础上,发现当时已知的 63种元素,如按原子量的大小由小到大排列,同时又根据元素性质对其进行分类,元素的物理性质和化学性质呈现周期性的变化规律,他把这个规律叫做化学元素周期律,并且编制了第一张体现化学元素周期律的元素周期表。
元素周期律:门捷列夫按原子量的大小由小到大排列,并根据元素性质进行分类,元素的物理性质和化学性质呈现周期性的变化规律。
俄国化学家门捷列夫发现了元素周期律,并编制了元素周期表。
①每个横行称为一个周期,每个纵列称为一个族,共7个周期、16个族;
②每个周期中的元素性质有规律地变化,当一个周期结束后,下一个周期又重复开始。每个族中的元素性质相近,例如,第Ⅰ族除氢元素外,都是典型的金属元素。第Ⅶ族都是典型的非金属元素;
③底色区别金属元素与非金属元素:底色蓝色表示非金属元素,底色为淡蓝色表示金属元素;金属元素位于元素周期表的左下方,非金属元素位于元素周期表的右上方 。
(2)元素周期表的结构:
七个周期
18纵(16族)
周期:金属—>非金属—>稀有气体
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
非金属区
金属区
零
族
元
素
横行:周期数=电子层数
周 期
1
2
3
纵列:族序数=最外层电子数
ⅠA
0
ⅡA ⅢA Ⅳ A ⅤA ⅥA ⅦA
02
原子序数
=质子数
=核电荷数
周期:越向右原子序数越大
族:越向下原子序数越大,化学性质相似
8 O
氧
16.00
原子序数
元素名称
相对原子质量
元素符号
原子序数= 核电荷数=质子数 =核外电子数
元素周期表中每一格放置一种元素,标有原子序数、元素符号、元素名称与相对原子质量等。
质子数相同的一类原子置于同一格中,如氢元素的三种原子(氕、氘、氚)虽然中子数不同,但质子数相同,因此在元素周期表中处于同一位置,这三种氢原子互为同位素。
原子序数实际是原子的核电荷数(即质子数),按照元素的原子序数从小到大排列,能更好地揭示元素性质呈现周期性变化规律的本质。
元素周期表是元素性质的总结,反映了元素的自然分类。它使人们研究数以千万计的物质及其错综复杂的化学现象有了头绪,为人类认识自然界提供了重要的工具。
(3)元素周期表的作用:
1. 如图,是元素周期表中硫元素的信息示意图,对图中信息理解错误的是( )
A. 质子数为16
B. 原子序数为16
C. 属于金属元素
D. 相对原子质量为32.066
C
2、已知某原子的原子序数为56,相对原子质量是137,则下列说法正确的是( )
A.核外电子数为81 B.中子数为81
C.核电荷数为81 D.质子数为81
B
解析: 相对原子质量=质子数+中子数
3.一种有趣的钟表式元素周期表如图所示,下列关于时针所对应的元素说法中正确的是( )
A.2:00对应的元素不是稀有气体元素
B.10:00对应的元素易形成化合物
C.9:00对应元素的离子符号为F+
D.该钟表的整点时间小时数与该元素的质子数相等
D
4.具有相同质子数和不同中子数的同一元素的不同原子互称同位素。氘和氚是核聚变的原料,已知氘、氚原子核内都只有1个质子,但含不同数目的中子,聚变发生后,氘、氚原子核转变为氦原子核。根据以上叙述,下列说法正确的是 ( )
A.氘和氚与氢的原子序数不同
B.氘原子和氚原子是氢的不同元素
C.氘原子和氚原子是氢的两种同位素
D.氘原子和氚原子的相对原子质量相同
C
5.如图是元素周期表的一部分,下列有关说法
正确的是 ( )
A.钠的原子核带22个单位正电荷
B.钙的元素符号为Ga
C.钾的核电荷数是19
D.钠的相对原子质量约是23g
C
6. 下列各图若为元素周期表的一部分(表中数字为原子序数),其中正确的是( )
A. B.
C. D.
2 3 4
11
19 20
2
10 11
17 18
3
10 11 12
19
6
14
32 33
D
7、如图所示为元素周期表的一部分,A~E代表五种不同元素。下列说法中,不正确的是( )
A.B、C同周期
B.A、D同族
C.原子序数:C>B
D.核电荷数:A=E
D
8、认真分析测定相对原子质量的示意图,推断A原子的相对原子质量约为( )
A.12 B.16 C.5 D.10
B
9. 主族元素在周期表中的位置取决于元素原子的( )
相对原子质量和核外电子数
相对原子质量和最外层电子数
电子层数和最外层电子数
电子层数和次外层电子数
C
解析:周期数=电子层数,族序数=最外层电子数。
10、下面是元素周期表的一部分,下列说法正确的是
( )
A.锂是非金属元素
B.氯原子的相对原子质量为35.45kg
C.硫的核外电子数为16
D.氟原子的中子数为9
C
同课章节目录
- 第1章 运动和力
- 1 机械运动
- 2 力
- 3 几种常见的力
- 4 运动和力
- 5 二力平衡的条件
- 第2章 压力 压强
- 1 压强
- 2 液体内部的压强
- 3 大气压强
- 4 流体的压强与流速的关系
- 第3章 浮力
- 1 密度
- 2 浮力
- 3 阿基米德原理
- 4 物体浮沉条件及其应用
- 第4章 植物的物质和能量的转化
- 1 绿色开花植物的营养器官
- 2 水在植物体中的代谢
- 3 无机盐在植物体内的代谢
- 4 植物的光合作用和呼吸作用
- 第5章 人体的物质和能量的转化
- 1 食物的消化和吸收
- 2 人体的呼吸
- 3 人体内的物质运输
- 4 人体的排泄
- 5 人体生命活动过程中物质和能量的转化
- 第6章 物质的构成
- 1 构成物质的微粒
- 2 元素
- 3 物质的分类
- 4 化学式
- 5 固态物质
