【粤教版】化学九年级下册 8.4.2常见盐(课件共31页)
文档属性
| 名称 | 【粤教版】化学九年级下册 8.4.2常见盐(课件共31页) |

|
|
| 格式 | pptx | ||
| 文件大小 | 955.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-13 00:00:00 | ||
图片预览











文档简介
(共31张PPT)
粤教版九年级下册
第八章 第四节
常见的盐(第二课时)
1
知识回顾
一、几种常见盐的用途
名称 氯化钠(______) 碳酸钙(_______)
俗称或 主要存在 ________的主要成分 ______________的
主要成分
性状 ______色晶体,易溶于水,有________味;溶液呈______性 多为灰白色矿物,纯净物为白色粉末;________溶于水,能溶于酸
CaCO3
食盐
石灰石、大理石
NaCl
白
咸
中
不
主要 用途 ________、制生理盐水、制化工原料 ________,制熟石灰、珍珠首饰,炼钢、炼铁、制水泥的原料
作调味品
建筑材料
名称 碳酸钠(_______) 碳酸氢钠(_______)
俗称或 主要存在 ________、苏打 ________
性状 白色晶体、风化成粉末,______溶于水,水溶液呈________性 _____色粉末,能溶于水,水溶液有弱的________性,较易________
NaHCO3
纯碱
小苏打
易
碱
白
碱
分解
Na2CO3
主要 用途 造纸、制____________,用于印染工业,制玻璃、瓷砖等 中和胃酸的药物、发酵剂、灭火剂的原料
洗涤剂、洗衣粉
二、盐的组成和分类
1.组成:由__________离子和____离子组成的________。
2.分类
(1)根据阳离子不同,可分为___盐、___盐、___盐等。
(2)根据阴离子不同,盐可分为___ 盐、___盐、____盐等。
金属(或铵根)
酸根
化合物
钠
钾
镁
硫酸
碳酸
硝酸
2
课堂导入
通过前面的学习我们知道,盐能与活泼金属发生置换反应,如:
Fe + CuSO4 == FeSO4 + Cu
除此之外,盐还能与哪些物质反应呢?我们一起来回顾一下。
3
新课讲授
盐的化学性质
01
盐的化学性质
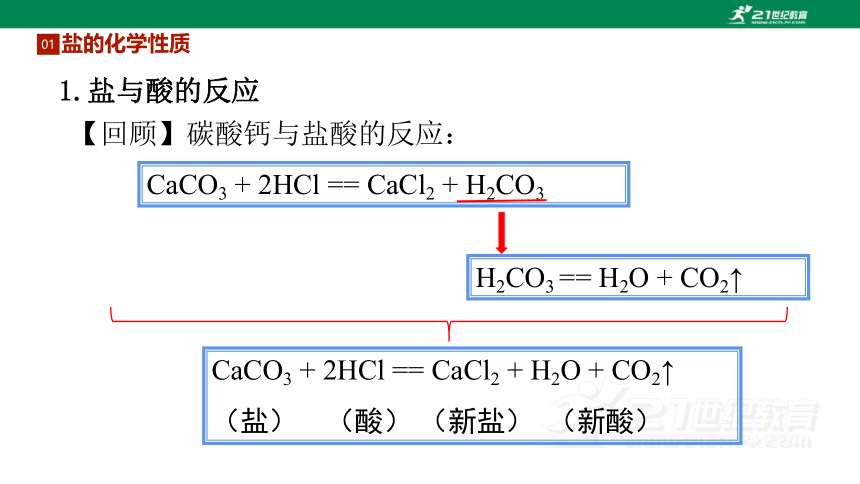
【回顾】碳酸钙与盐酸的反应:
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
(盐) (酸) (新盐) (新酸)
CaCO3 + 2HCl == CaCl2 + H2CO3
H2CO3 == H2O + CO2↑
1.盐与酸的反应
【回顾】硝酸银与稀盐酸的反应:
据此思考,哪些盐能与稀酸发生类似的反应?
碳酸盐与稀酸均可发生类似的反应,如:
Na2CO3+2HCl=2NaCl+H2O+CO2↑
AgNO3+HCl===AgCl↓+HNO3
(盐)(酸)(新盐)(新酸)
【总结】盐可能与酸发生复分解反应
酸+盐====新酸+新盐
2.盐与碱的反应
【回顾】硫酸铜和氯化铁分别与氢氧化钙的反应:
CuSO4 +2NaOH == Cu(OH)2↓+ Na2SO4
碱 盐 新碱 新盐
2FeCl3+3Ca(OH)2=2Fe(OH)3↓+3CaCl2
总结:碱能与某些盐反应。
碱+盐====新碱+新盐
3.盐与盐的反应
【回顾】氯化钡和碳酸钠的反应:
Na2CO3 + BaCl2 = BaCO3↓ + 2NaCl
盐1 盐2 新盐1 新盐2
【试一试】硫酸钠溶液和硝酸钡溶液的反应:
Ba(NO3)2 + Na2SO4 == BaSO4 ↓ + 2NaNO3
总结:两种盐之间可以发生复分解反应。
盐1+盐2====新盐1+新盐2
该类反应可用于检验硫酸和硫酸盐。
观察活动
目的:知道检验硫酸和硫酸盐的方法
【实验8-15】取一支试管加入少许硝酸钡溶液,再滴入几滴稀硫酸,观察现象。
【实验8-16】在上述有硫酸钡沉淀的试管中,滴加几滴稀硝酸,观察到的现象是________________
实验现象:有白色沉淀生成。
白色沉淀不溶解。
【实验8-17】(1)取一支试管加入少许碳酸钠溶液,再滴入几滴硝酸钡溶液,观察现象。
实验现象:有白色沉淀生成。
Ba(NO3)2 + Na2CO3 == BaCO3 ↓ + 2NaNO3
解释:
(2)在上述有碳酸钡沉淀的试管中,滴加几滴稀硝酸,观察到的现象是________________
白色沉淀逐渐溶解。
总结:
硫酸钡沉淀不溶于稀硝酸,碳酸钡沉淀溶于稀硝酸。
根据这一特征,可用硝酸钡溶液鉴别硫酸和可溶性硫酸盐。
盐的化学性质总结:
(可溶)
1.盐 + 金属 = 新盐 + 新金属 (置换反应)
2.盐 + 酸 = 新盐 + 新酸 (复分解反应)
3.盐 + 碱 = 新盐 + 新碱 (复分解反应)
4.盐 + 盐 = 新盐 + 新盐 (复分解反应)
思考:任意两种盐之间一定能发生复分解反应吗?
如:NaCl+kNO3==?
无明显现象,因为它们不发生反应。
那么复分解反应的发生需要哪些条件呢?
02
复分解反应发生的条件
Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOH
观察下列反应:
2NaOH + MgCl2 = Mg(OH)2↓ + 2NaCl
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
有沉淀生成
NaOH + NH4Cl = NaCl + NH3↑+ H2O
2HCl + CaCO3 = CaCl2 + CO2↑ + H2O
H2SO4 + Na2CO3 = Na2SO4 + CO2↑ + H2O
有气体生成
HCl + NaOH = NaCl + H2O
H2SO4 + Cu(OH)2 = CuSO4 + H2O
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Al2O3 + 3H2SO4 = 2Al2(SO4)3 + 3H2O
有水生成
复分解反应发生的条件:
生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生,否则就不能发生。
总结
判断下列反应能否发生,若能发生,尝试写出化学方程式。
3H2SO4 + Fe2O3 —
NaCl + AgNO3 —
NaOH + BaCl2 —
Na2CO3 + BaCl2 —
—
—
—
Fe2(SO4)3+3H2O
NaCl + H2O
×
BaSO4↓ + 2NaCl
思考:复分解反应为什么能发生呢?我们从微观角度来认识一下复分解反应的实质。
2NaOH + H2SO4 = Na2SO4 + 2H2O
NaOH
H2SO4
H+
H+
SO42-
Na+
SO42-
Na+
OH-
OH-
H2O
H2O
Na+
Na+
有水生成的复分解反应
复分解反应的实质:
2HCl + Na2CO3 = 2NaCl + H2O + CO2↑
Na2CO3
HCl
HCl
Na+
Na+
CO32-
H+
H+
Cl-
Cl-
Na+
Na+
H2CO3
Cl-
Cl-
H2O
CO2↑
+
有气体生成的复分解反应
Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOH
Ca(OH)2
Na2CO3
Na+
Na+
CO32-
Ca2+
OH-
OH-
CaCO3↓
OH-
OH-
Na+
Na+
有沉淀生成的复分解反应
Na2SO4 + 2KNO3 ——
K2SO4 + 2NaNO3
×
Na2SO4
KNO3
KNO3
Na+
Na+
SO42-
K+
K+
NO3-
NO3-
Na+
Na+
NO3-
NO3-
SO42-
K+
K+
K2SO4
不能发生复分解反应的类型
盐的溶解性规律:
1、钾、钠、铵、硝酸盐都可溶。
2、盐酸盐只有氯化银不溶。
3、硫酸盐只有硫酸钡不溶。
4、碳酸盐只溶钾、钠、铵,碳酸镁微溶,剩下都不溶。
1、酸都溶
2、可溶性溶碱有五位:钾、钠、铵、钙、钡。
酸与碱的的溶解性规律:
碳酸氢钠可能具有哪些化学性质?
1、受热易分解
2、与酸反应
NaHCO3+HCl== NaCl + CO2 ↑+ H2O
3、溶液显碱性
2NaHCO3 == Na2CO3 + CO2 ↑+ H2O
△
补充:
4
课堂小结
盐+金属 新盐+新金属
化学性质
复分解反应发生的条件:生成物中有沉淀(难溶物)、气体或水等
盐的化学性质
盐+酸 新盐+新酸
盐+碱 新盐+新碱
盐1+盐2 新盐1+新盐2
5
典型例题
考点一:盐的化学性质
【典型例题1】将某溶液分装在两支试管中,其中一支加入氢氧化钠,另一支加入硝酸钡,结果前者产生红褐色沉淀,后者产生白色沉淀,则原溶液是( )
A.CuCl2 B.Fe2(SO4)3
C.FeCl3 D.Cu (NO3)2
B
【迁移训练1】下列各组物质中,能相互反应且反应前后溶液总质量保持不变的是( )
A.氯化钾溶液和硝酸钠溶液
B.铁和硫酸铜溶液
C.稀盐酸和氢氧化钠溶液
D.硫酸和氯化钡溶液
C
考点二:复分解反应发生的条件
【典型例题2】下列两种物质的溶液混合后,能发生反应,且溶液的总质量不会改变的是( )
A.NaOH溶液和稀盐酸
B.Na2CO3溶液和稀盐酸
C.NaCl溶液和稀硫酸
D.Na2CO3溶液和BaCl2溶液
A
【迁移训练2】下列各组物质中,相互不能发生反应的是( )
A.氢氧化钠溶液与硝酸溶液
B.碳酸氢钠与稀盐酸
C.二氧化硫与氢氧化钙溶液
D.碳酸钡溶液与硫酸钠溶液
D
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
粤教版九年级下册
第八章 第四节
常见的盐(第二课时)
1
知识回顾
一、几种常见盐的用途
名称 氯化钠(______) 碳酸钙(_______)
俗称或 主要存在 ________的主要成分 ______________的
主要成分
性状 ______色晶体,易溶于水,有________味;溶液呈______性 多为灰白色矿物,纯净物为白色粉末;________溶于水,能溶于酸
CaCO3
食盐
石灰石、大理石
NaCl
白
咸
中
不
主要 用途 ________、制生理盐水、制化工原料 ________,制熟石灰、珍珠首饰,炼钢、炼铁、制水泥的原料
作调味品
建筑材料
名称 碳酸钠(_______) 碳酸氢钠(_______)
俗称或 主要存在 ________、苏打 ________
性状 白色晶体、风化成粉末,______溶于水,水溶液呈________性 _____色粉末,能溶于水,水溶液有弱的________性,较易________
NaHCO3
纯碱
小苏打
易
碱
白
碱
分解
Na2CO3
主要 用途 造纸、制____________,用于印染工业,制玻璃、瓷砖等 中和胃酸的药物、发酵剂、灭火剂的原料
洗涤剂、洗衣粉
二、盐的组成和分类
1.组成:由__________离子和____离子组成的________。
2.分类
(1)根据阳离子不同,可分为___盐、___盐、___盐等。
(2)根据阴离子不同,盐可分为___ 盐、___盐、____盐等。
金属(或铵根)
酸根
化合物
钠
钾
镁
硫酸
碳酸
硝酸
2
课堂导入
通过前面的学习我们知道,盐能与活泼金属发生置换反应,如:
Fe + CuSO4 == FeSO4 + Cu
除此之外,盐还能与哪些物质反应呢?我们一起来回顾一下。
3
新课讲授
盐的化学性质
01
盐的化学性质
【回顾】碳酸钙与盐酸的反应:
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
(盐) (酸) (新盐) (新酸)
CaCO3 + 2HCl == CaCl2 + H2CO3
H2CO3 == H2O + CO2↑
1.盐与酸的反应
【回顾】硝酸银与稀盐酸的反应:
据此思考,哪些盐能与稀酸发生类似的反应?
碳酸盐与稀酸均可发生类似的反应,如:
Na2CO3+2HCl=2NaCl+H2O+CO2↑
AgNO3+HCl===AgCl↓+HNO3
(盐)(酸)(新盐)(新酸)
【总结】盐可能与酸发生复分解反应
酸+盐====新酸+新盐
2.盐与碱的反应
【回顾】硫酸铜和氯化铁分别与氢氧化钙的反应:
CuSO4 +2NaOH == Cu(OH)2↓+ Na2SO4
碱 盐 新碱 新盐
2FeCl3+3Ca(OH)2=2Fe(OH)3↓+3CaCl2
总结:碱能与某些盐反应。
碱+盐====新碱+新盐
3.盐与盐的反应
【回顾】氯化钡和碳酸钠的反应:
Na2CO3 + BaCl2 = BaCO3↓ + 2NaCl
盐1 盐2 新盐1 新盐2
【试一试】硫酸钠溶液和硝酸钡溶液的反应:
Ba(NO3)2 + Na2SO4 == BaSO4 ↓ + 2NaNO3
总结:两种盐之间可以发生复分解反应。
盐1+盐2====新盐1+新盐2
该类反应可用于检验硫酸和硫酸盐。
观察活动
目的:知道检验硫酸和硫酸盐的方法
【实验8-15】取一支试管加入少许硝酸钡溶液,再滴入几滴稀硫酸,观察现象。
【实验8-16】在上述有硫酸钡沉淀的试管中,滴加几滴稀硝酸,观察到的现象是________________
实验现象:有白色沉淀生成。
白色沉淀不溶解。
【实验8-17】(1)取一支试管加入少许碳酸钠溶液,再滴入几滴硝酸钡溶液,观察现象。
实验现象:有白色沉淀生成。
Ba(NO3)2 + Na2CO3 == BaCO3 ↓ + 2NaNO3
解释:
(2)在上述有碳酸钡沉淀的试管中,滴加几滴稀硝酸,观察到的现象是________________
白色沉淀逐渐溶解。
总结:
硫酸钡沉淀不溶于稀硝酸,碳酸钡沉淀溶于稀硝酸。
根据这一特征,可用硝酸钡溶液鉴别硫酸和可溶性硫酸盐。
盐的化学性质总结:
(可溶)
1.盐 + 金属 = 新盐 + 新金属 (置换反应)
2.盐 + 酸 = 新盐 + 新酸 (复分解反应)
3.盐 + 碱 = 新盐 + 新碱 (复分解反应)
4.盐 + 盐 = 新盐 + 新盐 (复分解反应)
思考:任意两种盐之间一定能发生复分解反应吗?
如:NaCl+kNO3==?
无明显现象,因为它们不发生反应。
那么复分解反应的发生需要哪些条件呢?
02
复分解反应发生的条件
Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOH
观察下列反应:
2NaOH + MgCl2 = Mg(OH)2↓ + 2NaCl
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
有沉淀生成
NaOH + NH4Cl = NaCl + NH3↑+ H2O
2HCl + CaCO3 = CaCl2 + CO2↑ + H2O
H2SO4 + Na2CO3 = Na2SO4 + CO2↑ + H2O
有气体生成
HCl + NaOH = NaCl + H2O
H2SO4 + Cu(OH)2 = CuSO4 + H2O
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Al2O3 + 3H2SO4 = 2Al2(SO4)3 + 3H2O
有水生成
复分解反应发生的条件:
生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生,否则就不能发生。
总结
判断下列反应能否发生,若能发生,尝试写出化学方程式。
3H2SO4 + Fe2O3 —
NaCl + AgNO3 —
NaOH + BaCl2 —
Na2CO3 + BaCl2 —
—
—
—
Fe2(SO4)3+3H2O
NaCl + H2O
×
BaSO4↓ + 2NaCl
思考:复分解反应为什么能发生呢?我们从微观角度来认识一下复分解反应的实质。
2NaOH + H2SO4 = Na2SO4 + 2H2O
NaOH
H2SO4
H+
H+
SO42-
Na+
SO42-
Na+
OH-
OH-
H2O
H2O
Na+
Na+
有水生成的复分解反应
复分解反应的实质:
2HCl + Na2CO3 = 2NaCl + H2O + CO2↑
Na2CO3
HCl
HCl
Na+
Na+
CO32-
H+
H+
Cl-
Cl-
Na+
Na+
H2CO3
Cl-
Cl-
H2O
CO2↑
+
有气体生成的复分解反应
Ca(OH)2 + Na2CO3 = CaCO3↓ + 2NaOH
Ca(OH)2
Na2CO3
Na+
Na+
CO32-
Ca2+
OH-
OH-
CaCO3↓
OH-
OH-
Na+
Na+
有沉淀生成的复分解反应
Na2SO4 + 2KNO3 ——
K2SO4 + 2NaNO3
×
Na2SO4
KNO3
KNO3
Na+
Na+
SO42-
K+
K+
NO3-
NO3-
Na+
Na+
NO3-
NO3-
SO42-
K+
K+
K2SO4
不能发生复分解反应的类型
盐的溶解性规律:
1、钾、钠、铵、硝酸盐都可溶。
2、盐酸盐只有氯化银不溶。
3、硫酸盐只有硫酸钡不溶。
4、碳酸盐只溶钾、钠、铵,碳酸镁微溶,剩下都不溶。
1、酸都溶
2、可溶性溶碱有五位:钾、钠、铵、钙、钡。
酸与碱的的溶解性规律:
碳酸氢钠可能具有哪些化学性质?
1、受热易分解
2、与酸反应
NaHCO3+HCl== NaCl + CO2 ↑+ H2O
3、溶液显碱性
2NaHCO3 == Na2CO3 + CO2 ↑+ H2O
△
补充:
4
课堂小结
盐+金属 新盐+新金属
化学性质
复分解反应发生的条件:生成物中有沉淀(难溶物)、气体或水等
盐的化学性质
盐+酸 新盐+新酸
盐+碱 新盐+新碱
盐1+盐2 新盐1+新盐2
5
典型例题
考点一:盐的化学性质
【典型例题1】将某溶液分装在两支试管中,其中一支加入氢氧化钠,另一支加入硝酸钡,结果前者产生红褐色沉淀,后者产生白色沉淀,则原溶液是( )
A.CuCl2 B.Fe2(SO4)3
C.FeCl3 D.Cu (NO3)2
B
【迁移训练1】下列各组物质中,能相互反应且反应前后溶液总质量保持不变的是( )
A.氯化钾溶液和硝酸钠溶液
B.铁和硫酸铜溶液
C.稀盐酸和氢氧化钠溶液
D.硫酸和氯化钡溶液
C
考点二:复分解反应发生的条件
【典型例题2】下列两种物质的溶液混合后,能发生反应,且溶液的总质量不会改变的是( )
A.NaOH溶液和稀盐酸
B.Na2CO3溶液和稀盐酸
C.NaCl溶液和稀硫酸
D.Na2CO3溶液和BaCl2溶液
A
【迁移训练2】下列各组物质中,相互不能发生反应的是( )
A.氢氧化钠溶液与硝酸溶液
B.碳酸氢钠与稀盐酸
C.二氧化硫与氢氧化钙溶液
D.碳酸钡溶液与硫酸钠溶液
D
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
