2022-2023学年人教版九年级化学下册 11.2化学肥料(第3课时)课件(共33张PPT)
文档属性
| 名称 | 2022-2023学年人教版九年级化学下册 11.2化学肥料(第3课时)课件(共33张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 893.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-13 14:15:10 | ||
图片预览






文档简介
(共33张PPT)
11.2化学肥料(第3课时)
人教版初中化学—九年级上册—第十一单元:盐 化肥
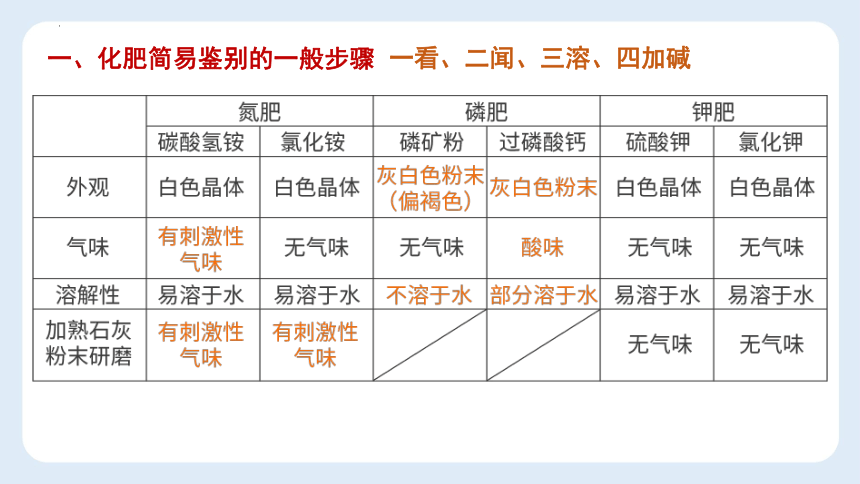
一、化肥简易鉴别的一般步骤
一看、二闻、三溶、四加碱
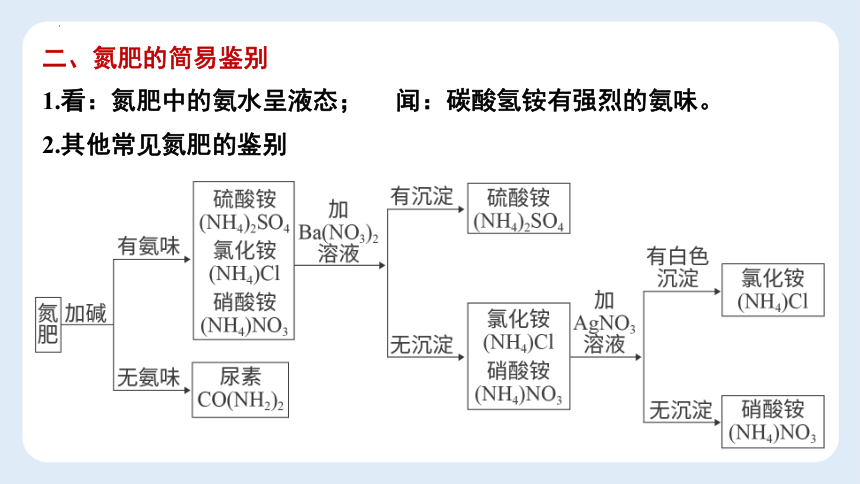
二、氮肥的简易鉴别
1.看:氮肥中的氨水呈液态;
闻:碳酸氢铵有强烈的氨味。
2.其他常见氮肥的鉴别
酸
碱
盐
→ H+ + 酸根离子
→ 金属离子(或NH4+)+ OH-
→ 金属离子(或NH4+)+ 酸根离子
蓝色沉淀
检验待测物中有没有某种离子。
根据离子的特性,利用它的特征反应来进行鉴定。
常见的有色沉淀:
Cu(OH)2
Fe(OH)3
红褐色沉淀
BaSO4、AgCl
既不溶于水,也不溶于酸
的白色沉淀
CaCO3、BaCO3、
Mg(OH)2、Ag2SO4等
不溶于水,但能溶于酸
的白色沉淀
一、概念
二、一般方法
多用复分解反应(生成沉淀、气体或水)鉴定。
三、操作步骤
4.得出结论
一取、二加、三现象、四结论
检验试剂
1.取样 取少量样品于试管中。
待测液
2.加试剂 向其中加入相应的检验试剂。
检验试剂
如果样品是固体,一般先用水溶解,配成溶液后,再加检验试剂。
3.观察现象
三、操作步骤
4.得出结论
一取、二加、三现象、四结论
1.取样 取少量样品于试管中。
2.加试剂 向其中加入相应的检验试剂。
如果样品是固体,一般先用水溶解,配成溶液后,再加检验试剂。
3.观察现象
有无色气体放出,
且该气体能使澄清石灰水变浑浊 (现象)
有二氧化碳气体放出(结果)
分析
推理
四、几种重要离子的鉴定
H+
①取少量待测液,
②取少量待测液,
溶液变红
产生气体
Zn+2HCl=ZnCl2+H2↑
滴入紫色石蕊试液
待测液
紫色石蕊试液
待测液
加入锌粒
锌粒
四、几种重要离子的鉴定
NH4+
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
研磨
取待测样品,与熟石灰混合研磨
产生有刺
激性气味
的气体
用湿润的红色石蕊
试纸检验产生的气体
试纸变蓝
NH3+H2O=NH3 H2O
NH3是唯一能使湿润的红色石蕊试纸变蓝的气体。
加入氢氧化钠溶液,加热;
/溶解后
NH4Cl+NaOH NaCl+NH3↑+H2O
四、几种重要离子的鉴定
Cu2+
蓝色
常见的有色沉淀:
CuCl2+2NaOH=Cu(OH)2↓+2NaCl
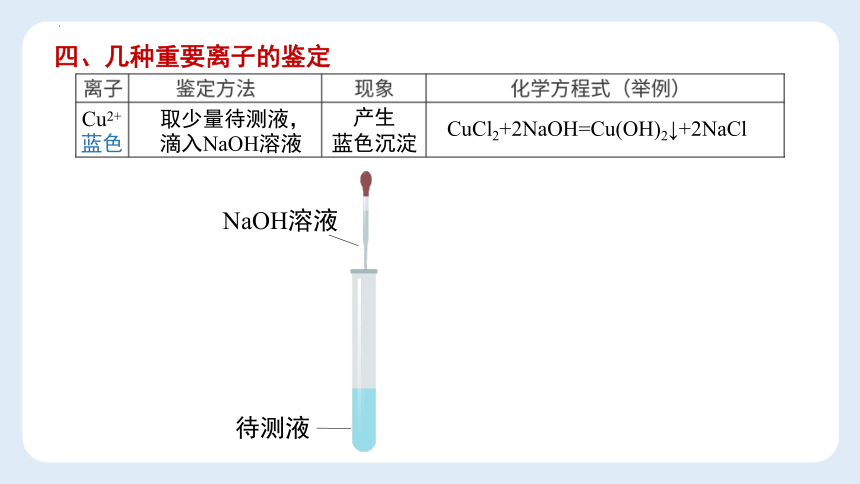
四、几种重要离子的鉴定
Cu2+
蓝色
CuCl2+2NaOH=Cu(OH)2↓+2NaCl
待测液
取少量待测液,
NaOH溶液
滴入NaOH溶液
产生
蓝色沉淀
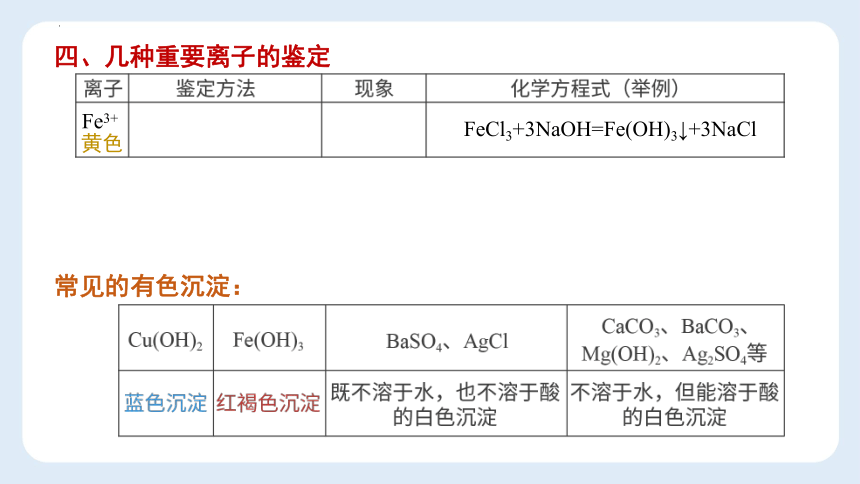
四、几种重要离子的鉴定
Fe3+
黄色
常见的有色沉淀:
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
四、几种重要离子的鉴定
Fe3+
黄色
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
待测液
取少量待测液,
NaOH溶液
滴入NaOH溶液
产生
红褐色沉淀
四、几种重要离子的鉴定
一、概念
检验待测物中有没有某种离子。
二、一般方法
根据离子的特性,利用它的特征反应来进行鉴定。
多用复分解反应(生成沉淀、气体或水)鉴定。
三、操作步骤
一取、二加、三现象、四结论
四、几种重要离子的鉴定
OH-
取少量待测液,
溶液变蓝
待测液
滴入少量紫色石蕊试液
紫色石蕊试液
/ 酚酞溶液
/变红
待测液
酚酞溶液
CO32-
或
HCO3-
取少量待测液,
放出无色无味的
气体,
Na2CO3+2HCl=2NaCl+CO2↑+H2O
NaHCO3+HCI=NaCI+CO2 +H2O
CO2+Ca(OH)2=CaCO3↓+H2O
待测液
稀盐酸
通入澄清石灰水中
放出的气体
稀盐酸,
滴入
澄清石灰水
待测液
澄清石灰
水变浑浊
Cl-
HCl+AgNO3=AgCl↓+HNO3
SO42- Ag2SO4白色沉淀
CO32- Ag2CO3白色沉淀
取少量待测液,
待测液
稀硝酸
先加
入稀硝酸
加稀硝酸后无现象,
AgNO3溶液
Cl-
HCl+AgNO3=AgCl↓+HNO3
SO42- Ag2SO4白色沉淀
CO32- Ag2CO3白色沉淀
取少量待测液,
先加
入稀硝酸
加稀硝酸后无现象,
AgNO3溶液
Cl-
HCl+AgNO3=AgCl↓+HNO3
取少量待测液,
待测液
稀硝酸
先加
入稀硝酸
加稀硝酸后无现象,
AgNO3溶液
、CO32-等的干扰),
(排除SO42-
AgNO3溶液
再加入
后产生不溶于稀
硝酸的白色沉淀
加入AgNO3
Cl-
HCl+AgNO3=AgCl↓+HNO3
取少量待测液,
先加
入稀硝酸
加稀硝酸后无现象,
AgNO3溶液
、CO32-等的干扰),
(排除SO42-
再加入
后产生不溶于稀
硝酸的白色沉淀
加入AgNO3
稀硝酸可否换成稀盐酸?
若换成稀盐酸,从外界引入了Cl-,无论原待测液中有没有Cl-,
加入AgNO3溶液,都会产生不溶于酸的白色沉淀,无法达到鉴定目的。
不可以;
SO42-
H2SO4+BaCl2=BaSO4↓+2HCl
CO32- BaCO3白色沉淀
Ag+ AgCl白色沉淀
BaCl2溶液
待测液
取少量待测液,先加入稀盐酸
稀盐酸
加稀盐酸后无现
象,
、Ag+等的干扰),
(排除CO32-
SO42-
H2SO4+BaCl2=BaSO4↓+2HCl
BaCl2溶液
待测液
取少量待测液,先加入稀盐酸
稀盐酸
加稀盐酸后无现
象,
、Ag+等的干扰),
(排除CO32-
再加入
BaCl2溶液
后产生不溶于稀
盐酸的白色沉淀
加入BaCl2
SO42-
H2SO4+BaCl2=BaSO4↓+2HCl
BaCl2溶液
取少量待测液,先加入稀盐酸
加稀盐酸后无现
象,
、Ag+等的干扰),
(排除CO32-
再加入
后产生不溶于稀
盐酸的白色沉淀
加入BaCl2
稀盐酸可否换成稀硝酸?
若换成稀硝酸,其中的H+仍然可以排除CO32-的干扰,
但NO3-不能与Ag+结合成沉淀,因而无法排除Ag+的干扰。
不可以;
四、几种重要离子的鉴定
例.下列各组溶液,不外加试剂就能鉴别出来的是( )
A.Na2CO3、HCl、BaCl2、NaCl
B.NaOH、FeCl3、HCl、HNO3
C.Na2CO3、NaCl、Na2SO4、Ba(OH)2
D.NaOH、Ba(NO3)2、NaCl、MgSO4
A
四、几种重要离子的鉴定
四、几种重要离子的鉴定
例1.向烧杯中逐滴加入X溶液至过量(甲图),生成沉淀或气体的质量与加入X溶液的质量符合乙图关系的是( )
A.向NaOH和NaCl的混合溶液中加K2SO4溶液
B.向NaCl和Na2CO3的混合溶液中加CaCl2溶液
C.向H2SO4和CuSO4的混合溶液中滴加NaOH溶液
D.向稀盐酸和稀硫酸的混合溶液中滴加Na2CO3溶液
C
例2.现有盐酸和CaCl2的混合溶液,向其中逐滴滴入Na2CO3溶液,生成沉淀质量与滴入Na2CO3溶液质量的变化关系如图所示。下列说法正确的是( )
A.滴至a g时,溶液中反应为CaCl2+Na2CO3=2NaCl+CaCO3↓
B.滴至b g时,溶液中含HCl、NaCl两种溶质
C.滴至c g时,溶液中溶质质量比原混合溶液中溶质质量大
D.滴至d g时,溶液呈中性
C
定性分析
能否反应
反应次序
定量分析
化学方程式
溶质的情况
溶液的酸碱性
Thanks
11.2化学肥料(第3课时)
人教版初中化学—九年级上册—第十一单元:盐 化肥
一、化肥简易鉴别的一般步骤
一看、二闻、三溶、四加碱
二、氮肥的简易鉴别
1.看:氮肥中的氨水呈液态;
闻:碳酸氢铵有强烈的氨味。
2.其他常见氮肥的鉴别
酸
碱
盐
→ H+ + 酸根离子
→ 金属离子(或NH4+)+ OH-
→ 金属离子(或NH4+)+ 酸根离子
蓝色沉淀
检验待测物中有没有某种离子。
根据离子的特性,利用它的特征反应来进行鉴定。
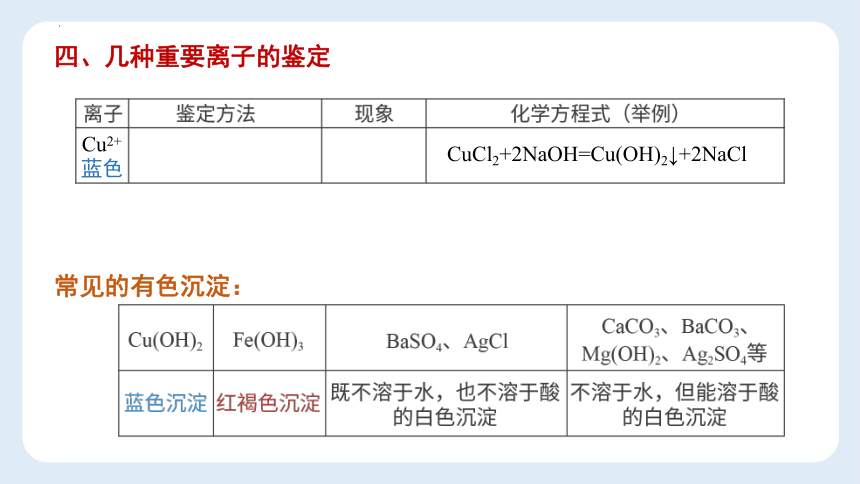
常见的有色沉淀:
Cu(OH)2
Fe(OH)3
红褐色沉淀
BaSO4、AgCl
既不溶于水,也不溶于酸
的白色沉淀
CaCO3、BaCO3、
Mg(OH)2、Ag2SO4等
不溶于水,但能溶于酸
的白色沉淀
一、概念
二、一般方法
多用复分解反应(生成沉淀、气体或水)鉴定。
三、操作步骤
4.得出结论
一取、二加、三现象、四结论
检验试剂
1.取样 取少量样品于试管中。
待测液
2.加试剂 向其中加入相应的检验试剂。
检验试剂
如果样品是固体,一般先用水溶解,配成溶液后,再加检验试剂。
3.观察现象
三、操作步骤
4.得出结论
一取、二加、三现象、四结论
1.取样 取少量样品于试管中。
2.加试剂 向其中加入相应的检验试剂。
如果样品是固体,一般先用水溶解,配成溶液后,再加检验试剂。
3.观察现象
有无色气体放出,
且该气体能使澄清石灰水变浑浊 (现象)
有二氧化碳气体放出(结果)
分析
推理
四、几种重要离子的鉴定
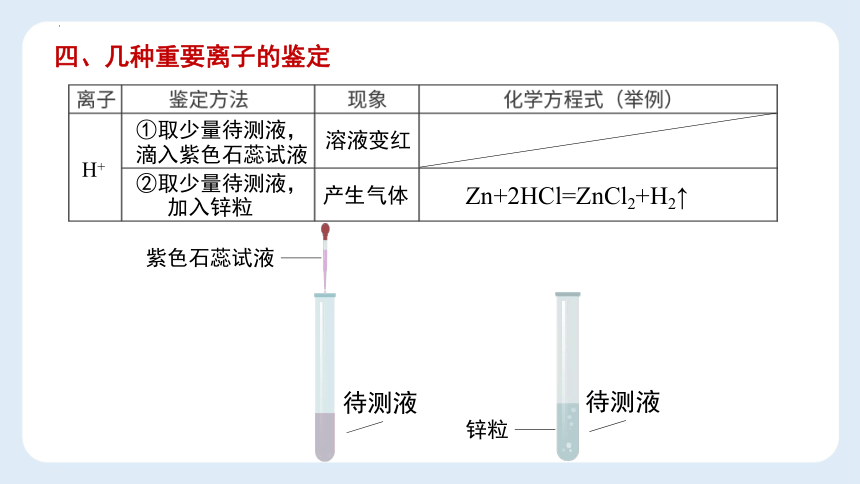
H+
①取少量待测液,
②取少量待测液,
溶液变红
产生气体
Zn+2HCl=ZnCl2+H2↑
滴入紫色石蕊试液
待测液
紫色石蕊试液
待测液
加入锌粒
锌粒
四、几种重要离子的鉴定
NH4+
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
研磨
取待测样品,与熟石灰混合研磨
产生有刺
激性气味
的气体
用湿润的红色石蕊
试纸检验产生的气体
试纸变蓝
NH3+H2O=NH3 H2O
NH3是唯一能使湿润的红色石蕊试纸变蓝的气体。
加入氢氧化钠溶液,加热;
/溶解后
NH4Cl+NaOH NaCl+NH3↑+H2O
四、几种重要离子的鉴定
Cu2+
蓝色
常见的有色沉淀:
CuCl2+2NaOH=Cu(OH)2↓+2NaCl
四、几种重要离子的鉴定
Cu2+
蓝色
CuCl2+2NaOH=Cu(OH)2↓+2NaCl
待测液
取少量待测液,
NaOH溶液
滴入NaOH溶液
产生
蓝色沉淀
四、几种重要离子的鉴定
Fe3+
黄色
常见的有色沉淀:
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
四、几种重要离子的鉴定
Fe3+
黄色
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
待测液
取少量待测液,
NaOH溶液
滴入NaOH溶液
产生
红褐色沉淀
四、几种重要离子的鉴定
一、概念
检验待测物中有没有某种离子。
二、一般方法
根据离子的特性,利用它的特征反应来进行鉴定。
多用复分解反应(生成沉淀、气体或水)鉴定。
三、操作步骤
一取、二加、三现象、四结论
四、几种重要离子的鉴定
OH-
取少量待测液,
溶液变蓝
待测液
滴入少量紫色石蕊试液
紫色石蕊试液
/ 酚酞溶液
/变红
待测液
酚酞溶液
CO32-
或
HCO3-
取少量待测液,
放出无色无味的
气体,
Na2CO3+2HCl=2NaCl+CO2↑+H2O
NaHCO3+HCI=NaCI+CO2 +H2O
CO2+Ca(OH)2=CaCO3↓+H2O
待测液
稀盐酸
通入澄清石灰水中
放出的气体
稀盐酸,
滴入
澄清石灰水
待测液
澄清石灰
水变浑浊
Cl-
HCl+AgNO3=AgCl↓+HNO3
SO42- Ag2SO4白色沉淀
CO32- Ag2CO3白色沉淀
取少量待测液,
待测液
稀硝酸
先加
入稀硝酸
加稀硝酸后无现象,
AgNO3溶液
Cl-
HCl+AgNO3=AgCl↓+HNO3
SO42- Ag2SO4白色沉淀
CO32- Ag2CO3白色沉淀
取少量待测液,
先加
入稀硝酸
加稀硝酸后无现象,
AgNO3溶液
Cl-
HCl+AgNO3=AgCl↓+HNO3
取少量待测液,
待测液
稀硝酸
先加
入稀硝酸
加稀硝酸后无现象,
AgNO3溶液
、CO32-等的干扰),
(排除SO42-
AgNO3溶液
再加入
后产生不溶于稀
硝酸的白色沉淀
加入AgNO3
Cl-
HCl+AgNO3=AgCl↓+HNO3
取少量待测液,
先加
入稀硝酸
加稀硝酸后无现象,
AgNO3溶液
、CO32-等的干扰),
(排除SO42-
再加入
后产生不溶于稀
硝酸的白色沉淀
加入AgNO3
稀硝酸可否换成稀盐酸?
若换成稀盐酸,从外界引入了Cl-,无论原待测液中有没有Cl-,
加入AgNO3溶液,都会产生不溶于酸的白色沉淀,无法达到鉴定目的。
不可以;
SO42-
H2SO4+BaCl2=BaSO4↓+2HCl
CO32- BaCO3白色沉淀
Ag+ AgCl白色沉淀
BaCl2溶液
待测液
取少量待测液,先加入稀盐酸
稀盐酸
加稀盐酸后无现
象,
、Ag+等的干扰),
(排除CO32-
SO42-
H2SO4+BaCl2=BaSO4↓+2HCl
BaCl2溶液
待测液
取少量待测液,先加入稀盐酸
稀盐酸
加稀盐酸后无现
象,
、Ag+等的干扰),
(排除CO32-
再加入
BaCl2溶液
后产生不溶于稀
盐酸的白色沉淀
加入BaCl2
SO42-
H2SO4+BaCl2=BaSO4↓+2HCl
BaCl2溶液
取少量待测液,先加入稀盐酸
加稀盐酸后无现
象,
、Ag+等的干扰),
(排除CO32-
再加入
后产生不溶于稀
盐酸的白色沉淀
加入BaCl2
稀盐酸可否换成稀硝酸?
若换成稀硝酸,其中的H+仍然可以排除CO32-的干扰,
但NO3-不能与Ag+结合成沉淀,因而无法排除Ag+的干扰。
不可以;
四、几种重要离子的鉴定
例.下列各组溶液,不外加试剂就能鉴别出来的是( )
A.Na2CO3、HCl、BaCl2、NaCl
B.NaOH、FeCl3、HCl、HNO3
C.Na2CO3、NaCl、Na2SO4、Ba(OH)2
D.NaOH、Ba(NO3)2、NaCl、MgSO4
A
四、几种重要离子的鉴定
四、几种重要离子的鉴定
例1.向烧杯中逐滴加入X溶液至过量(甲图),生成沉淀或气体的质量与加入X溶液的质量符合乙图关系的是( )
A.向NaOH和NaCl的混合溶液中加K2SO4溶液
B.向NaCl和Na2CO3的混合溶液中加CaCl2溶液
C.向H2SO4和CuSO4的混合溶液中滴加NaOH溶液
D.向稀盐酸和稀硫酸的混合溶液中滴加Na2CO3溶液
C
例2.现有盐酸和CaCl2的混合溶液,向其中逐滴滴入Na2CO3溶液,生成沉淀质量与滴入Na2CO3溶液质量的变化关系如图所示。下列说法正确的是( )
A.滴至a g时,溶液中反应为CaCl2+Na2CO3=2NaCl+CaCO3↓
B.滴至b g时,溶液中含HCl、NaCl两种溶质
C.滴至c g时,溶液中溶质质量比原混合溶液中溶质质量大
D.滴至d g时,溶液呈中性
C
定性分析
能否反应
反应次序
定量分析
化学方程式
溶质的情况
溶液的酸碱性
Thanks
同课章节目录
