第二章 第一节 第1课时 共价键 课件(共18张PPT) 化学人教版(2019)选择性必修2
文档属性
| 名称 | 第二章 第一节 第1课时 共价键 课件(共18张PPT) 化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 17:33:26 | ||
图片预览



文档简介
(共18张PPT)
第一节
共价键
高中化学 选择性必修2
第二章
第1课时 共价键
1.能说出共价键的概念与形成,知道共价键的特征——具有饱和性和方向性。
2. 了解σ键和π键的形成及特点。
学习目标
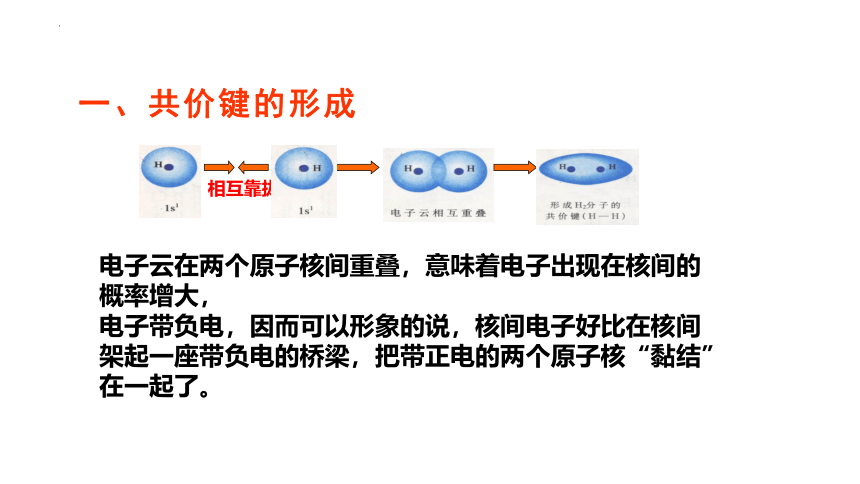
一、共价键的形成
相互靠拢
电子云在两个原子核间重叠,意味着电子出现在核间的概率增大,
电子带负电,因而可以形象的说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核“黏结”在一起了。
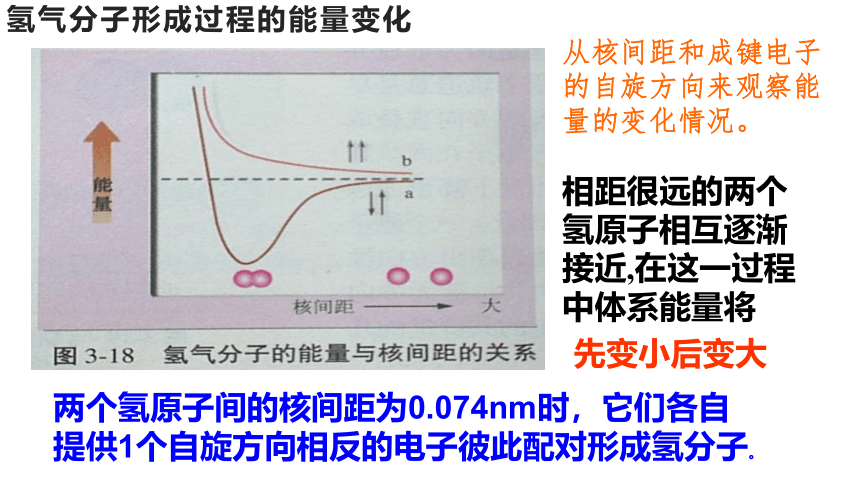
氢气分子形成过程的能量变化
从核间距和成键电子的自旋方向来观察能量的变化情况。
相距很远的两个氢原子相互逐渐接近,在这一过程中体系能量将
先变小后变大
两个氢原子间的核间距为0.074nm时,它们各自
提供1个自旋方向相反的电子彼此配对形成氢分子。
二、共价键的本质
当成键原子相互接近时,由于电子在两个原子核之间出现的概率增加,使它们同时受到两个原子核的吸引,从而使体系能量降低,形成化学键。即高概率地出现在两个原子核之间的电子与两个原子核之间的电性作用是共价键的本质。
三、共价键的形成条件
电负性相同或差值小的非金属元素原子形成的化学键为共价键
四、共价键的表示方法
用一条短线表示由一对共用电子所形成的共价键,依次类推“=”
表示共价双键
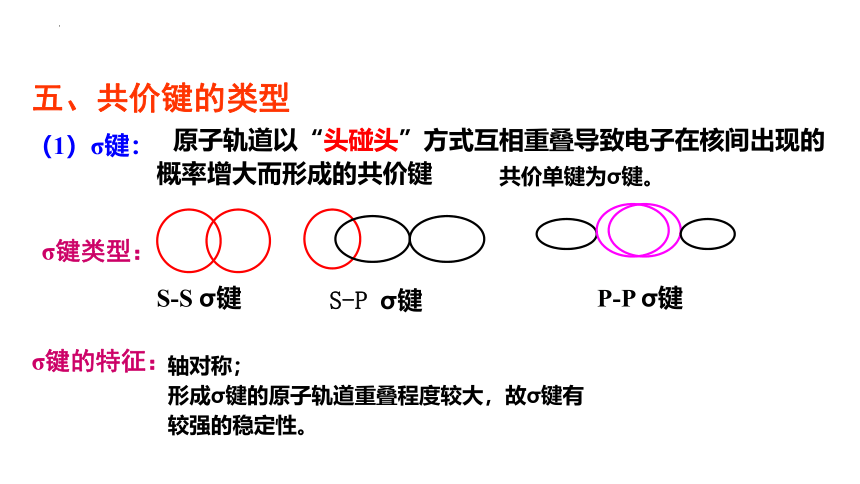
五、共价键的类型
(1)σ键:
共价单键为σ键。
原子轨道以“头碰头”方式互相重叠导致电子在核间出现的概率增大而形成的共价键
σ键类型:
S-S σ键
S-P σ键
P-P σ键
σ键的特征:
轴对称;
形成σ键的原子轨道重叠程度较大,故σ键有较强的稳定性。
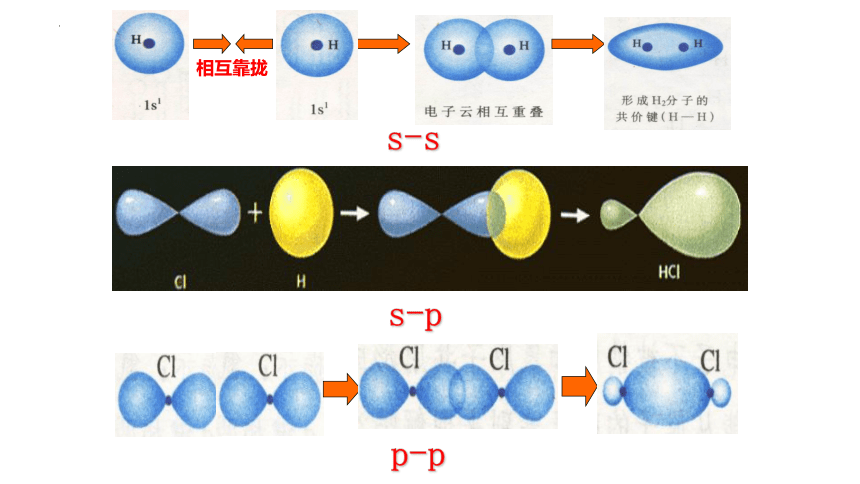
相互靠拢
s-s
s-p
p-p
(2)π键:
原子轨道以“肩并肩”方式相互重叠导致电子在核间出现的
概率增大而形成的共价键
π键特征:
肩并肩、两块组成、镜面对称、不能旋转、容易断裂。
两个原子轨道重叠程度大,电子在核间出现的概率越大,
形成的共价键越牢固,分子越稳定。
活动与探究
已知氮分子的共价键是叁键,你能写出它的电子式吗?氮原子的原子轨道是如何形成共价键的?
(提示:氮原子各自用三个p轨道分别跟另一个氮原子形成一个
σ键和两个π键。
z
z
y
y
x
s电子和s电子、s电子和p电子只能形成σ键;p电子和p电子既可形成σ键,又可能形成π键;且 p电子和p电子先形成σ键,后形成π键。
σ键和π键的比较
σ键 π键
成键方向
电子云形状
牢固程度
成键判断规律
“头碰头”
“肩并肩”
轴对称
镜像对称
强度大,不易断裂
强度较小易断裂
共价单键是 键,共价双键中一个是 键,另一个是 键,共价三键中一个是 键,另两个为 键
σ
σ
π
σ
π
1、σ键的常见类型有(1)s-s,(2)s-p,(2)p-p,请指出下列分子σ键所属类型:
A、HBr
B、NH3
C、F2
D、H2
课堂练习
s-p
s-p
p-p
s-s
2、已知π键可吸收紫外线,含π键物质可做护肤品。请问下列物质中哪些是含有π键的分子 ( )
A. NH3 B. CH4
C. CO2 D. C2H2
课堂练习
CD
3、下列关于σ键和π键的说法错误的是( )
含有π键的分子在反应时,π键是化学反应的积极参与者
B. 当原子形成分子时,首先形成σ键,可能形成π键
C. 有些原子在与其它原子形成分子时只能形成σ键,
不能形成π键
D. 在分子中,化学键可能只有π键而没有σ键
D
乙烷: 个σ键
乙烯: 个σ键 个π键
乙炔: 个σ键 个π键
7
5
1
3
2
4、乙烷、乙烯和乙炔分子中的共价键分别由几个σ键和几个π键组成?
有机物中的共价键
1、C – H 是σ键。
2、C—C 是σ键。
3、C=C 一个σ键,一个π键。
4、 C ≡C 一个σ键,两个π键。
乙烯、乙炔分子中C-C σ键比较稳定不容易断裂, π键比较容易断裂。
(1)、共价键具有饱和性
按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键,这就是共价键的“饱和性”。
如:H 原子、Cl原子都只有一个未成对电子,因而只能形成H2、HCl、Cl2分子,不能形成H3、H2Cl、Cl3分子
(2)共价键具有方向性
原子在形成共价键时,首先选择电子云重叠最多的方式,电子云最大重叠的方向
共价键的饱和性决定了各种原子形成分子时相互结合的数量关系。
共价键的方向性决定着分子的空间构型。
因为S轨道是球形对称的,所以S轨道与S轨道形成的共价键没有方向性。
六、共价键的特征
七、极性键和非极性键
1、非极性键:共用电子不偏向任何一个原子的共价键,
同种非金属元素的原子形成的共价键。
2、极性键:共用电子发生偏向的共价键,偏向吸引电子能力大的一方
不同种非金属元素的原子形成的共价键。
成键原子的电负性相差越大,键的极性越强。
依据成键原子所属元素电负性差值的大小,极性键可分为强极性键和弱极性键,
当电负性差值为零时,形成非极性共价键;差值不为零时,形成极性共价键,而且
差值越小,形成的共价键极性越弱。
谢 谢!
第一节
共价键
高中化学 选择性必修2
第二章
第1课时 共价键
1.能说出共价键的概念与形成,知道共价键的特征——具有饱和性和方向性。
2. 了解σ键和π键的形成及特点。
学习目标
一、共价键的形成
相互靠拢
电子云在两个原子核间重叠,意味着电子出现在核间的概率增大,
电子带负电,因而可以形象的说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核“黏结”在一起了。
氢气分子形成过程的能量变化
从核间距和成键电子的自旋方向来观察能量的变化情况。
相距很远的两个氢原子相互逐渐接近,在这一过程中体系能量将
先变小后变大
两个氢原子间的核间距为0.074nm时,它们各自
提供1个自旋方向相反的电子彼此配对形成氢分子。
二、共价键的本质
当成键原子相互接近时,由于电子在两个原子核之间出现的概率增加,使它们同时受到两个原子核的吸引,从而使体系能量降低,形成化学键。即高概率地出现在两个原子核之间的电子与两个原子核之间的电性作用是共价键的本质。
三、共价键的形成条件
电负性相同或差值小的非金属元素原子形成的化学键为共价键
四、共价键的表示方法
用一条短线表示由一对共用电子所形成的共价键,依次类推“=”
表示共价双键
五、共价键的类型
(1)σ键:
共价单键为σ键。
原子轨道以“头碰头”方式互相重叠导致电子在核间出现的概率增大而形成的共价键
σ键类型:
S-S σ键
S-P σ键
P-P σ键
σ键的特征:
轴对称;
形成σ键的原子轨道重叠程度较大,故σ键有较强的稳定性。
相互靠拢
s-s
s-p
p-p
(2)π键:
原子轨道以“肩并肩”方式相互重叠导致电子在核间出现的
概率增大而形成的共价键
π键特征:
肩并肩、两块组成、镜面对称、不能旋转、容易断裂。
两个原子轨道重叠程度大,电子在核间出现的概率越大,
形成的共价键越牢固,分子越稳定。
活动与探究
已知氮分子的共价键是叁键,你能写出它的电子式吗?氮原子的原子轨道是如何形成共价键的?
(提示:氮原子各自用三个p轨道分别跟另一个氮原子形成一个
σ键和两个π键。
z
z
y
y
x
s电子和s电子、s电子和p电子只能形成σ键;p电子和p电子既可形成σ键,又可能形成π键;且 p电子和p电子先形成σ键,后形成π键。
σ键和π键的比较
σ键 π键
成键方向
电子云形状
牢固程度
成键判断规律
“头碰头”
“肩并肩”
轴对称
镜像对称
强度大,不易断裂
强度较小易断裂
共价单键是 键,共价双键中一个是 键,另一个是 键,共价三键中一个是 键,另两个为 键
σ
σ
π
σ
π
1、σ键的常见类型有(1)s-s,(2)s-p,(2)p-p,请指出下列分子σ键所属类型:
A、HBr
B、NH3
C、F2
D、H2
课堂练习
s-p
s-p
p-p
s-s
2、已知π键可吸收紫外线,含π键物质可做护肤品。请问下列物质中哪些是含有π键的分子 ( )
A. NH3 B. CH4
C. CO2 D. C2H2
课堂练习
CD
3、下列关于σ键和π键的说法错误的是( )
含有π键的分子在反应时,π键是化学反应的积极参与者
B. 当原子形成分子时,首先形成σ键,可能形成π键
C. 有些原子在与其它原子形成分子时只能形成σ键,
不能形成π键
D. 在分子中,化学键可能只有π键而没有σ键
D
乙烷: 个σ键
乙烯: 个σ键 个π键
乙炔: 个σ键 个π键
7
5
1
3
2
4、乙烷、乙烯和乙炔分子中的共价键分别由几个σ键和几个π键组成?
有机物中的共价键
1、C – H 是σ键。
2、C—C 是σ键。
3、C=C 一个σ键,一个π键。
4、 C ≡C 一个σ键,两个π键。
乙烯、乙炔分子中C-C σ键比较稳定不容易断裂, π键比较容易断裂。
(1)、共价键具有饱和性
按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键,这就是共价键的“饱和性”。
如:H 原子、Cl原子都只有一个未成对电子,因而只能形成H2、HCl、Cl2分子,不能形成H3、H2Cl、Cl3分子
(2)共价键具有方向性
原子在形成共价键时,首先选择电子云重叠最多的方式,电子云最大重叠的方向
共价键的饱和性决定了各种原子形成分子时相互结合的数量关系。
共价键的方向性决定着分子的空间构型。
因为S轨道是球形对称的,所以S轨道与S轨道形成的共价键没有方向性。
六、共价键的特征
七、极性键和非极性键
1、非极性键:共用电子不偏向任何一个原子的共价键,
同种非金属元素的原子形成的共价键。
2、极性键:共用电子发生偏向的共价键,偏向吸引电子能力大的一方
不同种非金属元素的原子形成的共价键。
成键原子的电负性相差越大,键的极性越强。
依据成键原子所属元素电负性差值的大小,极性键可分为强极性键和弱极性键,
当电负性差值为零时,形成非极性共价键;差值不为零时,形成极性共价键,而且
差值越小,形成的共价键极性越弱。
谢 谢!
