实验活动8粗盐中难溶性杂质的去除同步练习人教版化学九年级下册 (有答案)
文档属性
| 名称 | 实验活动8粗盐中难溶性杂质的去除同步练习人教版化学九年级下册 (有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 148.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-13 23:24:38 | ||
图片预览


文档简介
实验活动8粗盐中难溶性杂质的去除
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.欲将粗盐提纯并用所得精盐配制一定溶质质量分数的氯化钠溶液。下列说法正确的是
A.过滤时,用玻璃棒搅拌加快过滤速度
B.蒸发时,将蒸发皿中晶体全部析出后才停止加热
C.配制溶液时必须使用的仪器有托盘天平、酒精灯、量筒、烧杯、玻璃棒等
D.配制溶液需要经过计算、称量、溶解、装瓶存放等步骤
2.粗盐提纯实验中说法正确的是( )
A.溶解时为了让粗盐加速溶解,尽可能的多加入一些水
B.过滤时玻璃棒必须靠在滤纸上方的漏斗壁上以防止滤纸破损
C.蒸发时需要将滤液全部蒸干后停止加热
D.粗盐可以直接放在烧杯中进行称量
3.粗盐含有少量的MgCl2,CaCl2,Na2SO4等杂质,为了将杂质除干净,先向粗盐溶液中分别加入过量的①NaOH②Na2CO3③BaCl2溶液,过滤,再加入④稀盐酸使溶液的pH=7将最后所得溶液进行蒸发可得到精盐,加入溶液的先后顺序错误的是( )
A.②③①④ B.③②①④ C.①③②④ D.③①②④
4.在“粗盐的提纯”实验中,一定用不到的仪器是
A.铁架台、蒸发皿 B.酒精灯、漏斗
C.细口瓶、试管 D.量筒、烧杯
5.有关“粗盐中难溶性杂质的去除”实验中说法不正确的是
A.多加水,让粗盐加速溶解
B.玻璃棒用了4次,但作用各不相同
C.粗盐经过溶解、过滤、蒸发、结晶可以得到初步提纯
D.当蒸发皿中出现较多量固体时,停止加热,利用余热使滤液蒸干
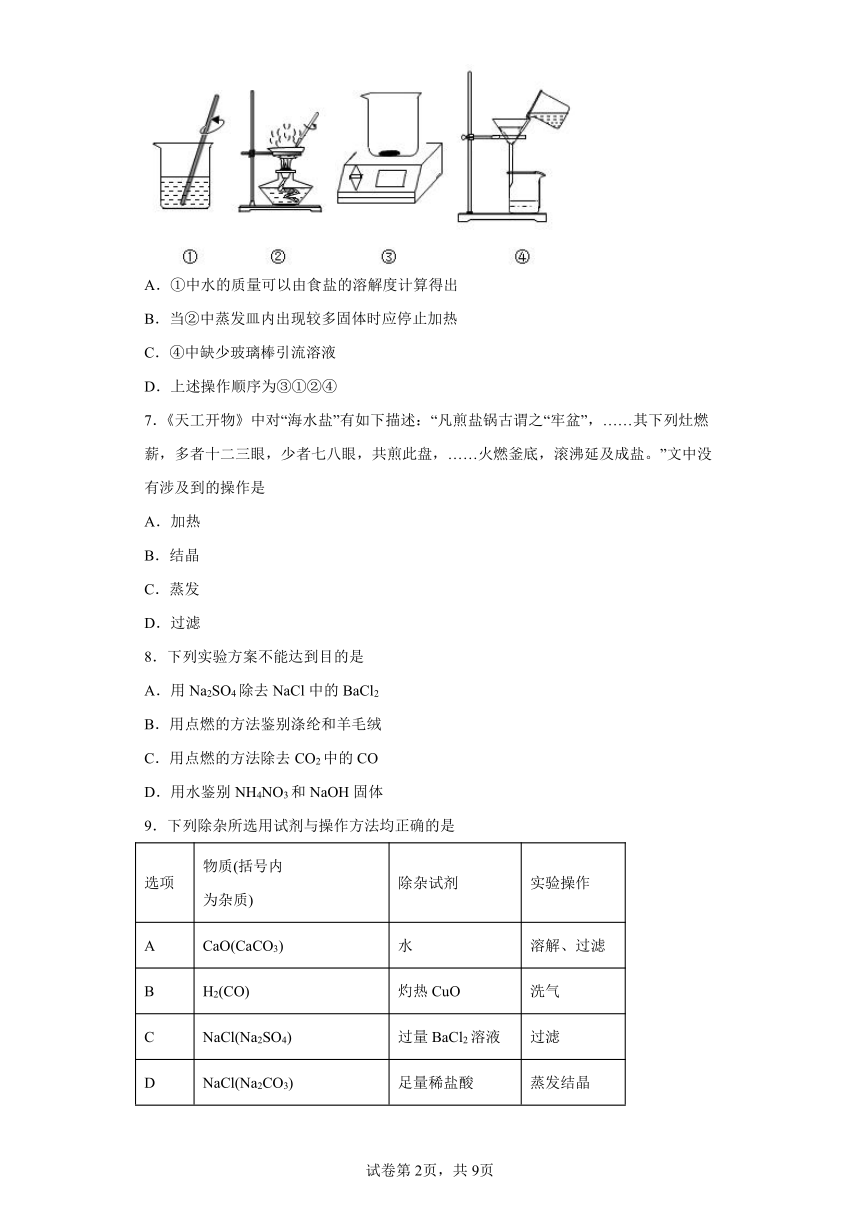
6.下图是粗盐提纯的部分实验操作。有关叙述错误的是
A.①中水的质量可以由食盐的溶解度计算得出
B.当②中蒸发皿内出现较多固体时应停止加热
C.④中缺少玻璃棒引流溶液
D.上述操作顺序为③①②④
7.《天工开物》中对“海水盐”有如下描述:“凡煎盐锅古谓之“牢盆”,……其下列灶燃薪,多者十二三眼,少者七八眼,共煎此盘,……火燃釜底,滚沸延及成盐。”文中没有涉及到的操作是
A.加热
B.结晶
C.蒸发
D.过滤
8.下列实验方案不能达到目的是
A.用Na2SO4除去NaCl中的BaCl2
B.用点燃的方法鉴别涤纶和羊毛绒
C.用点燃的方法除去CO2中的CO
D.用水鉴别NH4NO3和NaOH固体
9.下列除杂所选用试剂与操作方法均正确的是
选项 物质(括号内 为杂质) 除杂试剂 实验操作
A CaO(CaCO3) 水 溶解、过滤
B H2(CO) 灼热CuO 洗气
C NaCl(Na2SO4) 过量BaCl2溶液 过滤
D NaCl(Na2CO3) 足量稀盐酸 蒸发结晶
A.A B.B C.C D.D
10.某兴趣小组的同学进行“粗盐中难溶性杂质的去除”实验。下图是实验过程中的部分操作其中正确的是
A.取一定量粗盐 B.溶解 C.过滤 D.蒸发结晶
二、判断题
11.蒸发滤液时,待蒸发皿中滤液蒸干后停止加热( )
12.粗盐提纯的实验中涉及的分离操作有过滤和蒸发( )
13.除去粗盐中的沙子实验,实验结束后称量所得的精盐,产率偏高,其可能原因是蒸发时未充分蒸干固体( )
14.为了加快过滤速度,应该用玻璃棒在漏斗中不断搅拌( )
15.计算粗盐中精盐的产率公式是:产率=精盐质量/粗盐质量×100%( )
三、填空题
16.粗盐中含有较多的杂质,小林按照课本“活动与探究”的要求做粗盐提纯实验。
⑴仪器B的名称是________,在实验中用得最多的仪器是_________(填序号)。
⑵称量食盐应放在仪器A的_______盘,蒸发时防止液滴飞溅的操作是________________。
⑶“活动与探究”中,操作步骤有:①计算产率、②过滤、③溶解、④蒸发,正确的操作顺序为_________________(填序号)。
17.溶液与人类生产、生活密切相关。
(1)下列物质中,由分子构成的是_________(填字母,下同),溶于水后在溶液中以离子形式存在的是_________。
A 蔗糖 B 氯化氢 C 氯化钠 D 硫酸钠
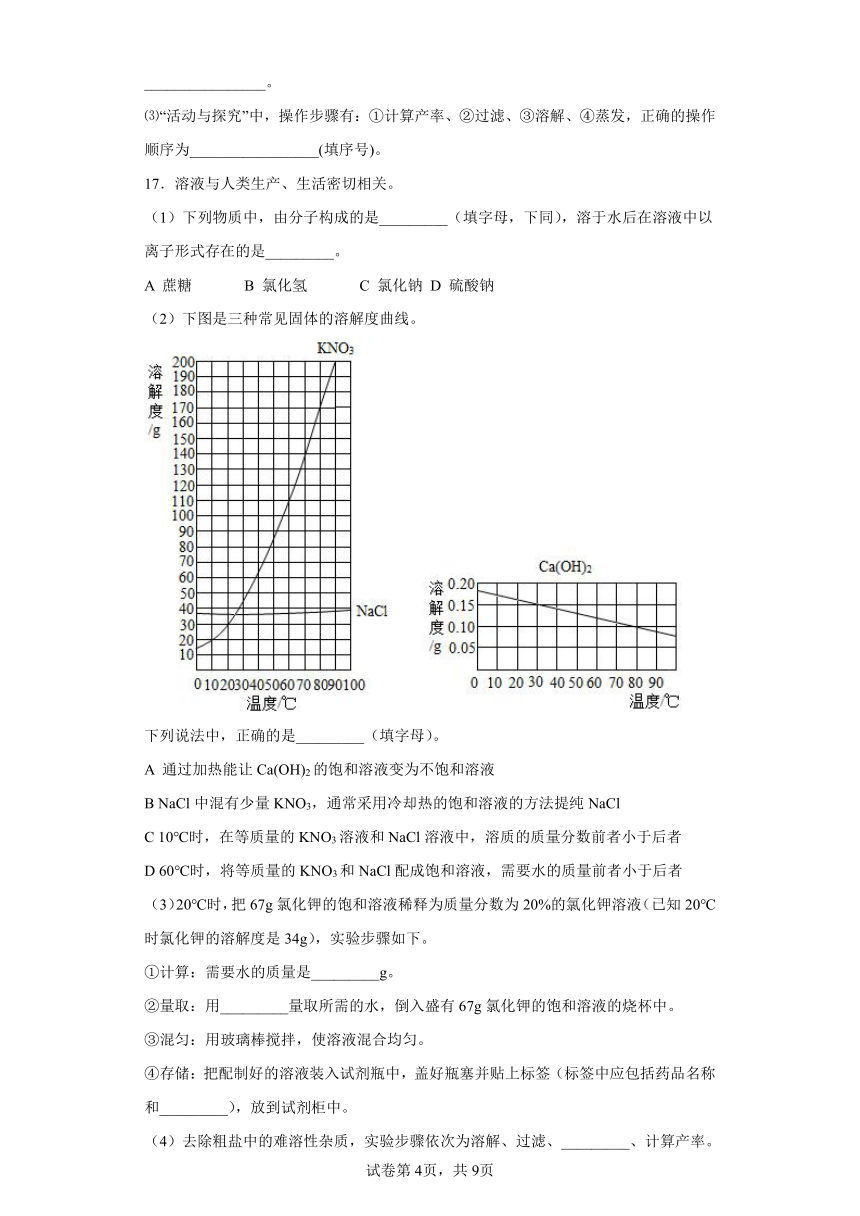
(2)下图是三种常见固体的溶解度曲线。
下列说法中,正确的是_________(填字母)。
A 通过加热能让Ca(OH)2的饱和溶液变为不饱和溶液
B NaCl中混有少量KNO3,通常采用冷却热的饱和溶液的方法提纯NaCl
C 10℃时,在等质量的KNO3溶液和NaCl溶液中,溶质的质量分数前者小于后者
D 60℃时,将等质量的KNO3和NaCl配成饱和溶液,需要水的质量前者小于后者
(3)20℃时,把67g氯化钾的饱和溶液稀释为质量分数为20%的氯化钾溶液(已知20℃时氯化钾的溶解度是34g),实验步骤如下。
①计算:需要水的质量是_________g。
②量取:用_________量取所需的水,倒入盛有67g氯化钾的饱和溶液的烧杯中。
③混匀:用玻璃棒搅拌,使溶液混合均匀。
④存储:把配制好的溶液装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品名称和_________),放到试剂柜中。
(4)去除粗盐中的难溶性杂质,实验步骤依次为溶解、过滤、_________、计算产率。称取5.0g粗盐,逐渐加入10mL水中,直到不再溶解,剩余粗盐1.0g,经提纯后得到精盐3.3g,则精盐的产率为_________。
18.下图是去除粗盐中难溶性杂质实验的三步操作。
(1)三步操作的正确顺序是______(填序号)。
(2)B中,用璃棒不断搅拌的目的是______。
19.实验室有两瓶失去标签的稀盐酸和氢氧化钠溶液(记作A、B),小强用下列方法进行鉴别,回答下列问题。
(1)他取适量的A、B两种溶液于试管中,分别加入适量氯化铁溶液,观察到A中产生红褐色沉淀,则A是_____,发生反应的化学方程式为________________;
(2)他另取适量的A、B两种溶液于试管中,分别加入适量碳酸钠溶液,观察到B中的现象为_______, 发生反应的化学方程式为________________;
(3)他通过测定溶液的酸碱度来鉴别:若pH_____7,则溶液为_______;
(4)他还利用了下列试剂进行鉴别,其中能鉴别的试剂是_______.(填字母)
A、锌 B、硝酸钠 C、石蕊试液.
20.溶液与人类生产、生活密切相关。
(1)甲、乙、丙三种固体物质溶解度曲线如图所示。
①t3℃时甲、乙、丙三种固体物质的溶解度由大到小的顺序是______。
②在______℃时,甲、丙两种物质的溶解度相等;
③在t3℃时,向盛有25g甲物质的烧杯中加入50g水,充分溶解后,所得溶液的质量为______g。
④将t3℃等质量的甲、乙饱和溶液降温到t2℃,所得溶液中溶质的质量大小关系为甲______乙(填“>”“=”“<”)。
(2)氯化钠样品中常含有可溶性杂质CaCl2和MgCl2。为除去可溶性杂质,将样品溶于水,依次加入稍过量的NaOH溶液、Na2CO3溶液。充分反应后过滤,得滤渣X和滤液,向滤液中加入过量的稀盐酸,蒸发得氯化钠晶体。下列说法正确的是______。
A滤渣X中有两种成分
B“向滤液中加入过量的稀盐酸”目的只是为了除去过量的NaOH
C将氯化钠溶液加热蒸发,至水分完全蒸干时停止加热
(3)在实验室中,欲配制溶质质量分数为16%的氯化钠溶液150g,需要称量氯化钠固体的质量为______g,将上述150g氯化钠溶液稀释成溶质质量分数为12%的溶液,需要加入蒸馏水的质量为______g。
四、综合应用题
21.酸碱盐种类繁多,与人类日常生活和工农业生产关系十分密切。
(1)酸具有相似的性质,因为不同的酸在水溶液中都能解离出______。
(2)检验敞口放置的氢氧化钠溶液是否变质,可以选用的一种试剂是_____。
(3)利用数字化实验设备,测定盐酸与氢氧化钠溶液反应时溶液pH变化,实验结果如图,当滴入溶液为V2mL时,所得溶液中溶质化学式为_______,所得溶液能使紫色石蕊溶液变成_____色。
(4)氯化钠是生活中常见的盐,为除去某粗盐水中的MgCl、CaCl2杂质,得到NaCl溶液,某化学小组设计了如下实验方案。
①过滤操作中所用到的玻璃仪器有烧杯、漏斗和____________.
②以上方案中有关反应的化学方程式为__________(写一个即可)
③写出溶液乙中含有的杂质,并将以上方案补充完整_______。
(5)某实验室用40g、20%的NaOH溶液洗涤一定量石油产品中残余的H2SO4,消耗NaOH溶液呈中性,请计算该一定量石油产品H2SO4的质量________。
22.我国海洋专属经济区幅员辽阔,海洋资源丰富,从海水中可以提取粗盐和制备金属镁等物质。
(1)粗盐提纯时每步操作都会用到的一种玻璃仪器是____________;
(2)从卤水中提取镁的过程如图所示:
在上述转化过程中①处所发生的反应属于____________反应(填“中和”“复分解” “化合”“分解”之一)。写出步骤②发生反应的化学方程式_________________________________。
(3)向装有等量水的A、B、C三个烧杯中分别加入10g、25g、25gNaNO3固体,充分溶解,现象如图1所示。
①烧杯中的溶液一定属于饱和溶液的是_______(填序号)
②在图2中,能表示NaNO3溶解度曲线的是_________(填“甲”或“乙”)
③要使烧杯B中剩余固体继续溶解,可采用的方法是__________。(填一种即可)
④依据图2的分析判断,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的是______填序号)
A.甲、乙都是饱和溶液
B.所含溶剂的质量:甲<乙
C.溶液的质量:甲>乙
D.溶质的质量分数:甲>乙
23.浩瀚的海洋蕴藏着丰富的化学资源,海水晒盐的主要流程如图所示。
(1)海水晒盐后的“母液”是氯化钠的__________(填“饱和”或“不饱和”)溶液。
(2)上述“母液”的主要溶质是氯化镁、氯化钠、硫酸镁和氯化钾,它们的溶解度曲线如图。氯化钾是低钠盐的主要添加剂,从上述“母液”中可以提取氯化钾,主要流程如图。
固体①的主要成分是氯化钠和硫酸镁,固体②的主要成分是氯化钾和氯化镁,则操作①和操作②依次为_____、________(此两空填“降温结晶”或“蒸发结晶”)。用冷水或饱和_______溶液洗涤固体②,干燥后可得到较纯净的氯化钾。
(3)利用“卤水”也可以制得金属镁等化工原料。下图某盐场1000g“卤水”中部分成分含量柱形图。
试计算:①若使1000g该“卤水”中的氯化镁和硫酸镁完全转化为Mg(OH)2沉淀,至少要20%NaOH溶液多少克?计算过程:_______
②将上述沉淀完全转化为无水MgCl2,并在熔融状态下进行电解,理论上最多可得到金属镁____克。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.D
3.A
4.C
5.A
6.D
7.D
8.C
9.D
10.D
11.错误
12.正确
13.正确
14.错误
15.正确
16.漏斗 F 左 用玻璃棒不断搅拌滤液 ③②④①
17.AB BCD D 18 量筒 溶液中溶质的质量分数 蒸发 82.5%
18.ACB 防止局部温度过高液体飞溅
19.NaOH 3NaOH+FeCl3=Fe(OH)3↓+3NaCl 有气泡产生 2HCl+Na2CO3=2NaCl+H2O+CO2↑ 〉 氢氧化钠 AC
20.甲、乙、丙 t1 65 < A 24 50
21.H+ 稀盐酸(或者稀硫酸、BaCl2溶液,CaCl2溶液等) HCl、NaCl 红 玻璃棒 Ba(OH)2 +MgSO4=BaSO4↓+Mg(OH)2↓(或者Ba(OH)2 +Na2CO3=BaCO3↓+2NaOH,CaCl2 +Na2CO3= CaCO3↓+2NaCl) Na2CO3和NaOH在溶液乙中加入适量稀盐酸 9.8g
22.玻璃棒 复分解 Mg(OH)2+2HCl=MgCl2+2H2O B 甲 升温或加水; BD
23.饱和 蒸发结晶 降温结晶 氯化钾 600g 48
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.欲将粗盐提纯并用所得精盐配制一定溶质质量分数的氯化钠溶液。下列说法正确的是
A.过滤时,用玻璃棒搅拌加快过滤速度
B.蒸发时,将蒸发皿中晶体全部析出后才停止加热
C.配制溶液时必须使用的仪器有托盘天平、酒精灯、量筒、烧杯、玻璃棒等
D.配制溶液需要经过计算、称量、溶解、装瓶存放等步骤
2.粗盐提纯实验中说法正确的是( )
A.溶解时为了让粗盐加速溶解,尽可能的多加入一些水
B.过滤时玻璃棒必须靠在滤纸上方的漏斗壁上以防止滤纸破损
C.蒸发时需要将滤液全部蒸干后停止加热
D.粗盐可以直接放在烧杯中进行称量
3.粗盐含有少量的MgCl2,CaCl2,Na2SO4等杂质,为了将杂质除干净,先向粗盐溶液中分别加入过量的①NaOH②Na2CO3③BaCl2溶液,过滤,再加入④稀盐酸使溶液的pH=7将最后所得溶液进行蒸发可得到精盐,加入溶液的先后顺序错误的是( )
A.②③①④ B.③②①④ C.①③②④ D.③①②④
4.在“粗盐的提纯”实验中,一定用不到的仪器是
A.铁架台、蒸发皿 B.酒精灯、漏斗
C.细口瓶、试管 D.量筒、烧杯
5.有关“粗盐中难溶性杂质的去除”实验中说法不正确的是
A.多加水,让粗盐加速溶解
B.玻璃棒用了4次,但作用各不相同
C.粗盐经过溶解、过滤、蒸发、结晶可以得到初步提纯
D.当蒸发皿中出现较多量固体时,停止加热,利用余热使滤液蒸干
6.下图是粗盐提纯的部分实验操作。有关叙述错误的是
A.①中水的质量可以由食盐的溶解度计算得出
B.当②中蒸发皿内出现较多固体时应停止加热
C.④中缺少玻璃棒引流溶液
D.上述操作顺序为③①②④
7.《天工开物》中对“海水盐”有如下描述:“凡煎盐锅古谓之“牢盆”,……其下列灶燃薪,多者十二三眼,少者七八眼,共煎此盘,……火燃釜底,滚沸延及成盐。”文中没有涉及到的操作是
A.加热
B.结晶
C.蒸发
D.过滤
8.下列实验方案不能达到目的是
A.用Na2SO4除去NaCl中的BaCl2
B.用点燃的方法鉴别涤纶和羊毛绒
C.用点燃的方法除去CO2中的CO
D.用水鉴别NH4NO3和NaOH固体
9.下列除杂所选用试剂与操作方法均正确的是
选项 物质(括号内 为杂质) 除杂试剂 实验操作
A CaO(CaCO3) 水 溶解、过滤
B H2(CO) 灼热CuO 洗气
C NaCl(Na2SO4) 过量BaCl2溶液 过滤
D NaCl(Na2CO3) 足量稀盐酸 蒸发结晶
A.A B.B C.C D.D
10.某兴趣小组的同学进行“粗盐中难溶性杂质的去除”实验。下图是实验过程中的部分操作其中正确的是
A.取一定量粗盐 B.溶解 C.过滤 D.蒸发结晶
二、判断题
11.蒸发滤液时,待蒸发皿中滤液蒸干后停止加热( )
12.粗盐提纯的实验中涉及的分离操作有过滤和蒸发( )
13.除去粗盐中的沙子实验,实验结束后称量所得的精盐,产率偏高,其可能原因是蒸发时未充分蒸干固体( )
14.为了加快过滤速度,应该用玻璃棒在漏斗中不断搅拌( )
15.计算粗盐中精盐的产率公式是:产率=精盐质量/粗盐质量×100%( )
三、填空题
16.粗盐中含有较多的杂质,小林按照课本“活动与探究”的要求做粗盐提纯实验。
⑴仪器B的名称是________,在实验中用得最多的仪器是_________(填序号)。
⑵称量食盐应放在仪器A的_______盘,蒸发时防止液滴飞溅的操作是________________。
⑶“活动与探究”中,操作步骤有:①计算产率、②过滤、③溶解、④蒸发,正确的操作顺序为_________________(填序号)。
17.溶液与人类生产、生活密切相关。
(1)下列物质中,由分子构成的是_________(填字母,下同),溶于水后在溶液中以离子形式存在的是_________。
A 蔗糖 B 氯化氢 C 氯化钠 D 硫酸钠
(2)下图是三种常见固体的溶解度曲线。
下列说法中,正确的是_________(填字母)。
A 通过加热能让Ca(OH)2的饱和溶液变为不饱和溶液
B NaCl中混有少量KNO3,通常采用冷却热的饱和溶液的方法提纯NaCl
C 10℃时,在等质量的KNO3溶液和NaCl溶液中,溶质的质量分数前者小于后者
D 60℃时,将等质量的KNO3和NaCl配成饱和溶液,需要水的质量前者小于后者
(3)20℃时,把67g氯化钾的饱和溶液稀释为质量分数为20%的氯化钾溶液(已知20℃时氯化钾的溶解度是34g),实验步骤如下。
①计算:需要水的质量是_________g。
②量取:用_________量取所需的水,倒入盛有67g氯化钾的饱和溶液的烧杯中。
③混匀:用玻璃棒搅拌,使溶液混合均匀。
④存储:把配制好的溶液装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品名称和_________),放到试剂柜中。
(4)去除粗盐中的难溶性杂质,实验步骤依次为溶解、过滤、_________、计算产率。称取5.0g粗盐,逐渐加入10mL水中,直到不再溶解,剩余粗盐1.0g,经提纯后得到精盐3.3g,则精盐的产率为_________。
18.下图是去除粗盐中难溶性杂质实验的三步操作。
(1)三步操作的正确顺序是______(填序号)。
(2)B中,用璃棒不断搅拌的目的是______。
19.实验室有两瓶失去标签的稀盐酸和氢氧化钠溶液(记作A、B),小强用下列方法进行鉴别,回答下列问题。
(1)他取适量的A、B两种溶液于试管中,分别加入适量氯化铁溶液,观察到A中产生红褐色沉淀,则A是_____,发生反应的化学方程式为________________;
(2)他另取适量的A、B两种溶液于试管中,分别加入适量碳酸钠溶液,观察到B中的现象为_______, 发生反应的化学方程式为________________;
(3)他通过测定溶液的酸碱度来鉴别:若pH_____7,则溶液为_______;
(4)他还利用了下列试剂进行鉴别,其中能鉴别的试剂是_______.(填字母)
A、锌 B、硝酸钠 C、石蕊试液.
20.溶液与人类生产、生活密切相关。
(1)甲、乙、丙三种固体物质溶解度曲线如图所示。
①t3℃时甲、乙、丙三种固体物质的溶解度由大到小的顺序是______。
②在______℃时,甲、丙两种物质的溶解度相等;
③在t3℃时,向盛有25g甲物质的烧杯中加入50g水,充分溶解后,所得溶液的质量为______g。
④将t3℃等质量的甲、乙饱和溶液降温到t2℃,所得溶液中溶质的质量大小关系为甲______乙(填“>”“=”“<”)。
(2)氯化钠样品中常含有可溶性杂质CaCl2和MgCl2。为除去可溶性杂质,将样品溶于水,依次加入稍过量的NaOH溶液、Na2CO3溶液。充分反应后过滤,得滤渣X和滤液,向滤液中加入过量的稀盐酸,蒸发得氯化钠晶体。下列说法正确的是______。
A滤渣X中有两种成分
B“向滤液中加入过量的稀盐酸”目的只是为了除去过量的NaOH
C将氯化钠溶液加热蒸发,至水分完全蒸干时停止加热
(3)在实验室中,欲配制溶质质量分数为16%的氯化钠溶液150g,需要称量氯化钠固体的质量为______g,将上述150g氯化钠溶液稀释成溶质质量分数为12%的溶液,需要加入蒸馏水的质量为______g。
四、综合应用题
21.酸碱盐种类繁多,与人类日常生活和工农业生产关系十分密切。
(1)酸具有相似的性质,因为不同的酸在水溶液中都能解离出______。
(2)检验敞口放置的氢氧化钠溶液是否变质,可以选用的一种试剂是_____。
(3)利用数字化实验设备,测定盐酸与氢氧化钠溶液反应时溶液pH变化,实验结果如图,当滴入溶液为V2mL时,所得溶液中溶质化学式为_______,所得溶液能使紫色石蕊溶液变成_____色。
(4)氯化钠是生活中常见的盐,为除去某粗盐水中的MgCl、CaCl2杂质,得到NaCl溶液,某化学小组设计了如下实验方案。
①过滤操作中所用到的玻璃仪器有烧杯、漏斗和____________.
②以上方案中有关反应的化学方程式为__________(写一个即可)
③写出溶液乙中含有的杂质,并将以上方案补充完整_______。
(5)某实验室用40g、20%的NaOH溶液洗涤一定量石油产品中残余的H2SO4,消耗NaOH溶液呈中性,请计算该一定量石油产品H2SO4的质量________。
22.我国海洋专属经济区幅员辽阔,海洋资源丰富,从海水中可以提取粗盐和制备金属镁等物质。
(1)粗盐提纯时每步操作都会用到的一种玻璃仪器是____________;
(2)从卤水中提取镁的过程如图所示:
在上述转化过程中①处所发生的反应属于____________反应(填“中和”“复分解” “化合”“分解”之一)。写出步骤②发生反应的化学方程式_________________________________。
(3)向装有等量水的A、B、C三个烧杯中分别加入10g、25g、25gNaNO3固体,充分溶解,现象如图1所示。
①烧杯中的溶液一定属于饱和溶液的是_______(填序号)
②在图2中,能表示NaNO3溶解度曲线的是_________(填“甲”或“乙”)
③要使烧杯B中剩余固体继续溶解,可采用的方法是__________。(填一种即可)
④依据图2的分析判断,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的是______填序号)
A.甲、乙都是饱和溶液
B.所含溶剂的质量:甲<乙
C.溶液的质量:甲>乙
D.溶质的质量分数:甲>乙
23.浩瀚的海洋蕴藏着丰富的化学资源,海水晒盐的主要流程如图所示。
(1)海水晒盐后的“母液”是氯化钠的__________(填“饱和”或“不饱和”)溶液。
(2)上述“母液”的主要溶质是氯化镁、氯化钠、硫酸镁和氯化钾,它们的溶解度曲线如图。氯化钾是低钠盐的主要添加剂,从上述“母液”中可以提取氯化钾,主要流程如图。
固体①的主要成分是氯化钠和硫酸镁,固体②的主要成分是氯化钾和氯化镁,则操作①和操作②依次为_____、________(此两空填“降温结晶”或“蒸发结晶”)。用冷水或饱和_______溶液洗涤固体②,干燥后可得到较纯净的氯化钾。
(3)利用“卤水”也可以制得金属镁等化工原料。下图某盐场1000g“卤水”中部分成分含量柱形图。
试计算:①若使1000g该“卤水”中的氯化镁和硫酸镁完全转化为Mg(OH)2沉淀,至少要20%NaOH溶液多少克?计算过程:_______
②将上述沉淀完全转化为无水MgCl2,并在熔融状态下进行电解,理论上最多可得到金属镁____克。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.D
3.A
4.C
5.A
6.D
7.D
8.C
9.D
10.D
11.错误
12.正确
13.正确
14.错误
15.正确
16.漏斗 F 左 用玻璃棒不断搅拌滤液 ③②④①
17.AB BCD D 18 量筒 溶液中溶质的质量分数 蒸发 82.5%
18.ACB 防止局部温度过高液体飞溅
19.NaOH 3NaOH+FeCl3=Fe(OH)3↓+3NaCl 有气泡产生 2HCl+Na2CO3=2NaCl+H2O+CO2↑ 〉 氢氧化钠 AC
20.甲、乙、丙 t1 65 < A 24 50
21.H+ 稀盐酸(或者稀硫酸、BaCl2溶液,CaCl2溶液等) HCl、NaCl 红 玻璃棒 Ba(OH)2 +MgSO4=BaSO4↓+Mg(OH)2↓(或者Ba(OH)2 +Na2CO3=BaCO3↓+2NaOH,CaCl2 +Na2CO3= CaCO3↓+2NaCl) Na2CO3和NaOH在溶液乙中加入适量稀盐酸 9.8g
22.玻璃棒 复分解 Mg(OH)2+2HCl=MgCl2+2H2O B 甲 升温或加水; BD
23.饱和 蒸发结晶 降温结晶 氯化钾 600g 48
答案第1页,共2页
答案第1页,共2页
同课章节目录
