第五单元 化学方程式 复习课件 (共33张PPT)
文档属性
| 名称 | 第五单元 化学方程式 复习课件 (共33张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-13 23:33:17 | ||
图片预览










文档简介
(共33张PPT)
化学方程式
- Experimental purpose -
1.
质量守恒定律的理解
2.
质量守恒定律的应用
3.
质量守恒定律的验证
4.
化学方程式的有关计算
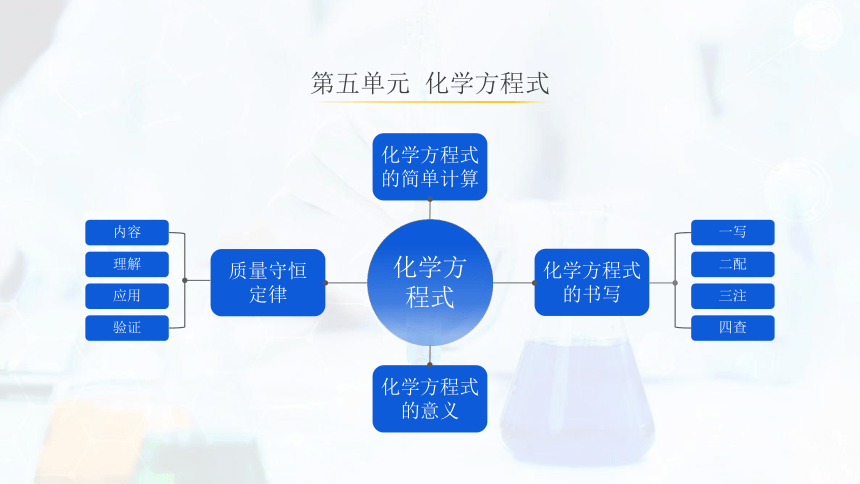
化学方程式
质量守恒
定律
内容
理解
应用
验证
化学方程式
的书写
化学方程式
的简单计算
化学方程式
的意义
一写
二配
三注
四查
第五单元 化学方程式
考点一、质量守恒定律的理解
一、内容:_______化学反应的各物质质量______,等于反应后生成的各物质质量_______。
二、理解:
1.反应物的总质量 = 生成物的总质量
2.反应物______的质量=生成物增加的质量
三、原因(三不变)
化学反应前后,原子的_______、_______和_______都不变。
参加
总和
总和
减少
种类
数目
质量
1.(2022·湖北咸宁一模)下列现象可用质量守恒定律解释的是( )
A.10g水受热变成10g水蒸气
B.50mL水加入50mL酒精,总体积约为100mL
C.5g蔗糖溶于95g水中,总质量为100g
D.1.2g碳与3.2g氧气恰好完全反应可生成4.4g二氧化碳
D
考点二、质量守恒定律的应用
应用一、推断未知物的化学式
例. (2017·河南)硝酸铜【Cu(NO3)2】受热分解会产生一种污染空气的有毒气体,该气体可能是( )
A. N2 B. NO2 C. NH3 D. SO2
B
1.定性推断
【依据】化学变化前后_______的种类不变(或质量守恒定律)。
【解析】反应物Cu(NO3)2中不含S和H,故C、D两项均不符合题意;A项N2无毒,B中NO2有毒、会污染空气,故正确答案应选B。
元素
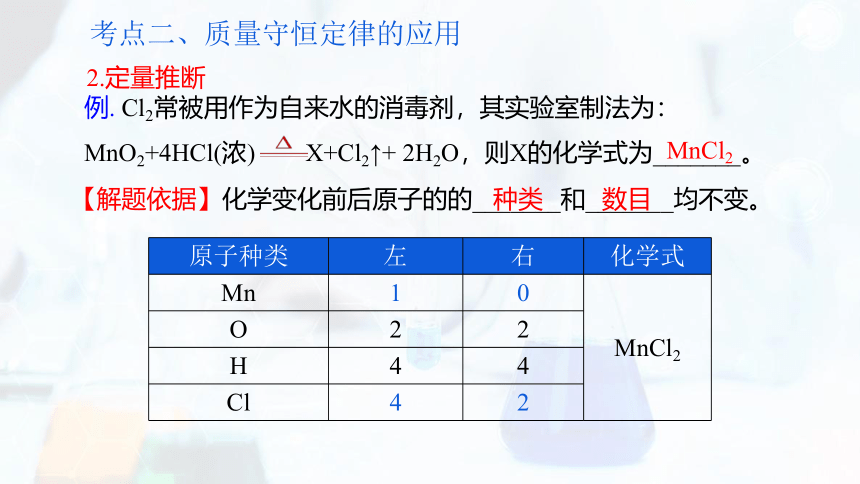
MnCl2
原子种类 左 右 化学式
Mn 1 0 MnCl2
O 2 2 H 4 4 Cl 4 2 2.定量推断
【解题依据】化学变化前后原子的的_______和_______均不变。
种类
数目
例. Cl2常被用作为自来水的消毒剂,其实验室制法为:
MnO2+4HCl(浓) X+Cl2↑+ 2H2O,则X的化学式为_______。
考点二、质量守恒定律的应用
2.(2022·广西桂林)实验室里一般不能制得氧气的物质是( )
A.高锰酸钾 B.氯酸钾 C.氯化钠 D.过氧化氢
D
1.(2022·山东东营)为了防止燃气泄漏,常在燃气中加入少量有特殊气味的乙硫醇(C2H5SH),一旦燃气泄漏即可闻到气味。乙硫醇在充足的氧气中燃烧时会生成一种空气污染物,该气体可能为( )
A.CO B.CO2 C.SO2 D.NO2
C
3.(2021·辽宁沈阳)硫酸氢钠是一种酸式盐,其水溶液显酸性。它的固体与过氧化钠粉末加热时发生如下反应: ,则X的化学式为( )
A.Na2S B.Na2SO4 C.Na D.NaOH
D
应用二、推断未知物的组成元素
1.定性推断
例.某物质在氧气中完全燃烧,测得生成物中含有二氧化碳、水蒸气、二氧化硫,下列对该有机物推断正确的是( )
A.一定含有碳、氢、硫元素,可能含有氧元素
B.一定含有碳、氢、氧元素
C.只含碳、氢元素
D.一定含有碳、氢、氧元素,可能含有硫元素
A
【解题依据】化学反应前后元素的种类不变。
【方法详解】
R+O2 CO2+ H2O + SO2
考点二、质量守恒定律的应用
2.定量推断
例.(2020·邵阳)已知某纯净物4.6 g在足量的氧气中充分燃烧后,生成8.8 g二氧化碳和5.4 g水。关于该纯净物组成的说法正确的是( )
A. 只含有碳、氢元素
B. 一定含有碳、氢、氧三种元素
C. 一定含有碳、氢元素,可能含有氧元素
D. 一定含有碳元素,可能含有氢、氧元素
解析:根据实际质量求出已知物的系数比
系数比=
相对分子质量
实际质量质量×10
B
质量 4.6g 9.6g 8.8g 5.4g
Mr 32 44 18
R + O2 = CO2+ H2O
系数 3 2 3
考点二、质量守恒定律的应用
1.某物质4.6g与氧气反应,生成8.8gCO2和5.4gH2O。下列说法正确的是( )
A. 参加反应的O2的质量为11.2g
B. 该物质中C、H元素的质量比为1:3
C. 该反应中CO2和H2O的分子数之比为2:3
D. 该物质中一定含有C、H元素,可能含有O元素
C
质量 4.6g 9.6g 8.8g 5.4g
Mr 32 44 18
R + O2 = CO2+ H2O
系数 3 2 3
m氧气=8.8g+5.4g-4.6g=9.6g
原子个数比≠元素质量比
分子个数比=系数比
【方法指导】1.根据质量守恒定律:X=2.6g+7.2g-6.6g-1.8g=1.4g。
2.(2016·河南)在点燃条件下,2.6g C2H2与7.2gO2恰好完全反应,生成6.6gCO2、1.8gH2O和xg CO。则x =____;
化学方程式为_____________________________________。
1.4
4C2H2 + 9O2 6CO2 + 4H2O + 2CO
点燃
C2H2 + O2 CO2 + H2O + CO
点燃
质量 2.6g 7.2g 6.6g 1.8g 1.4g
Mr 26 32 44 18 28
系数 1 1
9
4
3
2
1
2
通分,将分数变为整数
4 9 6 4 2
1. (2020·天水)在一密闭容器中加入a、b、c、d四种物质,测得反应前后各物质的质量如下表。下列说法正确的是( )
A. x等于90
B. b可能是单质
C. c一定是催化剂
D. 参加反应的a与d的质量比为7∶8
物 质 a b c d
反应前的质量/g 40 40 10 32
反应后的质量/g 12 x 10 0
D
先求待测值(未知量),写出反应表达式
还可能是与反应无关的物质
质量比等于质量变化之比
100
a + d b
28 32 60
应用三、图表计算题
考点二、质量守恒定律的应用
1.(2022·湖北鄂州)同学们前往实验室参观,实验员正将甲、乙、丙、丁四种物质在密闭容器中混合,使其在一定条件下反应一段时间,测得反应前后各物质质量如表,则下列说法不正确的是( )
A.乙可能是催化剂 B.x的值为25
C.该反应是分解反应 D.生成的丙、丁质量之比为14:11
甲 乙 丙 丁
反应前质量/g 40 3 2 3
反应后质量/g x 3 16 14
B
2.(2022·湖南衡阳)甲、乙、丙、丁四种物质在一定条件下充分混合,此时各物质的质量分数如图1所示。一段时间后,各物质的质量分数如图2所示。下列说法正确的是( )
A.丁是反应物 B.x的值为20
C.乙是此化学反应的催化剂 D.生成38g甲,需消耗60g丁
A
3.(2022·湖南常德)一定条件下,密闭容器中发生了某一化学反应,涉及的物质为甲、乙、丙、丁,如图为各物质在反应前和反应后某时刻的质量关系。下列说法不正确的是( )
A.x的值是31 B.甲、丁的相对分子质量之比可能为7:11
C.丁可能为单质 D.反应中消耗甲和乙的质量比为7:4
C
4.(2020·宜昌)某密闭容器中只有乙、丙、丁三种物质,在一定条件下发生了一个化学反应,容器中乙、丙、丁的质量随甲的质量变化情况如图所示。下列说法错误的是( )
A.a的值为12
B.丁属于化合物
C.当丁为5g时,容器中乙的质量为11g
D.当甲为2g时,容器中丙与丁的质量之比为12:5
D
前:10 0 10
后: 0 8 12
变:10 8 2
反应物的质量减少,生成物的质量增加,不变的可能为催化剂
丁 甲 + 乙
a=(10+0+10)-8=12
6:7.5=4:5
3.化学反应微观示意图
例.(2018·河南)如图是某反应的微观示意图
(1)写出图中单质的化学式为___________。
(2)写出该反应的化学方程式。
O2
(1)根据微观示意图写化学方程式
4NH3 + 5O2 4NO + 6H2O(注意配平)
考点二、质量守恒定律的应用
1.(2020·河南)如图为治理汽车尾气反应的微观示意图。下列有关说法正确的是( )
A.图中只有两种氧化物 B.该反应属于置换反应
C.相对分子质量最大的是NO D.生成丙和丁的质量比为7:22
D
2CO + 2NO N2 + 2CO2
28 88
7 22
2. (2022·湖北)“宏观-微观-符号”之间建立联系,能帮助我们更好地认识物质及变化的本质。某化学反应的微观示意图如图所示,下列说法正确的是( )
A.该反应前后,各元素的化合价没有发生改变
B.该反应中,实际参加反应的两种物质的分子个数比为2:3
C.该反应前后,原子的种类和数目都没有发生改变
D.该微观示意图中共有三种氧化物
C
首先“抓逃兵”,消除反应前后相同的微粒。莫把反应剩余物当做生成物。
2CH2O+2O2=2H2O+2CO2
2CH2O+2O2=2H2O+O2+2CO2
(2)补画微观示意图
例.(2022·海南模拟)如图为氢气与氯气反应的微观示意图
(1)请将图补充完整。
(2)请从微观角度解释:化学反应的实质是什么?
【依据】化学变化前后原子种类和数目保持不变。
考点二、质量守恒定律的应用
分子分为原子,原子又结合成新的分子
1.(2019.永州)甲烷燃烧的微观示意图如下,其中方框中需要补充的是( )
D
2.(2015·西藏)下图中参加反应的甲、乙分子和生成的丙分子的个数比为( )
A.5:1:2 B.2:1:2 C.3:1:2 D.1:1:2
B
1.试剂和装置的选择
(1)试剂之间能够发生_____反应;
(2)如果有气体参加或生成,应在_____容器中进行。
化学
密闭
【易错提醒】无论天平是否平衡,任何化学反应都遵守质量守恒定律。
例.为了验证质量守恒定律,某同学设计了如图实验。该实验能否达到目的?请说明理由。
改进措施:________________________
改为在密闭容器中进行。
不能。理由:反应生成的气体逸散到空气中
考点三、质量守恒定律的验证
1.(2015.河南)为验证质量守恒定律,某同学设计了如图实验。该实验能否达到实验目的?请说明理由。
【答案】不能。因为稀盐酸与硫酸钠溶液不能发生化学反应。
【解析】质量守恒定律指参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和,图示给出的稀盐酸与硫酸钠溶液不能发生化学反应,无法根据图示实验验证质量守恒定律。
2.(2019·山东)兴趣小组的同学利用下图装置,探究化学反应前后物质的质量是否守恒。应选用的药品是( )
A.铁粉和稀盐酸
B.硝酸钾晶体和水
C.碳酸钡粉末和稀硫酸
D.铜粉和硝酸银溶液
D
解析:A中铁粉与稀盐酸反应生成氢气逸散到空气中;B中硝酸钾与水不能发生化学反应;C中碳酸钡与稀硫酸反应生成二氧化碳气体逸散到空气中;D中铜粉与硝酸银能发生化学反应,且不生成气体。
1.(2021·辽宁期末)下列实验能够直接用于验证质量守恒定律的是( )
B
【技巧归纳】A、镁条在空气点燃生成氧化镁,反应前镁的质量不等于反应后氧化镁的质量,不能用来验证质量守恒定律,故A错误;B、氢氧化钠与硫酸铜溶液生成氢氧化铜沉淀和硫酸钠,没有气体参与反应,反应前后容器中物质的总质量也不变,能直接验证质量守恒定律,故B正确;C、食盐与水不发生化学反应,不能用于验证质量守恒定律,故C错误;D、过氧化氢在二氧化锰作催化剂时,反应生成水和氧气,氧气逸出,反应后烧杯中的物质质量减少,不能直接验证质量守恒定律,故D错误。
依据 反应中各物质实际质量比=微观质量比(相对分子质量×化学计量数) 计算 步骤 16g氢气在氧气中完全燃烧,求生成水的质量。 设:根据题意设未知数 解:设生成氧化镁的质量为x
2H2+O2 点燃 2H2O
4 36
16 g x
x=144 g
答:生成水的质量为144 g。
写:正确书写化学方程式 标:标出相关物质的质量比 列:列出比例式 求:求解 答:简明地写出答案 1.利用化学方程式的简单计算
考点四、化学方程式的有关计算
1.湿法炼铜为我国首创。早在西汉时期,就有从胆矾水溶液中置换出铜的记载,其反应的化学方程式为:Fe+CuSO4=Cu+FeSO4。若采用此法炼制128t铜,需要消耗铁的质量是多少?
答:需要消耗铁的质量为112t
解:设需要消耗铁的质量为x
Fe + CuSO4 = Cu + FeSO4
56 64
x 128t
56
64
=
x
128t
x=112t
2.字母方程式的有关计算
1.(2019·天津)在化学反应A+2B=C+2D中,已知16gA与64gB恰好完全反应,生成C和D的质量比为11:9,又知B的相对分子质量为32,则D的相对分子质量为( )
A.9 B.12 C.18 D.36
【方法指导】化学计算的核心:1.反应物的总质量=生成物的总质量2.实际质量比=微观质量比(微观质量比=相对分子质量×系数)根据题意,生成C和D的质量和为16g+64g=80g,又因为二者的质量比为11:9,所以生成的C的质量为 ,生成的D质量为 ,设D的相对分子质量为x,可得关系:
解得x=18,故选C。
C
考点四、化学方程式的有关计算
1.(2022·湖南湘西)在反应2A+B2=2C中,21gA和足量B2在一定条件下充分反应生成33gC,已知B的相对原子质量为16,则A的相对分子质量是( )
A.26 B.28 C.30 D.32
【方法指导】则A的相对分子质量是x,根据化学方程式中各物质的质量比可知:
2A + B2 = 2C
2x 16×2
21g 33g-21g
解得:x=28
B
2.(2019·辽宁模拟)在反应A+3B=2C+2D中,已知A和B的相对分子质量之比为7∶8,当2.8gA与一定量B恰好完余反应后,生成3.6gD,则生成C的质量为( )
A.9.6g B.8.8g C.6.8g D.4.4g
【方法指导】设与2.8gA恰好反应的B的质量是x,A的相对分子质量为7w,B的相对分子质量为8w,则: ,解得x=9.6g,根据质量守恒定律,生成C的质量为:2.8g+9.6g-3.6g=8.8g,故选B。
=
B
化学方程式
- Experimental purpose -
1.
质量守恒定律的理解
2.
质量守恒定律的应用
3.
质量守恒定律的验证
4.
化学方程式的有关计算
化学方程式
质量守恒
定律
内容
理解
应用
验证
化学方程式
的书写
化学方程式
的简单计算
化学方程式
的意义
一写
二配
三注
四查
第五单元 化学方程式
考点一、质量守恒定律的理解
一、内容:_______化学反应的各物质质量______,等于反应后生成的各物质质量_______。
二、理解:
1.反应物的总质量 = 生成物的总质量
2.反应物______的质量=生成物增加的质量
三、原因(三不变)
化学反应前后,原子的_______、_______和_______都不变。
参加
总和
总和
减少
种类
数目
质量
1.(2022·湖北咸宁一模)下列现象可用质量守恒定律解释的是( )
A.10g水受热变成10g水蒸气
B.50mL水加入50mL酒精,总体积约为100mL
C.5g蔗糖溶于95g水中,总质量为100g
D.1.2g碳与3.2g氧气恰好完全反应可生成4.4g二氧化碳
D
考点二、质量守恒定律的应用
应用一、推断未知物的化学式
例. (2017·河南)硝酸铜【Cu(NO3)2】受热分解会产生一种污染空气的有毒气体,该气体可能是( )
A. N2 B. NO2 C. NH3 D. SO2
B
1.定性推断
【依据】化学变化前后_______的种类不变(或质量守恒定律)。
【解析】反应物Cu(NO3)2中不含S和H,故C、D两项均不符合题意;A项N2无毒,B中NO2有毒、会污染空气,故正确答案应选B。
元素
MnCl2
原子种类 左 右 化学式
Mn 1 0 MnCl2
O 2 2 H 4 4 Cl 4 2 2.定量推断
【解题依据】化学变化前后原子的的_______和_______均不变。
种类
数目
例. Cl2常被用作为自来水的消毒剂,其实验室制法为:
MnO2+4HCl(浓) X+Cl2↑+ 2H2O,则X的化学式为_______。
考点二、质量守恒定律的应用
2.(2022·广西桂林)实验室里一般不能制得氧气的物质是( )
A.高锰酸钾 B.氯酸钾 C.氯化钠 D.过氧化氢
D
1.(2022·山东东营)为了防止燃气泄漏,常在燃气中加入少量有特殊气味的乙硫醇(C2H5SH),一旦燃气泄漏即可闻到气味。乙硫醇在充足的氧气中燃烧时会生成一种空气污染物,该气体可能为( )
A.CO B.CO2 C.SO2 D.NO2
C
3.(2021·辽宁沈阳)硫酸氢钠是一种酸式盐,其水溶液显酸性。它的固体与过氧化钠粉末加热时发生如下反应: ,则X的化学式为( )
A.Na2S B.Na2SO4 C.Na D.NaOH
D
应用二、推断未知物的组成元素
1.定性推断
例.某物质在氧气中完全燃烧,测得生成物中含有二氧化碳、水蒸气、二氧化硫,下列对该有机物推断正确的是( )
A.一定含有碳、氢、硫元素,可能含有氧元素
B.一定含有碳、氢、氧元素
C.只含碳、氢元素
D.一定含有碳、氢、氧元素,可能含有硫元素
A
【解题依据】化学反应前后元素的种类不变。
【方法详解】
R+O2 CO2+ H2O + SO2
考点二、质量守恒定律的应用
2.定量推断
例.(2020·邵阳)已知某纯净物4.6 g在足量的氧气中充分燃烧后,生成8.8 g二氧化碳和5.4 g水。关于该纯净物组成的说法正确的是( )
A. 只含有碳、氢元素
B. 一定含有碳、氢、氧三种元素
C. 一定含有碳、氢元素,可能含有氧元素
D. 一定含有碳元素,可能含有氢、氧元素
解析:根据实际质量求出已知物的系数比
系数比=
相对分子质量
实际质量质量×10
B
质量 4.6g 9.6g 8.8g 5.4g
Mr 32 44 18
R + O2 = CO2+ H2O
系数 3 2 3
考点二、质量守恒定律的应用
1.某物质4.6g与氧气反应,生成8.8gCO2和5.4gH2O。下列说法正确的是( )
A. 参加反应的O2的质量为11.2g
B. 该物质中C、H元素的质量比为1:3
C. 该反应中CO2和H2O的分子数之比为2:3
D. 该物质中一定含有C、H元素,可能含有O元素
C
质量 4.6g 9.6g 8.8g 5.4g
Mr 32 44 18
R + O2 = CO2+ H2O
系数 3 2 3
m氧气=8.8g+5.4g-4.6g=9.6g
原子个数比≠元素质量比
分子个数比=系数比
【方法指导】1.根据质量守恒定律:X=2.6g+7.2g-6.6g-1.8g=1.4g。
2.(2016·河南)在点燃条件下,2.6g C2H2与7.2gO2恰好完全反应,生成6.6gCO2、1.8gH2O和xg CO。则x =____;
化学方程式为_____________________________________。
1.4
4C2H2 + 9O2 6CO2 + 4H2O + 2CO
点燃
C2H2 + O2 CO2 + H2O + CO
点燃
质量 2.6g 7.2g 6.6g 1.8g 1.4g
Mr 26 32 44 18 28
系数 1 1
9
4
3
2
1
2
通分,将分数变为整数
4 9 6 4 2
1. (2020·天水)在一密闭容器中加入a、b、c、d四种物质,测得反应前后各物质的质量如下表。下列说法正确的是( )
A. x等于90
B. b可能是单质
C. c一定是催化剂
D. 参加反应的a与d的质量比为7∶8
物 质 a b c d
反应前的质量/g 40 40 10 32
反应后的质量/g 12 x 10 0
D
先求待测值(未知量),写出反应表达式
还可能是与反应无关的物质
质量比等于质量变化之比
100
a + d b
28 32 60
应用三、图表计算题
考点二、质量守恒定律的应用
1.(2022·湖北鄂州)同学们前往实验室参观,实验员正将甲、乙、丙、丁四种物质在密闭容器中混合,使其在一定条件下反应一段时间,测得反应前后各物质质量如表,则下列说法不正确的是( )
A.乙可能是催化剂 B.x的值为25
C.该反应是分解反应 D.生成的丙、丁质量之比为14:11
甲 乙 丙 丁
反应前质量/g 40 3 2 3
反应后质量/g x 3 16 14
B
2.(2022·湖南衡阳)甲、乙、丙、丁四种物质在一定条件下充分混合,此时各物质的质量分数如图1所示。一段时间后,各物质的质量分数如图2所示。下列说法正确的是( )
A.丁是反应物 B.x的值为20
C.乙是此化学反应的催化剂 D.生成38g甲,需消耗60g丁
A
3.(2022·湖南常德)一定条件下,密闭容器中发生了某一化学反应,涉及的物质为甲、乙、丙、丁,如图为各物质在反应前和反应后某时刻的质量关系。下列说法不正确的是( )
A.x的值是31 B.甲、丁的相对分子质量之比可能为7:11
C.丁可能为单质 D.反应中消耗甲和乙的质量比为7:4
C
4.(2020·宜昌)某密闭容器中只有乙、丙、丁三种物质,在一定条件下发生了一个化学反应,容器中乙、丙、丁的质量随甲的质量变化情况如图所示。下列说法错误的是( )
A.a的值为12
B.丁属于化合物
C.当丁为5g时,容器中乙的质量为11g
D.当甲为2g时,容器中丙与丁的质量之比为12:5
D
前:10 0 10
后: 0 8 12
变:10 8 2
反应物的质量减少,生成物的质量增加,不变的可能为催化剂
丁 甲 + 乙
a=(10+0+10)-8=12
6:7.5=4:5
3.化学反应微观示意图
例.(2018·河南)如图是某反应的微观示意图
(1)写出图中单质的化学式为___________。
(2)写出该反应的化学方程式。
O2
(1)根据微观示意图写化学方程式
4NH3 + 5O2 4NO + 6H2O(注意配平)
考点二、质量守恒定律的应用
1.(2020·河南)如图为治理汽车尾气反应的微观示意图。下列有关说法正确的是( )
A.图中只有两种氧化物 B.该反应属于置换反应
C.相对分子质量最大的是NO D.生成丙和丁的质量比为7:22
D
2CO + 2NO N2 + 2CO2
28 88
7 22
2. (2022·湖北)“宏观-微观-符号”之间建立联系,能帮助我们更好地认识物质及变化的本质。某化学反应的微观示意图如图所示,下列说法正确的是( )
A.该反应前后,各元素的化合价没有发生改变
B.该反应中,实际参加反应的两种物质的分子个数比为2:3
C.该反应前后,原子的种类和数目都没有发生改变
D.该微观示意图中共有三种氧化物
C
首先“抓逃兵”,消除反应前后相同的微粒。莫把反应剩余物当做生成物。
2CH2O+2O2=2H2O+2CO2
2CH2O+2O2=2H2O+O2+2CO2
(2)补画微观示意图
例.(2022·海南模拟)如图为氢气与氯气反应的微观示意图
(1)请将图补充完整。
(2)请从微观角度解释:化学反应的实质是什么?
【依据】化学变化前后原子种类和数目保持不变。
考点二、质量守恒定律的应用
分子分为原子,原子又结合成新的分子
1.(2019.永州)甲烷燃烧的微观示意图如下,其中方框中需要补充的是( )
D
2.(2015·西藏)下图中参加反应的甲、乙分子和生成的丙分子的个数比为( )
A.5:1:2 B.2:1:2 C.3:1:2 D.1:1:2
B
1.试剂和装置的选择
(1)试剂之间能够发生_____反应;
(2)如果有气体参加或生成,应在_____容器中进行。
化学
密闭
【易错提醒】无论天平是否平衡,任何化学反应都遵守质量守恒定律。
例.为了验证质量守恒定律,某同学设计了如图实验。该实验能否达到目的?请说明理由。
改进措施:________________________
改为在密闭容器中进行。
不能。理由:反应生成的气体逸散到空气中
考点三、质量守恒定律的验证
1.(2015.河南)为验证质量守恒定律,某同学设计了如图实验。该实验能否达到实验目的?请说明理由。
【答案】不能。因为稀盐酸与硫酸钠溶液不能发生化学反应。
【解析】质量守恒定律指参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和,图示给出的稀盐酸与硫酸钠溶液不能发生化学反应,无法根据图示实验验证质量守恒定律。
2.(2019·山东)兴趣小组的同学利用下图装置,探究化学反应前后物质的质量是否守恒。应选用的药品是( )
A.铁粉和稀盐酸
B.硝酸钾晶体和水
C.碳酸钡粉末和稀硫酸
D.铜粉和硝酸银溶液
D
解析:A中铁粉与稀盐酸反应生成氢气逸散到空气中;B中硝酸钾与水不能发生化学反应;C中碳酸钡与稀硫酸反应生成二氧化碳气体逸散到空气中;D中铜粉与硝酸银能发生化学反应,且不生成气体。
1.(2021·辽宁期末)下列实验能够直接用于验证质量守恒定律的是( )
B
【技巧归纳】A、镁条在空气点燃生成氧化镁,反应前镁的质量不等于反应后氧化镁的质量,不能用来验证质量守恒定律,故A错误;B、氢氧化钠与硫酸铜溶液生成氢氧化铜沉淀和硫酸钠,没有气体参与反应,反应前后容器中物质的总质量也不变,能直接验证质量守恒定律,故B正确;C、食盐与水不发生化学反应,不能用于验证质量守恒定律,故C错误;D、过氧化氢在二氧化锰作催化剂时,反应生成水和氧气,氧气逸出,反应后烧杯中的物质质量减少,不能直接验证质量守恒定律,故D错误。
依据 反应中各物质实际质量比=微观质量比(相对分子质量×化学计量数) 计算 步骤 16g氢气在氧气中完全燃烧,求生成水的质量。 设:根据题意设未知数 解:设生成氧化镁的质量为x
2H2+O2 点燃 2H2O
4 36
16 g x
x=144 g
答:生成水的质量为144 g。
写:正确书写化学方程式 标:标出相关物质的质量比 列:列出比例式 求:求解 答:简明地写出答案 1.利用化学方程式的简单计算
考点四、化学方程式的有关计算
1.湿法炼铜为我国首创。早在西汉时期,就有从胆矾水溶液中置换出铜的记载,其反应的化学方程式为:Fe+CuSO4=Cu+FeSO4。若采用此法炼制128t铜,需要消耗铁的质量是多少?
答:需要消耗铁的质量为112t
解:设需要消耗铁的质量为x
Fe + CuSO4 = Cu + FeSO4
56 64
x 128t
56
64
=
x
128t
x=112t
2.字母方程式的有关计算
1.(2019·天津)在化学反应A+2B=C+2D中,已知16gA与64gB恰好完全反应,生成C和D的质量比为11:9,又知B的相对分子质量为32,则D的相对分子质量为( )
A.9 B.12 C.18 D.36
【方法指导】化学计算的核心:1.反应物的总质量=生成物的总质量2.实际质量比=微观质量比(微观质量比=相对分子质量×系数)根据题意,生成C和D的质量和为16g+64g=80g,又因为二者的质量比为11:9,所以生成的C的质量为 ,生成的D质量为 ,设D的相对分子质量为x,可得关系:
解得x=18,故选C。
C
考点四、化学方程式的有关计算
1.(2022·湖南湘西)在反应2A+B2=2C中,21gA和足量B2在一定条件下充分反应生成33gC,已知B的相对原子质量为16,则A的相对分子质量是( )
A.26 B.28 C.30 D.32
【方法指导】则A的相对分子质量是x,根据化学方程式中各物质的质量比可知:
2A + B2 = 2C
2x 16×2
21g 33g-21g
解得:x=28
B
2.(2019·辽宁模拟)在反应A+3B=2C+2D中,已知A和B的相对分子质量之比为7∶8,当2.8gA与一定量B恰好完余反应后,生成3.6gD,则生成C的质量为( )
A.9.6g B.8.8g C.6.8g D.4.4g
【方法指导】设与2.8gA恰好反应的B的质量是x,A的相对分子质量为7w,B的相对分子质量为8w,则: ,解得x=9.6g,根据质量守恒定律,生成C的质量为:2.8g+9.6g-3.6g=8.8g,故选B。
=
B
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
