课题9.2.1 溶解度(第2课时)2022-2023学年九年级化学下册同步优质课件(共28张PPT)
文档属性
| 名称 | 课题9.2.1 溶解度(第2课时)2022-2023学年九年级化学下册同步优质课件(共28张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-14 16:21:57 | ||
图片预览







文档简介
(共28张PPT)
人教版九年级化学下册
第九单元 溶液
课题2 溶解度
(第2课时)
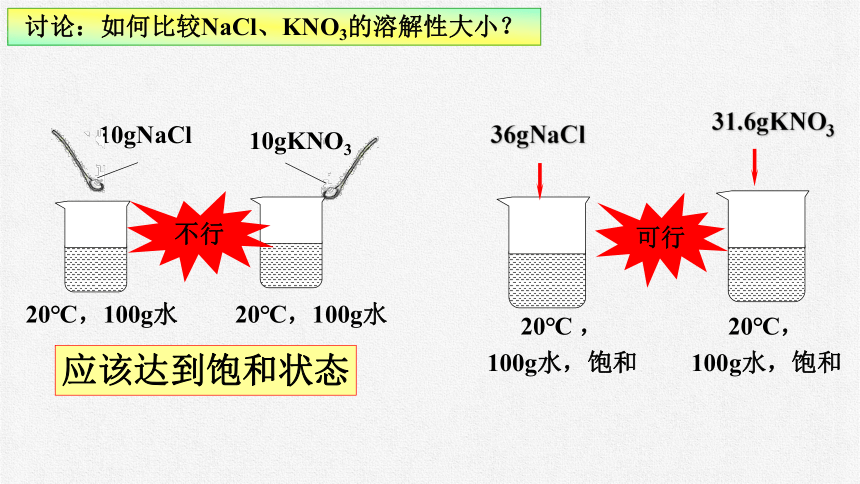
在课题1溶液的学习中,根据实验9-5和实验9-6,氯化钠和硝酸钾都能溶解在水中,谁更易溶?如何比较?
20℃ 40℃
应该在同一温度下
NaCl
KNO3
不行
讨论:如何比较NaCl、KNO3的溶解性大小?
20℃,20g水 20℃,100g水
溶剂量应该相同
不行
20℃,100g水 20℃,100g水
10gNaCl
10gKNO3
不行
应该达到饱和状态
36gNaCl
31.6gKNO3
20℃ ,
100g水,饱和
20℃,
100g水,饱和
可行
讨论:如何比较NaCl、KNO3的溶解性大小?
综上比较不同物质的溶解能力,应该控制的条件有:
定温度、定溶剂的量、定状态(达到饱和)
一、固体物质的溶解度
1.固体物质溶解度(通常用S 表示)定义:
在一定温度下,某固体物质在100克溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
2.四要素
条件:一定温度
标准:100克溶剂(未说明的情况下通常指水)
状态:饱和状态(最大值)
单位:质量(克)
内部因素:溶质和溶剂本身的性质
外部因素:________。
温度
3.影响因素
观察与思考:
20℃时,硝酸钾的溶解度是31.6克的意义?
含1:20℃时,100克水中最多能溶解硝酸钾的质量为31.6克;
含2:20℃时,100克水中溶解31.6克的硝酸钾就达到饱和状态。
含3:20℃时,硝酸钾的饱和溶液中,溶质溶剂和饱和溶液之间的质量比:31.6:100:131.6。
例题 下列有关溶解度的说法正确的是( )
A、100克水中溶解了20克物质刚好达到饱和,则该物质的溶解度是20克。
B、20℃时,100g水中溶解了10g某物质,在20℃时,该物质的溶解度是10g。
C、20℃时,50g水中最多可溶解18g食盐,在20℃ 时食盐的溶解度是18g。
D、20℃时,31.6g硝酸钾需要100g水才能恰好完全溶解,则20℃时硝酸钾的溶解度是31.6g。
D
难溶
微溶
可溶
易溶
0.01g
10g
1g
练习:
20℃时碳酸钙的溶解度是0.0013g,所以碳酸钙是 溶物质。
难
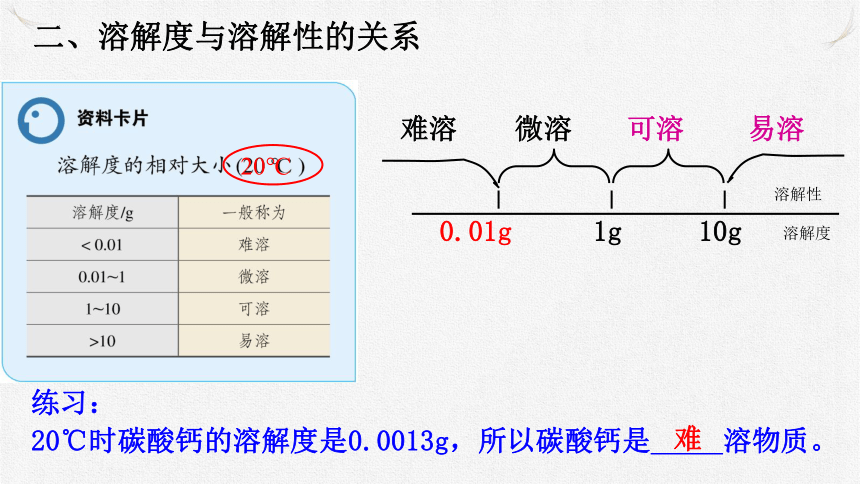
二、溶解度与溶解性的关系
20℃
溶解性
溶解度
(1)列表法(溶解度数据表):下表列出了硝酸钾和氯化钠在不同温度时的溶解度。
温度/℃ 0 10 20 30 40 50 60 70 80 90 100
溶解 度/g KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169 202 246
NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4 39.0 39.8
三、固体溶解度的表示方法
1.说出上述两种物质的溶解性?
2.以上两中物质溶解度随温度的变化如何变化?
(2)作图法(溶解度曲线):用纵坐标表示 ,横坐标表示 ,得到物质的溶解度随温度变化的曲线。
溶解度
温度
某种物质的溶解度除了列表表示,还有更直观的表示方法吗?
探究 完成P36探究题
温度℃ 0 20 40 60 70 80 90
溶解度 g/100 g水 13.3 31.6 63.9 110 138 169 202
以硝酸钾为例
0
t /℃
40
80
120
160
200
g/100 g水
s
70
10 20 30
40 50
60
80
100
90
思考:
KNO3的溶解度随温度变化有什么规律?
溶解度曲线的变化规律和结晶方法的选择:
(1)多数固体物质的溶解度随温度的升高而增大
(陡升型),如 、 等。此类物质
结晶方法选择 。
(2)少数固体物质的溶解度受温度变化影响很小(缓
升型),如_____。此类物质结晶方法选择_______。
(3)极少数固体物质的溶解度随温度的升高
而减小(下降型),
如____________,
结晶方法选
择_______。
KNO3
NaNO3
降温结晶
NaCl
蒸发结晶
Ca(OH)2
蒸发结晶
(1)曲线上的点均表示某物质在该温度下的溶解度。
(2)曲线下方的点表示这种物质在该温度下的不饱和溶液。
(3)曲线上方的点表示这种物质在该温度下的饱和溶液。
(4)曲线的交点表示不同物质在该温度下的溶解度相等。
(5)结晶法提纯的物质
(适宜于溶解度随温度变化趋势差异大的物质):
①降温结晶法(蒸发浓缩→降温结晶→过滤),如提纯NaCl和KNO3混合溶液中的KNO3;
②蒸发结晶法(蒸发结晶而不蒸干→趁热过滤),
如提纯NaCl和KNO3混合溶液中的NaCl。
留谁看谁
(6)固体物质溶解度受温度变化影响情况:
1.大多数固体物质溶解度随温度升高而增大,如硝酸钾等。
2.少数固体物质溶解度受温度影响不大,如食盐。
3.极少数固体物质溶解度随温度升高反而减小,如熟石灰。
所以影响固体溶解度的因素是:温度。
1.交点P 表示:
。
2.对于物质乙线上面的点A表示:
。
3.对于物质乙线上的点B表示:
。
4.对于物质乙线下面的点C表示:
。
5.在t2℃时,三种物质的溶解度:
。
t1℃时,甲、乙的溶解度相同
t2℃时,乙的饱和溶液
t2℃时,乙恰好是饱和溶液
t2℃时,乙的不饱和溶液
甲>乙>丙
溶解度曲线专题练习
6.在甲中混有少量乙,提纯甲:
。乙中混有少量甲,提纯乙: 。
7.根据溶解度曲线图可得,甲的不饱和溶液转化为饱和溶液可通过:
的方法 ;
将t2℃时丙的不饱和溶液转化为饱和溶液,可以通
过 的方法。
降温结晶
蒸发结晶
加入溶质甲或者
降温或恒温蒸发溶剂
增加A和蒸发溶剂
8.若t1℃时甲的溶解度为20g,则将15g的甲加入50g水中,得到溶液的质量为________9.在t2℃时甲、乙的饱和溶液降温到t1℃,二者析出的固体质
量: 。 10.在t2℃时,等质量的甲、乙配成饱和溶液所需水的质量______;用甲和乙配制成等质量的饱和溶液,所需水的质量______
60g
不一定甲>乙
(等质量的甲乙饱和溶液才满足)
甲<乙
甲<乙
11.将t2℃时甲、丙的饱和溶液分别降温 到t1℃时,各成分质量变化:
甲析出晶体,
丙由饱和溶液变为不饱和溶液
12.当温度为20℃时,可根据溶解度判断物质溶解性
减小
不变
不变不变
减小
不变
13.在t2℃时,三种物质的饱和溶液中,溶质质量分数大小关系为_____________将它们降温到t℃,溶质质量分数如何变化?溶质质量分数大小关系为____________
甲>乙>丙
甲乙析出晶体,
丙由饱和变得不饱和
乙>甲>丙
1.概念:某气体的压强为_____kPa和一定____时,在___体积水里溶解达到____状态时的气体______。
如氮气的压强为101kPa和温度为0 ℃时,1体积水里最多能溶解0.024体积的氮气,则在0 ℃时,氮气的溶解度为________。
101
温度
1
饱和
体积
0.024
四、气体溶解度
(1)为什么打开碳酸饮料的瓶盖后,汽水会自动喷出来。
(2)为什么喝了可乐以后,常常会打嗝?
气体在水中的溶解度与压强有关;
压强越小,气体溶解度越小
气体在水中的溶解度与温度有关;
温度越高,气体溶解度越小
2、影响气体溶解度的因素:
(3)天气闷热时,鱼儿为什么总爱跳出水面上进行呼吸?
温度越高,气体溶解度越小。
氮气的压强为101kPa和温度为0℃时,1体积水里最多能溶解0.024体积的氮气,
3、气体溶解度的意义
如:在0℃时,氮气的溶解度为0.024的意义。
影响气体溶解度的因素:
压强(正比)、温度(反比)
1.下图是甲、乙两种物质的溶解度曲线。t3℃时,将取ag甲和ag乙分别放入100g水中,充分搅拌,然后降温,下列说法不正确的是( )
A.t1℃时,甲的溶解度小于
乙的溶解度
B.降温至t2℃时,甲溶液和
乙溶液均饱和
C.降温至t1℃时,两种溶液
中溶质的质量分数相等
D.若甲中混有少量的乙,可用降温结晶的方法提纯甲
C
课堂检测
2.0℃时,向100g水中不断加入硝酸钾固体或改变温度,得到相应的溶液①~⑤。
③中溶液的质量为( )
A.60g B.100g C.160g D.163.9g
C
3. 60℃时,向100g水中加入一定量KNO3形成溶液,再降温至20℃,析出固体质量的变化如图1,结合图2,下列说法正确的是( )
A.加入的KNO3质量为41.6g
B.降温过程中KNO3溶液始终为饱和溶液
C.蒸发溶剂可将M点的溶液转化到N点
D.20℃时,100g KNO3饱和溶液中有KNO331. 6g
A
4.下列是硼酸在水中的溶解度表,下列说法不正确的是( )
温度/℃ 10 20 40 60 80 100
在水中溶解度/g 3 5 9 15 23 37
在水中滴入稀盐酸后的溶解度/g 3.3 5.6 10.1 16.6 25.1 41.3
A.硼酸属于可溶物质
B.硼酸在盐酸中溶解形成的水溶液,溶质只有硼酸
C.60℃时硼酸在水中的最大浓度不会超过15%
D.40℃时配制50g5%的硼酸溶液需加水47.5mL
B
D
5.将200g溶有物质M的溶液从95℃降低到10℃,不同温度时析出溶质M的质量如下表所示。下列说法正确的是( )
温度/℃ 95 90 80 30 10
析出M的质量/g 0 0 15 100 116
A.95℃时该溶液为饱和溶液
B.M的溶解度随温度的升高而减小
C.30℃时析出M后所得溶液中含100g水
D.从M的不饱和溶液中析出M可采用先蒸发溶剂、再冷却结晶的方法
人教版九年级化学下册
第九单元 溶液
课题2 溶解度
(第2课时)
在课题1溶液的学习中,根据实验9-5和实验9-6,氯化钠和硝酸钾都能溶解在水中,谁更易溶?如何比较?
20℃ 40℃
应该在同一温度下
NaCl
KNO3
不行
讨论:如何比较NaCl、KNO3的溶解性大小?
20℃,20g水 20℃,100g水
溶剂量应该相同
不行
20℃,100g水 20℃,100g水
10gNaCl
10gKNO3
不行
应该达到饱和状态
36gNaCl
31.6gKNO3
20℃ ,
100g水,饱和
20℃,
100g水,饱和
可行
讨论:如何比较NaCl、KNO3的溶解性大小?
综上比较不同物质的溶解能力,应该控制的条件有:
定温度、定溶剂的量、定状态(达到饱和)
一、固体物质的溶解度
1.固体物质溶解度(通常用S 表示)定义:
在一定温度下,某固体物质在100克溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
2.四要素
条件:一定温度
标准:100克溶剂(未说明的情况下通常指水)
状态:饱和状态(最大值)
单位:质量(克)
内部因素:溶质和溶剂本身的性质
外部因素:________。
温度
3.影响因素
观察与思考:
20℃时,硝酸钾的溶解度是31.6克的意义?
含1:20℃时,100克水中最多能溶解硝酸钾的质量为31.6克;
含2:20℃时,100克水中溶解31.6克的硝酸钾就达到饱和状态。
含3:20℃时,硝酸钾的饱和溶液中,溶质溶剂和饱和溶液之间的质量比:31.6:100:131.6。
例题 下列有关溶解度的说法正确的是( )
A、100克水中溶解了20克物质刚好达到饱和,则该物质的溶解度是20克。
B、20℃时,100g水中溶解了10g某物质,在20℃时,该物质的溶解度是10g。
C、20℃时,50g水中最多可溶解18g食盐,在20℃ 时食盐的溶解度是18g。
D、20℃时,31.6g硝酸钾需要100g水才能恰好完全溶解,则20℃时硝酸钾的溶解度是31.6g。
D
难溶
微溶
可溶
易溶
0.01g
10g
1g
练习:
20℃时碳酸钙的溶解度是0.0013g,所以碳酸钙是 溶物质。
难
二、溶解度与溶解性的关系
20℃
溶解性
溶解度
(1)列表法(溶解度数据表):下表列出了硝酸钾和氯化钠在不同温度时的溶解度。
温度/℃ 0 10 20 30 40 50 60 70 80 90 100
溶解 度/g KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110 138 169 202 246
NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4 39.0 39.8
三、固体溶解度的表示方法
1.说出上述两种物质的溶解性?
2.以上两中物质溶解度随温度的变化如何变化?
(2)作图法(溶解度曲线):用纵坐标表示 ,横坐标表示 ,得到物质的溶解度随温度变化的曲线。
溶解度
温度
某种物质的溶解度除了列表表示,还有更直观的表示方法吗?
探究 完成P36探究题
温度℃ 0 20 40 60 70 80 90
溶解度 g/100 g水 13.3 31.6 63.9 110 138 169 202
以硝酸钾为例
0
t /℃
40
80
120
160
200
g/100 g水
s
70
10 20 30
40 50
60
80
100
90
思考:
KNO3的溶解度随温度变化有什么规律?
溶解度曲线的变化规律和结晶方法的选择:
(1)多数固体物质的溶解度随温度的升高而增大
(陡升型),如 、 等。此类物质
结晶方法选择 。
(2)少数固体物质的溶解度受温度变化影响很小(缓
升型),如_____。此类物质结晶方法选择_______。
(3)极少数固体物质的溶解度随温度的升高
而减小(下降型),
如____________,
结晶方法选
择_______。
KNO3
NaNO3
降温结晶
NaCl
蒸发结晶
Ca(OH)2
蒸发结晶
(1)曲线上的点均表示某物质在该温度下的溶解度。
(2)曲线下方的点表示这种物质在该温度下的不饱和溶液。
(3)曲线上方的点表示这种物质在该温度下的饱和溶液。
(4)曲线的交点表示不同物质在该温度下的溶解度相等。
(5)结晶法提纯的物质
(适宜于溶解度随温度变化趋势差异大的物质):
①降温结晶法(蒸发浓缩→降温结晶→过滤),如提纯NaCl和KNO3混合溶液中的KNO3;
②蒸发结晶法(蒸发结晶而不蒸干→趁热过滤),
如提纯NaCl和KNO3混合溶液中的NaCl。
留谁看谁
(6)固体物质溶解度受温度变化影响情况:
1.大多数固体物质溶解度随温度升高而增大,如硝酸钾等。
2.少数固体物质溶解度受温度影响不大,如食盐。
3.极少数固体物质溶解度随温度升高反而减小,如熟石灰。
所以影响固体溶解度的因素是:温度。
1.交点P 表示:
。
2.对于物质乙线上面的点A表示:
。
3.对于物质乙线上的点B表示:
。
4.对于物质乙线下面的点C表示:
。
5.在t2℃时,三种物质的溶解度:
。
t1℃时,甲、乙的溶解度相同
t2℃时,乙的饱和溶液
t2℃时,乙恰好是饱和溶液
t2℃时,乙的不饱和溶液
甲>乙>丙
溶解度曲线专题练习
6.在甲中混有少量乙,提纯甲:
。乙中混有少量甲,提纯乙: 。
7.根据溶解度曲线图可得,甲的不饱和溶液转化为饱和溶液可通过:
的方法 ;
将t2℃时丙的不饱和溶液转化为饱和溶液,可以通
过 的方法。
降温结晶
蒸发结晶
加入溶质甲或者
降温或恒温蒸发溶剂
增加A和蒸发溶剂
8.若t1℃时甲的溶解度为20g,则将15g的甲加入50g水中,得到溶液的质量为________9.在t2℃时甲、乙的饱和溶液降温到t1℃,二者析出的固体质
量: 。 10.在t2℃时,等质量的甲、乙配成饱和溶液所需水的质量______;用甲和乙配制成等质量的饱和溶液,所需水的质量______
60g
不一定甲>乙
(等质量的甲乙饱和溶液才满足)
甲<乙
甲<乙
11.将t2℃时甲、丙的饱和溶液分别降温 到t1℃时,各成分质量变化:
甲析出晶体,
丙由饱和溶液变为不饱和溶液
12.当温度为20℃时,可根据溶解度判断物质溶解性
减小
不变
不变不变
减小
不变
13.在t2℃时,三种物质的饱和溶液中,溶质质量分数大小关系为_____________将它们降温到t℃,溶质质量分数如何变化?溶质质量分数大小关系为____________
甲>乙>丙
甲乙析出晶体,
丙由饱和变得不饱和
乙>甲>丙
1.概念:某气体的压强为_____kPa和一定____时,在___体积水里溶解达到____状态时的气体______。
如氮气的压强为101kPa和温度为0 ℃时,1体积水里最多能溶解0.024体积的氮气,则在0 ℃时,氮气的溶解度为________。
101
温度
1
饱和
体积
0.024
四、气体溶解度
(1)为什么打开碳酸饮料的瓶盖后,汽水会自动喷出来。
(2)为什么喝了可乐以后,常常会打嗝?
气体在水中的溶解度与压强有关;
压强越小,气体溶解度越小
气体在水中的溶解度与温度有关;
温度越高,气体溶解度越小
2、影响气体溶解度的因素:
(3)天气闷热时,鱼儿为什么总爱跳出水面上进行呼吸?
温度越高,气体溶解度越小。
氮气的压强为101kPa和温度为0℃时,1体积水里最多能溶解0.024体积的氮气,
3、气体溶解度的意义
如:在0℃时,氮气的溶解度为0.024的意义。
影响气体溶解度的因素:
压强(正比)、温度(反比)
1.下图是甲、乙两种物质的溶解度曲线。t3℃时,将取ag甲和ag乙分别放入100g水中,充分搅拌,然后降温,下列说法不正确的是( )
A.t1℃时,甲的溶解度小于
乙的溶解度
B.降温至t2℃时,甲溶液和
乙溶液均饱和
C.降温至t1℃时,两种溶液
中溶质的质量分数相等
D.若甲中混有少量的乙,可用降温结晶的方法提纯甲
C
课堂检测
2.0℃时,向100g水中不断加入硝酸钾固体或改变温度,得到相应的溶液①~⑤。
③中溶液的质量为( )
A.60g B.100g C.160g D.163.9g
C
3. 60℃时,向100g水中加入一定量KNO3形成溶液,再降温至20℃,析出固体质量的变化如图1,结合图2,下列说法正确的是( )
A.加入的KNO3质量为41.6g
B.降温过程中KNO3溶液始终为饱和溶液
C.蒸发溶剂可将M点的溶液转化到N点
D.20℃时,100g KNO3饱和溶液中有KNO331. 6g
A
4.下列是硼酸在水中的溶解度表,下列说法不正确的是( )
温度/℃ 10 20 40 60 80 100
在水中溶解度/g 3 5 9 15 23 37
在水中滴入稀盐酸后的溶解度/g 3.3 5.6 10.1 16.6 25.1 41.3
A.硼酸属于可溶物质
B.硼酸在盐酸中溶解形成的水溶液,溶质只有硼酸
C.60℃时硼酸在水中的最大浓度不会超过15%
D.40℃时配制50g5%的硼酸溶液需加水47.5mL
B
D
5.将200g溶有物质M的溶液从95℃降低到10℃,不同温度时析出溶质M的质量如下表所示。下列说法正确的是( )
温度/℃ 95 90 80 30 10
析出M的质量/g 0 0 15 100 116
A.95℃时该溶液为饱和溶液
B.M的溶解度随温度的升高而减小
C.30℃时析出M后所得溶液中含100g水
D.从M的不饱和溶液中析出M可采用先蒸发溶剂、再冷却结晶的方法
同课章节目录
