浙教版科学九年级上第1章第2节探索酸的性质
文档属性
| 名称 | 浙教版科学九年级上第1章第2节探索酸的性质 |  | |
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2014-01-13 10:13:04 | ||
图片预览







文档简介
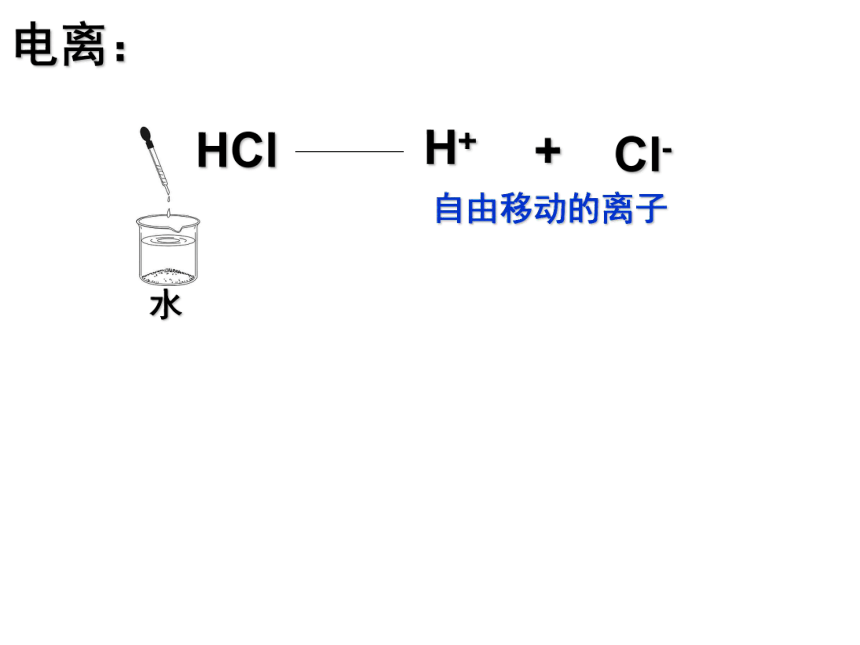
课件51张PPT。酸味的水果 内含酸性物质 第2节 探索酸的性质 H+ HCl H+ + Cl- 自由移动的离子 电离: 第2节 探索酸的性质 1.电离: 一些物质溶于水或受热熔化
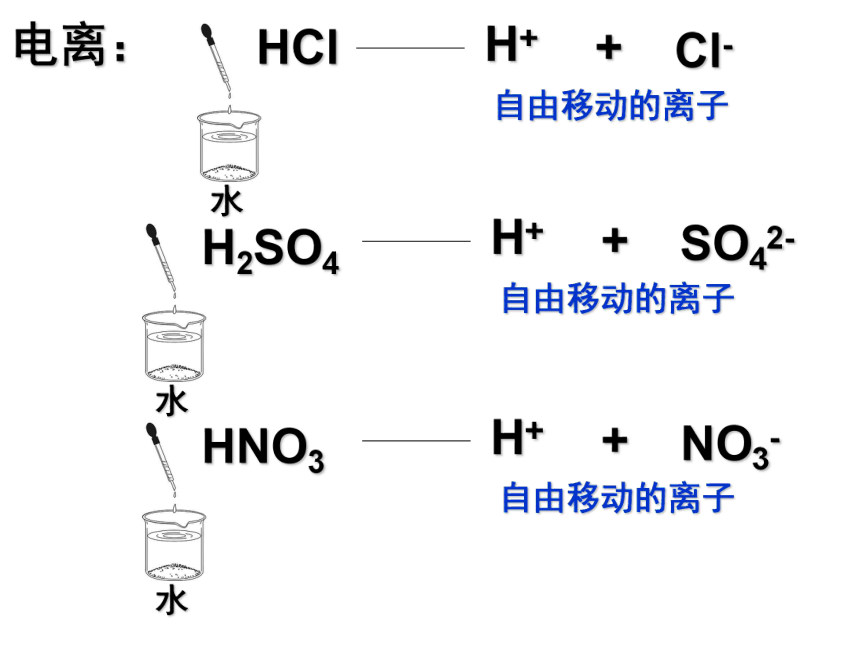
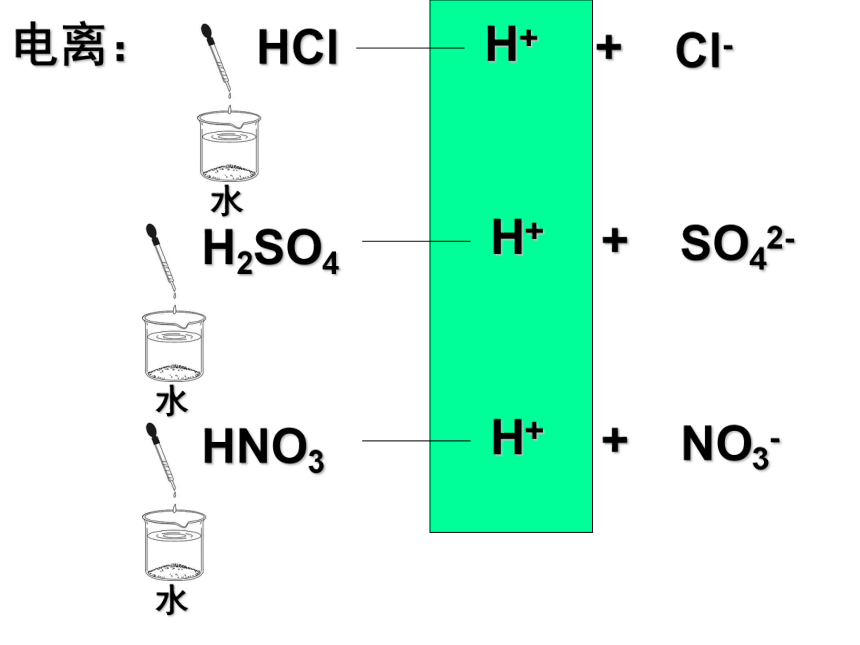
而离解成自由移动离子的过程。 一. HCl H+ + Cl- 自由移动的离子 电离: H+ + SO42- 自由移动的离子 H+ + NO3- 自由移动的离子 HCl H+ + Cl- 电离: H+ + SO42- H+ + NO3- 第2节 探索酸的性质 1.电离: 一些物质溶于水或受热熔化
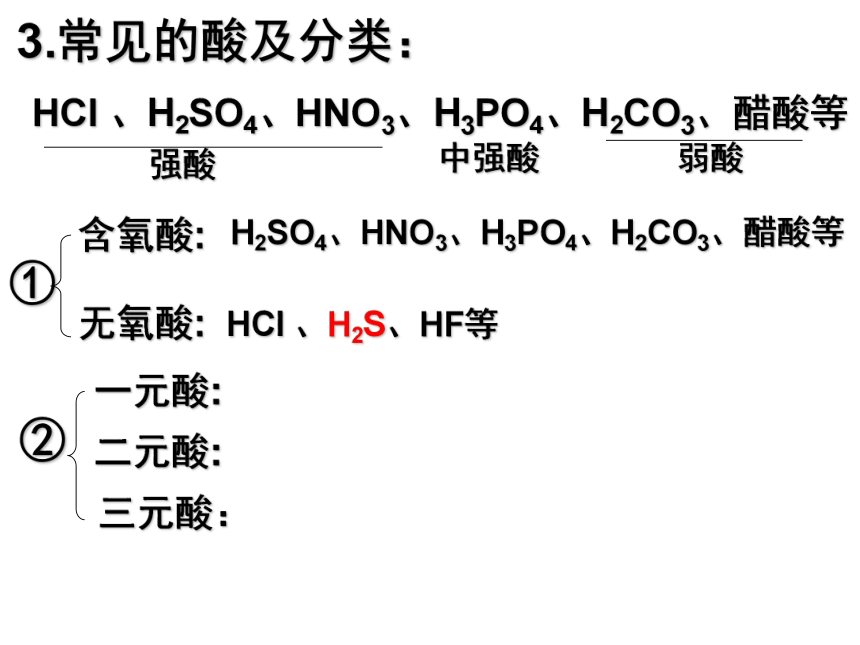
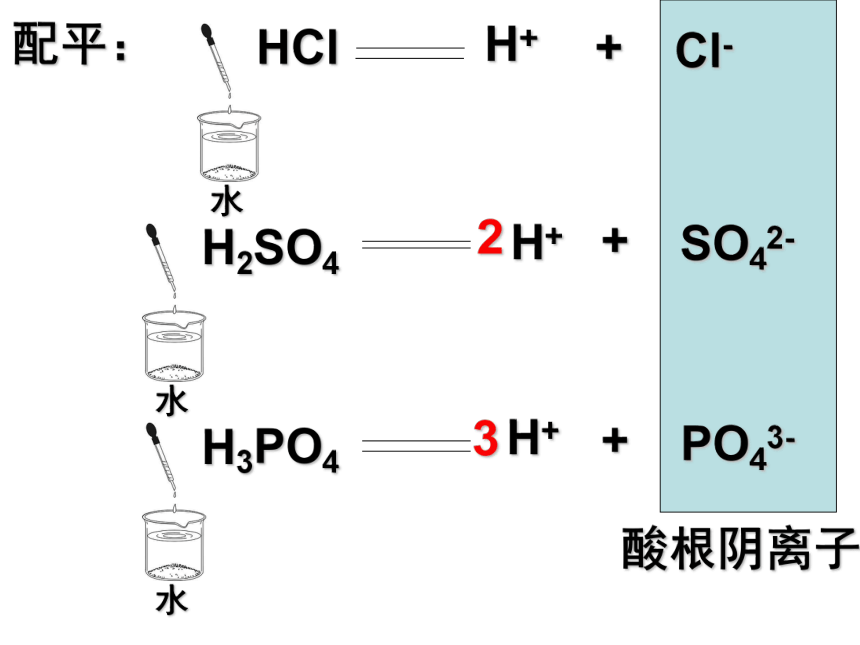
而离解成自由移动离子的过程。 2.酸: 电离时生成的阳离子全部都是氢离子的化合物 NH4HCO3呢?H3PO4呢? 3.常见的酸及分类: HCl 、H2SO4、HNO3、H3PO4、H2CO3、醋酸等 强酸 弱酸 中强酸 H2SO4、HNO3、H3PO4、H2CO3、醋酸等HCl 、H2S、HF等 HCl H+ + Cl- 配平: H+ + SO42- H3PO4 H+ + PO43- 2 3 4.电离方程式的书写: ①遵循质量守恒定律 ②遵循电荷守恒 HCl H+ + Cl- 配平: H+ + SO42- H3PO4 H+ + PO43- 2 3 酸根阴离子 4.电离方程式的书写: ①遵循质量守恒定律 ②遵循电荷守恒 5.酸 H+ + 酸根阴离子 6.酸的溶液 酸性溶液 或能使石蕊变红的溶液 ②显酸性的溶液不一定属于酸的溶液 ①酸的溶液显酸性 K、H+、SO42- 此溶液怎么配起来的? 活动1: 检验溶液的酸碱性: 二.酸的共性: 1.酸的溶液能使紫色石蕊变 色 (证明此溶液显 性;内含 离子)活动2: 在氢氧化钠溶液中先加石蕊再滴酸 二.酸的共性: 1.酸的溶液能使紫色石蕊变 色 (证明此溶液显 性;内含 离子)2.酸的溶液能与碱性物质反应 例:用胃舒平治疗胃酸过多 Al(OH)3 + HCl = AlCl3 + H2O 3 3 二.酸的共性: 1.酸的溶液能使紫色石蕊变 色 (证明此溶液显 性;内含 离子)2.酸的溶液能与碱性物质反应 例:用胃舒平治疗胃酸过多 Al(OH)3 + HCl = AlCl3 + H2O 3 3 但 使酚酞变色。 不能 活动3:与某些金属氧化物反应 3.能与某些金属氧化物反应: ①能除铁锈: a.现象:(Fe2O3) 铁锈逐渐消失溶液变黄色
若盐酸过多,还会有气泡出现 HCl + Fe2O3 = HCl + Fe = ②能与氧化铜反应: 棕黄色 a.现象:黑色粉末逐渐消失溶液变蓝色 HCl + CuO = 分析: 3HCl + Fe2O3 = FeCl3 + 3H2O 6HNO3 + Fe2O3 = 2Fe(NO3)3 + 3H2O 2HCl + CuO = CuCl2 + H2O 3H2SO4 + Fe2O3 = Fe2(SO4)3 + 3H2O 2HNO3 + CuO = Cu(NO3)2 + H2O 盐 3.能与某些金属氧化物反应: ①能除铁锈: a.现象:(Fe2O3) 铁锈逐渐消失溶液变黄色
若盐酸过多,还会有气泡出现 HCl + Fe2O3 = HCl + Fe = ②能与氧化铜反应: 棕黄色 a.现象:黑色粉末逐渐消失溶液变蓝色 HCl + CuO = 盐 + 水 活动4:与鸡蛋壳反应 4.能与某些盐反应 CaCO3 + HCl = CaCO3 + HNO3 = ①与碳酸钙反应: (现象) ②硫酸与氯化钡反应: (现象) H2SO4 + BaCl2 = BaSO4 + HCl 2 新的盐 新的酸 新盐 + 新酸 5.与某些金属金属反应: HCl + Zn = H2SO4 + Zn = 现象: 盐 + 氢气 三.酸的个性: 盐酸: 1.盐酸是由 溶于水而形成的溶液 氯化氢气体 (是混合物) HCl 氯化氢气体 盐酸 氢原子H 内含H+ 2.浓盐酸的特性: 挥发性 现象: 瓶口冒白雾 成因: 挥发出来的氯化氢气体溶于空气
中的水份里而形成的盐酸小液滴活动5:HCl + AgNO3 = NaCl + AgNO3 = AgCl + HNO3 AgCl + NaNO3 Cl- AgNO3与稀HNO3 2.浓盐酸的特性: 挥发性 现象: 瓶口冒白雾 成因: 挥发出来的氯化氢气体溶于空气
中的水份里而形成的盐酸小液滴2.浓盐酸的特性: 挥发性 现象: 瓶口冒白雾 成因: 挥发出来的氯化氢气体溶于空气
中的水份里而形成的盐酸小液滴3.Cl-的检验: 滴加AgNO3与稀HNO3 思考: 硫酸: 1.浓硫酸的特性: ①吸水性 可作O2、H2、N2、CO2、HCl
等气体的干燥剂②脱水性 (表现为有腐蚀性) 使有机物质失去H、O元素而炭化 ③强氧化性 与活泼金属能反应但不放H2 2.浓硫酸的稀释: (浓硫酸溶于水会放出大量的热) 将浓硫酸沿着玻璃棒倒入水中,并不断搅拌 H2SO4 + BaCl2 = Na2SO4 + Ba(NO3)2 = 分析: BaSO4 + HCl 2 H2SO4 + Ba(OH)2 = BaSO4 + H2O 2 BaSO4 + NaNO3 2 SO42- Ba2+ 3.硫酸根离子的检验: 常用Ba(NO3)2与稀HNO3 H2SO4 + BaCl2 = Na2SO4 + Ba(NO3)2 = 分析: BaSO4 + HCl 2 H2SO4 + Ba(OH)2 = BaSO4 + H2O 2 BaSO4 + NaNO3 2 SO42- Ba2+ 思考: 硝酸: ①有强氧化性 与活泼金属能反应但不放H2 ②不稳定,见光易分解 ③浓硝酸有挥发性 小结: 酸 HCl H2SO4 HNO3 H3PO4 H2CO3 H2S CH3COOH == H+ + Cl- == H+ + SO42- 2 == H+ + NO3- == H+ + PO43- 3 == H+ + CO32- 2 == H+ + S2- 2 == H+ + CH3COO- H+ 酸根阴离子 碱 NaOH KOH Ca(OH)2 == Na+ + OH- OH- Ba(OH)2 Mg(OH)2 Al(OH)3 == K+ + OH- == Ca2+ + OH- 2 == Ba2+ + OH- 2 == Ba2+ + OH- 2 == Al3+ + OH- 3 NH4OH == NH4+ + OH- ( NH3·H2O ) ( 一水合氨 ) 盐 NaCl == Na+ + Cl- FeCl3 FeCl2CuSO4AgNO3 BaSO4 CaCO3 Ba(NO3)2 Na2CO3 == Fe3+ + Cl- 3 == Fe2+ + Cl- 2 == Ag+ + NO3- == Ba2+ + NO3- 2 == Ba2+ + SO42- == Cu2+ + SO42- == Ca2+ + CO32- == Na+ + CO32- 2 酸根阴离子 酸的共性: 1.能使石蕊变 色;HCl H2SO4 HNO3 H2S 红 HCl H2SO4 HNO3 H2S 不能 酸的共性: 2.能与碱反应,HCl + NaOH = HCl + Al(OH)3 = H2SO4 + Cu(OH)2 = HNO3 + Ba(OH)2 = 生成盐和水 NaCl + H2O AlCl3 + H2O 3 3 CuSO4 + H2O 2 Ba(NO3)2 + H2O 2 2 复分解反应 H2SO4 + BaCl2 = Na2SO4 + Ba(NO3)2 = 分析: BaSO4 + HCl 2 H2SO4 + Ba(OH)2 = BaSO4 + H2O 2 BaSO4 + NaNO3 2 SO42- Ba2+ 复分解反应 四大基本反应类型: 化合反应: 分解反应: 置换反应: 复分解反应: A + B = AB AB = A + B AB + CD= AD + CB 酸的共性: 3.能与某些金属氧化物反应, Fe2O3 + HCl = CuO + H2SO4 = MgO + HNO3 = FeCl3 + H2O 2 6 3 CuSO4 + H2O Mg(NO3)2 + H2O 2 生成盐和水 酸的共性: 4.酸能与活泼金属反应, Fe + HCl = Zn + H2SO4 = Mg + HCl = FeCl2 + H2 2 MgCl2 + H2 2 ZnSO4 + H2 生成盐和H2 指稀HCl和稀H2SO4,浓硫酸与浓稀硝酸不行 思考:若酸过量,
你能证明H2是由Fe与HCl反应所致? 酸的共性: 5.酸能与某些盐反应,
而离解成自由移动离子的过程。 一. HCl H+ + Cl- 自由移动的离子 电离: H+ + SO42- 自由移动的离子 H+ + NO3- 自由移动的离子 HCl H+ + Cl- 电离: H+ + SO42- H+ + NO3- 第2节 探索酸的性质 1.电离: 一些物质溶于水或受热熔化
而离解成自由移动离子的过程。 2.酸: 电离时生成的阳离子全部都是氢离子的化合物 NH4HCO3呢?H3PO4呢? 3.常见的酸及分类: HCl 、H2SO4、HNO3、H3PO4、H2CO3、醋酸等 强酸 弱酸 中强酸 H2SO4、HNO3、H3PO4、H2CO3、醋酸等HCl 、H2S、HF等 HCl H+ + Cl- 配平: H+ + SO42- H3PO4 H+ + PO43- 2 3 4.电离方程式的书写: ①遵循质量守恒定律 ②遵循电荷守恒 HCl H+ + Cl- 配平: H+ + SO42- H3PO4 H+ + PO43- 2 3 酸根阴离子 4.电离方程式的书写: ①遵循质量守恒定律 ②遵循电荷守恒 5.酸 H+ + 酸根阴离子 6.酸的溶液 酸性溶液 或能使石蕊变红的溶液 ②显酸性的溶液不一定属于酸的溶液 ①酸的溶液显酸性 K、H+、SO42- 此溶液怎么配起来的? 活动1: 检验溶液的酸碱性: 二.酸的共性: 1.酸的溶液能使紫色石蕊变 色 (证明此溶液显 性;内含 离子)活动2: 在氢氧化钠溶液中先加石蕊再滴酸 二.酸的共性: 1.酸的溶液能使紫色石蕊变 色 (证明此溶液显 性;内含 离子)2.酸的溶液能与碱性物质反应 例:用胃舒平治疗胃酸过多 Al(OH)3 + HCl = AlCl3 + H2O 3 3 二.酸的共性: 1.酸的溶液能使紫色石蕊变 色 (证明此溶液显 性;内含 离子)2.酸的溶液能与碱性物质反应 例:用胃舒平治疗胃酸过多 Al(OH)3 + HCl = AlCl3 + H2O 3 3 但 使酚酞变色。 不能 活动3:与某些金属氧化物反应 3.能与某些金属氧化物反应: ①能除铁锈: a.现象:(Fe2O3) 铁锈逐渐消失溶液变黄色
若盐酸过多,还会有气泡出现 HCl + Fe2O3 = HCl + Fe = ②能与氧化铜反应: 棕黄色 a.现象:黑色粉末逐渐消失溶液变蓝色 HCl + CuO = 分析: 3HCl + Fe2O3 = FeCl3 + 3H2O 6HNO3 + Fe2O3 = 2Fe(NO3)3 + 3H2O 2HCl + CuO = CuCl2 + H2O 3H2SO4 + Fe2O3 = Fe2(SO4)3 + 3H2O 2HNO3 + CuO = Cu(NO3)2 + H2O 盐 3.能与某些金属氧化物反应: ①能除铁锈: a.现象:(Fe2O3) 铁锈逐渐消失溶液变黄色
若盐酸过多,还会有气泡出现 HCl + Fe2O3 = HCl + Fe = ②能与氧化铜反应: 棕黄色 a.现象:黑色粉末逐渐消失溶液变蓝色 HCl + CuO = 盐 + 水 活动4:与鸡蛋壳反应 4.能与某些盐反应 CaCO3 + HCl = CaCO3 + HNO3 = ①与碳酸钙反应: (现象) ②硫酸与氯化钡反应: (现象) H2SO4 + BaCl2 = BaSO4 + HCl 2 新的盐 新的酸 新盐 + 新酸 5.与某些金属金属反应: HCl + Zn = H2SO4 + Zn = 现象: 盐 + 氢气 三.酸的个性: 盐酸: 1.盐酸是由 溶于水而形成的溶液 氯化氢气体 (是混合物) HCl 氯化氢气体 盐酸 氢原子H 内含H+ 2.浓盐酸的特性: 挥发性 现象: 瓶口冒白雾 成因: 挥发出来的氯化氢气体溶于空气
中的水份里而形成的盐酸小液滴活动5:HCl + AgNO3 = NaCl + AgNO3 = AgCl + HNO3 AgCl + NaNO3 Cl- AgNO3与稀HNO3 2.浓盐酸的特性: 挥发性 现象: 瓶口冒白雾 成因: 挥发出来的氯化氢气体溶于空气
中的水份里而形成的盐酸小液滴2.浓盐酸的特性: 挥发性 现象: 瓶口冒白雾 成因: 挥发出来的氯化氢气体溶于空气
中的水份里而形成的盐酸小液滴3.Cl-的检验: 滴加AgNO3与稀HNO3 思考: 硫酸: 1.浓硫酸的特性: ①吸水性 可作O2、H2、N2、CO2、HCl
等气体的干燥剂②脱水性 (表现为有腐蚀性) 使有机物质失去H、O元素而炭化 ③强氧化性 与活泼金属能反应但不放H2 2.浓硫酸的稀释: (浓硫酸溶于水会放出大量的热) 将浓硫酸沿着玻璃棒倒入水中,并不断搅拌 H2SO4 + BaCl2 = Na2SO4 + Ba(NO3)2 = 分析: BaSO4 + HCl 2 H2SO4 + Ba(OH)2 = BaSO4 + H2O 2 BaSO4 + NaNO3 2 SO42- Ba2+ 3.硫酸根离子的检验: 常用Ba(NO3)2与稀HNO3 H2SO4 + BaCl2 = Na2SO4 + Ba(NO3)2 = 分析: BaSO4 + HCl 2 H2SO4 + Ba(OH)2 = BaSO4 + H2O 2 BaSO4 + NaNO3 2 SO42- Ba2+ 思考: 硝酸: ①有强氧化性 与活泼金属能反应但不放H2 ②不稳定,见光易分解 ③浓硝酸有挥发性 小结: 酸 HCl H2SO4 HNO3 H3PO4 H2CO3 H2S CH3COOH == H+ + Cl- == H+ + SO42- 2 == H+ + NO3- == H+ + PO43- 3 == H+ + CO32- 2 == H+ + S2- 2 == H+ + CH3COO- H+ 酸根阴离子 碱 NaOH KOH Ca(OH)2 == Na+ + OH- OH- Ba(OH)2 Mg(OH)2 Al(OH)3 == K+ + OH- == Ca2+ + OH- 2 == Ba2+ + OH- 2 == Ba2+ + OH- 2 == Al3+ + OH- 3 NH4OH == NH4+ + OH- ( NH3·H2O ) ( 一水合氨 ) 盐 NaCl == Na+ + Cl- FeCl3 FeCl2CuSO4AgNO3 BaSO4 CaCO3 Ba(NO3)2 Na2CO3 == Fe3+ + Cl- 3 == Fe2+ + Cl- 2 == Ag+ + NO3- == Ba2+ + NO3- 2 == Ba2+ + SO42- == Cu2+ + SO42- == Ca2+ + CO32- == Na+ + CO32- 2 酸根阴离子 酸的共性: 1.能使石蕊变 色;HCl H2SO4 HNO3 H2S 红 HCl H2SO4 HNO3 H2S 不能 酸的共性: 2.能与碱反应,HCl + NaOH = HCl + Al(OH)3 = H2SO4 + Cu(OH)2 = HNO3 + Ba(OH)2 = 生成盐和水 NaCl + H2O AlCl3 + H2O 3 3 CuSO4 + H2O 2 Ba(NO3)2 + H2O 2 2 复分解反应 H2SO4 + BaCl2 = Na2SO4 + Ba(NO3)2 = 分析: BaSO4 + HCl 2 H2SO4 + Ba(OH)2 = BaSO4 + H2O 2 BaSO4 + NaNO3 2 SO42- Ba2+ 复分解反应 四大基本反应类型: 化合反应: 分解反应: 置换反应: 复分解反应: A + B = AB AB = A + B AB + CD= AD + CB 酸的共性: 3.能与某些金属氧化物反应, Fe2O3 + HCl = CuO + H2SO4 = MgO + HNO3 = FeCl3 + H2O 2 6 3 CuSO4 + H2O Mg(NO3)2 + H2O 2 生成盐和水 酸的共性: 4.酸能与活泼金属反应, Fe + HCl = Zn + H2SO4 = Mg + HCl = FeCl2 + H2 2 MgCl2 + H2 2 ZnSO4 + H2 生成盐和H2 指稀HCl和稀H2SO4,浓硫酸与浓稀硝酸不行 思考:若酸过量,
你能证明H2是由Fe与HCl反应所致? 酸的共性: 5.酸能与某些盐反应,
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
