2022-2023学年人教版(2019)化学高一必修一第四章第一节课时5卤族元素的原子结构与性质练习题(Word含解析)
文档属性
| 名称 | 2022-2023学年人教版(2019)化学高一必修一第四章第一节课时5卤族元素的原子结构与性质练习题(Word含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-16 12:57:25 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2022-2023学年人教版(2019)化学高一必修一第四章第一节
课时5卤族元素的原子结构与性质练习题
学校:___________姓名:___________班级:___________
一、单选题
1.下列元素属于卤族元素的是( )
A.Li B.N C.Cl D.K
2.卤族元素是最活泼的一族非金属元素,下列关于卤族元素的说法正确的是( )
A.卤素单质的最外层电子数都是7
B.从上到下,卤素原子的电子层数依次增多,原子半径依次减小
C.从到,原子核对最外层电子的吸引能力依次减弱,原子得电子能力依次减弱
D.卤素单质与化合的难易程度由难到易的顺序为、、、
3.氟、氯、溴、碘性质上差异的主要原因是 ( )
A.原子的核电荷数依次增多
B.原子量依次增大
C.原子核外次外层电子数依次增多
D.原子核外电子层数依次增多
4.按、、、的顺序,下列叙述正确的是 ( )
A.单质的颜色逐渐加深 B.单质与水反应的剧烈程度逐渐增强
C.与氢气反应越来越容易 D.单质的熔、沸点逐渐降低
5.下列关于卤族元素的递变规律不正确的是 ( )
A.、、、的氧化性逐渐减弱
B.、、、的热稳定性逐渐减弱
C.、、、的还原性逐渐增强,颜色逐渐变深
D.、、、的密度逐渐增大
6.关于、、、性质的比较,下列说法不正确的是( )
A.酸性: B.还原性:
C.氢化物均易溶于水 D.与氢气反应的剧烈程度:
7.下列关于碘元素(原子序数为53)的放射性同位素的叙述中正确的是( )
A.一个原子中含有131个质子
B.位于元素周期表中第四周期第ⅦA族
C.其氢化物为,比的稳定性弱
D.最高价氧化物对应的水化物为,比的酸性强
8.下列有关卤素的说法错误的是 ( )
A.新制氯水显浅黄绿色,但放置一段时间之后颜色会褪去
B.除外,相对分子质量小的卤素单质可将相对分子质量大的卤素从其盐溶液中置换出来
C.淀粉-碘化钾溶液在空气中变蓝,发生了反应:
D.由、、、的酸性递增的事实,可推出、、、的非金属性递增
9.为比较卤素单质氧化性进行实验:①氯水滴入溴化钠溶液中,溶液变黄;②氯水滴入碘化钾溶液中,溶液变褐色。下列有关分析不合理的是 ( )
A.①中反应: Cl2+ 2Br-=2Cl-+ Br2
B.②中再加入CCl4,振荡、静置,下层溶液为紫红色
C.根据①②得出结论:氧化性Cl2>Br2>I2
D.将②中氯水换成溴水即可得出最后结论
10.下列关于碱金属或卤族元素的叙述正确的是 ( )
A.碱金属单质都可保存在煤油中
B.比活泼,故可以从溶液中置换出
C.砹()是第6周期的卤族元素,根据卤族元素性质的递变规律可知还原性:
D.卤素单质与水反应的通式为
11.下列组合中关于卤素的叙述全部正确的是( )
①卤素只以化合态存在于自然界中 ②随核电荷数增加,单质熔沸点降低
③随核电荷数增加,单质氧化性增强 ④随核电荷数增加,气态氢化物稳定性逐渐增强
⑤易形成-1价离子 ⑥从上到下原子半径逐渐减小
⑦从上到下非金属性逐渐减弱
A.①③⑤ B.①⑤⑦ C.②⑥⑦ D.①②④
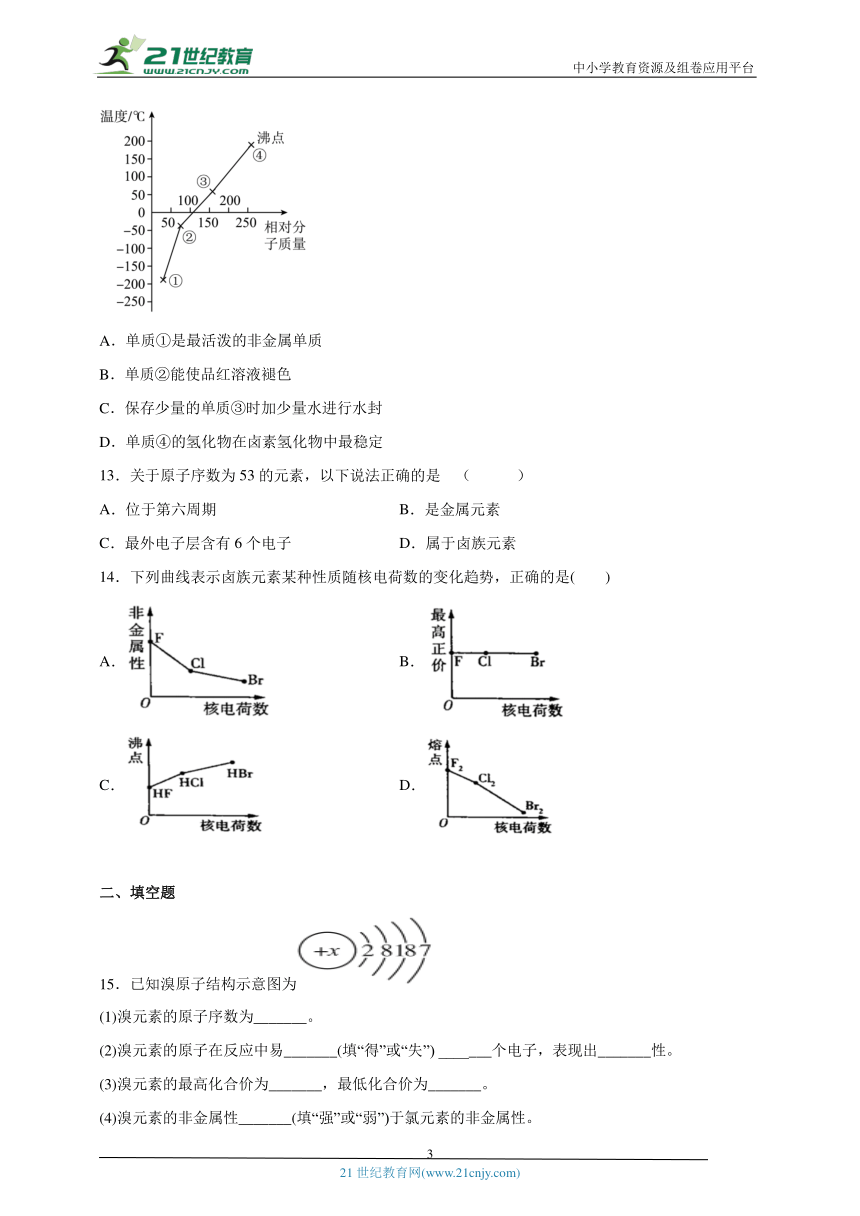
12.如图是卤素单质(、、、)的沸点与相对分子质量的关系图,下列说法错误的是 ( )
A.单质①是最活泼的非金属单质
B.单质②能使品红溶液褪色
C.保存少量的单质③时加少量水进行水封
D.单质④的氢化物在卤素氢化物中最稳定
13.关于原子序数为53的元素,以下说法正确的是 ( )
A.位于第六周期 B.是金属元素
C.最外电子层含有6个电子 D.属于卤族元素
14.下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是( )
A. B.
C. D.
二、填空题
15.已知溴原子结构示意图为
(1)溴元素的原子序数为_______。
(2)溴元素的原子在反应中易_______(填“得”或“失”) _______个电子,表现出_______性。
(3)溴元素的最高化合价为_______,最低化合价为_______。
(4)溴元素的非金属性_______(填“强”或“弱”)于氯元素的非金属性。
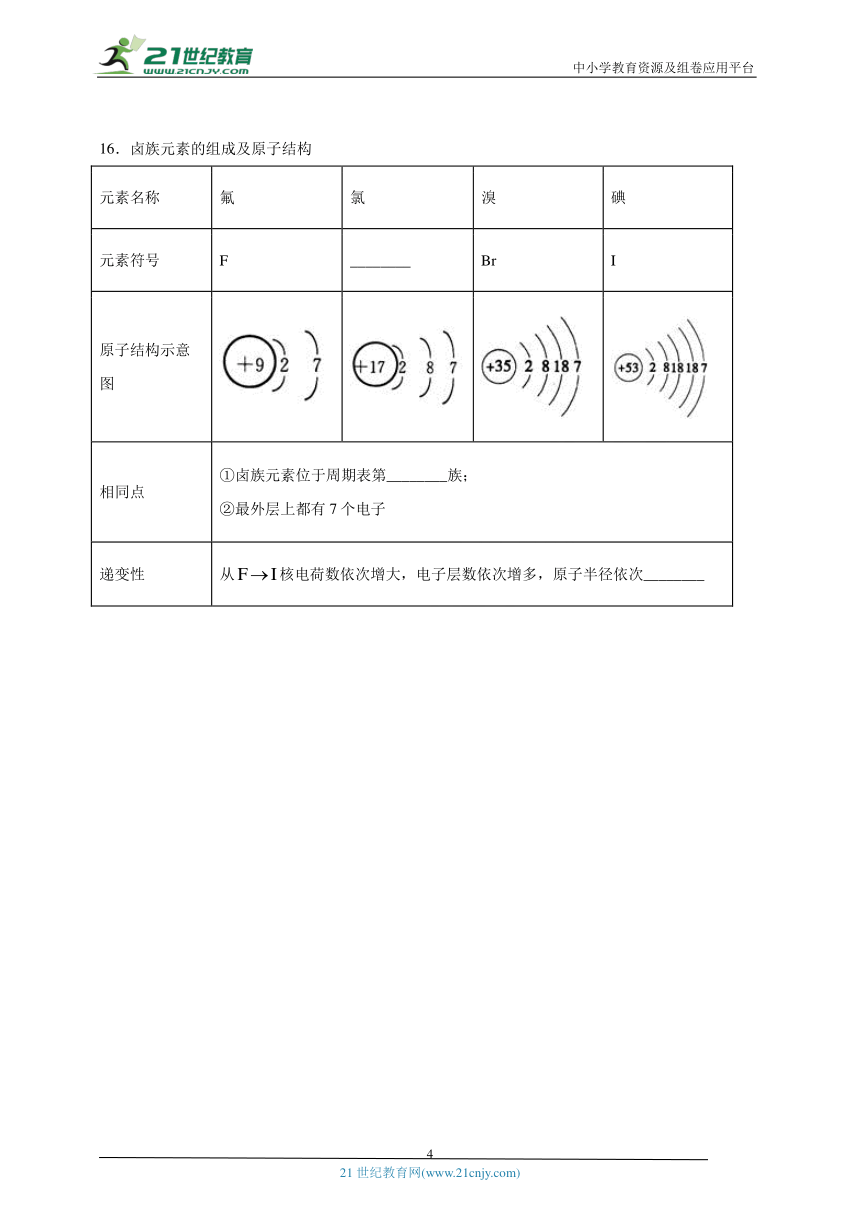
16.卤族元素的组成及原子结构
元素名称 氟 氯 溴 碘
元素符号 F ________ Br I
原子结构示意图
相同点 ①卤族元素位于周期表第________族;②最外层上都有7个电子
递变性 从核电荷数依次增大,电子层数依次增多,原子半径依次________
参考答案:
1.D
【详解】此粒子为原子,属于17号元素,第三周期VIIA族元素,是氯元素,容易得到1个电子达到稳定结构,故选项D说法不正确,答案选D。
2.C
【详解】A. 卤素原子的最外层电子数都是7,故A错误;
B. 从上到下,卤素原子的电子层数依次增多,原子半径依次增大,故B错误;
C. 从到,原子核对最外层电子的吸引能力依次减弱,原子得电子能力依次减弱,故C正确;
D. 卤素单质与化合的难易程度由易到难的顺序为、、、,故D错误;
故选C。
3.D
【详解】由于氟、氯、溴、碘原子核外最外层电子数相等,电子层数依次增多,原子核对最外层电子数的吸引能力逐渐减弱,导致氟、氯、溴、碘金属性逐渐增强,非金属性逐渐减弱,因此氟、氯、溴、碘性质上差异的主要原因是原子核外电子层数依次增多,故选D。
4.A
【详解】A.、、、单质的颜色分别是浅黄绿色、黄绿色、深红棕色和紫黑色,即颜色逐渐加深,选项A正确;
B.、、、元素的非金属性逐渐减弱,其单质与水反应的剧烈程度逐渐减弱,选项B不正确;
C.、、、元素的非金属性逐渐减弱,其单质与氢气的反应越来越难,选项C不正确;
D.、、、单质在常温常压下分别为气体、气体、液体、固体,它们的熔、沸点逐渐升高,选项D不正确。
答案选A。
5.C
【详解】A.随着原子序数的增大,卤族元素的得电子能力逐渐减弱,、、、的氧化性逐渐减弱,选项A正确;
B.随着原子序数的增大,卤族元素的得电子能力逐渐减弱,所以单质与氢气化合的能力逐渐减弱,、、、的热稳定性逐渐减弱,选项B正确;
C.随着原子序数的增大,卤族元素的得电子能力逐渐减弱,所以对应阴离子的失电子能力逐渐增强,即、、、的还原性逐渐增强,但四种离子均为无色,选项C错误;
D.随着原子序数的增大,卤素单质的密度逐渐增大,选项D正确。
答案选C。
6.B
【详解】A. 因非金属性:,则最高价氧化物对应水化物的酸性:,故A正确;
B. 从,卤族元素的非金属性逐渐减弱,对应氢化物的还原性逐渐增强,故B错误;
C. 卤族元素的氢化物均易溶于水,故C正确;
D. 卤族元素的非金属性随着原子序数增大而减弱,元素的非金属性越强,其单质与氢气反应越剧烈,则与氢气反应的剧烈程度:,故D正确;
故选B。
7.C
【详解】A.为碘元素的一种核素,原子中含有53个质子,质量数为131,选项A错误;
B.位于元素周期表中第五周期第Ⅰ族,选项B错误;
C.同主族元素从上至下,非金属性依次减弱,非金属性越强,对应的气态氢化物的稳定性越强,非金属性:,则气态氢化物的稳定性:,选项C正确;
D.元素的非金属性越强,最高价氧化物对应水化物的酸性越强,则酸性:,选项D错误。
答案选C。
8.D
【详解】A.新制氯水中含较多的氯气,显浅黄绿色,氯水中不稳定,见光易分解,,,则新制氯水放置数天后颜色变浅,选项A正确;
B.卤族元素从上到下,单质的氧化性逐渐增强,除外,相对分子质量小的卤素单质可将相对分子质量大的卤素从其盐溶液中置换出来,选项B正确;
C.淀粉-碘化钾溶液在空气中变蓝,是因为碘离子被氧气氧化成碘单质,反应的离子方程式为,选项C正确;
D.元素的非金属性越强,最高价氧化物对应水化物的酸性越强,不能根据氢化物的酸性强弱判断元素的非金属性,选项D错误。
答案选D。
9.C
【详解】A. 氯水滴入溴化钠溶液中,溶液变黄,说明有单质溴生成,则①中反应为Cl2+2Br-=2Cl-+Br2,A正确;
B. 氯水滴入碘化钾溶液中,溶液变褐色,说明有单质碘生成,则②中再加入CCl4,振荡、静置,下层溶液为紫红色,B正确;
C. 根据①②得出结论是氧化性氯气强于溴和碘,但不能得出溴强于碘的结论,C错误;
D. 要验证溴的氧化性强于碘,只需要将②中氯水换成溴水即可得出最后结论,D正确;
答案选C。
10.A
【详解】常温下氯酸钾与浓盐酸反应放出 Cl2 , Cl2 的颜色是黄绿色,①处充满黄绿色的 Cl2 ;
Cl2 进入玻璃管后与②处 NaBr 溶液发生置换反应生成 Br2 ,溴的水溶液颜色为橙色,所以②处的白色棉球变为橙色;
Cl2 和③处 KI 溶液反应置换出 I2 ,淀粉溶液遇 I2 变蓝,③处棉球变为蓝色;
④处 Cl2 与 NaOH 溶液反应生成 NaCl 、 NaClO ,棉球本身是白色的,所以④处的颜色为白色;
故①②③④的颜色分别为:黄绿色;橙色;蓝色;白色;答案选A。
11.B
【详解】①卤素原子最外层有7个电子,极易得到电子形成8个电子的稳定结构,所以卤素单质性质很活泼,极容易和其它物质反应,因此卤素只以化合态存在于自然界中,①正确;
②卤素单质形成的都是分子晶体,随着核电荷数的增大,单质由气态→液态→固态,单质的熔沸点升高,②错误;
③从上到下原子半径逐渐增大,原子获得电子的能力逐渐减弱,所以随核电荷数增加,单质氧化性逐渐减弱,③错误;
④从上到下原子半径逐渐增大,原子获得电子的能力逐渐减弱,因此与H原子结合能力逐渐减弱,故随核电荷数增加,气态氢化物稳定性逐渐减弱,④错误;
⑤卤素原子最外层有7个电子,极易得到电子形成8个电子的稳定结构,因此易形成-1价离子,⑤正确;
⑥从上到下原子序数逐渐增大,原子核对核外电子吸引力逐渐减弱,因此原子半径逐渐增大,⑥错误;
⑦由于从上到下原子核外电子层数逐渐增多,原子半径逐渐增大,原子失去电子的能力逐渐增强,获得电子的能力逐渐减弱,所以从上到下元素的非金属性逐渐减弱,⑦正确;
故正确的说法有①⑤⑦,故合理选项是B。
12.D
【详解】A.卤素单质的沸点与其相对分子质量成正比,根据题图知,单质①、②、③、④分别是、、、卤族元素中,元素的非金属性随着原子序数增大而减弱,非金属性越强,其单质越活泼,所以单质活泼性最强的是,选项A正确;
B.氯气和水反应生成次氯酸,次氯酸具有漂白性,所以单质②()能使品红溶液褪色,选项B正确;
C.溴易挥发,在水中的溶解度较小,且密度大于水,所以为防止溴挥发,可以用水液封,选项C正确;
D.元素的非金属性越强,则其气态氢化物的稳定性越强,卤素的非金属性:,则的氢化物稳定性在卤素氢化物中最差,选项D错误。
13.D
【解析】原子序数为53的元素比零族54号元素氙少一个质子,而氙位于第五周期,所以53号元素位于第五周期、第ⅦA族,最外层含有7个电子,属于卤族元素,而卤族元素均是非金属元素,答案选D。
14 A
【解析】A. 对于卤素来说,随着核电荷数的增大,元素的原子半径逐渐增大,得电子能力逐渐减小,非金属性逐渐减弱,A项正确;
B. 卤素原子最外层电子数相同,但由于F的非金属性最强,与其他元素形成化合物时,不可能失去电子,因此F没有最高正化合价,B项错误;
C. 一般情况下,同主族元素形成的化合物结构相似,相对分子质量越大,范德华力就越大,物质的熔、沸点就越高,但HF的分子之间除存在范德华力外,还存在氢键,使其熔、沸点比HCl、HBr的高,C项错误;
D. 卤素单质都是由分子构成的物质,相对分子质量越大,范德华力就越大,物质的熔、沸点就越高,D项错误。答案选A。
15.(1)35
(2) 得 1 氧化
(3) +7 -1
(4)弱
【详解】(1)溴原子的原子的序数为2+8+18+7=35;
(2)溴元素的原子在反应中易得到1个电子转化为8电子稳定结构,表现为氧化性;
(3)最外层电子数是7个,则溴元素的最高化合价+7价,最低化合价为-1价;
(4)同主族自上而下非金属性逐渐减弱,则溴元素的非金属性比氯元素的非金属性弱;
16 【答案】Cl ⅦA 增大。
【解析】
氯的元素符号为Cl,在元素周期表中最外层电子数=主族元素的族序数,根据卤族元素原子的结构示意图,卤族元素最外层都含有7个电子,位于周期表第ⅦA族,从核电荷数依次增大,电子层数依次增多,原子半径依次增大,故答案为:Cl;ⅦA;增大
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
2022-2023学年人教版(2019)化学高一必修一第四章第一节
课时5卤族元素的原子结构与性质练习题
学校:___________姓名:___________班级:___________
一、单选题
1.下列元素属于卤族元素的是( )
A.Li B.N C.Cl D.K
2.卤族元素是最活泼的一族非金属元素,下列关于卤族元素的说法正确的是( )
A.卤素单质的最外层电子数都是7
B.从上到下,卤素原子的电子层数依次增多,原子半径依次减小
C.从到,原子核对最外层电子的吸引能力依次减弱,原子得电子能力依次减弱
D.卤素单质与化合的难易程度由难到易的顺序为、、、
3.氟、氯、溴、碘性质上差异的主要原因是 ( )
A.原子的核电荷数依次增多
B.原子量依次增大
C.原子核外次外层电子数依次增多
D.原子核外电子层数依次增多
4.按、、、的顺序,下列叙述正确的是 ( )
A.单质的颜色逐渐加深 B.单质与水反应的剧烈程度逐渐增强
C.与氢气反应越来越容易 D.单质的熔、沸点逐渐降低
5.下列关于卤族元素的递变规律不正确的是 ( )
A.、、、的氧化性逐渐减弱
B.、、、的热稳定性逐渐减弱
C.、、、的还原性逐渐增强,颜色逐渐变深
D.、、、的密度逐渐增大
6.关于、、、性质的比较,下列说法不正确的是( )
A.酸性: B.还原性:
C.氢化物均易溶于水 D.与氢气反应的剧烈程度:
7.下列关于碘元素(原子序数为53)的放射性同位素的叙述中正确的是( )
A.一个原子中含有131个质子
B.位于元素周期表中第四周期第ⅦA族
C.其氢化物为,比的稳定性弱
D.最高价氧化物对应的水化物为,比的酸性强
8.下列有关卤素的说法错误的是 ( )
A.新制氯水显浅黄绿色,但放置一段时间之后颜色会褪去
B.除外,相对分子质量小的卤素单质可将相对分子质量大的卤素从其盐溶液中置换出来
C.淀粉-碘化钾溶液在空气中变蓝,发生了反应:
D.由、、、的酸性递增的事实,可推出、、、的非金属性递增
9.为比较卤素单质氧化性进行实验:①氯水滴入溴化钠溶液中,溶液变黄;②氯水滴入碘化钾溶液中,溶液变褐色。下列有关分析不合理的是 ( )
A.①中反应: Cl2+ 2Br-=2Cl-+ Br2
B.②中再加入CCl4,振荡、静置,下层溶液为紫红色
C.根据①②得出结论:氧化性Cl2>Br2>I2
D.将②中氯水换成溴水即可得出最后结论
10.下列关于碱金属或卤族元素的叙述正确的是 ( )
A.碱金属单质都可保存在煤油中
B.比活泼,故可以从溶液中置换出
C.砹()是第6周期的卤族元素,根据卤族元素性质的递变规律可知还原性:
D.卤素单质与水反应的通式为
11.下列组合中关于卤素的叙述全部正确的是( )
①卤素只以化合态存在于自然界中 ②随核电荷数增加,单质熔沸点降低
③随核电荷数增加,单质氧化性增强 ④随核电荷数增加,气态氢化物稳定性逐渐增强
⑤易形成-1价离子 ⑥从上到下原子半径逐渐减小
⑦从上到下非金属性逐渐减弱
A.①③⑤ B.①⑤⑦ C.②⑥⑦ D.①②④
12.如图是卤素单质(、、、)的沸点与相对分子质量的关系图,下列说法错误的是 ( )
A.单质①是最活泼的非金属单质
B.单质②能使品红溶液褪色
C.保存少量的单质③时加少量水进行水封
D.单质④的氢化物在卤素氢化物中最稳定
13.关于原子序数为53的元素,以下说法正确的是 ( )
A.位于第六周期 B.是金属元素
C.最外电子层含有6个电子 D.属于卤族元素
14.下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是( )
A. B.
C. D.
二、填空题
15.已知溴原子结构示意图为
(1)溴元素的原子序数为_______。
(2)溴元素的原子在反应中易_______(填“得”或“失”) _______个电子,表现出_______性。
(3)溴元素的最高化合价为_______,最低化合价为_______。
(4)溴元素的非金属性_______(填“强”或“弱”)于氯元素的非金属性。
16.卤族元素的组成及原子结构
元素名称 氟 氯 溴 碘
元素符号 F ________ Br I
原子结构示意图
相同点 ①卤族元素位于周期表第________族;②最外层上都有7个电子
递变性 从核电荷数依次增大,电子层数依次增多,原子半径依次________
参考答案:
1.D
【详解】此粒子为原子,属于17号元素,第三周期VIIA族元素,是氯元素,容易得到1个电子达到稳定结构,故选项D说法不正确,答案选D。
2.C
【详解】A. 卤素原子的最外层电子数都是7,故A错误;
B. 从上到下,卤素原子的电子层数依次增多,原子半径依次增大,故B错误;
C. 从到,原子核对最外层电子的吸引能力依次减弱,原子得电子能力依次减弱,故C正确;
D. 卤素单质与化合的难易程度由易到难的顺序为、、、,故D错误;
故选C。
3.D
【详解】由于氟、氯、溴、碘原子核外最外层电子数相等,电子层数依次增多,原子核对最外层电子数的吸引能力逐渐减弱,导致氟、氯、溴、碘金属性逐渐增强,非金属性逐渐减弱,因此氟、氯、溴、碘性质上差异的主要原因是原子核外电子层数依次增多,故选D。
4.A
【详解】A.、、、单质的颜色分别是浅黄绿色、黄绿色、深红棕色和紫黑色,即颜色逐渐加深,选项A正确;
B.、、、元素的非金属性逐渐减弱,其单质与水反应的剧烈程度逐渐减弱,选项B不正确;
C.、、、元素的非金属性逐渐减弱,其单质与氢气的反应越来越难,选项C不正确;
D.、、、单质在常温常压下分别为气体、气体、液体、固体,它们的熔、沸点逐渐升高,选项D不正确。
答案选A。
5.C
【详解】A.随着原子序数的增大,卤族元素的得电子能力逐渐减弱,、、、的氧化性逐渐减弱,选项A正确;
B.随着原子序数的增大,卤族元素的得电子能力逐渐减弱,所以单质与氢气化合的能力逐渐减弱,、、、的热稳定性逐渐减弱,选项B正确;
C.随着原子序数的增大,卤族元素的得电子能力逐渐减弱,所以对应阴离子的失电子能力逐渐增强,即、、、的还原性逐渐增强,但四种离子均为无色,选项C错误;
D.随着原子序数的增大,卤素单质的密度逐渐增大,选项D正确。
答案选C。
6.B
【详解】A. 因非金属性:,则最高价氧化物对应水化物的酸性:,故A正确;
B. 从,卤族元素的非金属性逐渐减弱,对应氢化物的还原性逐渐增强,故B错误;
C. 卤族元素的氢化物均易溶于水,故C正确;
D. 卤族元素的非金属性随着原子序数增大而减弱,元素的非金属性越强,其单质与氢气反应越剧烈,则与氢气反应的剧烈程度:,故D正确;
故选B。
7.C
【详解】A.为碘元素的一种核素,原子中含有53个质子,质量数为131,选项A错误;
B.位于元素周期表中第五周期第Ⅰ族,选项B错误;
C.同主族元素从上至下,非金属性依次减弱,非金属性越强,对应的气态氢化物的稳定性越强,非金属性:,则气态氢化物的稳定性:,选项C正确;
D.元素的非金属性越强,最高价氧化物对应水化物的酸性越强,则酸性:,选项D错误。
答案选C。
8.D
【详解】A.新制氯水中含较多的氯气,显浅黄绿色,氯水中不稳定,见光易分解,,,则新制氯水放置数天后颜色变浅,选项A正确;
B.卤族元素从上到下,单质的氧化性逐渐增强,除外,相对分子质量小的卤素单质可将相对分子质量大的卤素从其盐溶液中置换出来,选项B正确;
C.淀粉-碘化钾溶液在空气中变蓝,是因为碘离子被氧气氧化成碘单质,反应的离子方程式为,选项C正确;
D.元素的非金属性越强,最高价氧化物对应水化物的酸性越强,不能根据氢化物的酸性强弱判断元素的非金属性,选项D错误。
答案选D。
9.C
【详解】A. 氯水滴入溴化钠溶液中,溶液变黄,说明有单质溴生成,则①中反应为Cl2+2Br-=2Cl-+Br2,A正确;
B. 氯水滴入碘化钾溶液中,溶液变褐色,说明有单质碘生成,则②中再加入CCl4,振荡、静置,下层溶液为紫红色,B正确;
C. 根据①②得出结论是氧化性氯气强于溴和碘,但不能得出溴强于碘的结论,C错误;
D. 要验证溴的氧化性强于碘,只需要将②中氯水换成溴水即可得出最后结论,D正确;
答案选C。
10.A
【详解】常温下氯酸钾与浓盐酸反应放出 Cl2 , Cl2 的颜色是黄绿色,①处充满黄绿色的 Cl2 ;
Cl2 进入玻璃管后与②处 NaBr 溶液发生置换反应生成 Br2 ,溴的水溶液颜色为橙色,所以②处的白色棉球变为橙色;
Cl2 和③处 KI 溶液反应置换出 I2 ,淀粉溶液遇 I2 变蓝,③处棉球变为蓝色;
④处 Cl2 与 NaOH 溶液反应生成 NaCl 、 NaClO ,棉球本身是白色的,所以④处的颜色为白色;
故①②③④的颜色分别为:黄绿色;橙色;蓝色;白色;答案选A。
11.B
【详解】①卤素原子最外层有7个电子,极易得到电子形成8个电子的稳定结构,所以卤素单质性质很活泼,极容易和其它物质反应,因此卤素只以化合态存在于自然界中,①正确;
②卤素单质形成的都是分子晶体,随着核电荷数的增大,单质由气态→液态→固态,单质的熔沸点升高,②错误;
③从上到下原子半径逐渐增大,原子获得电子的能力逐渐减弱,所以随核电荷数增加,单质氧化性逐渐减弱,③错误;
④从上到下原子半径逐渐增大,原子获得电子的能力逐渐减弱,因此与H原子结合能力逐渐减弱,故随核电荷数增加,气态氢化物稳定性逐渐减弱,④错误;
⑤卤素原子最外层有7个电子,极易得到电子形成8个电子的稳定结构,因此易形成-1价离子,⑤正确;
⑥从上到下原子序数逐渐增大,原子核对核外电子吸引力逐渐减弱,因此原子半径逐渐增大,⑥错误;
⑦由于从上到下原子核外电子层数逐渐增多,原子半径逐渐增大,原子失去电子的能力逐渐增强,获得电子的能力逐渐减弱,所以从上到下元素的非金属性逐渐减弱,⑦正确;
故正确的说法有①⑤⑦,故合理选项是B。
12.D
【详解】A.卤素单质的沸点与其相对分子质量成正比,根据题图知,单质①、②、③、④分别是、、、卤族元素中,元素的非金属性随着原子序数增大而减弱,非金属性越强,其单质越活泼,所以单质活泼性最强的是,选项A正确;
B.氯气和水反应生成次氯酸,次氯酸具有漂白性,所以单质②()能使品红溶液褪色,选项B正确;
C.溴易挥发,在水中的溶解度较小,且密度大于水,所以为防止溴挥发,可以用水液封,选项C正确;
D.元素的非金属性越强,则其气态氢化物的稳定性越强,卤素的非金属性:,则的氢化物稳定性在卤素氢化物中最差,选项D错误。
13.D
【解析】原子序数为53的元素比零族54号元素氙少一个质子,而氙位于第五周期,所以53号元素位于第五周期、第ⅦA族,最外层含有7个电子,属于卤族元素,而卤族元素均是非金属元素,答案选D。
14 A
【解析】A. 对于卤素来说,随着核电荷数的增大,元素的原子半径逐渐增大,得电子能力逐渐减小,非金属性逐渐减弱,A项正确;
B. 卤素原子最外层电子数相同,但由于F的非金属性最强,与其他元素形成化合物时,不可能失去电子,因此F没有最高正化合价,B项错误;
C. 一般情况下,同主族元素形成的化合物结构相似,相对分子质量越大,范德华力就越大,物质的熔、沸点就越高,但HF的分子之间除存在范德华力外,还存在氢键,使其熔、沸点比HCl、HBr的高,C项错误;
D. 卤素单质都是由分子构成的物质,相对分子质量越大,范德华力就越大,物质的熔、沸点就越高,D项错误。答案选A。
15.(1)35
(2) 得 1 氧化
(3) +7 -1
(4)弱
【详解】(1)溴原子的原子的序数为2+8+18+7=35;
(2)溴元素的原子在反应中易得到1个电子转化为8电子稳定结构,表现为氧化性;
(3)最外层电子数是7个,则溴元素的最高化合价+7价,最低化合价为-1价;
(4)同主族自上而下非金属性逐渐减弱,则溴元素的非金属性比氯元素的非金属性弱;
16 【答案】Cl ⅦA 增大。
【解析】
氯的元素符号为Cl,在元素周期表中最外层电子数=主族元素的族序数,根据卤族元素原子的结构示意图,卤族元素最外层都含有7个电子,位于周期表第ⅦA族,从核电荷数依次增大,电子层数依次增多,原子半径依次增大,故答案为:Cl;ⅦA;增大
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
