华师大版八年级上册科学第六章02构成物质的微粒2(课件 31 PPT)
文档属性
| 名称 | 华师大版八年级上册科学第六章02构成物质的微粒2(课件 31 PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 22.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-12-19 12:28:34 | ||
图片预览





文档简介
(共31张PPT)
构成物质的微粒
第二课时
第六章 物质的构成
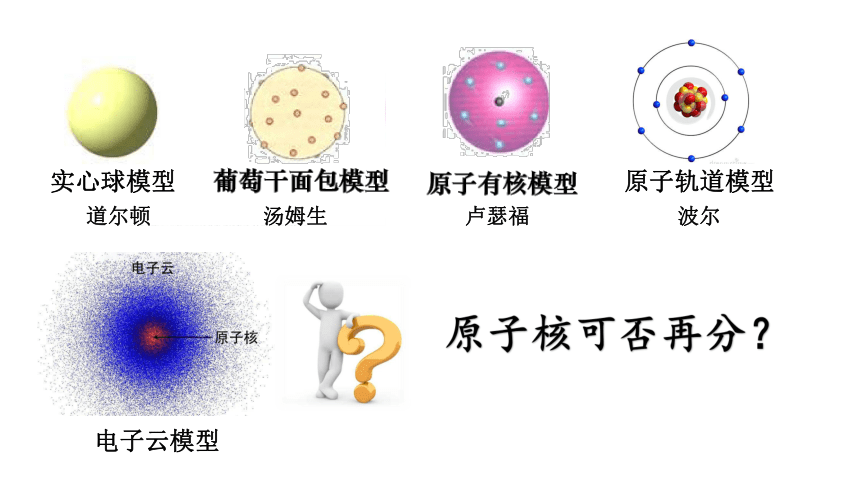
人类对原子的认知过程
实心球模型
道尔顿
汤姆生
卢瑟福
原子是组成物质的最小单位,原子是一个实心球体,不可再分
研究低压气体的放电现象时发现了电子,电子普遍存在于原子之中,原子由更小的微粒构成。
α粒子散射实验,
原子是由带正电荷的原子核和带负电荷的核外电子构成的。电子在原子核外空间绕核做高速运动。
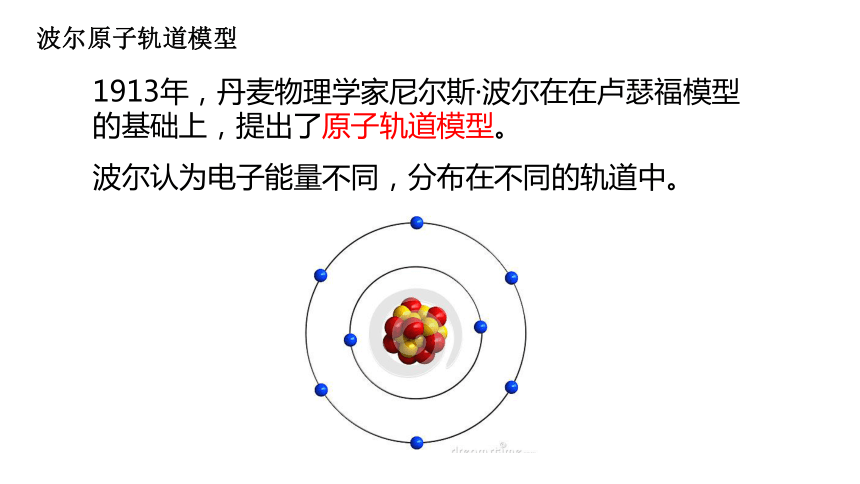
波尔原子轨道模型
1913年,丹麦物理学家尼尔斯·波尔在在卢瑟福模型的基础上,提出了原子轨道模型。
波尔认为电子能量不同,分布在不同的轨道中。
电子云模型(1927年—1935年)
电子云模型中的电子在原子核外很小的空间内做高速运动,其运行没有固定的规律,接近近代人类对原子结构的认识。
实心球模型
道尔顿
汤姆生
卢瑟福
原子轨道模型
波尔
电子云模型
原子核可否再分?
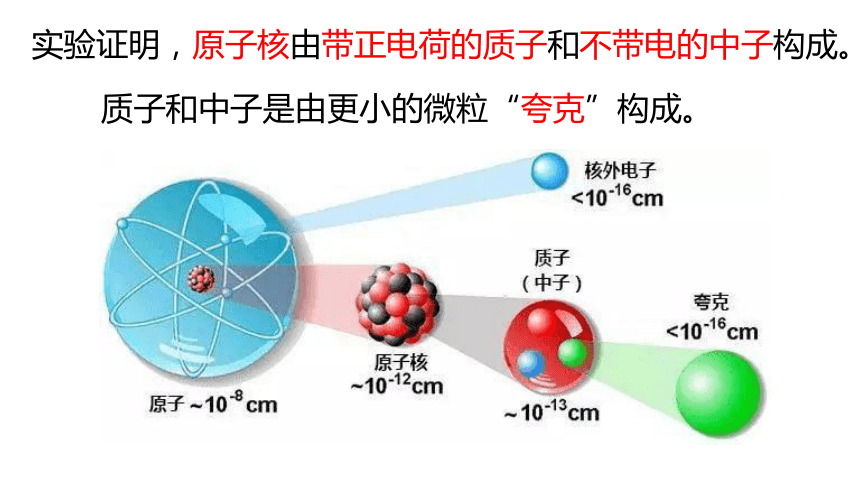
实验证明,原子核由带正电荷的质子和不带电的中子构成。
质子和中子是由更小的微粒“夸克”构成。
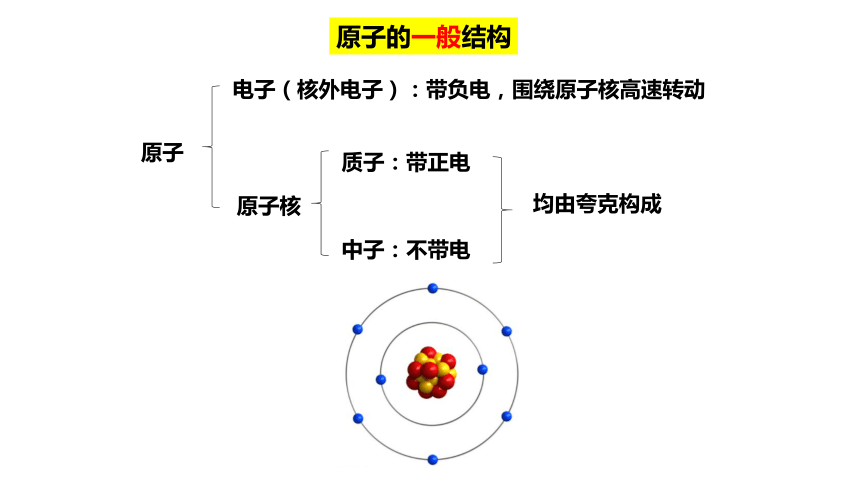
原子的一般结构
原子
电子(核外电子):带负电,围绕原子核高速转动
原子核
质子:带正电
中子:不带电
均由夸克构成
思考:
①核外电子数带负电,质子数带正电,那原子整体带电吗?
②核电荷数指的是原子核所带的正电荷数,原子的核电荷数
与质子数相等吗?
在原子中,存在以下等量关系
原子内核外电子数=质子数,因此原子整体不带电(不显电性)
原子核是由质子和中子构成的,质子带正电荷,中子不带电,
因此核电荷数=质子数
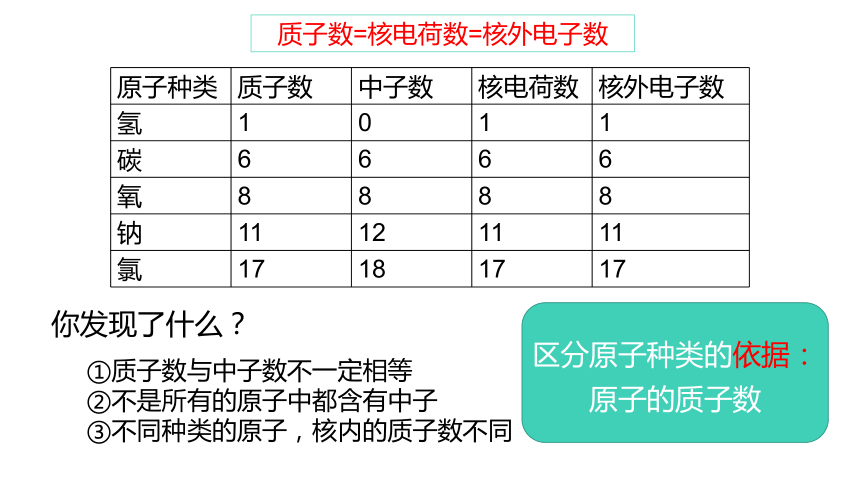
质子数=核电荷数=核外电子数
原子种类 质子数 中子数 核电荷数 核外电子数
氢 1 0 1 1
碳 6 6 6 6
氧 8 8 8 8
钠 11 12 11 11
氯 17 18 17 17
质子数=核电荷数=核外电子数
你发现了什么?
①质子数与中子数不一定相等
②不是所有的原子中都含有中子
③不同种类的原子,核内的质子数不同
区分原子种类的依据:
原子的质子数
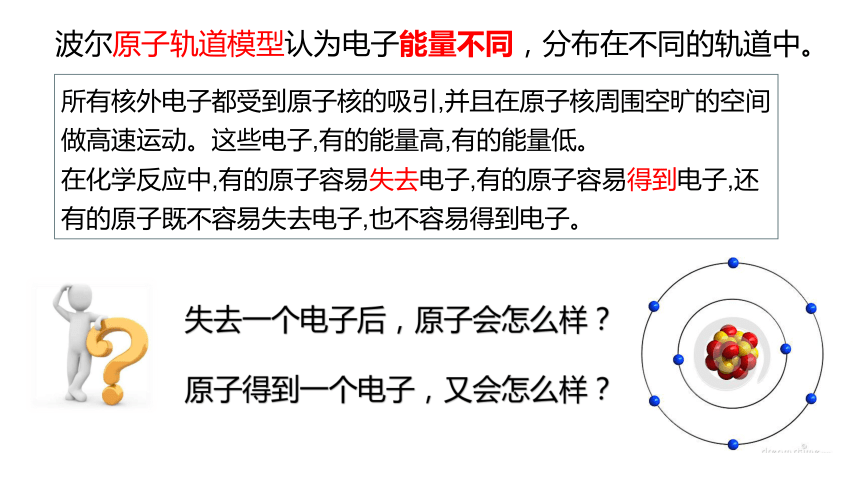
波尔原子轨道模型认为电子能量不同,分布在不同的轨道中。
所有核外电子都受到原子核的吸引,并且在原子核周围空旷的空间做高速运动。这些电子,有的能量高,有的能量低。
在化学反应中,有的原子容易失去电子,有的原子容易得到电子,还有的原子既不容易失去电子,也不容易得到电子。
失去一个电子后,原子会怎么样?
原子得到一个电子,又会怎么样?
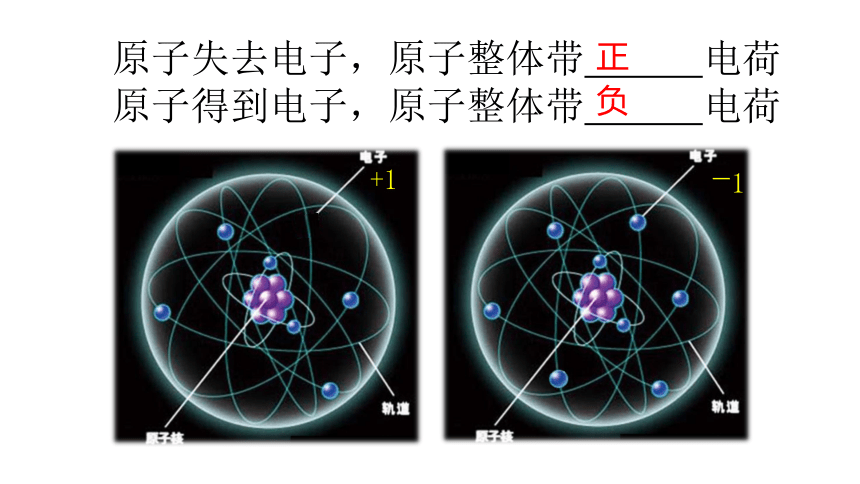
原子失去电子,原子整体带 电荷
原子得到电子,原子整体带 电荷
正
+1
-1
负
三、离子
带电荷的原子或原子团 ——离子
在一定条件下,原子可以失去或者得到电子,成为带电荷的离子。
举例:
食盐的主要成分——氯化钠,既不是原子构成的,也不是分子构成的,而是由大量的钠离子和大量的氯离子相互吸引,聚集在一起形成的。
金属钠在氯气中燃烧(一定条件),
氯原子会从钠原子中夺取一个电子成为带一个单位 (电子的
电荷量)负电荷的氯离子,
钠原子因失去一个电子成为带一个单位正电荷的钠离子
带有相反电荷的钠离子与氯离子因静电相互作用聚集在一起,构成食盐的主要成分——氯化钠。
氯原子
钠原子
一个电子
氯离子(带负电)
钠离子(带正电)
离子也是构成物质的一种微粒
氯化钠、氯化钾等盐类物质都是由离子构成的。
带正电荷的离子(失去电子后的原子)称为阳离子,
带负电荷的离子(得到电子后的原子)称为阴离子。
原子
分子、原子、离子的关系
构成
分子
分解
阳离子
失电子
阴离子
得电子
失电子
得电子
分子、原子、离子都能构成物质
分子、原子、离子是怎么构成物质的?
生活中有哪些现象能体现出物体的微观组成?
扩散现象
不同物质相互接触,彼此进入对方现象。
思考
1.固体有扩散现象吗?
2.扩散现象说明了什么?
扩散现象说明分子、原子与离子都在 。
金块
铅块
五年后
金块
铅块
彼此扩散一毫米
不断运动
3.分子、原子与离子的运动有规律吗?
分子、原子与离子的运动是无规则运动。
4.温度对扩散现象会有什么影响?
物体温度越高,
分子无规则运动越快。
进一步思考,物体间为什么会发生扩散现象?
结论:分子间有间隙。
分子间有间隙的其他表现:物体热胀冷缩。
物体热胀冷缩是因为温度越高分子间隙越大,温度越低分子间隙越小(分子大小不变)。
气球
气体分子
受热
再进一步思考,物体内部分子在不停地运动,为什么固体和液体中分子不会飞散开,总是聚合在一起?
结论:分子间存在引力
更深入的思考,
分子间有引力,为什么分子间还有间隙?
分子间有间隙,固体液体为什么很难被压缩?
分子间同时存在引力和斥力,它们随分子距离变化而变化。
r=r0
引力=斥力
r引力<斥力
r>r0
引力>斥力
r>10r0
无作用力
r0≈10-10m
分子间同时存在引力和斥力
物质的微粒模型
观点②:分子、原子、离子的质量很小,体积很小
观点③:微粒之间有一定的空隙,并有相互作用力
(存在引力和斥力)
观点④:微粒在不断进行无规则运动
观点①:物质由微粒(分子、原子、离子)构成
物质的微粒模型应用——水的三态变化
为什么水没有固定形状,而冰可以有固定形状?
固态冰中的水分子相互作用力较强,它们按一定的次序整齐地排列,水分子只能固定位置上振动。随着温度升高,水分子吸收能量,运动加剧,
分子间相互作用力减弱。
0℃ 时,冰开始熔化成水。冰熔化时需要吸收能量,用于破坏冰的整齐排列的结构。
随着温度的升高,水分子运动更加剧烈,分子之间的空隙更大,分子之间的作用力更弱,水成为水蒸气。
熔化
凝固
汽化
液化
注:为简化图片,图中
一个蓝圆表示一个水分子
物态变化的微观实质:微粒间距变化的过程
1.下列说法错误的是( )
A.原子不显电性
B.在化学变化中能否再分是原子和分子的本质区别
C.原子的质量主要集中在原子核上
D.所有原子的原子核都含有中子和质子
D
2.20世纪初,科学家先后提出了如图①②③所示的三种原子模型,依照提出时
间的先后顺序排列正确的是( )
A.①②③ B.③②①
C.②③① D.①③②
D
练习
3.知识梳理有助于我们对已学知识进行巩固,如图所示,某同学学习物质结构
层次后以氧气为例进行了梳理,下列选项中与a、b、c相对应的是( )
A.原子、原子核、核外电子
B.原子核、原子、核外电子
C.原子、核外电子、原子核
D.核外电子、原子核、原子
A
练习
4.下列有关分子、原子和离子的说法正确的是( )
A.分子是保持物质性质的一种粒子
B.分子很小,所以没有质量
C.分子、原子、离子都可以构成物质
D.在化学反应中,分子可以再分,原子也可以再分
C
5.物质在一定条件下会发生三态变化,这主要是由于( )
A.分子的大小发生了变化
B.分子之间的空隙发生了变化
C.分子的质量发生了变化
D.分子从静止状态变为运动状态
B
练习
6.下列现象用分子的观点解释错误的是( )
A.烧开水时壶盖被顶起说明分子的体积变大
B.破镜不能重圆说明分子间互相作用的引力和斥力几乎为零
C.10mL酒精和10mL水混合后体积小于20mL说明分子间有间隙
D.白糖在水中溶解不见了,是因为糖分子运动到水分子间隔中了
A
练习
7.固态碘受热后会变成紫红色的碘蒸气,无论是固态碘还是碘蒸气都能使切开
的土豆变成蓝色,这说明( )
A.分子在不停地运动 B.分子间有一定的空隙
C.分子有一定的大小 D.同种分子化学性质相同
D
A
练习
构成物质的微粒
第二课时
第六章 物质的构成
人类对原子的认知过程
实心球模型
道尔顿
汤姆生
卢瑟福
原子是组成物质的最小单位,原子是一个实心球体,不可再分
研究低压气体的放电现象时发现了电子,电子普遍存在于原子之中,原子由更小的微粒构成。
α粒子散射实验,
原子是由带正电荷的原子核和带负电荷的核外电子构成的。电子在原子核外空间绕核做高速运动。
波尔原子轨道模型
1913年,丹麦物理学家尼尔斯·波尔在在卢瑟福模型的基础上,提出了原子轨道模型。
波尔认为电子能量不同,分布在不同的轨道中。
电子云模型(1927年—1935年)
电子云模型中的电子在原子核外很小的空间内做高速运动,其运行没有固定的规律,接近近代人类对原子结构的认识。
实心球模型
道尔顿
汤姆生
卢瑟福
原子轨道模型
波尔
电子云模型
原子核可否再分?
实验证明,原子核由带正电荷的质子和不带电的中子构成。
质子和中子是由更小的微粒“夸克”构成。
原子的一般结构
原子
电子(核外电子):带负电,围绕原子核高速转动
原子核
质子:带正电
中子:不带电
均由夸克构成
思考:
①核外电子数带负电,质子数带正电,那原子整体带电吗?
②核电荷数指的是原子核所带的正电荷数,原子的核电荷数
与质子数相等吗?
在原子中,存在以下等量关系
原子内核外电子数=质子数,因此原子整体不带电(不显电性)
原子核是由质子和中子构成的,质子带正电荷,中子不带电,
因此核电荷数=质子数
质子数=核电荷数=核外电子数
原子种类 质子数 中子数 核电荷数 核外电子数
氢 1 0 1 1
碳 6 6 6 6
氧 8 8 8 8
钠 11 12 11 11
氯 17 18 17 17
质子数=核电荷数=核外电子数
你发现了什么?
①质子数与中子数不一定相等
②不是所有的原子中都含有中子
③不同种类的原子,核内的质子数不同
区分原子种类的依据:
原子的质子数
波尔原子轨道模型认为电子能量不同,分布在不同的轨道中。
所有核外电子都受到原子核的吸引,并且在原子核周围空旷的空间做高速运动。这些电子,有的能量高,有的能量低。
在化学反应中,有的原子容易失去电子,有的原子容易得到电子,还有的原子既不容易失去电子,也不容易得到电子。
失去一个电子后,原子会怎么样?
原子得到一个电子,又会怎么样?
原子失去电子,原子整体带 电荷
原子得到电子,原子整体带 电荷
正
+1
-1
负
三、离子
带电荷的原子或原子团 ——离子
在一定条件下,原子可以失去或者得到电子,成为带电荷的离子。
举例:
食盐的主要成分——氯化钠,既不是原子构成的,也不是分子构成的,而是由大量的钠离子和大量的氯离子相互吸引,聚集在一起形成的。
金属钠在氯气中燃烧(一定条件),
氯原子会从钠原子中夺取一个电子成为带一个单位 (电子的
电荷量)负电荷的氯离子,
钠原子因失去一个电子成为带一个单位正电荷的钠离子
带有相反电荷的钠离子与氯离子因静电相互作用聚集在一起,构成食盐的主要成分——氯化钠。
氯原子
钠原子
一个电子
氯离子(带负电)
钠离子(带正电)
离子也是构成物质的一种微粒
氯化钠、氯化钾等盐类物质都是由离子构成的。
带正电荷的离子(失去电子后的原子)称为阳离子,
带负电荷的离子(得到电子后的原子)称为阴离子。
原子
分子、原子、离子的关系
构成
分子
分解
阳离子
失电子
阴离子
得电子
失电子
得电子
分子、原子、离子都能构成物质
分子、原子、离子是怎么构成物质的?
生活中有哪些现象能体现出物体的微观组成?
扩散现象
不同物质相互接触,彼此进入对方现象。
思考
1.固体有扩散现象吗?
2.扩散现象说明了什么?
扩散现象说明分子、原子与离子都在 。
金块
铅块
五年后
金块
铅块
彼此扩散一毫米
不断运动
3.分子、原子与离子的运动有规律吗?
分子、原子与离子的运动是无规则运动。
4.温度对扩散现象会有什么影响?
物体温度越高,
分子无规则运动越快。
进一步思考,物体间为什么会发生扩散现象?
结论:分子间有间隙。
分子间有间隙的其他表现:物体热胀冷缩。
物体热胀冷缩是因为温度越高分子间隙越大,温度越低分子间隙越小(分子大小不变)。
气球
气体分子
受热
再进一步思考,物体内部分子在不停地运动,为什么固体和液体中分子不会飞散开,总是聚合在一起?
结论:分子间存在引力
更深入的思考,
分子间有引力,为什么分子间还有间隙?
分子间有间隙,固体液体为什么很难被压缩?
分子间同时存在引力和斥力,它们随分子距离变化而变化。
r=r0
引力=斥力
r
r>r0
引力>斥力
r>10r0
无作用力
r0≈10-10m
分子间同时存在引力和斥力
物质的微粒模型
观点②:分子、原子、离子的质量很小,体积很小
观点③:微粒之间有一定的空隙,并有相互作用力
(存在引力和斥力)
观点④:微粒在不断进行无规则运动
观点①:物质由微粒(分子、原子、离子)构成
物质的微粒模型应用——水的三态变化
为什么水没有固定形状,而冰可以有固定形状?
固态冰中的水分子相互作用力较强,它们按一定的次序整齐地排列,水分子只能固定位置上振动。随着温度升高,水分子吸收能量,运动加剧,
分子间相互作用力减弱。
0℃ 时,冰开始熔化成水。冰熔化时需要吸收能量,用于破坏冰的整齐排列的结构。
随着温度的升高,水分子运动更加剧烈,分子之间的空隙更大,分子之间的作用力更弱,水成为水蒸气。
熔化
凝固
汽化
液化
注:为简化图片,图中
一个蓝圆表示一个水分子
物态变化的微观实质:微粒间距变化的过程
1.下列说法错误的是( )
A.原子不显电性
B.在化学变化中能否再分是原子和分子的本质区别
C.原子的质量主要集中在原子核上
D.所有原子的原子核都含有中子和质子
D
2.20世纪初,科学家先后提出了如图①②③所示的三种原子模型,依照提出时
间的先后顺序排列正确的是( )
A.①②③ B.③②①
C.②③① D.①③②
D
练习
3.知识梳理有助于我们对已学知识进行巩固,如图所示,某同学学习物质结构
层次后以氧气为例进行了梳理,下列选项中与a、b、c相对应的是( )
A.原子、原子核、核外电子
B.原子核、原子、核外电子
C.原子、核外电子、原子核
D.核外电子、原子核、原子
A
练习
4.下列有关分子、原子和离子的说法正确的是( )
A.分子是保持物质性质的一种粒子
B.分子很小,所以没有质量
C.分子、原子、离子都可以构成物质
D.在化学反应中,分子可以再分,原子也可以再分
C
5.物质在一定条件下会发生三态变化,这主要是由于( )
A.分子的大小发生了变化
B.分子之间的空隙发生了变化
C.分子的质量发生了变化
D.分子从静止状态变为运动状态
B
练习
6.下列现象用分子的观点解释错误的是( )
A.烧开水时壶盖被顶起说明分子的体积变大
B.破镜不能重圆说明分子间互相作用的引力和斥力几乎为零
C.10mL酒精和10mL水混合后体积小于20mL说明分子间有间隙
D.白糖在水中溶解不见了,是因为糖分子运动到水分子间隔中了
A
练习
7.固态碘受热后会变成紫红色的碘蒸气,无论是固态碘还是碘蒸气都能使切开
的土豆变成蓝色,这说明( )
A.分子在不停地运动 B.分子间有一定的空隙
C.分子有一定的大小 D.同种分子化学性质相同
D
A
练习
同课章节目录
- 第1章 运动和力
- 1 机械运动
- 2 力
- 3 几种常见的力
- 4 运动和力
- 5 二力平衡的条件
- 第2章 压力 压强
- 1 压强
- 2 液体内部的压强
- 3 大气压强
- 4 流体的压强与流速的关系
- 第3章 浮力
- 1 密度
- 2 浮力
- 3 阿基米德原理
- 4 物体浮沉条件及其应用
- 第4章 植物的物质和能量的转化
- 1 绿色开花植物的营养器官
- 2 水在植物体中的代谢
- 3 无机盐在植物体内的代谢
- 4 植物的光合作用和呼吸作用
- 第5章 人体的物质和能量的转化
- 1 食物的消化和吸收
- 2 人体的呼吸
- 3 人体内的物质运输
- 4 人体的排泄
- 5 人体生命活动过程中物质和能量的转化
- 第6章 物质的构成
- 1 构成物质的微粒
- 2 元素
- 3 物质的分类
- 4 化学式
- 5 固态物质
