化学人教版(2019)选择性必修1 4.3 金属的腐蚀与防护(共23张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 4.3 金属的腐蚀与防护(共23张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-17 12:45:38 | ||
图片预览




文档简介
(共23张PPT)
第三节 金属的腐蚀与防护
第四章 化学反应与电能
一.金属的腐蚀
1.金属腐蚀含义
金属或合金与周围的气体或液体物质发生氧化还原反应而引起损耗的现象。
2.实质
金属失电子变成阳离子,被氧化,其反应为:M - ne- === Mn+
如:Fe - 2e- === Fe2+(铁发生腐蚀时,产物是Fe2+)
3.类型
化学腐蚀
电化学腐蚀
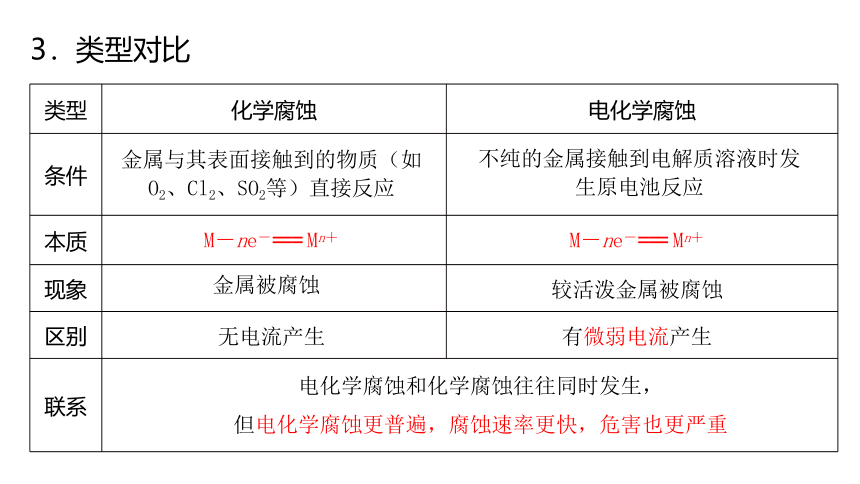
3.类型对比
类型 化学腐蚀 电化学腐蚀
条件
本质
现象
区别
联系
金属与其表面接触到的物质(如O2、Cl2、SO2等)直接反应
不纯的金属接触到电解质溶液时发生原电池反应
M-ne-=== Mn+
M-ne-=== Mn+
金属被腐蚀
较活泼金属被腐蚀
无电流产生
有微弱电流产生
电化学腐蚀和化学腐蚀往往同时发生,
但电化学腐蚀更普遍,腐蚀速率更快,危害也更严重
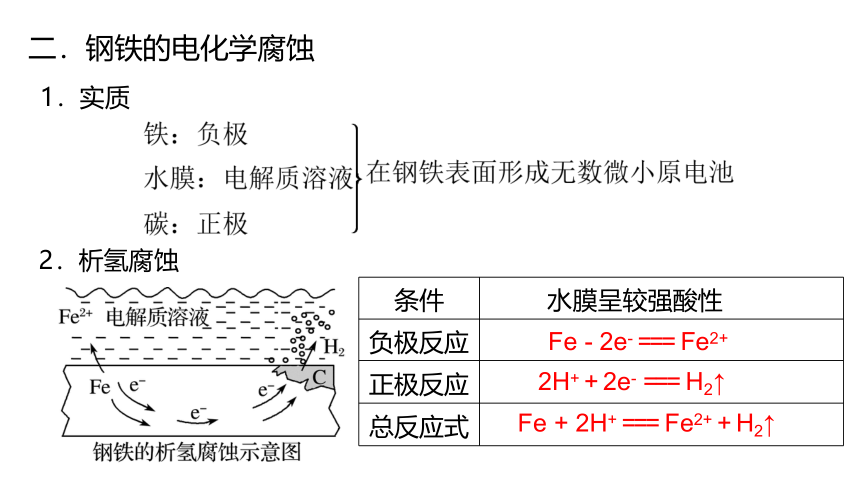
二.钢铁的电化学腐蚀
1.实质
2.析氢腐蚀
条件 水膜呈较强酸性
负极反应
正极反应
总反应式
Fe - 2e- === Fe2+
2H+ + 2e- === H2↑
Fe + 2H+ === Fe2+ + H2↑
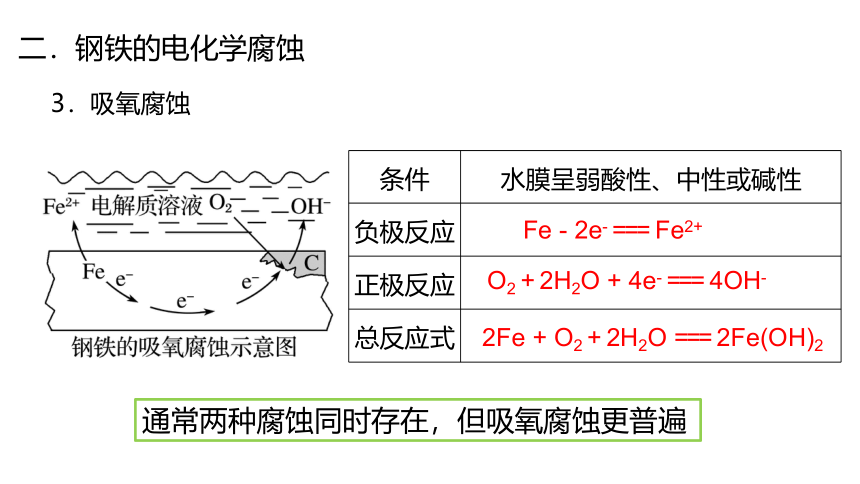
二.钢铁的电化学腐蚀
3.吸氧腐蚀
条件 水膜呈弱酸性、中性或碱性
负极反应
正极反应
总反应式
Fe - 2e- === Fe2+
O2 + 2H2O + 4e- === 4OH-
2Fe + O2 + 2H2O === 2Fe(OH)2
通常两种腐蚀同时存在,但吸氧腐蚀更普遍
Fe2+ + 2OH- === Fe(OH)2↓
4Fe(OH)2 + 2H2O + O2 === 4Fe(OH)3
2Fe(OH)3 === Fe2O3·xH2O + (3﹣x)H2O
二.钢铁的电化学腐蚀
4.铁锈的形成
铁锈的主要成分
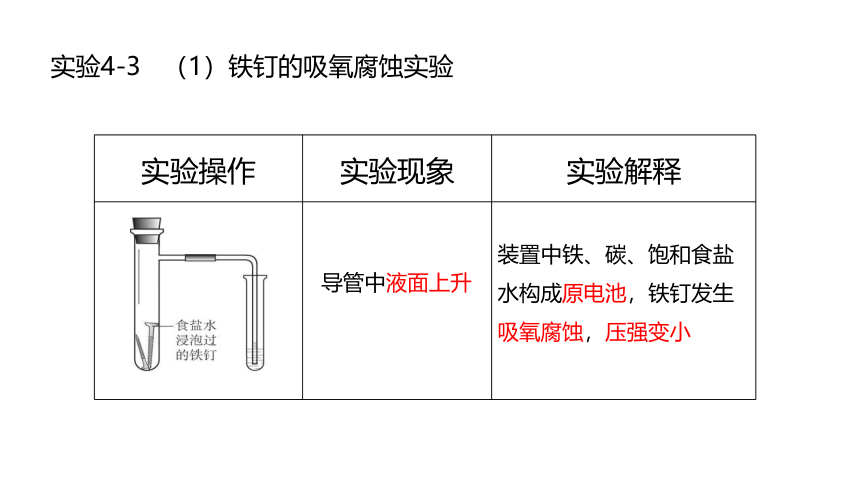
实验操作 实验现象 实验解释
导管中液面上升
装置中铁、碳、饱和食盐水构成原电池,铁钉发生吸氧腐蚀,压强变小
实验4-3 (1)铁钉的吸氧腐蚀实验
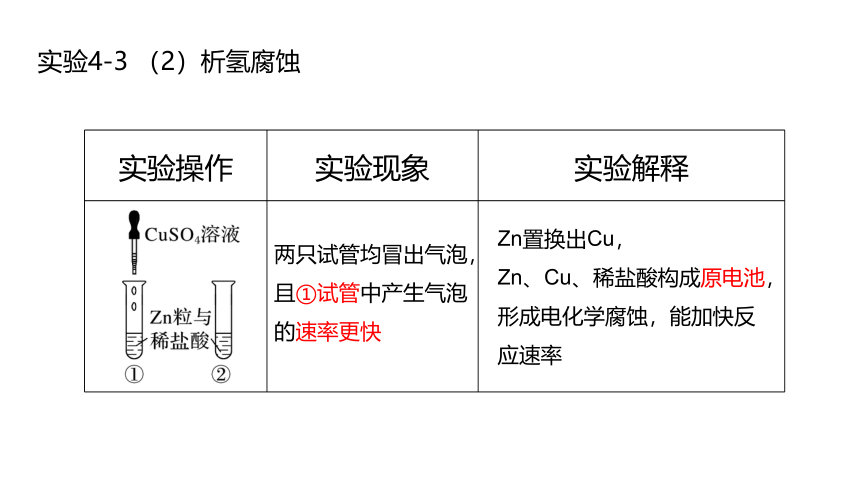
实验4-3 (2)析氢腐蚀
实验操作 实验现象 实验解释
两只试管均冒出气泡,且①试管中产生气泡的速率更快
Zn置换出Cu,
Zn、Cu、稀盐酸构成原电池,形成电化学腐蚀,能加快反应速率
请解释下列有关铁生锈现象的原因。
1.相对于在内河行驶的轮船来说,海轮更容易被腐蚀。
因为海水中含有较多的氯化钠等盐类,导电能力比内河的水更强,而在电解质溶液中,电化学腐蚀更容易进行。
2. 1910年遗留在南极的食品罐头,其表面至今很少有铁锈出现。
由于南极的温度常年在0℃以下,说明在较高温度下,腐蚀更易进行。
3.用于连接铜板的铁螺丝容易生锈。
由于铁与铜及空气中的水蒸汽构成了原电池,铁作原电池的负极,因此铁易被腐蚀而生锈。
1、改变金属材料的组成
如:含铬、镍等合金元素的不锈钢具有很好的抗腐蚀性能。
在金属中添加其他金属或非金属可以制成性能优异的合金。
钛合金
抗腐蚀性,生物相容性
不锈钢
三.金属的防护
2、在金属表面覆盖保护层
在金属表面覆盖致密的保护层,将金属制品与周围物质隔开。
表面喷涂油漆、矿物性油脂或覆盖搪瓷、塑料等
电镀:表面镀上一层锌、锡、铬、镍等
化学方法:生成致密的四氧化三铁薄膜
阳极氧化:使铝制品表面形成致密的氧化膜
非金属保护层
金属保护层
发蓝处理
钝化处理
三.金属的防护
3、电化学保护法
(1)牺牲阳极法
负极 :
正极 :
应用 :
锅炉内壁、船舶外壳安装镁合金或锌块
原理:
原电池原理
被保护的金属
更活泼金属
三.金属的防护
实验装置
现象
有关反应
电流表
阳极
阴极
指针偏转
逐渐溶解
质量不变;加入铁氰化钾溶液,无现象
Zn-2e-=Zn2+
O2+4e-+4H+=2H2O
——
Fe、Zn和经过酸化的NaCl溶液构成原电池;该装置中铁未被腐蚀
结论:
Fe2+检验:Fe2+与K3[Fe(CN)6] (黄色)反应生成KFe[Fe(CN)6]沉淀(带有特征蓝色)。
实验4-4 牺牲阳极法实验(1)
实验装置
现象
解释
(a)
(b)
靠近锌皮处颜色无变化,
靠近裸露的铁钉处出现红色
靠近铜丝处出现红色,
靠近裸露的铁钉处出现蓝色
构成原电池:
Zn作阳极(负极):被腐蚀
Zn-2e- =Zn2+
铁作阴极(正极):铁被保护
O2+2H2O+4e-=4OH-
构成原电池:
铁作阳极(负极):被腐蚀
Fe-2e- =Fe2+
铜作阴极(正极)
O2+2H2O+4e-=4OH-
实验4-4 牺牲阳极法实验(2)
调整外加电压,强制电子流向被保护的钢铁设备,使钢铁表面腐蚀电流降至零或接近零。
阴极 :
阳极 :
应用 :
钢铁闸门,地下管道连接电源负极
原理:
电解池原理
被保护的金属
辅助电极(不溶性)
3、电化学保护法
(2)外加电流法
三.金属的防护
思考与讨论
1、牺牲阳极法、外加电流法都要采用辅助阳极,两种方法中辅助阳极发生的反应类型是否相同?
牺牲阳极法:辅助阳极金属材料活动性必须比被保护的金属的活动性要强。
相同,都是发生氧化反应。
2、对于用作辅助阳极的金属的化学性质各有什么要求?
外加电流法:辅助阳极只起导电作用,惰性电解和金属均可作辅助阳极,但最好选用惰性电极。
四.金属腐蚀快慢的比较
同一金属在相同电解质溶液中,腐蚀快慢如下:
(1)对同一种金属来说,腐蚀的快慢:
强电解质溶液>弱电解质溶液>非电解质溶液。
(2)活动性不同的两金属:
活动性差别越大,活动性强的金属腐蚀越快。
(3)对同一种电解质溶液来说:
溶液浓度越大,腐蚀越快,且氧化剂浓度越高,氧化性越强,腐蚀越快。
(4)不同原理引起的腐蚀的速率:
电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。
(5)从防腐措施方面分析腐蚀的快慢:
外加电流的保护法防腐<牺牲阳极的保护法防腐<有一般防护条件的防腐<无防护条件的防腐。
金属的腐蚀与防护
金属的腐蚀
金属的防护
化学腐蚀
金属表面覆盖保护层
电化学腐蚀
改变金属材料的组成
电化学保护法
1)牺牲阳极法
2)外加电流法
1)析氢腐蚀
2)吸氧腐蚀
课堂小结
1.金属的腐蚀与防护无处不在,下列说法错误的是 ( )
A.纯铁在潮湿空气中不易被腐蚀
B.一次性保暖贴是利用电化学腐蚀提供热量
C.地下钢管与电源正极连接采用的是外加电流的阴极保护法
D.铺设在隧道中的钢轨每隔一根轨枕系一块锌片,采用的是牺牲阳极的阴极保护法
C
课堂练习
2.装置中的纯锌棒都浸在相同浓度的稀硫酸中,锌棒腐蚀速度从快到慢的顺序是
A.③④②① B.②③①④ C.④②①③ D.③②①④
【答案】D
3.如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和盐酸,各加入生铁块,放置一段时间。下列有关描述错误的是
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是Fe-2e-=Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
【答案】B
4.从古至今化学均与生活、生产密切相关,化学工业在各国的国民经济中占有重要地位,是许多国家的基础产业和支柱产业。下列有关说法错误的是
A.战国曾侯乙编钟属于青铜制品,青铜是一种合金
B.敦煌莫高窟壁画中绿色颜料铜绿的主要成分是碳酸铜
C.港珠澳大桥水下钢柱镶铝块防腐的方法为牺牲阳极的阴极保护法
D.大兴机场的隔震支座由橡胶和钢板相互叠加黏结而成,不属于新型无机材料
【答案】B
第三节 金属的腐蚀与防护
第四章 化学反应与电能
一.金属的腐蚀
1.金属腐蚀含义
金属或合金与周围的气体或液体物质发生氧化还原反应而引起损耗的现象。
2.实质
金属失电子变成阳离子,被氧化,其反应为:M - ne- === Mn+
如:Fe - 2e- === Fe2+(铁发生腐蚀时,产物是Fe2+)
3.类型
化学腐蚀
电化学腐蚀
3.类型对比
类型 化学腐蚀 电化学腐蚀
条件
本质
现象
区别
联系
金属与其表面接触到的物质(如O2、Cl2、SO2等)直接反应
不纯的金属接触到电解质溶液时发生原电池反应
M-ne-=== Mn+
M-ne-=== Mn+
金属被腐蚀
较活泼金属被腐蚀
无电流产生
有微弱电流产生
电化学腐蚀和化学腐蚀往往同时发生,
但电化学腐蚀更普遍,腐蚀速率更快,危害也更严重
二.钢铁的电化学腐蚀
1.实质
2.析氢腐蚀
条件 水膜呈较强酸性
负极反应
正极反应
总反应式
Fe - 2e- === Fe2+
2H+ + 2e- === H2↑
Fe + 2H+ === Fe2+ + H2↑
二.钢铁的电化学腐蚀
3.吸氧腐蚀
条件 水膜呈弱酸性、中性或碱性
负极反应
正极反应
总反应式
Fe - 2e- === Fe2+
O2 + 2H2O + 4e- === 4OH-
2Fe + O2 + 2H2O === 2Fe(OH)2
通常两种腐蚀同时存在,但吸氧腐蚀更普遍
Fe2+ + 2OH- === Fe(OH)2↓
4Fe(OH)2 + 2H2O + O2 === 4Fe(OH)3
2Fe(OH)3 === Fe2O3·xH2O + (3﹣x)H2O
二.钢铁的电化学腐蚀
4.铁锈的形成
铁锈的主要成分
实验操作 实验现象 实验解释
导管中液面上升
装置中铁、碳、饱和食盐水构成原电池,铁钉发生吸氧腐蚀,压强变小
实验4-3 (1)铁钉的吸氧腐蚀实验
实验4-3 (2)析氢腐蚀
实验操作 实验现象 实验解释
两只试管均冒出气泡,且①试管中产生气泡的速率更快
Zn置换出Cu,
Zn、Cu、稀盐酸构成原电池,形成电化学腐蚀,能加快反应速率
请解释下列有关铁生锈现象的原因。
1.相对于在内河行驶的轮船来说,海轮更容易被腐蚀。
因为海水中含有较多的氯化钠等盐类,导电能力比内河的水更强,而在电解质溶液中,电化学腐蚀更容易进行。
2. 1910年遗留在南极的食品罐头,其表面至今很少有铁锈出现。
由于南极的温度常年在0℃以下,说明在较高温度下,腐蚀更易进行。
3.用于连接铜板的铁螺丝容易生锈。
由于铁与铜及空气中的水蒸汽构成了原电池,铁作原电池的负极,因此铁易被腐蚀而生锈。
1、改变金属材料的组成
如:含铬、镍等合金元素的不锈钢具有很好的抗腐蚀性能。
在金属中添加其他金属或非金属可以制成性能优异的合金。
钛合金
抗腐蚀性,生物相容性
不锈钢
三.金属的防护
2、在金属表面覆盖保护层
在金属表面覆盖致密的保护层,将金属制品与周围物质隔开。
表面喷涂油漆、矿物性油脂或覆盖搪瓷、塑料等
电镀:表面镀上一层锌、锡、铬、镍等
化学方法:生成致密的四氧化三铁薄膜
阳极氧化:使铝制品表面形成致密的氧化膜
非金属保护层
金属保护层
发蓝处理
钝化处理
三.金属的防护
3、电化学保护法
(1)牺牲阳极法
负极 :
正极 :
应用 :
锅炉内壁、船舶外壳安装镁合金或锌块
原理:
原电池原理
被保护的金属
更活泼金属
三.金属的防护
实验装置
现象
有关反应
电流表
阳极
阴极
指针偏转
逐渐溶解
质量不变;加入铁氰化钾溶液,无现象
Zn-2e-=Zn2+
O2+4e-+4H+=2H2O
——
Fe、Zn和经过酸化的NaCl溶液构成原电池;该装置中铁未被腐蚀
结论:
Fe2+检验:Fe2+与K3[Fe(CN)6] (黄色)反应生成KFe[Fe(CN)6]沉淀(带有特征蓝色)。
实验4-4 牺牲阳极法实验(1)
实验装置
现象
解释
(a)
(b)
靠近锌皮处颜色无变化,
靠近裸露的铁钉处出现红色
靠近铜丝处出现红色,
靠近裸露的铁钉处出现蓝色
构成原电池:
Zn作阳极(负极):被腐蚀
Zn-2e- =Zn2+
铁作阴极(正极):铁被保护
O2+2H2O+4e-=4OH-
构成原电池:
铁作阳极(负极):被腐蚀
Fe-2e- =Fe2+
铜作阴极(正极)
O2+2H2O+4e-=4OH-
实验4-4 牺牲阳极法实验(2)
调整外加电压,强制电子流向被保护的钢铁设备,使钢铁表面腐蚀电流降至零或接近零。
阴极 :
阳极 :
应用 :
钢铁闸门,地下管道连接电源负极
原理:
电解池原理
被保护的金属
辅助电极(不溶性)
3、电化学保护法
(2)外加电流法
三.金属的防护
思考与讨论
1、牺牲阳极法、外加电流法都要采用辅助阳极,两种方法中辅助阳极发生的反应类型是否相同?
牺牲阳极法:辅助阳极金属材料活动性必须比被保护的金属的活动性要强。
相同,都是发生氧化反应。
2、对于用作辅助阳极的金属的化学性质各有什么要求?
外加电流法:辅助阳极只起导电作用,惰性电解和金属均可作辅助阳极,但最好选用惰性电极。
四.金属腐蚀快慢的比较
同一金属在相同电解质溶液中,腐蚀快慢如下:
(1)对同一种金属来说,腐蚀的快慢:
强电解质溶液>弱电解质溶液>非电解质溶液。
(2)活动性不同的两金属:
活动性差别越大,活动性强的金属腐蚀越快。
(3)对同一种电解质溶液来说:
溶液浓度越大,腐蚀越快,且氧化剂浓度越高,氧化性越强,腐蚀越快。
(4)不同原理引起的腐蚀的速率:
电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。
(5)从防腐措施方面分析腐蚀的快慢:
外加电流的保护法防腐<牺牲阳极的保护法防腐<有一般防护条件的防腐<无防护条件的防腐。
金属的腐蚀与防护
金属的腐蚀
金属的防护
化学腐蚀
金属表面覆盖保护层
电化学腐蚀
改变金属材料的组成
电化学保护法
1)牺牲阳极法
2)外加电流法
1)析氢腐蚀
2)吸氧腐蚀
课堂小结
1.金属的腐蚀与防护无处不在,下列说法错误的是 ( )
A.纯铁在潮湿空气中不易被腐蚀
B.一次性保暖贴是利用电化学腐蚀提供热量
C.地下钢管与电源正极连接采用的是外加电流的阴极保护法
D.铺设在隧道中的钢轨每隔一根轨枕系一块锌片,采用的是牺牲阳极的阴极保护法
C
课堂练习
2.装置中的纯锌棒都浸在相同浓度的稀硫酸中,锌棒腐蚀速度从快到慢的顺序是
A.③④②① B.②③①④ C.④②①③ D.③②①④
【答案】D
3.如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和盐酸,各加入生铁块,放置一段时间。下列有关描述错误的是
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是Fe-2e-=Fe2+
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
【答案】B
4.从古至今化学均与生活、生产密切相关,化学工业在各国的国民经济中占有重要地位,是许多国家的基础产业和支柱产业。下列有关说法错误的是
A.战国曾侯乙编钟属于青铜制品,青铜是一种合金
B.敦煌莫高窟壁画中绿色颜料铜绿的主要成分是碳酸铜
C.港珠澳大桥水下钢柱镶铝块防腐的方法为牺牲阳极的阴极保护法
D.大兴机场的隔震支座由橡胶和钢板相互叠加黏结而成,不属于新型无机材料
【答案】B
