课题9.3 溶液的浓度(2课时)同步优质课件-2022-2023学年九年级人教版化学下册(共26张PPT)
文档属性
| 名称 | 课题9.3 溶液的浓度(2课时)同步优质课件-2022-2023学年九年级人教版化学下册(共26张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-17 07:16:01 | ||
图片预览





文档简介
(共26张PPT)
人教版九年级化学下册
第九单元 溶液
课题3 溶液的浓度(1)
为什么会出现这样的奇景?
漂浮在死海上
我们都有这样的生活经验:在两杯等量的水中分别加入1勺糖和2勺糖时,完全溶解后两杯糖水的甜度是不同的,通俗地说就是这两杯糖水的浓稀不同。那么,在化学中如何定量地表示溶液的浓稀呢?
一、溶液的浓度
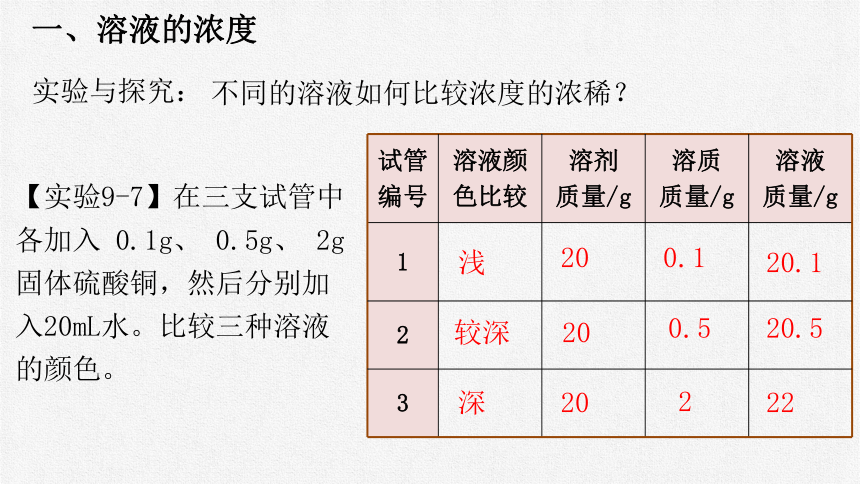
实验与探究:
不同的溶液如何比较浓度的浓稀?
【实验9-7】在三支试管中各加入 0.1g、 0.5g、 2g固体硫酸铜,然后分别加入20mL水。比较三种溶液的颜色。
试管 编号 溶液颜 色比较 溶剂 质量/g 溶质 质量/g 溶液
质量/g
1
2
3
浅
20
0.1
20.1
较深
20
0.5
20.5
深
20
2
22
淡蓝 蓝色 深蓝
对于有色溶液来说,根据颜色的深浅可以区分溶液是浓还是稀。但这种方法比较粗略,不能准确地表明一定量的溶液里究竟含有多少溶质。
表示溶液浓度的方法很多,这里主要介绍溶质的质量分数。
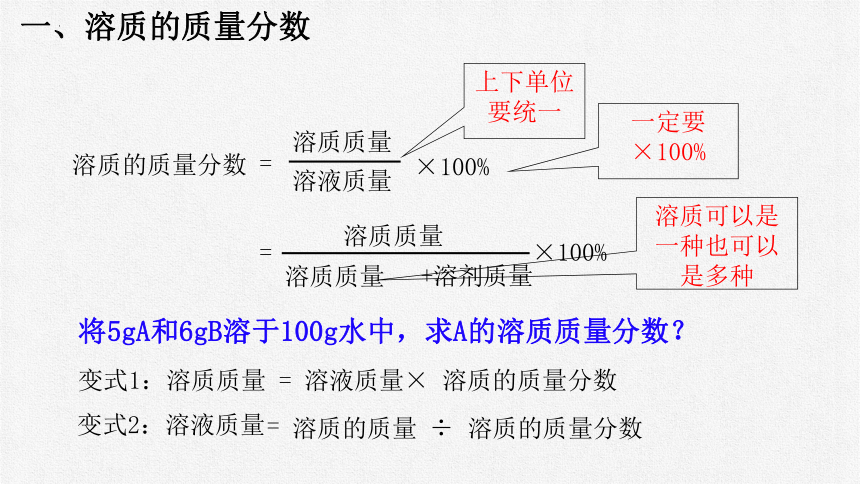
一、溶质的质量分数
=
溶液质量
溶质质量
溶质的质量分数
×100%
×100%
=
+溶剂质量
溶质质量
溶质质量
变式1:溶质质量 = 溶液质量× 溶质的质量分数
上下单位要统一
一定要
×100%
溶质可以是一种也可以是多种
将5gA和6gB溶于100g水中,求A的溶质质量分数?
溶质的质量 溶质的质量分数
变式2:溶液质量
=
÷
例1 对“10%的食盐溶液”含义的解释错误的是( )
A.100g水中溶解了10g食盐
B.100g食盐溶液溶解有10g食盐
C.将10g食盐溶解于90g水中所得的溶液
D.将食盐与水按1:9的质量比配成的溶液
A
① 溶质质量是指被溶解的部分,没有被溶解的溶质质量
不能计算在内。
②结晶水合物溶于水,其溶质是不含结晶水的化合物
(例CuSO4·5H2O)。
注意:
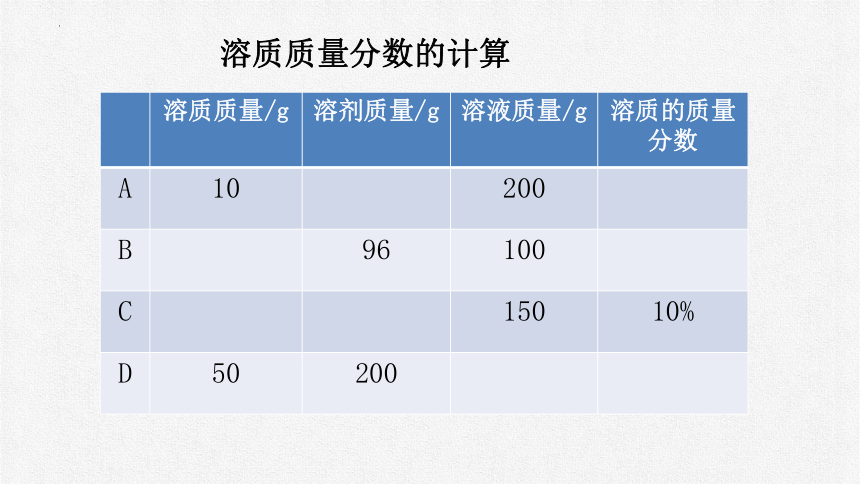
溶质质量/g 溶剂质量/g 溶液质量/g 溶质的质量分数
A 10 200
B 96 100
C 150 10%
D 50 200
溶质质量分数的计算
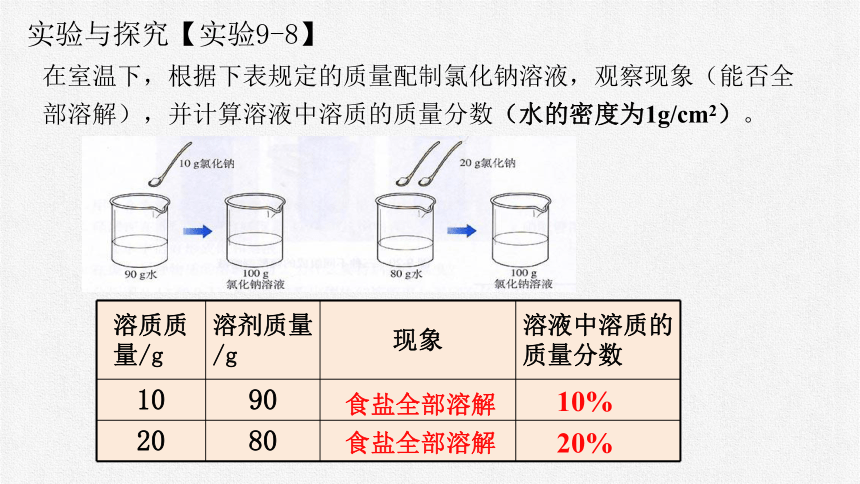
实验与探究【实验9-8】
在室温下,根据下表规定的质量配制氯化钠溶液,观察现象(能否全部溶解),并计算溶液中溶质的质量分数(水的密度为1g/cm2)。
溶质质量/g 溶剂质量/g 现象 溶液中溶质的质量分数
10 90
20 80
食盐全部溶解
食盐全部溶解
10%
20%
已知20℃时,氯化钠的溶解度是36g。有人说:“20℃时氯化钠饱和溶液中溶质的质量分数为36%。”这种说法对吗?为什么?
讨论:
不对,应该是36g/136g×100%=26.5%
二、溶质质量分数与溶解度的联系和区别
1.溶质的质量分数36% 是指:每 100g溶液中含有36g溶质。
2.溶质t 0C时溶解度36g是指:在t 0C 时,100g水最多溶解该
溶质36g。
饱和溶液的
溶质质量分数=
S
S+100g
×100%
(1)溶解度曲线上对应点的位置越高,溶质的质量分数越大(曲线上方的点按相应温度下的饱和溶液计算)。
(2)饱和溶液的溶解度变小,有晶体析出,溶质的质量分数减小;饱和溶液的溶解度变大,溶液变为不饱和溶液,溶质的质量分数不变。
(3)饱和溶液变为不饱和溶液,溶质的质量分数不一定变小,如将KNO3饱和溶液升高温度;不饱和溶液变为饱和溶液,溶质的质量分数不一定变大,如将KNO3不饱和溶液降温到恰好饱和。
归纳与小结:
例1:在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
解:
=
溶液质量
溶质质量
溶质的质量分数
×100%
溶质质量 = 溶液质量× 溶质的质量分数
=150kg×16%
=126kg
溶剂质量 = 溶液质量- 溶质的质量
=150kg-24kg
=24kg
答:略。
练习1 下列几种硝酸钾溶液中溶质的质量分数最大的是( )
A.150g水溶解30g硝酸钾;
B.15g硝酸钾溶解在85g水中;
C.85g硝酸钾溶液中含有15g硝酸钾;
D.一定量的硝酸钾溶于80g水中制成100g硝酸钾溶液。
D
练习2 已知20℃时氯化钠的溶解度为36.0g,在该温度下把40g氯化钠放入100g水中,充分搅拌,所得溶液中溶质的质量分数为多少?
由溶解度定义可知, 20℃时100g水中最多能溶解36.0g氯化钠,故所加40g氯化钠不能完全溶解,此时所得溶液为饱和溶液。
分析
解:溶质的质量分数
答:所得溶液中溶质的质量分数为26.5%.
人教版九年级化学下册
第九单元 溶液
课题3 溶液的浓度(2)
例1:化学实验室现有质量分数为98%的浓硫酸,但在实验中常需要用较稀的硫酸。要把50g上述浓硫酸稀释成20%的稀硫酸,需要水的质量是多少?
解:设稀释后溶液的质量为x。
50g×98%=x×20%
解得:x=245g
需要水的质量=245g-50g=195g
答:需要水的质量为195g。
三、有关溶液稀释浓缩问题的计算
解题依据:加水时 m溶质前=m溶质后
1.根据化学方程式进行计算,列两行中的第二行各物质的质量比是指纯净物之间质量比。凡是溶液参加的反应都是指溶质。
2.
3. m前1+m前2+……=m固+m液+m气
四、溶质质量分数的综合计算
=
溶液质量
溶质质量
溶质的质量分数
×100%
根据化学方程式进行计算
根据质量守恒进行计算
杂质和生成的沉淀
溶液质量
例1.向20g铜锌合金中不断加入一定溶质质量分数的稀盐酸,加入稀盐酸的质量与固体质量的关系如图所示。请回答:
(1)合金中锌的质量为______。
(2)当加入稀盐酸60g时,过滤,
求所得滤液中溶质的质量分数(写
计算过程,计算结果保留0.1%)。
(1)6.5g ………………………1分
(2)解:设加入60g稀盐酸,生成H2的质量为x,生成氯化锌的质量为y。
Zn + 2HCl = H2↑ + ZnCl2 ……………………2分
65 2 136
6.5g x y
…………………………4分
x=0.2g y=13.6g ……………6分
所得滤液中溶质的质量分数为
……………………8分
答:所得滤液中溶质的质量分数为20.5%。
例2
1.溶质的质量分数
课堂小结:
=
溶液质量
溶质质量
溶质的质量分数
×100%
2.溶质质量分数与溶解度的联系和区别:
一定温度下:某物质的饱和溶液的溶质质量分数=
该温度下的溶解度
该温度下的溶解度+100g
×
100%
1.在20℃时,将40 g硝酸钾固体加入100 g水中,充分搅拌后,仍有8.4 g硝酸钾固体未溶解。请填写下列空白:
(1)所得溶液是20℃时硝酸钾的_____溶液(填“饱和”或“不饱和”);
(2)20℃时硝酸钾的溶解度为______;
(3)所得溶液中硝酸钾的质量分数为______。
饱和
31.6g
24%
2.某温度时,蒸干35 g氯化钾溶液,得到7 g氯化钾,求该溶液中溶质的质量分数。
解:
练习:
3. 有100g10%的盐酸溶液,要使其溶质质量分数增大一倍,应采取的方法是( )
A.把溶液的量倒掉一半
B.溶质的质量增大一倍
C.将100g10%的盐酸与200g25%的盐酸混合
D.蒸发掉溶剂的质量是原溶液质量的一半
C
4. 100 g某硫酸恰好与13 g锌完全起反应。试计算这种硫酸中溶质的质量分数。
5. 73 g质量分数为20%的盐酸与足量大理石反应,生成二氧化碳的质量是多少?这些二氧化碳的体积(标准状况)是多少?(在标准状况下,二氧化碳的密度为1.977 g/L。)
人教版九年级化学下册
第九单元 溶液
课题3 溶液的浓度(1)
为什么会出现这样的奇景?
漂浮在死海上
我们都有这样的生活经验:在两杯等量的水中分别加入1勺糖和2勺糖时,完全溶解后两杯糖水的甜度是不同的,通俗地说就是这两杯糖水的浓稀不同。那么,在化学中如何定量地表示溶液的浓稀呢?
一、溶液的浓度
实验与探究:
不同的溶液如何比较浓度的浓稀?
【实验9-7】在三支试管中各加入 0.1g、 0.5g、 2g固体硫酸铜,然后分别加入20mL水。比较三种溶液的颜色。
试管 编号 溶液颜 色比较 溶剂 质量/g 溶质 质量/g 溶液
质量/g
1
2
3
浅
20
0.1
20.1
较深
20
0.5
20.5
深
20
2
22
淡蓝 蓝色 深蓝
对于有色溶液来说,根据颜色的深浅可以区分溶液是浓还是稀。但这种方法比较粗略,不能准确地表明一定量的溶液里究竟含有多少溶质。
表示溶液浓度的方法很多,这里主要介绍溶质的质量分数。
一、溶质的质量分数
=
溶液质量
溶质质量
溶质的质量分数
×100%
×100%
=
+溶剂质量
溶质质量
溶质质量
变式1:溶质质量 = 溶液质量× 溶质的质量分数
上下单位要统一
一定要
×100%
溶质可以是一种也可以是多种
将5gA和6gB溶于100g水中,求A的溶质质量分数?
溶质的质量 溶质的质量分数
变式2:溶液质量
=
÷
例1 对“10%的食盐溶液”含义的解释错误的是( )
A.100g水中溶解了10g食盐
B.100g食盐溶液溶解有10g食盐
C.将10g食盐溶解于90g水中所得的溶液
D.将食盐与水按1:9的质量比配成的溶液
A
① 溶质质量是指被溶解的部分,没有被溶解的溶质质量
不能计算在内。
②结晶水合物溶于水,其溶质是不含结晶水的化合物
(例CuSO4·5H2O)。
注意:
溶质质量/g 溶剂质量/g 溶液质量/g 溶质的质量分数
A 10 200
B 96 100
C 150 10%
D 50 200
溶质质量分数的计算
实验与探究【实验9-8】
在室温下,根据下表规定的质量配制氯化钠溶液,观察现象(能否全部溶解),并计算溶液中溶质的质量分数(水的密度为1g/cm2)。
溶质质量/g 溶剂质量/g 现象 溶液中溶质的质量分数
10 90
20 80
食盐全部溶解
食盐全部溶解
10%
20%
已知20℃时,氯化钠的溶解度是36g。有人说:“20℃时氯化钠饱和溶液中溶质的质量分数为36%。”这种说法对吗?为什么?
讨论:
不对,应该是36g/136g×100%=26.5%
二、溶质质量分数与溶解度的联系和区别
1.溶质的质量分数36% 是指:每 100g溶液中含有36g溶质。
2.溶质t 0C时溶解度36g是指:在t 0C 时,100g水最多溶解该
溶质36g。
饱和溶液的
溶质质量分数=
S
S+100g
×100%
(1)溶解度曲线上对应点的位置越高,溶质的质量分数越大(曲线上方的点按相应温度下的饱和溶液计算)。
(2)饱和溶液的溶解度变小,有晶体析出,溶质的质量分数减小;饱和溶液的溶解度变大,溶液变为不饱和溶液,溶质的质量分数不变。
(3)饱和溶液变为不饱和溶液,溶质的质量分数不一定变小,如将KNO3饱和溶液升高温度;不饱和溶液变为饱和溶液,溶质的质量分数不一定变大,如将KNO3不饱和溶液降温到恰好饱和。
归纳与小结:
例1:在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
解:
=
溶液质量
溶质质量
溶质的质量分数
×100%
溶质质量 = 溶液质量× 溶质的质量分数
=150kg×16%
=126kg
溶剂质量 = 溶液质量- 溶质的质量
=150kg-24kg
=24kg
答:略。
练习1 下列几种硝酸钾溶液中溶质的质量分数最大的是( )
A.150g水溶解30g硝酸钾;
B.15g硝酸钾溶解在85g水中;
C.85g硝酸钾溶液中含有15g硝酸钾;
D.一定量的硝酸钾溶于80g水中制成100g硝酸钾溶液。
D
练习2 已知20℃时氯化钠的溶解度为36.0g,在该温度下把40g氯化钠放入100g水中,充分搅拌,所得溶液中溶质的质量分数为多少?
由溶解度定义可知, 20℃时100g水中最多能溶解36.0g氯化钠,故所加40g氯化钠不能完全溶解,此时所得溶液为饱和溶液。
分析
解:溶质的质量分数
答:所得溶液中溶质的质量分数为26.5%.
人教版九年级化学下册
第九单元 溶液
课题3 溶液的浓度(2)
例1:化学实验室现有质量分数为98%的浓硫酸,但在实验中常需要用较稀的硫酸。要把50g上述浓硫酸稀释成20%的稀硫酸,需要水的质量是多少?
解:设稀释后溶液的质量为x。
50g×98%=x×20%
解得:x=245g
需要水的质量=245g-50g=195g
答:需要水的质量为195g。
三、有关溶液稀释浓缩问题的计算
解题依据:加水时 m溶质前=m溶质后
1.根据化学方程式进行计算,列两行中的第二行各物质的质量比是指纯净物之间质量比。凡是溶液参加的反应都是指溶质。
2.
3. m前1+m前2+……=m固+m液+m气
四、溶质质量分数的综合计算
=
溶液质量
溶质质量
溶质的质量分数
×100%
根据化学方程式进行计算
根据质量守恒进行计算
杂质和生成的沉淀
溶液质量
例1.向20g铜锌合金中不断加入一定溶质质量分数的稀盐酸,加入稀盐酸的质量与固体质量的关系如图所示。请回答:
(1)合金中锌的质量为______。
(2)当加入稀盐酸60g时,过滤,
求所得滤液中溶质的质量分数(写
计算过程,计算结果保留0.1%)。
(1)6.5g ………………………1分
(2)解:设加入60g稀盐酸,生成H2的质量为x,生成氯化锌的质量为y。
Zn + 2HCl = H2↑ + ZnCl2 ……………………2分
65 2 136
6.5g x y
…………………………4分
x=0.2g y=13.6g ……………6分
所得滤液中溶质的质量分数为
……………………8分
答:所得滤液中溶质的质量分数为20.5%。
例2
1.溶质的质量分数
课堂小结:
=
溶液质量
溶质质量
溶质的质量分数
×100%
2.溶质质量分数与溶解度的联系和区别:
一定温度下:某物质的饱和溶液的溶质质量分数=
该温度下的溶解度
该温度下的溶解度+100g
×
100%
1.在20℃时,将40 g硝酸钾固体加入100 g水中,充分搅拌后,仍有8.4 g硝酸钾固体未溶解。请填写下列空白:
(1)所得溶液是20℃时硝酸钾的_____溶液(填“饱和”或“不饱和”);
(2)20℃时硝酸钾的溶解度为______;
(3)所得溶液中硝酸钾的质量分数为______。
饱和
31.6g
24%
2.某温度时,蒸干35 g氯化钾溶液,得到7 g氯化钾,求该溶液中溶质的质量分数。
解:
练习:
3. 有100g10%的盐酸溶液,要使其溶质质量分数增大一倍,应采取的方法是( )
A.把溶液的量倒掉一半
B.溶质的质量增大一倍
C.将100g10%的盐酸与200g25%的盐酸混合
D.蒸发掉溶剂的质量是原溶液质量的一半
C
4. 100 g某硫酸恰好与13 g锌完全起反应。试计算这种硫酸中溶质的质量分数。
5. 73 g质量分数为20%的盐酸与足量大理石反应,生成二氧化碳的质量是多少?这些二氧化碳的体积(标准状况)是多少?(在标准状况下,二氧化碳的密度为1.977 g/L。)
同课章节目录
