高三化学复习教案 物质的制备
文档属性
| 名称 | 高三化学复习教案 物质的制备 |  | |
| 格式 | zip | ||
| 文件大小 | 139.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-01-14 22:07:23 | ||
图片预览

文档简介
物质的制备
一.考试要求:
1.掌握并应用化学实验的基本方法和技能。
2.元素化合物的相关知识。
3.能运用观察、实验、阅读资料等多种手段收集证据,能运用比较、分类、归纳、概括等方法形成探究结论。
二.命题趋势:试题重点考查学生综合实验的处理能力。引导学生重视元素化合物性质的学习,掌握并应用化学实验的基本方法和技能。重视物质制备生产实际过程中条件控制、产品杂质离子的检验、产率的提高、混合物的分离和提纯、结晶等实验综合能力的培养和训练,进而“能将与化学相关的实际问题分解,综合运用相关知识和科学方法,解决生产、生活实际和科学研究中的简单化学问题”。
三.问题精析:
例.(15分)柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:FeSO4+Na2CO3=FeCO3↓+Na2SO4 FeCO3+C6H8O7=FeC6H6O7+CO2↑+H2O 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子 开始沉淀的pH 沉淀完全的pH
Fe3+ 1.1 3.2
Al3+ 3.0 5.0
Fe2+ 5.8 8.8
(1)制备FeCO3时,选用的加料方式是 (填字母),原因是
。
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是
。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。①铁粉的作用是 。②反应结束后,无需过滤,除去过量铁粉的方法是 。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是
。
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁。请结合右图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应,
,得到FeSO4溶液,
,得到FeSO4·7H2O晶体。
四.课堂练习:
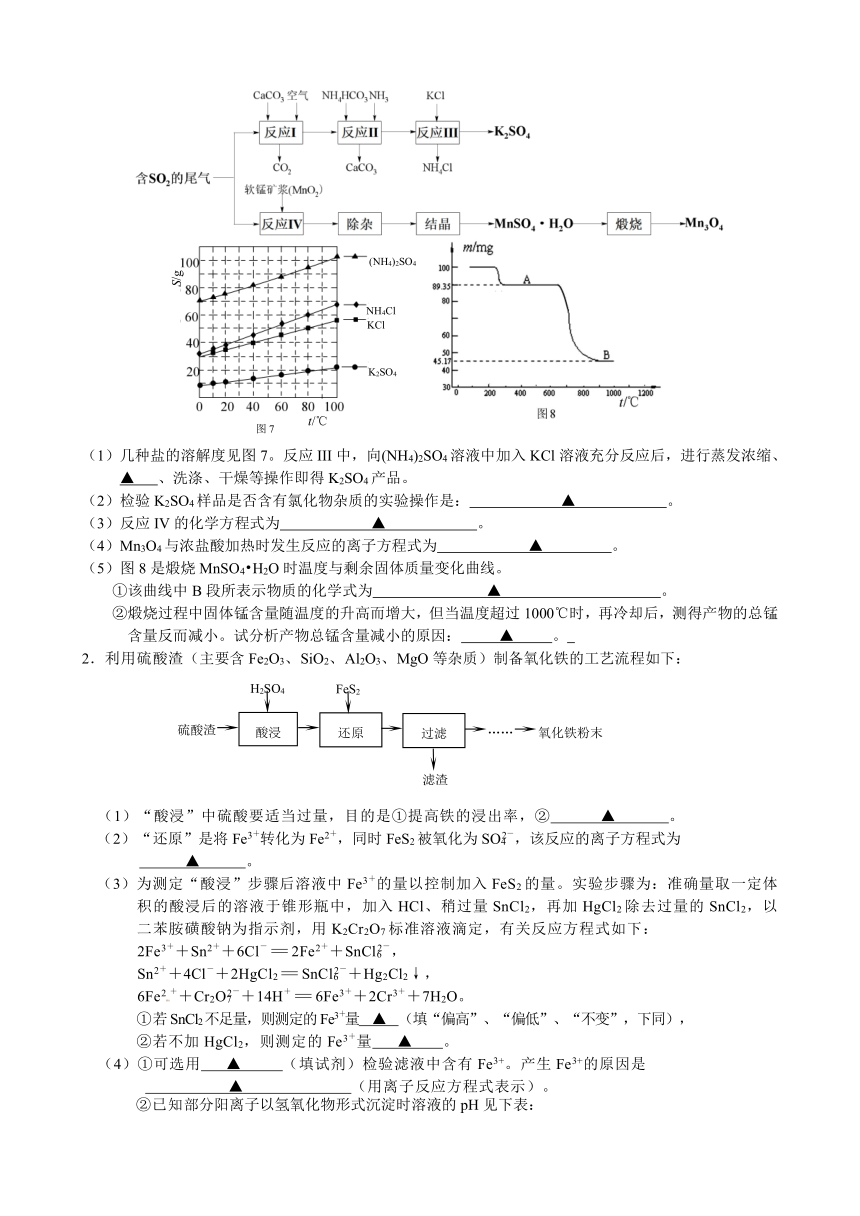
1 . (12分) K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备K2SO4和Mn3O4的工艺流程如下:
(1)几种盐的溶解度见图7。反应III中,向(NH4)2SO4溶液中加入KCl溶液充分反应后,进行蒸发浓缩、 ▲ 、洗涤、干燥等操作即得K2SO4产品。
(2)检验K2SO4样品是否含有氯化物杂质的实验操作是: ▲ 。
(3)反应IV的化学方程式为 ▲ 。
(4)Mn3O4与浓盐酸加热时发生反应的离子方程式为 ▲ 。
(5)图8是煅烧MnSO4 H2O时温度与剩余固体质量变化曲线。
①该曲线中B段所表示物质的化学式为 ▲ 。
②煅烧过程中固体锰含量随温度的升高而增大,但当温度超过1000℃时,再冷却后,测得产物的总锰含量反而减小。试分析产物总锰含量减小的原因: ▲ 。
2.利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
(1)“酸浸”中硫酸要适当过量,目的是①提高铁的浸出率,② ▲ 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为
▲ 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量 ▲ (填“偏高”、“偏低”、“不变”,下同),
②若不加HgCl2,则测定的Fe3+量 ▲ 。
(4)①可选用 ▲ (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是
▲ (用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 Fe(OH)3 Al(OH)3 Fe(OH)2 Mg(OH)2 Mn(OH)2
开始沉淀 2.7 3.8 7.5 9.4 8.3
完全沉淀 3.2 5.2 9.7 12.4 9.8
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。
请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化: ▲ ;
b.沉淀: ▲ ;
c.分离,洗涤;
d.烘干,研磨。
五.专题检测:
1.Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO3 溶液,生成Ag2O沉淀,保持反应温度为80,边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品。反应方程式为2AgNO3+4KOH+K2S2O8 Ag2O2↓+2KNO3+K2SO4+2H2O
回答下列问题:
(1)上述制备过程中,检验洗涤是否完全的方法是
。
2.KNO3是重要的化工产品,下面是一种已获得专利的KNO3制备方法的主
要步骤:
(1)反应Ⅰ中,CaSO4与NH4HCO3的物质的量之比为1∶2,该反应的化学方程式为______________________________________________________________________。
(2)反应Ⅱ需在干态、加热的条件下进行,加热的目的是_______________________
_____________________________________________________________________;
从反应Ⅳ所得混合物中分离出CaSO4的方法是趁热过滤,趁热过滤的目的是_____________________________________________________________________。
(3)检验反应Ⅱ所得K2SO4中是否混有KCl的方法是:取少量K2SO4样品溶解于水,_____________________________________________________________________。
(4)整个流程中,可循环利用的物质除(NH4)2SO4外,还有________(填化学式)。
3.从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2和Fe2O3等)中回收V2O5的一种生产工艺流程示意图如下:
21世纪教育网
回答下列问题:
(1)①中废渣的主要成分是 ▲ 。
(2)②、③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):R2(SO4)n(水层)+ 2n HA(有机层) 2 RA n(有机层)+ n H2SO4(水层)。②中萃取时必须加入适量碱,其原因是 ▲ ;③中反萃取时加入的X试剂是 ▲ 。
(3)完成④中反应的离子方程式:21世纪教育网
ClO3— + VO2++ H+ = VO3++ ( )+ ( )
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如下表
pH 1.3 1.4 1.5 1.6 1.7 1.8 1.9 2.0 2.1
钒沉淀率/% 88.1 94.8 96.5 98.0 98.821世纪教育网 98.8 96.4 93.1 89.3
试判断在实际生产时,⑤中加入氨水调节溶液的最佳pH为 ▲ ;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< ▲ 。(已知:25℃时,Ksp(Fe(OH)3)=2.6×10―39。)
(5)写出废液Y中除H+之外的两种阳离子: ▲ 。
(6)生产时,将②中的酸性萃余液循环用于①中的水浸。在整个工艺过程中,可以循环利用的物质还有 ▲ 。
(7)全矾液流电池是一种新型电能储存和高效转化装置(如图所示,a、b均为惰性电极),已知:
V2+为紫色,V3+为绿色,VO2+为蓝色,VO2+为黄色。当充电时,右槽溶液颜色由绿色变为紫色。则:
①全矾液流电池的工作原理为:
VO2++V2++2H+ VO2++H2O+V3+
(请在可逆符号上下的括号中填“充”、“放”)
当充电时,b极接直流电源 ▲ 极。21世纪教育网
②放电过程中,a极的反应式为 ▲ ,当转移
1.0 mol电子时共有1.0 mol H+从 ▲ 槽迁移进 ▲ 槽(填“左”、“右”)。
【参考答案】答案
例
(15分)
(1)c 避免生成Fe(OH)2沉淀
(2)取最后一次的洗涤滤液1~2 mL于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净。
(3)①防止+2价的铁元素被氧化 ②加入适量柠檬酸让铁粉反应完全
(4)降低柠檬酸亚铁在水中的溶解量,有利于晶体析出
(5)过滤,向反应液中加入足量的铁粉,充分搅拌后,滴加NaOH溶液调节反应液的pH约为5,过滤。或过滤,向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体,向固体中加入足量稀硫酸至固体完全溶解,再加入足量的铁粉,充分搅拌后,过滤。
(滴加稀硫酸酸化)加热浓缩得到60℃饱和溶液 冷却至0℃结晶,过滤,少量冰水洗涤,低温干燥
课堂练习
1(1)趁热过滤 (2分)
(2)取少量样品于试管中配成溶液,滴加过量Ba(NO3)2溶液,取上层清液滴加AgNO3溶液(2分)
(3)MnO2+SO2=MnSO4(2分)
(4)Mn3O4+8H++2Cl-3Mn2++Cl2↑+4H2O(2分)
(5)①Mn3O4 (2分)
②部分Mn3O4又被氧化为Mn2O3或MnO2,造成总锰含量减小(2分)
2(1)抑制Fe3+的水解 (1分)
(2)14Fe3++FeS2+8H2O=15Fe2++2SO42—+16H+ (2分)
(3) ①偏低(2分) ②偏高(2分)
(4)①KSCN或 (2分) 4Fe2++O2+4H+=4Fe3++2H2O (2分)
②a.向溶液中加入过量的酸性高锰酸钾溶液,搅拌(2分)
b.滴加NaOH溶液,调节溶液为pH为3.2~3.8 (2分)
专题检测
1[答案] (1)取少许最后一次洗涤滤液,滴入1~2滴Ba(NO3)2溶液,若不出现白色浑浊,表示已洗涤完全(或取少许最后一次洗涤滤液,滴入1~2滴酚酞溶液,若溶液不显红色,表示已洗涤完全)
2答案 (1)CaSO4+2NH4HCO3===CaCO3↓+(NH4)2SO4+H2O+CO2↑
(2)加快化学反应速率,分离NH4Cl与K2SO4 防止KNO3结晶,提高KNO3的产率
(3)加入Ba(NO3)2溶液至不再产生沉淀,静置,向上层清液中滴加AgNO3溶液,若有沉淀生成,说明K2SO4中混有KCl
(4)CaSO4、KNO3
3(1)SiO2 (3分) (2)加入碱中和产生的酸,平衡右移,提高钒的萃取率 硫酸
(3)1 6 6 6 1 Cl— 3 H2O (3分) (4)1.7 2.6×10―3 mol/L(3分)
(5)Fe3+、VO3+、NH4+、K+(任写两种即可)
(6)有机萃取剂、氨水(或氨气)
(7)放(1分) 充(1分) 负(1分) VO2++2H++e—= VO2+ +H2O 右(1分)左(1分)
图7
S/g
K2SO4
KCl
NH4Cl
(NH4)2SO4
t/℃
硫酸渣
酸浸
还原
过滤
H2SO4
FeS2
滤渣
……
氧化铁粉末
焙烧
⑥
沉淀
废钒
催化剂
K2 SO3
水
11%硫酸
水浸
①
酸浸
还原
废渣
强酸性浸出液(含VO2+、K+、SO42—等)
酸性萃余液(K+、SO42—等)
② 萃取
有机萃取剂
有机萃取剂
酸性水溶液(含VO2+、Fe3+、SO42—等)
调pH、沉钒
⑤
X试剂
反萃取
③
氯酸钾
氧化
④
氨水
废液Y
成品V2O5
废气(含
NH3等)
有机溶液
( )电
( )电
一.考试要求:
1.掌握并应用化学实验的基本方法和技能。
2.元素化合物的相关知识。
3.能运用观察、实验、阅读资料等多种手段收集证据,能运用比较、分类、归纳、概括等方法形成探究结论。
二.命题趋势:试题重点考查学生综合实验的处理能力。引导学生重视元素化合物性质的学习,掌握并应用化学实验的基本方法和技能。重视物质制备生产实际过程中条件控制、产品杂质离子的检验、产率的提高、混合物的分离和提纯、结晶等实验综合能力的培养和训练,进而“能将与化学相关的实际问题分解,综合运用相关知识和科学方法,解决生产、生活实际和科学研究中的简单化学问题”。
三.问题精析:
例.(15分)柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:FeSO4+Na2CO3=FeCO3↓+Na2SO4 FeCO3+C6H8O7=FeC6H6O7+CO2↑+H2O 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子 开始沉淀的pH 沉淀完全的pH
Fe3+ 1.1 3.2
Al3+ 3.0 5.0
Fe2+ 5.8 8.8
(1)制备FeCO3时,选用的加料方式是 (填字母),原因是
。
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是
。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。①铁粉的作用是 。②反应结束后,无需过滤,除去过量铁粉的方法是 。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是
。
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁。请结合右图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应,
,得到FeSO4溶液,
,得到FeSO4·7H2O晶体。
四.课堂练习:
1 . (12分) K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备K2SO4和Mn3O4的工艺流程如下:
(1)几种盐的溶解度见图7。反应III中,向(NH4)2SO4溶液中加入KCl溶液充分反应后,进行蒸发浓缩、 ▲ 、洗涤、干燥等操作即得K2SO4产品。
(2)检验K2SO4样品是否含有氯化物杂质的实验操作是: ▲ 。
(3)反应IV的化学方程式为 ▲ 。
(4)Mn3O4与浓盐酸加热时发生反应的离子方程式为 ▲ 。
(5)图8是煅烧MnSO4 H2O时温度与剩余固体质量变化曲线。
①该曲线中B段所表示物质的化学式为 ▲ 。
②煅烧过程中固体锰含量随温度的升高而增大,但当温度超过1000℃时,再冷却后,测得产物的总锰含量反而减小。试分析产物总锰含量减小的原因: ▲ 。
2.利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
(1)“酸浸”中硫酸要适当过量,目的是①提高铁的浸出率,② ▲ 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为
▲ 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量 ▲ (填“偏高”、“偏低”、“不变”,下同),
②若不加HgCl2,则测定的Fe3+量 ▲ 。
(4)①可选用 ▲ (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是
▲ (用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 Fe(OH)3 Al(OH)3 Fe(OH)2 Mg(OH)2 Mn(OH)2
开始沉淀 2.7 3.8 7.5 9.4 8.3
完全沉淀 3.2 5.2 9.7 12.4 9.8
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。
请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化: ▲ ;
b.沉淀: ▲ ;
c.分离,洗涤;
d.烘干,研磨。
五.专题检测:
1.Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO3 溶液,生成Ag2O沉淀,保持反应温度为80,边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品。反应方程式为2AgNO3+4KOH+K2S2O8 Ag2O2↓+2KNO3+K2SO4+2H2O
回答下列问题:
(1)上述制备过程中,检验洗涤是否完全的方法是
。
2.KNO3是重要的化工产品,下面是一种已获得专利的KNO3制备方法的主
要步骤:
(1)反应Ⅰ中,CaSO4与NH4HCO3的物质的量之比为1∶2,该反应的化学方程式为______________________________________________________________________。
(2)反应Ⅱ需在干态、加热的条件下进行,加热的目的是_______________________
_____________________________________________________________________;
从反应Ⅳ所得混合物中分离出CaSO4的方法是趁热过滤,趁热过滤的目的是_____________________________________________________________________。
(3)检验反应Ⅱ所得K2SO4中是否混有KCl的方法是:取少量K2SO4样品溶解于水,_____________________________________________________________________。
(4)整个流程中,可循环利用的物质除(NH4)2SO4外,还有________(填化学式)。
3.从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2和Fe2O3等)中回收V2O5的一种生产工艺流程示意图如下:
21世纪教育网
回答下列问题:
(1)①中废渣的主要成分是 ▲ 。
(2)②、③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):R2(SO4)n(水层)+ 2n HA(有机层) 2 RA n(有机层)+ n H2SO4(水层)。②中萃取时必须加入适量碱,其原因是 ▲ ;③中反萃取时加入的X试剂是 ▲ 。
(3)完成④中反应的离子方程式:21世纪教育网
ClO3— + VO2++ H+ = VO3++ ( )+ ( )
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如下表
pH 1.3 1.4 1.5 1.6 1.7 1.8 1.9 2.0 2.1
钒沉淀率/% 88.1 94.8 96.5 98.0 98.821世纪教育网 98.8 96.4 93.1 89.3
试判断在实际生产时,⑤中加入氨水调节溶液的最佳pH为 ▲ ;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< ▲ 。(已知:25℃时,Ksp(Fe(OH)3)=2.6×10―39。)
(5)写出废液Y中除H+之外的两种阳离子: ▲ 。
(6)生产时,将②中的酸性萃余液循环用于①中的水浸。在整个工艺过程中,可以循环利用的物质还有 ▲ 。
(7)全矾液流电池是一种新型电能储存和高效转化装置(如图所示,a、b均为惰性电极),已知:
V2+为紫色,V3+为绿色,VO2+为蓝色,VO2+为黄色。当充电时,右槽溶液颜色由绿色变为紫色。则:
①全矾液流电池的工作原理为:
VO2++V2++2H+ VO2++H2O+V3+
(请在可逆符号上下的括号中填“充”、“放”)
当充电时,b极接直流电源 ▲ 极。21世纪教育网
②放电过程中,a极的反应式为 ▲ ,当转移
1.0 mol电子时共有1.0 mol H+从 ▲ 槽迁移进 ▲ 槽(填“左”、“右”)。
【参考答案】答案
例
(15分)
(1)c 避免生成Fe(OH)2沉淀
(2)取最后一次的洗涤滤液1~2 mL于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净。
(3)①防止+2价的铁元素被氧化 ②加入适量柠檬酸让铁粉反应完全
(4)降低柠檬酸亚铁在水中的溶解量,有利于晶体析出
(5)过滤,向反应液中加入足量的铁粉,充分搅拌后,滴加NaOH溶液调节反应液的pH约为5,过滤。或过滤,向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体,向固体中加入足量稀硫酸至固体完全溶解,再加入足量的铁粉,充分搅拌后,过滤。
(滴加稀硫酸酸化)加热浓缩得到60℃饱和溶液 冷却至0℃结晶,过滤,少量冰水洗涤,低温干燥
课堂练习
1(1)趁热过滤 (2分)
(2)取少量样品于试管中配成溶液,滴加过量Ba(NO3)2溶液,取上层清液滴加AgNO3溶液(2分)
(3)MnO2+SO2=MnSO4(2分)
(4)Mn3O4+8H++2Cl-3Mn2++Cl2↑+4H2O(2分)
(5)①Mn3O4 (2分)
②部分Mn3O4又被氧化为Mn2O3或MnO2,造成总锰含量减小(2分)
2(1)抑制Fe3+的水解 (1分)
(2)14Fe3++FeS2+8H2O=15Fe2++2SO42—+16H+ (2分)
(3) ①偏低(2分) ②偏高(2分)
(4)①KSCN或 (2分) 4Fe2++O2+4H+=4Fe3++2H2O (2分)
②a.向溶液中加入过量的酸性高锰酸钾溶液,搅拌(2分)
b.滴加NaOH溶液,调节溶液为pH为3.2~3.8 (2分)
专题检测
1[答案] (1)取少许最后一次洗涤滤液,滴入1~2滴Ba(NO3)2溶液,若不出现白色浑浊,表示已洗涤完全(或取少许最后一次洗涤滤液,滴入1~2滴酚酞溶液,若溶液不显红色,表示已洗涤完全)
2答案 (1)CaSO4+2NH4HCO3===CaCO3↓+(NH4)2SO4+H2O+CO2↑
(2)加快化学反应速率,分离NH4Cl与K2SO4 防止KNO3结晶,提高KNO3的产率
(3)加入Ba(NO3)2溶液至不再产生沉淀,静置,向上层清液中滴加AgNO3溶液,若有沉淀生成,说明K2SO4中混有KCl
(4)CaSO4、KNO3
3(1)SiO2 (3分) (2)加入碱中和产生的酸,平衡右移,提高钒的萃取率 硫酸
(3)1 6 6 6 1 Cl— 3 H2O (3分) (4)1.7 2.6×10―3 mol/L(3分)
(5)Fe3+、VO3+、NH4+、K+(任写两种即可)
(6)有机萃取剂、氨水(或氨气)
(7)放(1分) 充(1分) 负(1分) VO2++2H++e—= VO2+ +H2O 右(1分)左(1分)
图7
S/g
K2SO4
KCl
NH4Cl
(NH4)2SO4
t/℃
硫酸渣
酸浸
还原
过滤
H2SO4
FeS2
滤渣
……
氧化铁粉末
焙烧
⑥
沉淀
废钒
催化剂
K2 SO3
水
11%硫酸
水浸
①
酸浸
还原
废渣
强酸性浸出液(含VO2+、K+、SO42—等)
酸性萃余液(K+、SO42—等)
② 萃取
有机萃取剂
有机萃取剂
酸性水溶液(含VO2+、Fe3+、SO42—等)
调pH、沉钒
⑤
X试剂
反萃取
③
氯酸钾
氧化
④
氨水
废液Y
成品V2O5
废气(含
NH3等)
有机溶液
( )电
( )电
同课章节目录
