4.2.1 电解池的工作原理 课件(共25张ppt,WPS打开) 2022-2023学年上学期高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.2.1 电解池的工作原理 课件(共25张ppt,WPS打开) 2022-2023学年上学期高二化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 24.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 16:00:24 | ||
图片预览






文档简介
(共25张PPT)
第四章 化学反应与电能
第二节 电解池
第一课时 电解池的工作原理
1.了解电解、电解池的概念,认识电解是电能转化为化学能的重要形式;
2.形成系统分析电解池的一般思路和方法,能初步设计简单的电解池;
3.了解电解过程中,粒子放电顺序与其氧化性还原性的关系,能解释或推测电解反应的产物,并能用电极反应和总反应进行表征。
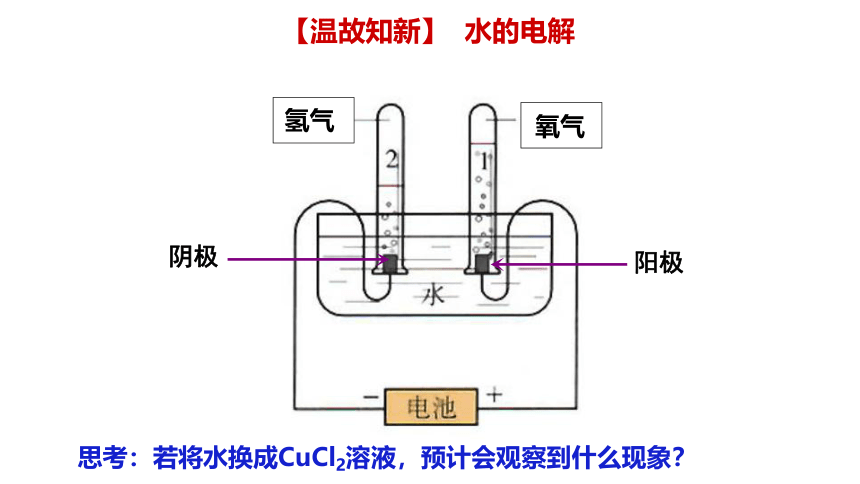
阴极
阳极
氢气
氧气
思考:若将水换成CuCl2溶液,预计会观察到什么现象?
【温故知新】 水的电解
【实验4-2】
在U形管中注入质量分数为25%的CuCl2溶液,插入两根石墨棒作电极材料(如图4-9)。把湿润的碘化钾淀粉试纸放在与直流电源正极相连的石墨棒附近。接通直流电源,观察U形管内的现象和试纸颜色的变化。
一、电解原理
【实验4-2】
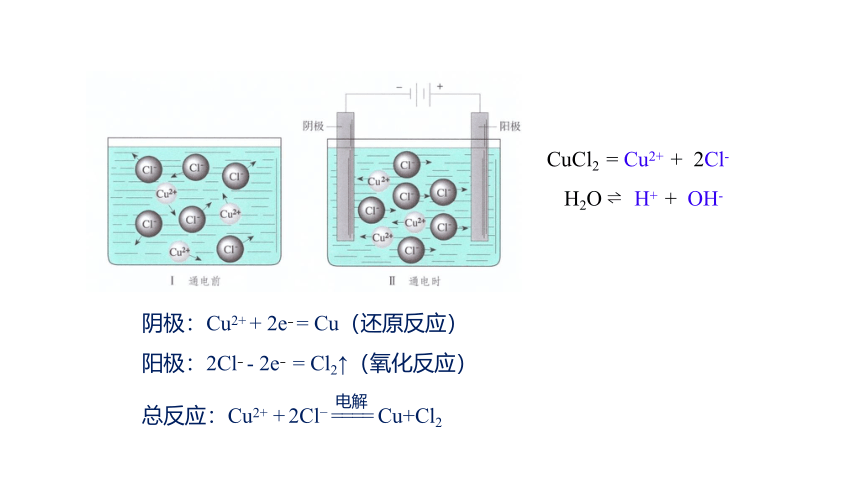
实验现象:
1.与直流电源负极相连的石墨棒上逐渐覆盖了一层红色的物质。
2.与直流电源正极相连的石墨棒上有气泡产生,气体能使湿润的碘化钾淀粉试纸变成蓝色。
思考下列问题:
(1)两极产物分别是什么物质?说明是什么离子发生了什么反应?
(2)离子的移动方向?电极产物和离子氧化性、还原性强弱有无关系?
CuCl2 = Cu2+ + 2Cl-
H2O H+ + OH-
阴极:Cu2+ + 2e = Cu(还原反应)
阳极:2Cl - 2e = Cl2↑(氧化反应)
总反应:Cu2+ + 2Cl = = = = Cu+Cl2
电解
把电能转化成化学能的装置。
一、电解原理
①直流电源
②电极
③电解质溶液或熔融电解质
④形成闭合回路
阴极:与电源负极相连
阳极:与电源正极相连
使电流通过电解质溶液(或熔融电解质)而在阳极、阴极引起氧化还原反应的过程。
2. 电解池(电解槽):
3. 电解池构成条件
1. 电解:
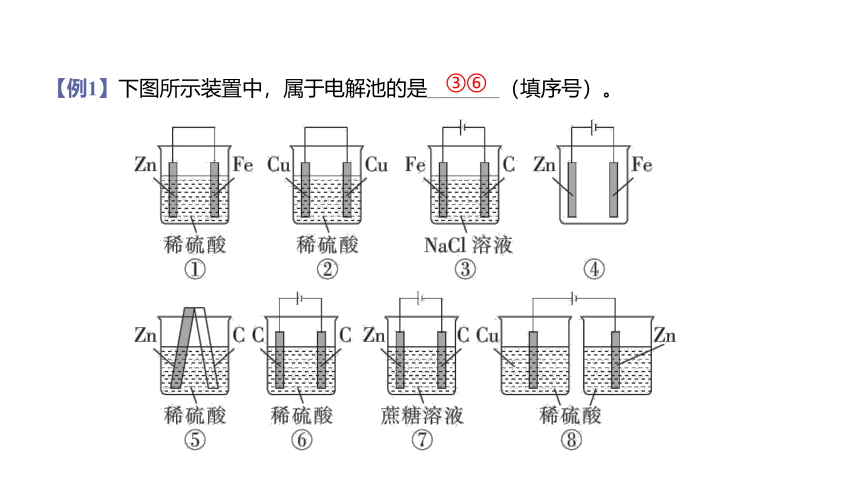
【例1】下图所示装置中,属于电解池的是_______(填序号)。
③⑥
思考与讨论
请结合图4-10Ⅱ绘制反映电解池工作原理的示意图,并与同学交流。示意图要求包括以下内容:
(1)注明电解池的组成。
(2)标明氧化反应和还原反应发生的区域。
(3)标明电子的运动方向和阴离子、阳离子的迁移方向。
阴极
电解质溶液
(或熔融电解质)
e-
e-
阴离子
还原反应
–
+
阳极
4.电解原理
阳离子
氧化反应
(1)电极
阴极:与电源负极相连,得电子发生还原反应。
阳极:与电源正极相连,失电子发生氧化反应。
(2)电子移动方向
负极
阴极
阳极
正极
导线
导线
(3)离子移动方向
阳离子
阴极
阴离子
阳极
放电顺序:S2- > I- >Br- > Cl- > OH- > 含氧酸根 (NO3-、SO42-、CO32-)> F-
(1)阴极:与电极材料无关,氧化性强的离子先放电。
注意:K+5.阴、阳两极放电顺序
放电顺序:K+(2)阳极:若是活性电极(除C/Pt/Au)做阳极,电极失电子;
若是惰性电极作阳极,还原性强的离子先放电。
【例2】 某同学按如图所示的装置进行电解实验,下列说法正确的是_________(填序号)。
①电解过程中,铜电极上的电极反应式:
②电解初期,主反应:
③电解一定时间后,石墨电极上有铜析出
④整个电解过程中,
①②③
判断两极放电离子,写出电解池的电极反应式和电池总反应。
3.某化学兴趣小组用惰性电极(Pt)电解以下溶液,如图所示:
类型 实例 电极反应式 电解质溶液复原
(1) 电解 水型 含氧酸 (如H2SO4)
强碱 (如NaOH) 活泼金属的最高价含氧酸盐 (如Na2SO4、KNO3) 加水
6.用惰性电极电解电解质溶液的一般规律
阴极:4H+ + 4e- = 2H2↑
阳极:2 H2O - 4e- = 4H+ + O2↑
阴极:4H2O+4e- = 2H2↑+4OH-
阳极:4OH--4e- = 2H2O+O2↑
阴极:4H2O + 4e- = 2H2↑ + 4OH-
阳极:2H2O - 4e- = 4H+ + O2↑
电解
总反应: 2H2O== 2H2↑+O2↑
类型 实例 电极反应式和电解方程式 电解质溶液复原
(2) 电解电解 质型 无氧酸 (如HCl)
不活泼金属的 无氧酸盐 (如CuCl2)
通氯化氢
加氯化铜
阴极:2H++2e- = H2↑
阳极:2Cl--2e- = Cl2↑
电解
总反应:2HCl=== H2↑+Cl2↑
阴极:Cu2++2e- = Cu
阳极:2Cl--2e- = Cl2↑
6.用惰性电极电解电解质溶液的一般规律
类型 实例 电极反应式和电解方程式 电解质溶液复原
(3) 放氢气生碱型 活泼金属的无氧酸盐 (如NaCl)
(4) 放氧气生酸型 不活泼金属的最高价含氧酸盐 (如CuSO4)
通氯化氢
加CuO
或CuCO3
阴极: 4H2O + 4e- = 2H2↑ + 4OH-
阳极: 2Cl- - 2e- = Cl2↑
总反应:2NaCl + 2H2O === 2NaOH + H2↑ + Cl2↑
电解
阴极: Cu2+ + 2e- = Cu
阳极: 2H2O-4e- = 4H+ + O2↑
总反应:2CuSO4 + 2H2O === 2Cu + 2H2SO4 + O2↑
电解
6.用惰性电极电解电解质溶液的一般规律
【例3】 用惰性电极进行电解,下列说法正确的是( @45@ )。
A.电解稀硫酸,实质上是电解水,故溶液 不变
B.电解稀 溶液,要消耗 ,故溶液 减小
C.电解 溶液,在阴极上和阳极上生成气体产物的物质的量之比为
D.电解 溶液,在阴极上和阳极上生成产物的物质的量之比为
D
【例4】 用惰性电极电解下列溶液一段时间后再加入一定量的某种纯净物(方括号内的物质),能使溶液恢复到原来的成分和浓度的是( @47@ )。(已知原溶液中电解质未完全电解)
A. B.
C. D.
B
随堂检测·精评价
1.用石墨作电极电解 溶液,下列说法正确的是( @49@ )。
A.在阳极上析出金属铜 B.在阴极上析出金属铜
C.在阴极上产生有刺激性气味的气体 D.阳极上发生还原反应
B
2.图中 、 分别是直流电源的两极,通电后发现 电极质量增加, 电极处有无色无味气体放出,符合这一情况的是( )。
选项 电极 电极 极 溶液的溶质
锌 石墨 负极
石墨 石墨 负极
银 铁 正极
铜 石墨 负极
A
3.有下列两组电解池,电极均为惰性电极,实验时通电时间和电流强度都相同。
(1) 电解后,溶液 增大的是_____(填“甲”、“乙”、“丙”或“丁”,下同),溶液 减小的是_________。
丙
甲、丁
(2) 电解后电极上有固体析出的是_____。
丁
(3) 电解时生成的气体在同温同压下总体积相等的是_____________。
甲、乙、丙
4.[2021年海南卷] 液氨中存在平衡: 。电解池装置如图所示,以 的液氨溶液为电解液,电解过程中 、 两个惰性电极上都有气泡产生。下列有关说法正确的是( @57@ )。
B
A.
B.
C.电解过程中,阴极附近
D.理论上两极产生的气体物质的量之比为
5.[2021年天津卷] 如下图所示电解装置中,通电后石墨电极Ⅱ上有 生成, 逐渐溶解,下列判断错误 的是( @59@ )。
A.
B.通电一段时间后,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色
C.随着电解的进行,
D.当
C
第四章 化学反应与电能
第二节 电解池
第一课时 电解池的工作原理
1.了解电解、电解池的概念,认识电解是电能转化为化学能的重要形式;
2.形成系统分析电解池的一般思路和方法,能初步设计简单的电解池;
3.了解电解过程中,粒子放电顺序与其氧化性还原性的关系,能解释或推测电解反应的产物,并能用电极反应和总反应进行表征。
阴极
阳极
氢气
氧气
思考:若将水换成CuCl2溶液,预计会观察到什么现象?
【温故知新】 水的电解
【实验4-2】
在U形管中注入质量分数为25%的CuCl2溶液,插入两根石墨棒作电极材料(如图4-9)。把湿润的碘化钾淀粉试纸放在与直流电源正极相连的石墨棒附近。接通直流电源,观察U形管内的现象和试纸颜色的变化。
一、电解原理
【实验4-2】
实验现象:
1.与直流电源负极相连的石墨棒上逐渐覆盖了一层红色的物质。
2.与直流电源正极相连的石墨棒上有气泡产生,气体能使湿润的碘化钾淀粉试纸变成蓝色。
思考下列问题:
(1)两极产物分别是什么物质?说明是什么离子发生了什么反应?
(2)离子的移动方向?电极产物和离子氧化性、还原性强弱有无关系?
CuCl2 = Cu2+ + 2Cl-
H2O H+ + OH-
阴极:Cu2+ + 2e = Cu(还原反应)
阳极:2Cl - 2e = Cl2↑(氧化反应)
总反应:Cu2+ + 2Cl = = = = Cu+Cl2
电解
把电能转化成化学能的装置。
一、电解原理
①直流电源
②电极
③电解质溶液或熔融电解质
④形成闭合回路
阴极:与电源负极相连
阳极:与电源正极相连
使电流通过电解质溶液(或熔融电解质)而在阳极、阴极引起氧化还原反应的过程。
2. 电解池(电解槽):
3. 电解池构成条件
1. 电解:
【例1】下图所示装置中,属于电解池的是_______(填序号)。
③⑥
思考与讨论
请结合图4-10Ⅱ绘制反映电解池工作原理的示意图,并与同学交流。示意图要求包括以下内容:
(1)注明电解池的组成。
(2)标明氧化反应和还原反应发生的区域。
(3)标明电子的运动方向和阴离子、阳离子的迁移方向。
阴极
电解质溶液
(或熔融电解质)
e-
e-
阴离子
还原反应
–
+
阳极
4.电解原理
阳离子
氧化反应
(1)电极
阴极:与电源负极相连,得电子发生还原反应。
阳极:与电源正极相连,失电子发生氧化反应。
(2)电子移动方向
负极
阴极
阳极
正极
导线
导线
(3)离子移动方向
阳离子
阴极
阴离子
阳极
放电顺序:S2- > I- >Br- > Cl- > OH- > 含氧酸根 (NO3-、SO42-、CO32-)> F-
(1)阴极:与电极材料无关,氧化性强的离子先放电。
注意:K+
放电顺序:K+
若是惰性电极作阳极,还原性强的离子先放电。
【例2】 某同学按如图所示的装置进行电解实验,下列说法正确的是_________(填序号)。
①电解过程中,铜电极上的电极反应式:
②电解初期,主反应:
③电解一定时间后,石墨电极上有铜析出
④整个电解过程中,
①②③
判断两极放电离子,写出电解池的电极反应式和电池总反应。
3.某化学兴趣小组用惰性电极(Pt)电解以下溶液,如图所示:
类型 实例 电极反应式 电解质溶液复原
(1) 电解 水型 含氧酸 (如H2SO4)
强碱 (如NaOH) 活泼金属的最高价含氧酸盐 (如Na2SO4、KNO3) 加水
6.用惰性电极电解电解质溶液的一般规律
阴极:4H+ + 4e- = 2H2↑
阳极:2 H2O - 4e- = 4H+ + O2↑
阴极:4H2O+4e- = 2H2↑+4OH-
阳极:4OH--4e- = 2H2O+O2↑
阴极:4H2O + 4e- = 2H2↑ + 4OH-
阳极:2H2O - 4e- = 4H+ + O2↑
电解
总反应: 2H2O== 2H2↑+O2↑
类型 实例 电极反应式和电解方程式 电解质溶液复原
(2) 电解电解 质型 无氧酸 (如HCl)
不活泼金属的 无氧酸盐 (如CuCl2)
通氯化氢
加氯化铜
阴极:2H++2e- = H2↑
阳极:2Cl--2e- = Cl2↑
电解
总反应:2HCl=== H2↑+Cl2↑
阴极:Cu2++2e- = Cu
阳极:2Cl--2e- = Cl2↑
6.用惰性电极电解电解质溶液的一般规律
类型 实例 电极反应式和电解方程式 电解质溶液复原
(3) 放氢气生碱型 活泼金属的无氧酸盐 (如NaCl)
(4) 放氧气生酸型 不活泼金属的最高价含氧酸盐 (如CuSO4)
通氯化氢
加CuO
或CuCO3
阴极: 4H2O + 4e- = 2H2↑ + 4OH-
阳极: 2Cl- - 2e- = Cl2↑
总反应:2NaCl + 2H2O === 2NaOH + H2↑ + Cl2↑
电解
阴极: Cu2+ + 2e- = Cu
阳极: 2H2O-4e- = 4H+ + O2↑
总反应:2CuSO4 + 2H2O === 2Cu + 2H2SO4 + O2↑
电解
6.用惰性电极电解电解质溶液的一般规律
【例3】 用惰性电极进行电解,下列说法正确的是( @45@ )。
A.电解稀硫酸,实质上是电解水,故溶液 不变
B.电解稀 溶液,要消耗 ,故溶液 减小
C.电解 溶液,在阴极上和阳极上生成气体产物的物质的量之比为
D.电解 溶液,在阴极上和阳极上生成产物的物质的量之比为
D
【例4】 用惰性电极电解下列溶液一段时间后再加入一定量的某种纯净物(方括号内的物质),能使溶液恢复到原来的成分和浓度的是( @47@ )。(已知原溶液中电解质未完全电解)
A. B.
C. D.
B
随堂检测·精评价
1.用石墨作电极电解 溶液,下列说法正确的是( @49@ )。
A.在阳极上析出金属铜 B.在阴极上析出金属铜
C.在阴极上产生有刺激性气味的气体 D.阳极上发生还原反应
B
2.图中 、 分别是直流电源的两极,通电后发现 电极质量增加, 电极处有无色无味气体放出,符合这一情况的是( )。
选项 电极 电极 极 溶液的溶质
锌 石墨 负极
石墨 石墨 负极
银 铁 正极
铜 石墨 负极
A
3.有下列两组电解池,电极均为惰性电极,实验时通电时间和电流强度都相同。
(1) 电解后,溶液 增大的是_____(填“甲”、“乙”、“丙”或“丁”,下同),溶液 减小的是_________。
丙
甲、丁
(2) 电解后电极上有固体析出的是_____。
丁
(3) 电解时生成的气体在同温同压下总体积相等的是_____________。
甲、乙、丙
4.[2021年海南卷] 液氨中存在平衡: 。电解池装置如图所示,以 的液氨溶液为电解液,电解过程中 、 两个惰性电极上都有气泡产生。下列有关说法正确的是( @57@ )。
B
A.
B.
C.电解过程中,阴极附近
D.理论上两极产生的气体物质的量之比为
5.[2021年天津卷] 如下图所示电解装置中,通电后石墨电极Ⅱ上有 生成, 逐渐溶解,下列判断
A.
B.通电一段时间后,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色
C.随着电解的进行,
D.当
C
