4.1.2 化学电源 课件(共46张ppt,WPS打开) 2022-2023学年上学期高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.1.2 化学电源 课件(共46张ppt,WPS打开) 2022-2023学年上学期高二化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 16:02:18 | ||
图片预览










文档简介
(共46张PPT)
第四章 化学反应与电能
第一节 原电池
第2课时 化学电源
1.了解和学习电池的分类、优点及适用范围。
2.了解几类化学电源的构造、原理。(重点)
3.掌握原电池电极方程式及总反应方程式的书写。(重难点)
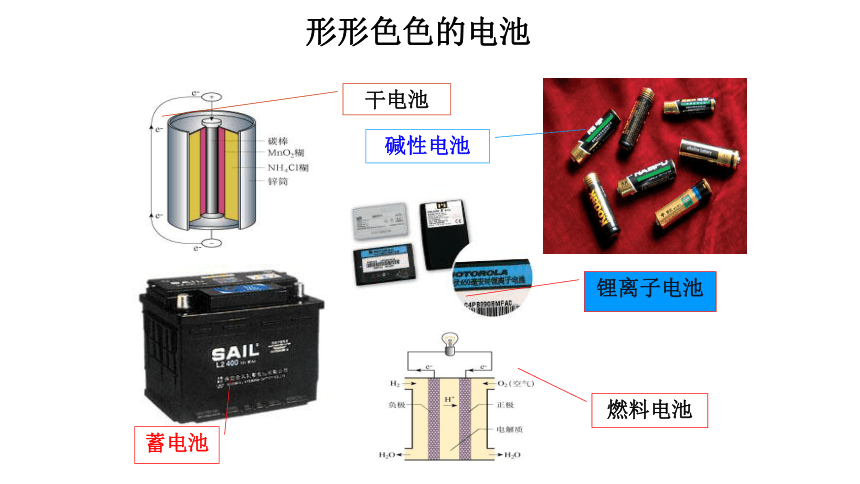
形形色色的电池
干电池
碱性电池
蓄电池
锂离子电池
燃料电池
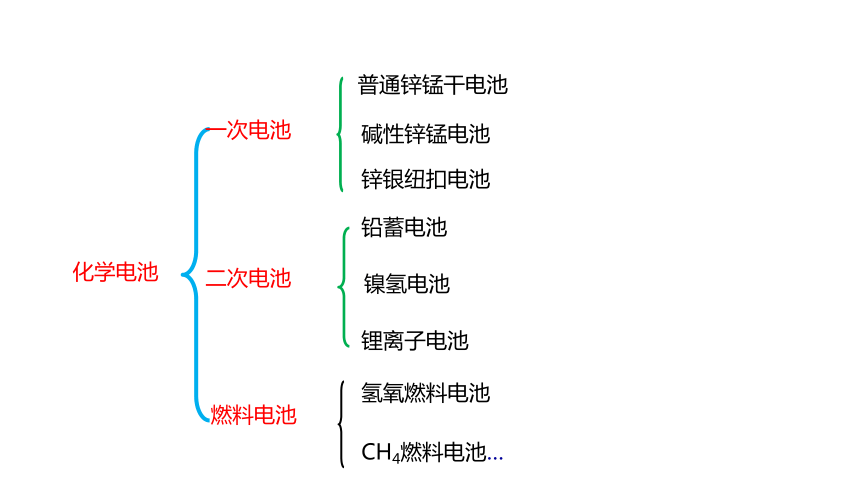
化学电池
一次电池
二次电池
燃料电池
碱性锌锰电池
铅蓄电池
锂离子电池
镍氢电池
普通锌锰干电池
锌银纽扣电池
氢氧燃料电池
CH4燃料电池…
电池优劣的判断标准:
① 比能量
[单位:(w·h/kg),(w·h/L)]
指电池单位质量或单位体积所能输出电能的多少。
② 比功率
[单位:(W/kg,W/L)]
指电池单位质量或单位体积所能输出功率的大小。
③ 电池的可储存时间的长短
一般情况,质量轻、体积小而输出电能多、功率大、储存时间长的电池,其质量好。
(1)普通锌锰电池
总反应:Zn+2NH4Cl+2MnO2=[Zn(NH3)2]Cl2+2MnO(OH)
正极:2MnO2+2NH4++2e- = 2MnO(OH)+2NH3↑
1.一次电池
活性物质(发生氧化还原反应的物质)消耗到一定程度,就不能使用的电池叫一次电池,也叫干电池。
二、化学电源
优点:制作简单,价格便宜;
缺点:放电时间短,电压下降快;容易漏液(锌外壳变薄)
电极 :
Zn为负极,碳棒为正极,活性物质MnO2
电解液:
NH4Cl、ZnCl2 糊
负极:Zn-2e-+2NH3 = [Zn(NH3)2]2+
(2)碱性锌锰电池
电极 :
Zn一端作负极,二氧化锰一端作正极
电解液:
KOH
负极:
Zn + 2OH- - 2e- = Zn(OH)2
2MnO2 + H2O + 2e- = 2MnO(OH)+ 2OH-
Zn + 2MnO2 + 2H2O = Zn(OH)2 + 2MnO(OH)
总反应:
正极:
优点:能量和储存时间有所提高,适用于大电流和连续放电;不易发生泄漏
(3)锌银纽扣电池
电极:
Zn为负极,Ag2O为正极
负极:
Zn + 2OH- - 2e- = Zn(OH)2
总反应:
正极:
Ag2O+2e-+H2O = 2Ag+2OH-
Zn+Ag2O+H2O = Zn(OH)2+2Ag
优点:比能量大、电压稳定,储存时间长,适宜小电流连续放电。广泛用于电子手表、照相机、计算器和其他微型电子仪器。
电解质:
KOH
银锌电池广泛用作电子仪器的电源,它的充电和放电过程可以表示为:
在此电池放电时,负极上发生反应的物质是( )
A、Ag B、Zn(OH)2
C、Ag2O D、Zn
2Ag + Zn(OH)2 Ag2O +Zn+H2O
D
2.充电电池
充电电池又称二次电池,放电时所进行的氧化还原反应,在充电时又逆向进行,使电池恢复到放电前的状态。
铅酸蓄电池
镍氢电池
锂离子电池
Pb+PbO2+2H2SO4 2PbSO4+2H2O
电极:Pb为负极, PbO2为正极。
电解液: 30%的H2SO4溶液
(1)铅酸蓄电池
负极:
正极:
总电池反应:
Pb+SO42--2e- = PbSO4
PbO2+4H++SO42-+2e- = PbSO4+2H2O
Pb+PbO2+2H2SO4 = 2PbSO4+2H2O
放电过程:
放电过程中,负极质量的变化是 ,H2SO4溶液的浓度 。
增大
减小
(1)铅酸蓄电池
充电过程:
阴极(还原反应):
阳极(氧化反应):
充电时,铅酸蓄电池正极与直流电源正极相连,负极与直流电源负极相连。
即“负极接负极,正极接正极”。
铅蓄电池优点:电压稳定、使用方便、安全可靠、价格低廉
Pb+PbO2+2H2SO4 2PbSO4+2H2O
总反应:2PbSO4+2H2O =Pb+PbO2+2H2SO4
练习、铅酸电池常用作汽车电瓶,其构造如图所示,工作时该电池总的方程式为:
Pb+PbO2+2H2SO4===2PbSO4+2H2O
按要求回答下列问题:
(1)负极材料是____,正极材料是______,电解质
溶液是_______。
(2)工作时,电解质溶液中的H+移向___________极。
(3)工作时,电解质溶液中硫酸的浓度_____(填“增大”“减小”或“不变”)。
Pb
PbO2
H2SO4
PbO2电(正)
减小
(2)锂离子电池
总反应:
负极:
正极:
用途:便携式电子设备(智能手机、笔记本电脑等)和交通工具(电动汽车、电动自行车等;大型储能电站等)
LixCy- xe- = xLi++Cy
Li1-xCoO2 + xLi+ + xe- = LiCoO2
电极:负极为嵌锂石墨,正极为LiCoO2(钴酸锂)
电解质溶液:LiPF6(六氟磷酸锂)的碳酸酯溶液
优点:质量小、体积小、储存和输出能量大。
原理: 利用原电池的工作原理,燃料和氧化剂分别放在两个电极上发生氧化还原反应,将化学能直接转化为电能。
与其他电池的区别:反应物不储存在电池内部,由外设设备提供燃料和氧化剂。
优点:高效(燃料利用率高,超过80%),环境友好。
3.燃料电池
介质 电池反应:2H2 +O2 = 2H2O 酸性 负极
正极
碱性 负极
正极
熔融氧化物 负极
正极
2H2 - 4e- = 4H+
O2 + 4H+ + 4e- = 2H2O
2H2 + 4OH-- 4e- = 4H2O
O2 + 2H2O + 4e- = 4OH-
(1)氢氧燃料电池
2H2 - 4e- +2O2-= 2H2O
O2 + 4e- = 2O2-
练习、据媒体报道:以氢氧燃料电池为动力的公交车即将在北京试运行。质子交换膜燃料电池(PEMFC)常作为电动汽车的动力源。该燃料电池以氢为燃料,空气为氧化剂,铂做催化剂,导电离子是H+。下列对该燃料电池的描述中正确的是( )
①正极反应为:O2 + 4H+ + 4e- = 2H2O
②负极反应为:2H2-4e- = 4H+
③总的化学反应为:2H2 + O2 = 2H2O
④氢离子通过电解质向正极移动
A①②③ B②③④ C①②④ D①②③④
D
电解质 酸性(H2SO4) 碱性(KOH)
总反应
负极
正极
CH4 + 2O2 = CO2+ 2H2O
CH4 - 8e- + 2H2O = CO2 +8H+
2O2 + 8e- + 8H+ = 4H2O
(2)甲烷燃料电池
CH4 + 2O2 + 2OH- = CO32- + 3H2O
CH4 + 10OH- - 8e- = CO32- + 7H2O
2O2 + 4H2O + 8e- = 8OH-
电解质 熔融氧化物 熔融碳酸盐
总反应
负极
正极
CH4 + 2O2 = CO2+ 2H2O
(2)甲烷燃料电池
CH4 - 8e-+ 4O2- = CO2 + 2H2O
2O2 + 8e- = 4O2-
CH4 + 2O2 = CO2+ 2H2O
CH4 - 8e-+ 4CO32- = 5CO2 + 2H2O
2O2 + 8e- + 4CO2 = 4CO32-
练习1、书写甲醇(CH3OH)燃料电池的酸性、碱性环境下的电极反应式
酸性
总反应:2CH3OH + 3O2 = 2CO2 + 4H2O
正极:3O2 + 12e-+12H+ = 6H2O
负极:2CH3OH - 12e- +2H2O = 12H+ + 2CO2
碱性
总反应:2CH3OH + 3O2 +4OH-= 2CO32-+ 6H2O
正极:3O2 + 12e-+6H2O = 12OH-
负极:2CH3OH - 12e- +16OH- = 2CO32-+ 12H2O
练习2、如图为肼燃料电池示意图,请写出正、负极电极反应式及总反应式
正极:O2+4e-+2H2O = 4OH-
负极:N2H4-4e-+4OH- = 4H2O+N2
总反应:N2H4+O2 = N2+2H2O
【例1】 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。某碱性锌锰电池以氢氧化钾溶液为电解液,电池反应为 ,下列说法错误 的是( @42@ )。
A.电池工作时,锌失去电子
B.电池的正极反应式为
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过 电子,锌的质量理论上减小
C
【例2】 微型纽扣电池在现代生活中有广泛应用,有一种锌银电池,其总反应为 。下列叙述中正确的是( @44@ )。
A.在使用过程中,电池负极区溶液的 逐渐增大
B.在使用过程中,电子由 经外电路流向
C. 是负极, 是正极
D. 发生还原反应, 发生氧化反应
C
【例3】 镍镉电池是一种二次电池,使用寿命为10~15年。镍镉电池的总反应为 。下列说法不正确 的是( @49@ )。
A.放电时,负极发生氧化反应,电极反应式为
B.充电时,阳极反应式为
C.电池工作时,负极区 增大,正极区 减小
D.该电池充电时将电能转化为化学能
C
【例4】 我国科学家发明了一种“可固氮”的锂-氮二次电池,用可传递 的醚类作电解质,电池的总反应为 。下列说法正确的是( @51@ )。
A.固氮时,锂电极上发生还原反应
B.脱氮时,钌复合电极的电极反应式:
C.固氮时,外电路中电子由钌复合电极流向锂电极
D.固氮时,钌复合电极作负极
B
【例5】 煤-空气燃料电池原理如图所示,下列说法错误 的是( @60@ )。
A.随着反应的进行,氧化物电解质的量不断减少
B.负极的电极反应式为
C.电极
D.煤-空气燃料电池的能量效率比煤燃烧发电的能量效率高
A
【例6】 一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为 。下列有关说法正确的是( @62@ )。
A.检测时,电解质溶液中的 向负极移动
B.若有 电子转移,则在标准状况下消耗 氧气
C.电池反应的化学方程式为
D.正极上发生的反应为
C
1.下列电池不属于 化学电池的是( @64@ )。
A.碱性干电池 B.铅酸蓄电池 C.燃料电池 D.太阳能电池
D
2.下列有关电池的说法错误 的是( @66@ )。
A.手机中使用的锂离子电池属于二次电池
B.甲醇燃料电池可把化学能转化为
C.锌铜原电池工作时,电子沿外电路从铜电极流向锌电极
D.铅酸蓄电池使用一段时间后,电解质溶液的酸性减弱,导电能力下降
C
3.瑞典 公司设计的曾用于驱动潜艇的液氨-液氧燃料电池的工作原理如图所示,下列有关说法正确的是( @68@ )。
A.电极2发生氧化反应
B.电池工作时,
C.电流由电极1经外电路流向电极2
D.电极1发生的电极反应为
D
4.[2021年辽宁卷] 如图,某液态金属储能电池放电时产生金属化合物 。下列说法正确的是( @70@ )。
A.放电时,
B.放电时,
C.充电时,
D.充电时,
B
5.[2021年福建卷] 催化剂 (Ⅱ)的应用,使 电池的研究取得了新的进展。 电池结构和该催化剂作用下正极反应可能的历程如图所示。
下列说法错误 的是( @72@ )。
A.
B.充电时,
C.放电时,正极反应为
D.
D
练习与应用
1.为了验证a、b、c三种金属的活动性顺序进行如下实验:①将金属片a、b插入稀硫酸中,用导线将
它们与电流表相连,发现a是负极;②用金属片b、c替换a、b后重复上述实验,发现c是正极。则
a、b、c三种金属的活动性由强到弱的顺序为 。
2.根据化学反应设计原电池(选用相同的盐桥)时,下列各项中合理的是( )
选项 A B C D
正极(金属/电解质溶液) Zn/ZnSO4 溶液 Fe/FeCl2溶液 Zn/H2SO4(稀) Fe/ZnSO4 溶液
负极(金属/电解质溶液) Fe/H2SO4(稀) Zn/ZnSO4 溶液 Fe/FeCl2溶液 Zn/FeCl2溶液
练习与应用
3.碱性锌锰电池的总反应为:Zn+2MnO2+2H2O = 2MnO(OH) + Zn(OH)2。下列关于该电池的说法中正确的是( )
A.Zn为负极,MnO2为正极 B.工作时KOH没有发挥作用
C.工作时电子由MnO2经外电路流向Zn D.Zn发生还原反应,MnO2发生氧化反应
4.贮备电池具有下列特点:日常将电池的一种组成部分(如电解质溶液)与其他部分隔离备用;使用时电池可迅速被激活并提供足量电能。贮备电池主要用于应急救援和武器系统等。Mg-AgCl电池
是一种可被海水激活的贮备电池。下列叙述中错误的是( )
A.负极反应为Mg-2e- = Mg2+ B.正极反应为Ag+ + e- = Ag
C.电池放电时Cl-由正极向负极迁移 D.负极会发生副反应:Mg+2H2O=Mg(OH)2+H2↑
练习与应用
5.根据甲醇在酸性电解质溶液中与氧气作用生成二氧化碳和水的反应,设计一种燃料电池。该燃料电池工作时,负极上发生的反应为( )
A. CH3OH + O2 -2e- = H2O + CO2 + 2H+ B. O2 + 4H+ + 4e- = 2H2O
C. CH3OH-6e- + H2O = CO2 ↑ +6H+ D. 4OH- - 4e- = O2 ↑ +2H2O
6.普通锌锰电池(如右图)和碱性锌锰电池是生活中用量很大的两种干电池。普通锌锰电池放电时发生的主要反应为:
Zn + 2NH4Cl + 2MnO2 = Zn(NH3)2Cl2 + 2MnO(OH)
(1)请写出普通锌锰电池中的负极材料、电解质的主要成分,以及正极发生的主要反应。
(2)与普通锌锰电池相比,请指出碱性锌锰电池的优点,并说明理由。
高考真题
原电池
1.(2022·全国甲卷)一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示(KOH溶液中,Zn2+以Zn(OH)42-存在)。电池放电时,下列叙述错误的是
A.Ⅱ区的K+通过隔膜向Ⅲ区迁移
B.Ⅰ区的SO42-通过隔膜向Ⅱ区迁移
C. MnO2电极反应:MnO2+2e-+4H+=Mn2++2H2O
D.电池总反应:
Zn+4OH-+MnO2+4H+=Zn(OH) 42- +Mn2++2H2O
4.(2021·山东)以KOH溶液为离子导体,分别组成CH3OH—O2、N2H4—O2、(CH3)2NNH2—O2清洁燃料电池,下列说法正确的是
A.放电过程中,K+均向负极移动
B.放电过程中,KOH物质的量均减小
C.消耗等质量燃料,(CH3)2NNH2—O2燃料电池的理论放电量最大
D.消耗1molO2时,理论上N2H4—O2燃料电池气体产物的体积在标准状况下为11.2L
5.(2021·河北)K—O2电池结构如图,a和b为两个电极,其中之一为单质钾片。关于该电池,下列说法错误的是
A.隔膜允许K+通过,不允许O2通过
B.放电时,电流由b电极沿导线流向a电极;充电时,b电极为阳极
C.产生1Ah电量时,生成KO2的质量与消耗O2的质量比值约为2.22
D.用此电池为铅酸蓄电池充电,消耗3.9g钾时,铅酸蓄电池消耗0.9g水
6.(2021·浙江)某全固态薄膜锂离子电池截面结构如图所示,电极A为非晶硅薄膜,充电时Li+得电子成为Li嵌入该薄膜材料中;电极B为LiCoO2薄膜;集流体起导电作用。下列说法不正确的是
8.(2019新课标Ⅰ)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是
第四章 化学反应与电能
第一节 原电池
第2课时 化学电源
1.了解和学习电池的分类、优点及适用范围。
2.了解几类化学电源的构造、原理。(重点)
3.掌握原电池电极方程式及总反应方程式的书写。(重难点)
形形色色的电池
干电池
碱性电池
蓄电池
锂离子电池
燃料电池
化学电池
一次电池
二次电池
燃料电池
碱性锌锰电池
铅蓄电池
锂离子电池
镍氢电池
普通锌锰干电池
锌银纽扣电池
氢氧燃料电池
CH4燃料电池…
电池优劣的判断标准:
① 比能量
[单位:(w·h/kg),(w·h/L)]
指电池单位质量或单位体积所能输出电能的多少。
② 比功率
[单位:(W/kg,W/L)]
指电池单位质量或单位体积所能输出功率的大小。
③ 电池的可储存时间的长短
一般情况,质量轻、体积小而输出电能多、功率大、储存时间长的电池,其质量好。
(1)普通锌锰电池
总反应:Zn+2NH4Cl+2MnO2=[Zn(NH3)2]Cl2+2MnO(OH)
正极:2MnO2+2NH4++2e- = 2MnO(OH)+2NH3↑
1.一次电池
活性物质(发生氧化还原反应的物质)消耗到一定程度,就不能使用的电池叫一次电池,也叫干电池。
二、化学电源
优点:制作简单,价格便宜;
缺点:放电时间短,电压下降快;容易漏液(锌外壳变薄)
电极 :
Zn为负极,碳棒为正极,活性物质MnO2
电解液:
NH4Cl、ZnCl2 糊
负极:Zn-2e-+2NH3 = [Zn(NH3)2]2+
(2)碱性锌锰电池
电极 :
Zn一端作负极,二氧化锰一端作正极
电解液:
KOH
负极:
Zn + 2OH- - 2e- = Zn(OH)2
2MnO2 + H2O + 2e- = 2MnO(OH)+ 2OH-
Zn + 2MnO2 + 2H2O = Zn(OH)2 + 2MnO(OH)
总反应:
正极:
优点:能量和储存时间有所提高,适用于大电流和连续放电;不易发生泄漏
(3)锌银纽扣电池
电极:
Zn为负极,Ag2O为正极
负极:
Zn + 2OH- - 2e- = Zn(OH)2
总反应:
正极:
Ag2O+2e-+H2O = 2Ag+2OH-
Zn+Ag2O+H2O = Zn(OH)2+2Ag
优点:比能量大、电压稳定,储存时间长,适宜小电流连续放电。广泛用于电子手表、照相机、计算器和其他微型电子仪器。
电解质:
KOH
银锌电池广泛用作电子仪器的电源,它的充电和放电过程可以表示为:
在此电池放电时,负极上发生反应的物质是( )
A、Ag B、Zn(OH)2
C、Ag2O D、Zn
2Ag + Zn(OH)2 Ag2O +Zn+H2O
D
2.充电电池
充电电池又称二次电池,放电时所进行的氧化还原反应,在充电时又逆向进行,使电池恢复到放电前的状态。
铅酸蓄电池
镍氢电池
锂离子电池
Pb+PbO2+2H2SO4 2PbSO4+2H2O
电极:Pb为负极, PbO2为正极。
电解液: 30%的H2SO4溶液
(1)铅酸蓄电池
负极:
正极:
总电池反应:
Pb+SO42--2e- = PbSO4
PbO2+4H++SO42-+2e- = PbSO4+2H2O
Pb+PbO2+2H2SO4 = 2PbSO4+2H2O
放电过程:
放电过程中,负极质量的变化是 ,H2SO4溶液的浓度 。
增大
减小
(1)铅酸蓄电池
充电过程:
阴极(还原反应):
阳极(氧化反应):
充电时,铅酸蓄电池正极与直流电源正极相连,负极与直流电源负极相连。
即“负极接负极,正极接正极”。
铅蓄电池优点:电压稳定、使用方便、安全可靠、价格低廉
Pb+PbO2+2H2SO4 2PbSO4+2H2O
总反应:2PbSO4+2H2O =
练习、铅酸电池常用作汽车电瓶,其构造如图所示,工作时该电池总的方程式为:
Pb+PbO2+2H2SO4===2PbSO4+2H2O
按要求回答下列问题:
(1)负极材料是____,正极材料是______,电解质
溶液是_______。
(2)工作时,电解质溶液中的H+移向___________极。
(3)工作时,电解质溶液中硫酸的浓度_____(填“增大”“减小”或“不变”)。
Pb
PbO2
H2SO4
PbO2电(正)
减小
(2)锂离子电池
总反应:
负极:
正极:
用途:便携式电子设备(智能手机、笔记本电脑等)和交通工具(电动汽车、电动自行车等;大型储能电站等)
LixCy- xe- = xLi++Cy
Li1-xCoO2 + xLi+ + xe- = LiCoO2
电极:负极为嵌锂石墨,正极为LiCoO2(钴酸锂)
电解质溶液:LiPF6(六氟磷酸锂)的碳酸酯溶液
优点:质量小、体积小、储存和输出能量大。
原理: 利用原电池的工作原理,燃料和氧化剂分别放在两个电极上发生氧化还原反应,将化学能直接转化为电能。
与其他电池的区别:反应物不储存在电池内部,由外设设备提供燃料和氧化剂。
优点:高效(燃料利用率高,超过80%),环境友好。
3.燃料电池
介质 电池反应:2H2 +O2 = 2H2O 酸性 负极
正极
碱性 负极
正极
熔融氧化物 负极
正极
2H2 - 4e- = 4H+
O2 + 4H+ + 4e- = 2H2O
2H2 + 4OH-- 4e- = 4H2O
O2 + 2H2O + 4e- = 4OH-
(1)氢氧燃料电池
2H2 - 4e- +2O2-= 2H2O
O2 + 4e- = 2O2-
练习、据媒体报道:以氢氧燃料电池为动力的公交车即将在北京试运行。质子交换膜燃料电池(PEMFC)常作为电动汽车的动力源。该燃料电池以氢为燃料,空气为氧化剂,铂做催化剂,导电离子是H+。下列对该燃料电池的描述中正确的是( )
①正极反应为:O2 + 4H+ + 4e- = 2H2O
②负极反应为:2H2-4e- = 4H+
③总的化学反应为:2H2 + O2 = 2H2O
④氢离子通过电解质向正极移动
A①②③ B②③④ C①②④ D①②③④
D
电解质 酸性(H2SO4) 碱性(KOH)
总反应
负极
正极
CH4 + 2O2 = CO2+ 2H2O
CH4 - 8e- + 2H2O = CO2 +8H+
2O2 + 8e- + 8H+ = 4H2O
(2)甲烷燃料电池
CH4 + 2O2 + 2OH- = CO32- + 3H2O
CH4 + 10OH- - 8e- = CO32- + 7H2O
2O2 + 4H2O + 8e- = 8OH-
电解质 熔融氧化物 熔融碳酸盐
总反应
负极
正极
CH4 + 2O2 = CO2+ 2H2O
(2)甲烷燃料电池
CH4 - 8e-+ 4O2- = CO2 + 2H2O
2O2 + 8e- = 4O2-
CH4 + 2O2 = CO2+ 2H2O
CH4 - 8e-+ 4CO32- = 5CO2 + 2H2O
2O2 + 8e- + 4CO2 = 4CO32-
练习1、书写甲醇(CH3OH)燃料电池的酸性、碱性环境下的电极反应式
酸性
总反应:2CH3OH + 3O2 = 2CO2 + 4H2O
正极:3O2 + 12e-+12H+ = 6H2O
负极:2CH3OH - 12e- +2H2O = 12H+ + 2CO2
碱性
总反应:2CH3OH + 3O2 +4OH-= 2CO32-+ 6H2O
正极:3O2 + 12e-+6H2O = 12OH-
负极:2CH3OH - 12e- +16OH- = 2CO32-+ 12H2O
练习2、如图为肼燃料电池示意图,请写出正、负极电极反应式及总反应式
正极:O2+4e-+2H2O = 4OH-
负极:N2H4-4e-+4OH- = 4H2O+N2
总反应:N2H4+O2 = N2+2H2O
【例1】 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。某碱性锌锰电池以氢氧化钾溶液为电解液,电池反应为 ,下列说法
A.电池工作时,锌失去电子
B.电池的正极反应式为
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过 电子,锌的质量理论上减小
C
【例2】 微型纽扣电池在现代生活中有广泛应用,有一种锌银电池,其总反应为 。下列叙述中正确的是( @44@ )。
A.在使用过程中,电池负极区溶液的 逐渐增大
B.在使用过程中,电子由 经外电路流向
C. 是负极, 是正极
D. 发生还原反应, 发生氧化反应
C
【例3】 镍镉电池是一种二次电池,使用寿命为10~15年。镍镉电池的总反应为 。下列说法
A.放电时,负极发生氧化反应,电极反应式为
B.充电时,阳极反应式为
C.电池工作时,负极区 增大,正极区 减小
D.该电池充电时将电能转化为化学能
C
【例4】 我国科学家发明了一种“可固氮”的锂-氮二次电池,用可传递 的醚类作电解质,电池的总反应为 。下列说法正确的是( @51@ )。
A.固氮时,锂电极上发生还原反应
B.脱氮时,钌复合电极的电极反应式:
C.固氮时,外电路中电子由钌复合电极流向锂电极
D.固氮时,钌复合电极作负极
B
【例5】 煤-空气燃料电池原理如图所示,下列说法
A.随着反应的进行,氧化物电解质的量不断减少
B.负极的电极反应式为
C.电极
D.煤-空气燃料电池的能量效率比煤燃烧发电的能量效率高
A
【例6】 一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为 。下列有关说法正确的是( @62@ )。
A.检测时,电解质溶液中的 向负极移动
B.若有 电子转移,则在标准状况下消耗 氧气
C.电池反应的化学方程式为
D.正极上发生的反应为
C
1.下列电池
A.碱性干电池 B.铅酸蓄电池 C.燃料电池 D.太阳能电池
D
2.下列有关电池的说法
A.手机中使用的锂离子电池属于二次电池
B.甲醇燃料电池可把化学能转化为
C.锌铜原电池工作时,电子沿外电路从铜电极流向锌电极
D.铅酸蓄电池使用一段时间后,电解质溶液的酸性减弱,导电能力下降
C
3.瑞典 公司设计的曾用于驱动潜艇的液氨-液氧燃料电池的工作原理如图所示,下列有关说法正确的是( @68@ )。
A.电极2发生氧化反应
B.电池工作时,
C.电流由电极1经外电路流向电极2
D.电极1发生的电极反应为
D
4.[2021年辽宁卷] 如图,某液态金属储能电池放电时产生金属化合物 。下列说法正确的是( @70@ )。
A.放电时,
B.放电时,
C.充电时,
D.充电时,
B
5.[2021年福建卷] 催化剂 (Ⅱ)的应用,使 电池的研究取得了新的进展。 电池结构和该催化剂作用下正极反应可能的历程如图所示。
下列说法
A.
B.充电时,
C.放电时,正极反应为
D.
D
练习与应用
1.为了验证a、b、c三种金属的活动性顺序进行如下实验:①将金属片a、b插入稀硫酸中,用导线将
它们与电流表相连,发现a是负极;②用金属片b、c替换a、b后重复上述实验,发现c是正极。则
a、b、c三种金属的活动性由强到弱的顺序为 。
2.根据化学反应设计原电池(选用相同的盐桥)时,下列各项中合理的是( )
选项 A B C D
正极(金属/电解质溶液) Zn/ZnSO4 溶液 Fe/FeCl2溶液 Zn/H2SO4(稀) Fe/ZnSO4 溶液
负极(金属/电解质溶液) Fe/H2SO4(稀) Zn/ZnSO4 溶液 Fe/FeCl2溶液 Zn/FeCl2溶液
练习与应用
3.碱性锌锰电池的总反应为:Zn+2MnO2+2H2O = 2MnO(OH) + Zn(OH)2。下列关于该电池的说法中正确的是( )
A.Zn为负极,MnO2为正极 B.工作时KOH没有发挥作用
C.工作时电子由MnO2经外电路流向Zn D.Zn发生还原反应,MnO2发生氧化反应
4.贮备电池具有下列特点:日常将电池的一种组成部分(如电解质溶液)与其他部分隔离备用;使用时电池可迅速被激活并提供足量电能。贮备电池主要用于应急救援和武器系统等。Mg-AgCl电池
是一种可被海水激活的贮备电池。下列叙述中错误的是( )
A.负极反应为Mg-2e- = Mg2+ B.正极反应为Ag+ + e- = Ag
C.电池放电时Cl-由正极向负极迁移 D.负极会发生副反应:Mg+2H2O=Mg(OH)2+H2↑
练习与应用
5.根据甲醇在酸性电解质溶液中与氧气作用生成二氧化碳和水的反应,设计一种燃料电池。该燃料电池工作时,负极上发生的反应为( )
A. CH3OH + O2 -2e- = H2O + CO2 + 2H+ B. O2 + 4H+ + 4e- = 2H2O
C. CH3OH-6e- + H2O = CO2 ↑ +6H+ D. 4OH- - 4e- = O2 ↑ +2H2O
6.普通锌锰电池(如右图)和碱性锌锰电池是生活中用量很大的两种干电池。普通锌锰电池放电时发生的主要反应为:
Zn + 2NH4Cl + 2MnO2 = Zn(NH3)2Cl2 + 2MnO(OH)
(1)请写出普通锌锰电池中的负极材料、电解质的主要成分,以及正极发生的主要反应。
(2)与普通锌锰电池相比,请指出碱性锌锰电池的优点,并说明理由。
高考真题
原电池
1.(2022·全国甲卷)一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示(KOH溶液中,Zn2+以Zn(OH)42-存在)。电池放电时,下列叙述错误的是
A.Ⅱ区的K+通过隔膜向Ⅲ区迁移
B.Ⅰ区的SO42-通过隔膜向Ⅱ区迁移
C. MnO2电极反应:MnO2+2e-+4H+=Mn2++2H2O
D.电池总反应:
Zn+4OH-+MnO2+4H+=Zn(OH) 42- +Mn2++2H2O
4.(2021·山东)以KOH溶液为离子导体,分别组成CH3OH—O2、N2H4—O2、(CH3)2NNH2—O2清洁燃料电池,下列说法正确的是
A.放电过程中,K+均向负极移动
B.放电过程中,KOH物质的量均减小
C.消耗等质量燃料,(CH3)2NNH2—O2燃料电池的理论放电量最大
D.消耗1molO2时,理论上N2H4—O2燃料电池气体产物的体积在标准状况下为11.2L
5.(2021·河北)K—O2电池结构如图,a和b为两个电极,其中之一为单质钾片。关于该电池,下列说法错误的是
A.隔膜允许K+通过,不允许O2通过
B.放电时,电流由b电极沿导线流向a电极;充电时,b电极为阳极
C.产生1Ah电量时,生成KO2的质量与消耗O2的质量比值约为2.22
D.用此电池为铅酸蓄电池充电,消耗3.9g钾时,铅酸蓄电池消耗0.9g水
6.(2021·浙江)某全固态薄膜锂离子电池截面结构如图所示,电极A为非晶硅薄膜,充电时Li+得电子成为Li嵌入该薄膜材料中;电极B为LiCoO2薄膜;集流体起导电作用。下列说法不正确的是
8.(2019新课标Ⅰ)利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是
