第12章盐同步复习题九年级化学京改版(2013)下册(含答案)
文档属性
| 名称 | 第12章盐同步复习题九年级化学京改版(2013)下册(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 128.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-19 07:30:38 | ||
图片预览



文档简介
第12章盐同步复习题 九年级化学京改版(2013)下册
一、单选题
1.学习了物质分类与转化规律后,某同学绘制了部分物质间相互反应的关系图。图中阴影部分表示相邻两类物质的反应,其中不能用于制取ZnCl2的是( )
A.① B.② C.③ D.④
2.“柴、米、油、盐”是厨房常备用品其主要成分属于无机物的是
A.柴(纤维素) B.米(淀粉) C.油(脂肪) D.盐(氯化钠)
3.侯氏制碱法的生产过程涉及如下反应:NH3+CO2+NaCl+X=NaHCO3↓+NH4Cl,2NaHCO3Na2CO3+CO2↑+H2O。下列说法错误的是
A.X的化学式为H2O B.NaHCO3受热易分解
C.CO2和Na2CO3中碳元素的化合价不同 D.NaHCO3分解产生的CO2可以回收再利用
4.下列各组常见的固体物质中,用水不能区分的是
A.NaOH和NH4NO3
B.CuSO4和Na2SO4
C.Na2CO3和CaCO3
D.NaCl和KCl
5.兴趣小组的同学利用下图装置,探究化学反应前后物质的质量是否守恒。应选用的药品是
A.铁粉和稀盐酸液体中
B.硝酸钾晶体和水
C.碳酸钡粉末和稀硫酸
D.铜粉和硝酸银溶液
6.下列各组物质的稀溶液,不需要加入其他试剂就能鉴别出来的是( )
A.FeCl3 NaCl NaOH KCl
B.CuSO4 Ba(OH)2 HCl HNO3
C.Na2SO4 BaCl2 Na2CO3 HNO3
D.Ca(OH)2 K2CO3 CaCl2 NaCl
7.我国制碱工业的先驱——侯德榜先生,1921年留美回国后,潜心研究制碱技术,发明了将制碱与制氨结合起来的联合制碱法(又称侯氏制碱法),为纯碱和氮肥工业技术的发展做出了杰出贡献。下列物质中能与纯碱发生反应的是
A.NaOH B.NaHCO3 C.H2SO4 D.K2SO4
8.如图所示,U型管内a、b液面相平,当挤压滴管的胶头,使试剂X进入锥形瓶内,一段时间后会观察到a液面高于b液面。则试剂X、Y的组合可能是
A.水、硝酸铵
B.水、烧碱
C.稀硫酸、铁粉
D.稀盐酸、小苏打
9.化肥和农药影响农作物的产量。下列说法正确的是
A.使用化肥越多,农作物产量越高
B.铵态氮肥与熟石灰混合使用可以提高肥效
C.大量使用农药会导致土壤和食品污染,因此要杜绝使用农药
D.适当增大蔬菜大棚内二氧化碳的浓度,可以促进蔬菜的光合作用
10.下列各组物质间的反应,要借助酸碱指示剂才能判断出反应发生的是
A.锌与稀盐酸 B.氯化铁溶液与氢氧化钠溶液
C.氧化铁与稀硫酸 D.烧碱与稀硫酸
二、简答题
11.粗盐中除了泥沙以外,还含有氯化镁、硫酸钠和氯化钙等其它杂质。欲除去粗盐中的可溶性杂质,依次加入了过量的氢氧化钠溶液、氯化钡溶液和碳酸钠溶液。请你分析:
(1)此时得到的溶液中所含杂质有哪些_____?设计实验证明你的猜想_____。(写出操作步骤和现象)。
(2)为最终获得精盐,进行过滤操作后还需要增加的操作是_____。
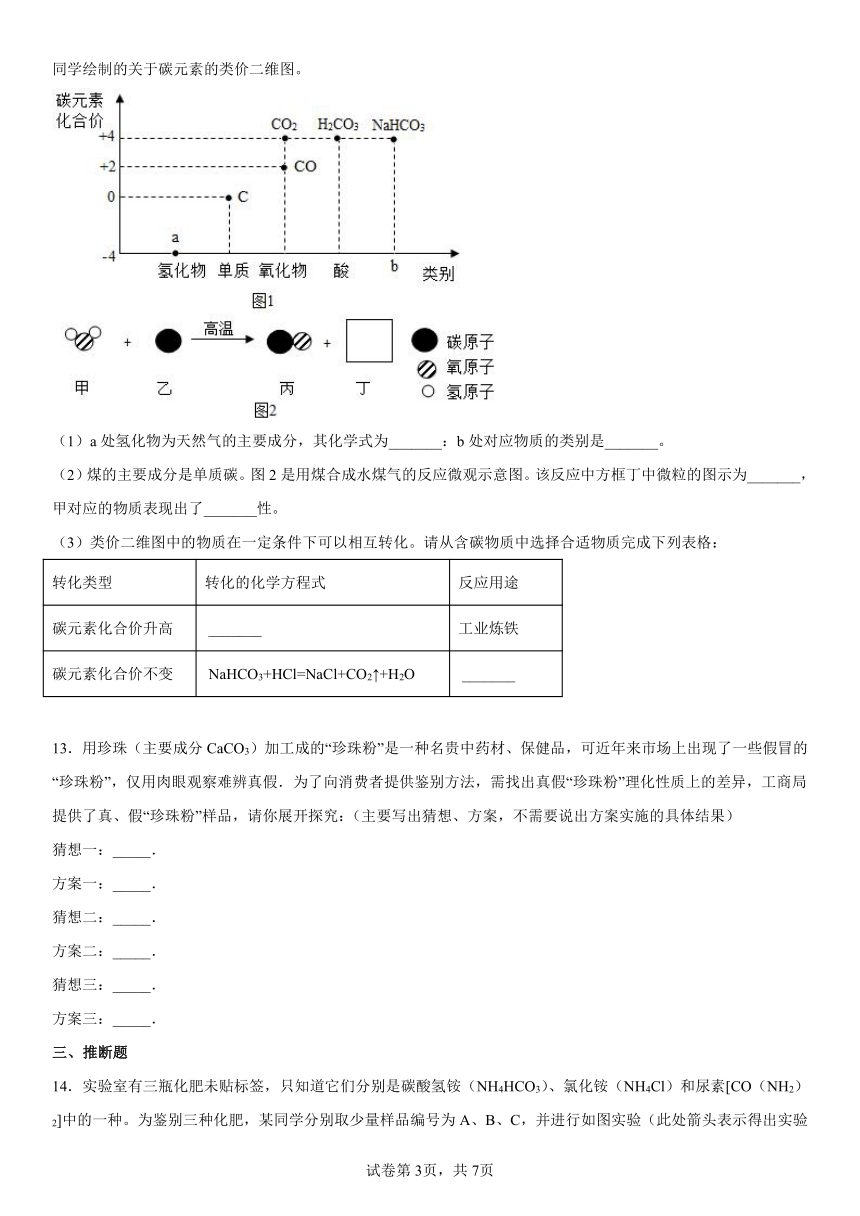
12.类价二维图反映的是元素的化合价与物质类别之间的关系,构建类价二维图是化学学习的重要方法。图1是某同学绘制的关于碳元素的类价二维图。
(1)a处氢化物为天然气的主要成分,其化学式为_______:b处对应物质的类别是_______。
(2)煤的主要成分是单质碳。图2是用煤合成水煤气的反应微观示意图。该反应中方框丁中微粒的图示为_______,甲对应的物质表现出了_______性。
(3)类价二维图中的物质在一定条件下可以相互转化。请从含碳物质中选择合适物质完成下列表格:
转化类型 转化的化学方程式 反应用途
碳元素化合价升高 _______ 工业炼铁
碳元素化合价不变 NaHCO3+HCl=NaCl+CO2↑+H2O _______
13.用珍珠(主要成分CaCO3)加工成的“珍珠粉”是一种名贵中药材、保健品,可近年来市场上出现了一些假冒的“珍珠粉”,仅用肉眼观察难辨真假.为了向消费者提供鉴别方法,需找出真假“珍珠粉”理化性质上的差异,工商局提供了真、假“珍珠粉”样品,请你展开探究:(主要写出猜想、方案,不需要说出方案实施的具体结果)
猜想一:_____.
方案一:_____.
猜想二:_____.
方案二:_____.
猜想三:_____.
方案三:_____.
三、推断题
14.实验室有三瓶化肥未贴标签,只知道它们分别是碳酸氢铵(NH4HCO3)、氯化铵(NH4Cl)和尿素[CO(NH2)2]中的一种。为鉴别三种化肥,某同学分别取少量样品编号为A、B、C,并进行如图实验(此处箭头表示得出实验结论):
根据上述实验回答:
(1)写出三种化肥的名称:A______;B______;C______。
(2)如果实验Ⅱ中B、C两种样品没有另取,对实验结果______(填“有”或“无”)影响。
(3)常温下如要鉴别B、C两种样品,______(填“能”或“不能”)采取闻气味的方法。
(4)写出操作Ⅱ中涉及的化学反应的方程式:______。
15.在盐酸、碳酸钠、火碱、二氧化碳、镁、食盐、石灰水、氧化铜、银、木炭粉等物质中,按类别选择适当物质,使下图连线的物质之间能相互反应,并回答问题:
(1)写出B的名称________.
(2)写出D的化学式________.
(3)写出E和F反应的化学方程式____________________________________________.
四、实验题
16.工业上常用电解饱和食盐水的方法制取烧碱,某化学兴趣小组为了探究久置的工业烧碱的成分,进行了如下实验:
(1)取少量样品于烧杯中,向其中加入过量稀盐酸,观察到有气泡产生,说明样品中含有_____,该反应的化学方程式为_____,接着又向烧杯中继续加入硝酸银溶液,出现了白色沉淀,甲同学立刻得出结论:样品中还含有氯化钠,乙同学对该结论提出了质疑,认为不一定含有氯化钠,理由是_____;
(2)丙同学认为除了需要确认是否含有氯化钠外,还需要确认样品中是否含有氢氧化钠,于是,大家又进行了以下实验:
①另取少量样品溶解于水,向其中加入过量硝酸钙溶液,产生白色沉淀,然后过滤、洗涤;
②向滤液中加入足量稀硝酸,再滴入硝酸银溶液后产生白色沉淀;
③向滤渣中加少量水后滴入酚酞,溶液变红.
由此判断,滤渣中的物质是_____(填化学式).
(3)根据以上经验,得出的结论正确的是_____(填序号)
A.样品中无NaCl
B.样品中只有NaOH和Na2CO3
C.样品中无NaOH
D.样品中有Na2CO3、NaOH和NaCl
17.进行如下微型实验,研究物质的性质。
(1)A中无色酚酞溶液变为红色,证明碳酸钠溶液显_____性。
(2)B中产生大量气泡的原因是_____(用化学方程式解释)。
(3)碳酸钠溶液在鉴别C、D中的物质时,依据的不同现象是_____。
(4)E中发生复分解反应,产生白色沉淀,其反应的化学方程式为_____。
18.实验室现有一瓶含少量水的碳酸氢铵样品,为测定其中碳酸氢铵的质量分数,某化学兴趣小组利用如图所示装置进行实验(该装置气密性良好,装置B、C中所装药品均足量,碱石灰是氧化钙和氢氧化钠的混合物)。已知:NH3能被酸溶液吸收。
部分实验步骤如下:
Ⅰ、打开弹簧夹,通入一段时间的氮气;
Ⅱ、关闭弹簧夹,给碳酸氢铵样品加热;
Ⅲ、当样品反应完全,…,再停止加热,直到玻璃管冷却;
Ⅳ、实验完毕,测得装置B、C中药品的质量分别增加了m1、m2。
请回答下列问题:
(1)氨气溶于水显_____(填“酸性”、“中性”或“碱性”)。NH4HCO3属于_____(选填“氮肥”“磷肥”“钾肥”或“复合肥”),该物质中氮元素的化合价为_____。
(2)装置B中盛放的液体是_____。装置C中发生反应的化学方程式为_____,装置D的作用是_____。
(3)步骤Ⅲ中,当样品反应完全时的现象是_____,停止加热前应进行的操作是_____。
(4)该样品中碳酸氢铵的质量分数的表达式为_____(用m1、m2的代数式表示)。
五、计算题
19.小新用20 g含碳酸钠53%的天然碱制取氢氧化钠用于制作“叶脉书签”(杂质不参加反应)。操作过程如下。请计算:
(1)20 g样品中碳酸钠的质量为多少g;
(2)反应后所得滤液中氢氧化钠的质量分数为多少?(写出计算过程)
20.小宁用稀盐酸和石灰石反应制取二氧化碳(石灰石中的杂质既不溶于水也不和酸反应),为了探究反应后溶液的成分,他又进行如下实验:取反应后的溶液50g于烧杯中,逐滴滴入碳酸钠溶液,发现先有气泡产生,后生成白色沉淀。下表为产生的气体总质量、沉淀总质量与滴入碳酸钠溶液总质量的关系。
碳酸钠溶液总质量/g 25.0 50.0 75.0 100.0 125.0 150.0 175.0 200.0
气体总质量/g 1.1 2.2 2.2 2.2 2.2 2.2 2.2 2.2
沉淀总质量/g 0 0 2.5 5.0 m n 9.0 9.0
(1)表中n=______。
(2)所取的反应后50g溶液中溶质是______。
(3)所用碳酸钠溶液中溶质的质量分数是多少?
21.某化肥厂生产的一种化肥包装袋上的说明如图所示,化学兴趣小组为测定其纯度,取样品5.6克,完全溶于水,向所得溶液中加入100克一定溶质质量分数的硝酸银溶液,恰好完全反应生成14.35克沉淀(杂质不与硝酸银溶液反应)。通过计算回答。
氯化铵净重25Kg 纯度≥95% XX化肥有限责任公司
(1)所用硝酸银溶液的溶质质量分数;_____。
(2)该化肥是否合格(结果精确到0.1%)。_____。
22.某化学兴趣小组为测定某石灰石样品(杂质不溶于水,也不与酸反应)中碳酸钙的质量分数,进行如图所示的实验。请根据以上信息回答下列问题:
(1)写出反应的化学方程式 ;
(2)该反应中产生二氧化碳的总质量为 g;
(3)列出求解该样品中参加反应的碳酸钙质量(x)的比例式 ;
(4)石灰石样品中碳酸钙的质量分数为 ;
(5)某同学想用上述石灰石样品250t,可制得含杂质的生石灰的质量是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.C
4.D
5.D
6.C
7.C
8.A
9.D
10.D
11. 氢氧化钠和碳酸钠 取得到的溶液,向其中滴加足量的氯化钙(或氯化钡)溶液,产生白色沉淀,静置,向上层清液中滴加无色酚酞溶液,溶液变为红色 向滤液中加入适量的稀盐酸,充分反应后蒸发结晶
12. CH4 盐 氧化 Fe2O3+3CO 2Fe+3CO2 治疗胃酸过多
13. 真假“珍珠粉”灼烧后可能有不同现象 取样,在酒精灯火焰上灼烧片刻,观察颜色、状态变化 真、假“珍珠粉”的溶解性可能不同 取样,分别将它们的放入足量的水中,分辨溶解性有无差异 真、假“珍珠粉”的是否与盐酸反应冒气泡 取样,分别将它们的放入装有盐酸的试管中,观察气泡有无差异
14. 尿素 碳酸氢铵 氯化铵 无 能 NH4HCO3+HCl═NH4Cl+H2O+CO2↑
15. 盐酸 Ca(OH)2 C+CO22CO
16. 碳酸钠 Na2CO3+2HCl═2NaCl+H2O+CO2↑ 由于事先“向其中加入过量稀盐酸”,引入了氯离子,无法判断氯离子是来自于盐酸还是原样品 碳酸钙 D
17. 碱 Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ 碳酸钠溶液与氢氧化钠溶液不反应,无现象;碳酸钠溶液与石灰水反应生成碳酸钙白色沉淀和水 Na2CO3 + CaCl2 == CaCO3 ↓+ 2NaCl
18. 碱性 氮肥 -3 浓硫酸 CO2+2NaOH=Na2CO3+H2O 防止空气中的二氧化碳进入装置C 玻璃管中样品完全消失 打开弹簧夹,通入一段时间的氮气
19.(1)10.6g
20 g样品中碳酸钠的质量为20g×53%=10.6g
(2)设反应生成氢氧化钠的质量为x,
反应后滤液中氢氧化钠的质量分数为×100%=4%;
答:反应后所得滤液中氢氧化钠的质量分数为4%。
20.(1)9.0
(2)氯化钙和氯化氢CaCl2和HCl
(3)解:设所用碳酸钠溶液中溶质的质量分数为x
答:所用碳酸钠溶液中溶质的质量分数是10.6%。
21.解:设硝酸银的质量为x,氯化铵质量为y。
x=17g
y=5.35g
所用硝酸银溶液的溶质质量分数
样品的纯度为
故填:17%,合格
22.(1)(2)8.8(3)20g(4)80%(5)162t
答案第1页,共2页
答案第1页,共2页
一、单选题
1.学习了物质分类与转化规律后,某同学绘制了部分物质间相互反应的关系图。图中阴影部分表示相邻两类物质的反应,其中不能用于制取ZnCl2的是( )
A.① B.② C.③ D.④
2.“柴、米、油、盐”是厨房常备用品其主要成分属于无机物的是
A.柴(纤维素) B.米(淀粉) C.油(脂肪) D.盐(氯化钠)
3.侯氏制碱法的生产过程涉及如下反应:NH3+CO2+NaCl+X=NaHCO3↓+NH4Cl,2NaHCO3Na2CO3+CO2↑+H2O。下列说法错误的是
A.X的化学式为H2O B.NaHCO3受热易分解
C.CO2和Na2CO3中碳元素的化合价不同 D.NaHCO3分解产生的CO2可以回收再利用
4.下列各组常见的固体物质中,用水不能区分的是
A.NaOH和NH4NO3
B.CuSO4和Na2SO4
C.Na2CO3和CaCO3
D.NaCl和KCl
5.兴趣小组的同学利用下图装置,探究化学反应前后物质的质量是否守恒。应选用的药品是
A.铁粉和稀盐酸液体中
B.硝酸钾晶体和水
C.碳酸钡粉末和稀硫酸
D.铜粉和硝酸银溶液
6.下列各组物质的稀溶液,不需要加入其他试剂就能鉴别出来的是( )
A.FeCl3 NaCl NaOH KCl
B.CuSO4 Ba(OH)2 HCl HNO3
C.Na2SO4 BaCl2 Na2CO3 HNO3
D.Ca(OH)2 K2CO3 CaCl2 NaCl
7.我国制碱工业的先驱——侯德榜先生,1921年留美回国后,潜心研究制碱技术,发明了将制碱与制氨结合起来的联合制碱法(又称侯氏制碱法),为纯碱和氮肥工业技术的发展做出了杰出贡献。下列物质中能与纯碱发生反应的是
A.NaOH B.NaHCO3 C.H2SO4 D.K2SO4
8.如图所示,U型管内a、b液面相平,当挤压滴管的胶头,使试剂X进入锥形瓶内,一段时间后会观察到a液面高于b液面。则试剂X、Y的组合可能是
A.水、硝酸铵
B.水、烧碱
C.稀硫酸、铁粉
D.稀盐酸、小苏打
9.化肥和农药影响农作物的产量。下列说法正确的是
A.使用化肥越多,农作物产量越高
B.铵态氮肥与熟石灰混合使用可以提高肥效
C.大量使用农药会导致土壤和食品污染,因此要杜绝使用农药
D.适当增大蔬菜大棚内二氧化碳的浓度,可以促进蔬菜的光合作用
10.下列各组物质间的反应,要借助酸碱指示剂才能判断出反应发生的是
A.锌与稀盐酸 B.氯化铁溶液与氢氧化钠溶液
C.氧化铁与稀硫酸 D.烧碱与稀硫酸
二、简答题
11.粗盐中除了泥沙以外,还含有氯化镁、硫酸钠和氯化钙等其它杂质。欲除去粗盐中的可溶性杂质,依次加入了过量的氢氧化钠溶液、氯化钡溶液和碳酸钠溶液。请你分析:
(1)此时得到的溶液中所含杂质有哪些_____?设计实验证明你的猜想_____。(写出操作步骤和现象)。
(2)为最终获得精盐,进行过滤操作后还需要增加的操作是_____。
12.类价二维图反映的是元素的化合价与物质类别之间的关系,构建类价二维图是化学学习的重要方法。图1是某同学绘制的关于碳元素的类价二维图。
(1)a处氢化物为天然气的主要成分,其化学式为_______:b处对应物质的类别是_______。
(2)煤的主要成分是单质碳。图2是用煤合成水煤气的反应微观示意图。该反应中方框丁中微粒的图示为_______,甲对应的物质表现出了_______性。
(3)类价二维图中的物质在一定条件下可以相互转化。请从含碳物质中选择合适物质完成下列表格:
转化类型 转化的化学方程式 反应用途
碳元素化合价升高 _______ 工业炼铁
碳元素化合价不变 NaHCO3+HCl=NaCl+CO2↑+H2O _______
13.用珍珠(主要成分CaCO3)加工成的“珍珠粉”是一种名贵中药材、保健品,可近年来市场上出现了一些假冒的“珍珠粉”,仅用肉眼观察难辨真假.为了向消费者提供鉴别方法,需找出真假“珍珠粉”理化性质上的差异,工商局提供了真、假“珍珠粉”样品,请你展开探究:(主要写出猜想、方案,不需要说出方案实施的具体结果)
猜想一:_____.
方案一:_____.
猜想二:_____.
方案二:_____.
猜想三:_____.
方案三:_____.
三、推断题
14.实验室有三瓶化肥未贴标签,只知道它们分别是碳酸氢铵(NH4HCO3)、氯化铵(NH4Cl)和尿素[CO(NH2)2]中的一种。为鉴别三种化肥,某同学分别取少量样品编号为A、B、C,并进行如图实验(此处箭头表示得出实验结论):
根据上述实验回答:
(1)写出三种化肥的名称:A______;B______;C______。
(2)如果实验Ⅱ中B、C两种样品没有另取,对实验结果______(填“有”或“无”)影响。
(3)常温下如要鉴别B、C两种样品,______(填“能”或“不能”)采取闻气味的方法。
(4)写出操作Ⅱ中涉及的化学反应的方程式:______。
15.在盐酸、碳酸钠、火碱、二氧化碳、镁、食盐、石灰水、氧化铜、银、木炭粉等物质中,按类别选择适当物质,使下图连线的物质之间能相互反应,并回答问题:
(1)写出B的名称________.
(2)写出D的化学式________.
(3)写出E和F反应的化学方程式____________________________________________.
四、实验题
16.工业上常用电解饱和食盐水的方法制取烧碱,某化学兴趣小组为了探究久置的工业烧碱的成分,进行了如下实验:
(1)取少量样品于烧杯中,向其中加入过量稀盐酸,观察到有气泡产生,说明样品中含有_____,该反应的化学方程式为_____,接着又向烧杯中继续加入硝酸银溶液,出现了白色沉淀,甲同学立刻得出结论:样品中还含有氯化钠,乙同学对该结论提出了质疑,认为不一定含有氯化钠,理由是_____;
(2)丙同学认为除了需要确认是否含有氯化钠外,还需要确认样品中是否含有氢氧化钠,于是,大家又进行了以下实验:
①另取少量样品溶解于水,向其中加入过量硝酸钙溶液,产生白色沉淀,然后过滤、洗涤;
②向滤液中加入足量稀硝酸,再滴入硝酸银溶液后产生白色沉淀;
③向滤渣中加少量水后滴入酚酞,溶液变红.
由此判断,滤渣中的物质是_____(填化学式).
(3)根据以上经验,得出的结论正确的是_____(填序号)
A.样品中无NaCl
B.样品中只有NaOH和Na2CO3
C.样品中无NaOH
D.样品中有Na2CO3、NaOH和NaCl
17.进行如下微型实验,研究物质的性质。
(1)A中无色酚酞溶液变为红色,证明碳酸钠溶液显_____性。
(2)B中产生大量气泡的原因是_____(用化学方程式解释)。
(3)碳酸钠溶液在鉴别C、D中的物质时,依据的不同现象是_____。
(4)E中发生复分解反应,产生白色沉淀,其反应的化学方程式为_____。
18.实验室现有一瓶含少量水的碳酸氢铵样品,为测定其中碳酸氢铵的质量分数,某化学兴趣小组利用如图所示装置进行实验(该装置气密性良好,装置B、C中所装药品均足量,碱石灰是氧化钙和氢氧化钠的混合物)。已知:NH3能被酸溶液吸收。
部分实验步骤如下:
Ⅰ、打开弹簧夹,通入一段时间的氮气;
Ⅱ、关闭弹簧夹,给碳酸氢铵样品加热;
Ⅲ、当样品反应完全,…,再停止加热,直到玻璃管冷却;
Ⅳ、实验完毕,测得装置B、C中药品的质量分别增加了m1、m2。
请回答下列问题:
(1)氨气溶于水显_____(填“酸性”、“中性”或“碱性”)。NH4HCO3属于_____(选填“氮肥”“磷肥”“钾肥”或“复合肥”),该物质中氮元素的化合价为_____。
(2)装置B中盛放的液体是_____。装置C中发生反应的化学方程式为_____,装置D的作用是_____。
(3)步骤Ⅲ中,当样品反应完全时的现象是_____,停止加热前应进行的操作是_____。
(4)该样品中碳酸氢铵的质量分数的表达式为_____(用m1、m2的代数式表示)。
五、计算题
19.小新用20 g含碳酸钠53%的天然碱制取氢氧化钠用于制作“叶脉书签”(杂质不参加反应)。操作过程如下。请计算:
(1)20 g样品中碳酸钠的质量为多少g;
(2)反应后所得滤液中氢氧化钠的质量分数为多少?(写出计算过程)
20.小宁用稀盐酸和石灰石反应制取二氧化碳(石灰石中的杂质既不溶于水也不和酸反应),为了探究反应后溶液的成分,他又进行如下实验:取反应后的溶液50g于烧杯中,逐滴滴入碳酸钠溶液,发现先有气泡产生,后生成白色沉淀。下表为产生的气体总质量、沉淀总质量与滴入碳酸钠溶液总质量的关系。
碳酸钠溶液总质量/g 25.0 50.0 75.0 100.0 125.0 150.0 175.0 200.0
气体总质量/g 1.1 2.2 2.2 2.2 2.2 2.2 2.2 2.2
沉淀总质量/g 0 0 2.5 5.0 m n 9.0 9.0
(1)表中n=______。
(2)所取的反应后50g溶液中溶质是______。
(3)所用碳酸钠溶液中溶质的质量分数是多少?
21.某化肥厂生产的一种化肥包装袋上的说明如图所示,化学兴趣小组为测定其纯度,取样品5.6克,完全溶于水,向所得溶液中加入100克一定溶质质量分数的硝酸银溶液,恰好完全反应生成14.35克沉淀(杂质不与硝酸银溶液反应)。通过计算回答。
氯化铵净重25Kg 纯度≥95% XX化肥有限责任公司
(1)所用硝酸银溶液的溶质质量分数;_____。
(2)该化肥是否合格(结果精确到0.1%)。_____。
22.某化学兴趣小组为测定某石灰石样品(杂质不溶于水,也不与酸反应)中碳酸钙的质量分数,进行如图所示的实验。请根据以上信息回答下列问题:
(1)写出反应的化学方程式 ;
(2)该反应中产生二氧化碳的总质量为 g;
(3)列出求解该样品中参加反应的碳酸钙质量(x)的比例式 ;
(4)石灰石样品中碳酸钙的质量分数为 ;
(5)某同学想用上述石灰石样品250t,可制得含杂质的生石灰的质量是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.C
4.D
5.D
6.C
7.C
8.A
9.D
10.D
11. 氢氧化钠和碳酸钠 取得到的溶液,向其中滴加足量的氯化钙(或氯化钡)溶液,产生白色沉淀,静置,向上层清液中滴加无色酚酞溶液,溶液变为红色 向滤液中加入适量的稀盐酸,充分反应后蒸发结晶
12. CH4 盐 氧化 Fe2O3+3CO 2Fe+3CO2 治疗胃酸过多
13. 真假“珍珠粉”灼烧后可能有不同现象 取样,在酒精灯火焰上灼烧片刻,观察颜色、状态变化 真、假“珍珠粉”的溶解性可能不同 取样,分别将它们的放入足量的水中,分辨溶解性有无差异 真、假“珍珠粉”的是否与盐酸反应冒气泡 取样,分别将它们的放入装有盐酸的试管中,观察气泡有无差异
14. 尿素 碳酸氢铵 氯化铵 无 能 NH4HCO3+HCl═NH4Cl+H2O+CO2↑
15. 盐酸 Ca(OH)2 C+CO22CO
16. 碳酸钠 Na2CO3+2HCl═2NaCl+H2O+CO2↑ 由于事先“向其中加入过量稀盐酸”,引入了氯离子,无法判断氯离子是来自于盐酸还是原样品 碳酸钙 D
17. 碱 Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ 碳酸钠溶液与氢氧化钠溶液不反应,无现象;碳酸钠溶液与石灰水反应生成碳酸钙白色沉淀和水 Na2CO3 + CaCl2 == CaCO3 ↓+ 2NaCl
18. 碱性 氮肥 -3 浓硫酸 CO2+2NaOH=Na2CO3+H2O 防止空气中的二氧化碳进入装置C 玻璃管中样品完全消失 打开弹簧夹,通入一段时间的氮气
19.(1)10.6g
20 g样品中碳酸钠的质量为20g×53%=10.6g
(2)设反应生成氢氧化钠的质量为x,
反应后滤液中氢氧化钠的质量分数为×100%=4%;
答:反应后所得滤液中氢氧化钠的质量分数为4%。
20.(1)9.0
(2)氯化钙和氯化氢CaCl2和HCl
(3)解:设所用碳酸钠溶液中溶质的质量分数为x
答:所用碳酸钠溶液中溶质的质量分数是10.6%。
21.解:设硝酸银的质量为x,氯化铵质量为y。
x=17g
y=5.35g
所用硝酸银溶液的溶质质量分数
样品的纯度为
故填:17%,合格
22.(1)(2)8.8(3)20g(4)80%(5)162t
答案第1页,共2页
答案第1页,共2页
