第四单元盐化肥单元测试题九年级化学人教版(五四学制)全一册(含答案)
文档属性
| 名称 | 第四单元盐化肥单元测试题九年级化学人教版(五四学制)全一册(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 200.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-19 07:35:22 | ||
图片预览


文档简介
第四单元盐化肥单元测试题 九年级化学人教版(五四学制)全一册
一、单选题
1.下列化肥从外观即可与其他化肥相区别的是( )
A.硝酸钾 B.氯化铵 C.磷矿粉 D.氯化钾
2.某农用物资店的货架上待售的化肥有(NH4)2SO4、NH4H2PO4、CO(NH2)2,其中缺少的肥料品种是
A.氮肥
B.磷肥
C.钾肥
D.复合肥料
3.下列说法正确的是
A.NaHCO3俗称苏打
B.CaCO3可用作补钙剂
C.Na2CO3俗称火碱
D.K2CO3属于复合肥
4.下列实验中有化学反应发生,且能观察到明显现象的是
A.向氯化钾溶液中滴入稀硫酸
B.向硫酸钠溶液中滴入氯化锌溶液
C.向氧化铜粉末中滴入氢氧化钠溶液
D.高温下向氧化铁粉末中通入一氧化碳
5.向10mLpH为12的溶液中加入试剂,溶液的pH肯定增大的是
A.加水 B.氢氧化钠颗粒
C.pH为4的溶液 D.稀硫酸
6.食盐、食醋、纯碱均是家庭厨房中常用的物质,利用这些物质,我能够完成的实验是
①检验自来水中是否含有氯离子;
②除去热水瓶中的水垢;
③区分食盐和纯碱;
④检验鸡蛋壳中是否含有碳酸钙。
A.① ② B.① ③ C.① ④ D.②③④
7.2020年世界水日的主题是“水与气候变化”。下列关于水的说法正确的是
A.生活中硬水转化为软水的方法是煮沸
B.电解水实验中产生氢气和氧气的体积比为1:8
C.化合物之间有水生成的反应一定是复分解反应
D.过滤后的河水为纯净水
8.饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
9.下列有关NaCl的叙述,错误的是
A.不溶于水 B.溶液呈中性
C.是食盐的主要成分 D.可用于配制生理盐水
10.某同学总结的Ca(OH)2的化学性质如图,下列说法错误的是
A.甲一定是碳酸盐
B.反应②为放热反应
C.反应③可用于检验某种温室气体
D.向澄清石灰水中加入紫色石蕊试液,试液由紫色变为蓝色
11.下列实验目的与所用试剂相符的是
A.证明NaOH溶液中含有Na2CO3――酚酞试剂
B.证明NaOH溶液中含有Na2CO3――澄清石灰水
C.除去NaOH溶液中的Na2CO3杂质――稀盐酸
D.除去NaOH溶液中的Na2CO3杂质――CaCl2溶液
12.如图所示,滴管中吸入某种液体,平底烧瓶中盛有另一种物质,挤压滴管滴入液体,一段时间后气球明显鼓起。下列选项符合题意的是
选项 滴管内物质 平底烧瓶内物质
A 稀盐酸 锌粒
B 水 氧化钙
C 氢氧化钠溶液 二氧化碳气体
D 碳酸钠溶液 稀硫酸
A.A B.B
C.C D.D
二、简答题
13.请用所学的化学知识回答下列问题。
(1)氯化钠在生产和生活中的用途?(写出一种)
(2)请写出用汽油清洗油污和用洗涤剂清洗油污的各自原理。
14.某同学在验证复分解反应发生的条件时,从一瓶敞口放置的氢氧化钠溶液取出少量滴入硝酸钡溶液中,结果发现溶液中出现了白色沉淀。请帮他分析出现上述现象的原因?_____试写出有关反应的化学方程式__________。
三、推断题
15.有A,B,C,D四种可溶性的物质,每种由以下两组中的离子构成。(每种离子只能选用一次)
阳离子
阴离子
四种物质之间的反应有如下现象:
(1)A+B→白色沉淀,不溶于稀硝酸。
(2)B+D→蓝色沉淀。
(3)C+B→白色沉淀,再加稀硝酸沉淀溶解并生成C。
由此可推知:A为_____,B为_____,C为_____,D为_____。(写化学式)
16.A~F六种物质共含H、C、O、N、Ca、Cu六种元素,分别为非金属单质、金属氧化物、非金属氧化物、酸、碱、盐中的一种。其中,A为温室气体,BC均为黑色固体,盐中不含金属。相邻物质之间能发生化学反应。
(1)A的固体俗称是_______________;
(2)E与F反应的现象是______________________________;
(3)C与D反应的化学方程式________________________,属于________反应(填基本反应类型)。
四、实验题
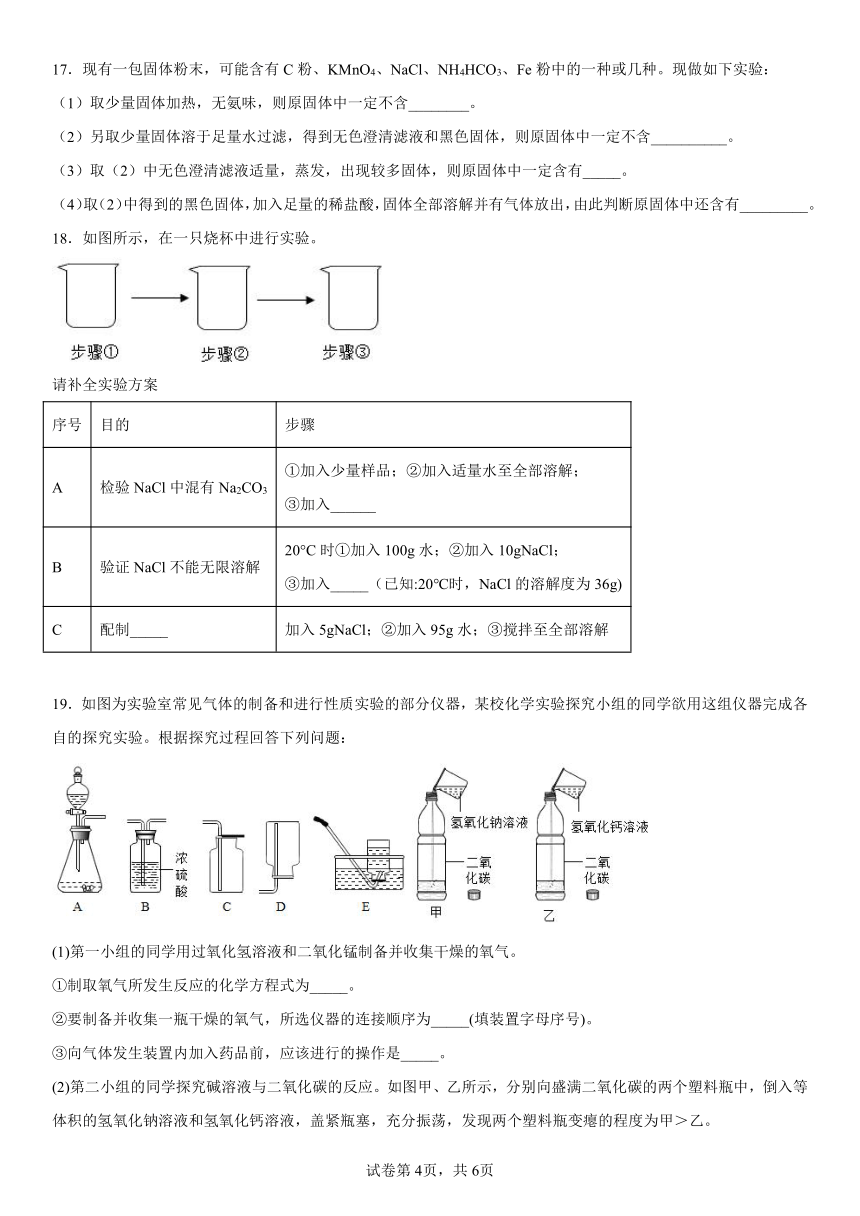
17.现有一包固体粉末,可能含有C粉、KMnO4、NaCl、NH4HCO3、Fe粉中的一种或几种。现做如下实验:
(1)取少量固体加热,无氨味,则原固体中一定不含________。
(2)另取少量固体溶于足量水过滤,得到无色澄清滤液和黑色固体,则原固体中一定不含__________。
(3)取(2)中无色澄清滤液适量,蒸发,出现较多固体,则原固体中一定含有_____。
(4)取(2)中得到的黑色固体,加入足量的稀盐酸,固体全部溶解并有气体放出,由此判断原固体中还含有_________。
18.如图所示,在一只烧杯中进行实验。
请补全实验方案
序号 目的 步骤
A 检验NaCl中混有Na2CO3 ①加入少量样品;②加入适量水至全部溶解; ③加入______
B 验证NaCl不能无限溶解 20°C时①加入100g水;②加入10gNaCl; ③加入_____(已知:20℃时,NaCl的溶解度为36g)
C 配制_____ 加入5gNaCl;②加入95g水;③搅拌至全部溶解
19.如图为实验室常见气体的制备和进行性质实验的部分仪器,某校化学实验探究小组的同学欲用这组仪器完成各自的探究实验。根据探究过程回答下列问题:
(1)第一小组的同学用过氧化氢溶液和二氧化锰制备并收集干燥的氧气。
①制取氧气所发生反应的化学方程式为_____。
②要制备并收集一瓶干燥的氧气,所选仪器的连接顺序为_____(填装置字母序号)。
③向气体发生装置内加入药品前,应该进行的操作是_____。
(2)第二小组的同学探究碱溶液与二氧化碳的反应。如图甲、乙所示,分别向盛满二氧化碳的两个塑料瓶中,倒入等体积的氢氧化钠溶液和氢氧化钙溶液,盖紧瓶塞,充分振荡,发现两个塑料瓶变瘪的程度为甲>乙。
①同学们发现乙瓶内液体出现白色浑浊,请写出该反应的化学方程式_____。
②同学们看到甲瓶内的液体没有明显变化,小明同学想检验氢氧化钠溶液是否与二氧化碳发生了反应,他所想到的下列试剂中,不能得到结果的是_____。
A.稀盐酸
B.氯化钡溶液
C.石蕊试液
D.硝酸钙溶液
五、计算题
20.某样品硝酸钾中含有一定质量的氯化钾.为了测定其中硝酸钾的质量分数做如下实验:取10g该样品加入58.87g水使其完全溶解,向溶液中逐滴加入硝酸银溶液至恰好完全反应,共用去34g硝酸银溶液;过滤、烘干称得沉淀为2.87g.根据实验计算:
(1)样品中硝酸钾的质量分数为多少_____?
(2)反应后所得溶液中溶质的质量分数为多少_____?
21.现有25 g石灰石样品,请按下面要求计算:
(1)25 g样品与足量的稀盐酸反应放出8.8 gCO2(杂质不溶于酸,且不与酸反应),请计算该样品的纯度(CaCO3的质量分数)是多少________?
(2)若将一定质量的该石灰石样品高温煅烧,有关物质质量随反应时间的变化如表所示:
时间/min t1 t2 t3 t4 t5
CO2质量/g 2.2 4.4 6.6 8.8 8.8
剩余固体质量/g 22.8 20.6 m 16.2 16.2
则m=_____,t3时剩余固体中除杂质外含有的物质是____(填化学式)。
22.小明帮爸爸给庄稼地施肥时,发现了如图所示的化肥,查阅资料得知,碳酸氢铵的化学式为 NH4HCO3,请回答:
(1)该化肥属于 (请选填“氮肥”、“磷肥”、“钾肥”、“复合肥”)。
(2)纯净的碳酸氢铵中氮元素的质量分数。(结果保留一位小数)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.C
3.B
4.D
5.B
6.D
7.A
8.B
9.A
10.A
11.B
12.C
13.(1)氯化钠在生产中可以用于化工原料生产烧碱等;在生活中可以用于调味、腌渍等
(2)汽油清洗油污是汽油溶解油污形成溶液;用洗涤剂清洗油污是洗涤剂乳化油污,把油污以小液滴形式分散到水中形成乳浊液
14. NaOH溶液与空气中的CO2反应生成了Na2CO3,Na2CO3溶液与Ba(NO3)2溶液反应生成了BaCO3白色沉淀 ,
15. Na2SO4 Ba(OH)2 Mg(NO3)2 CuCl2
16. 干冰 有刺激性气味(氨味) CuO+2HNO3==Cu(NO3)2+H2O 复分解
17. NH4HCO3 KMnO4 NaCl Fe
18. 稀盐酸(或稀硫酸,合理即可) 超过26g的氯化钠(合理即可) 100g溶质质量分数为5%的氯化钠溶液
19. 2H2O22H2O+O2↑ A、B、C 检查装置气密性 Ca(OH)2+CO2═CaCO3↓+H2O C
20.(1)85.1%(2)10.53%
21.(1)80%(2)18.4;CaCO3和CaO
22.(1)氮肥;(2)17.7%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列化肥从外观即可与其他化肥相区别的是( )
A.硝酸钾 B.氯化铵 C.磷矿粉 D.氯化钾
2.某农用物资店的货架上待售的化肥有(NH4)2SO4、NH4H2PO4、CO(NH2)2,其中缺少的肥料品种是
A.氮肥
B.磷肥
C.钾肥
D.复合肥料
3.下列说法正确的是
A.NaHCO3俗称苏打
B.CaCO3可用作补钙剂
C.Na2CO3俗称火碱
D.K2CO3属于复合肥
4.下列实验中有化学反应发生,且能观察到明显现象的是
A.向氯化钾溶液中滴入稀硫酸
B.向硫酸钠溶液中滴入氯化锌溶液
C.向氧化铜粉末中滴入氢氧化钠溶液
D.高温下向氧化铁粉末中通入一氧化碳
5.向10mLpH为12的溶液中加入试剂,溶液的pH肯定增大的是
A.加水 B.氢氧化钠颗粒
C.pH为4的溶液 D.稀硫酸
6.食盐、食醋、纯碱均是家庭厨房中常用的物质,利用这些物质,我能够完成的实验是
①检验自来水中是否含有氯离子;
②除去热水瓶中的水垢;
③区分食盐和纯碱;
④检验鸡蛋壳中是否含有碳酸钙。
A.① ② B.① ③ C.① ④ D.②③④
7.2020年世界水日的主题是“水与气候变化”。下列关于水的说法正确的是
A.生活中硬水转化为软水的方法是煮沸
B.电解水实验中产生氢气和氧气的体积比为1:8
C.化合物之间有水生成的反应一定是复分解反应
D.过滤后的河水为纯净水
8.饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
9.下列有关NaCl的叙述,错误的是
A.不溶于水 B.溶液呈中性
C.是食盐的主要成分 D.可用于配制生理盐水
10.某同学总结的Ca(OH)2的化学性质如图,下列说法错误的是
A.甲一定是碳酸盐
B.反应②为放热反应
C.反应③可用于检验某种温室气体
D.向澄清石灰水中加入紫色石蕊试液,试液由紫色变为蓝色
11.下列实验目的与所用试剂相符的是
A.证明NaOH溶液中含有Na2CO3――酚酞试剂
B.证明NaOH溶液中含有Na2CO3――澄清石灰水
C.除去NaOH溶液中的Na2CO3杂质――稀盐酸
D.除去NaOH溶液中的Na2CO3杂质――CaCl2溶液
12.如图所示,滴管中吸入某种液体,平底烧瓶中盛有另一种物质,挤压滴管滴入液体,一段时间后气球明显鼓起。下列选项符合题意的是
选项 滴管内物质 平底烧瓶内物质
A 稀盐酸 锌粒
B 水 氧化钙
C 氢氧化钠溶液 二氧化碳气体
D 碳酸钠溶液 稀硫酸
A.A B.B
C.C D.D
二、简答题
13.请用所学的化学知识回答下列问题。
(1)氯化钠在生产和生活中的用途?(写出一种)
(2)请写出用汽油清洗油污和用洗涤剂清洗油污的各自原理。
14.某同学在验证复分解反应发生的条件时,从一瓶敞口放置的氢氧化钠溶液取出少量滴入硝酸钡溶液中,结果发现溶液中出现了白色沉淀。请帮他分析出现上述现象的原因?_____试写出有关反应的化学方程式__________。
三、推断题
15.有A,B,C,D四种可溶性的物质,每种由以下两组中的离子构成。(每种离子只能选用一次)
阳离子
阴离子
四种物质之间的反应有如下现象:
(1)A+B→白色沉淀,不溶于稀硝酸。
(2)B+D→蓝色沉淀。
(3)C+B→白色沉淀,再加稀硝酸沉淀溶解并生成C。
由此可推知:A为_____,B为_____,C为_____,D为_____。(写化学式)
16.A~F六种物质共含H、C、O、N、Ca、Cu六种元素,分别为非金属单质、金属氧化物、非金属氧化物、酸、碱、盐中的一种。其中,A为温室气体,BC均为黑色固体,盐中不含金属。相邻物质之间能发生化学反应。
(1)A的固体俗称是_______________;
(2)E与F反应的现象是______________________________;
(3)C与D反应的化学方程式________________________,属于________反应(填基本反应类型)。
四、实验题
17.现有一包固体粉末,可能含有C粉、KMnO4、NaCl、NH4HCO3、Fe粉中的一种或几种。现做如下实验:
(1)取少量固体加热,无氨味,则原固体中一定不含________。
(2)另取少量固体溶于足量水过滤,得到无色澄清滤液和黑色固体,则原固体中一定不含__________。
(3)取(2)中无色澄清滤液适量,蒸发,出现较多固体,则原固体中一定含有_____。
(4)取(2)中得到的黑色固体,加入足量的稀盐酸,固体全部溶解并有气体放出,由此判断原固体中还含有_________。
18.如图所示,在一只烧杯中进行实验。
请补全实验方案
序号 目的 步骤
A 检验NaCl中混有Na2CO3 ①加入少量样品;②加入适量水至全部溶解; ③加入______
B 验证NaCl不能无限溶解 20°C时①加入100g水;②加入10gNaCl; ③加入_____(已知:20℃时,NaCl的溶解度为36g)
C 配制_____ 加入5gNaCl;②加入95g水;③搅拌至全部溶解
19.如图为实验室常见气体的制备和进行性质实验的部分仪器,某校化学实验探究小组的同学欲用这组仪器完成各自的探究实验。根据探究过程回答下列问题:
(1)第一小组的同学用过氧化氢溶液和二氧化锰制备并收集干燥的氧气。
①制取氧气所发生反应的化学方程式为_____。
②要制备并收集一瓶干燥的氧气,所选仪器的连接顺序为_____(填装置字母序号)。
③向气体发生装置内加入药品前,应该进行的操作是_____。
(2)第二小组的同学探究碱溶液与二氧化碳的反应。如图甲、乙所示,分别向盛满二氧化碳的两个塑料瓶中,倒入等体积的氢氧化钠溶液和氢氧化钙溶液,盖紧瓶塞,充分振荡,发现两个塑料瓶变瘪的程度为甲>乙。
①同学们发现乙瓶内液体出现白色浑浊,请写出该反应的化学方程式_____。
②同学们看到甲瓶内的液体没有明显变化,小明同学想检验氢氧化钠溶液是否与二氧化碳发生了反应,他所想到的下列试剂中,不能得到结果的是_____。
A.稀盐酸
B.氯化钡溶液
C.石蕊试液
D.硝酸钙溶液
五、计算题
20.某样品硝酸钾中含有一定质量的氯化钾.为了测定其中硝酸钾的质量分数做如下实验:取10g该样品加入58.87g水使其完全溶解,向溶液中逐滴加入硝酸银溶液至恰好完全反应,共用去34g硝酸银溶液;过滤、烘干称得沉淀为2.87g.根据实验计算:
(1)样品中硝酸钾的质量分数为多少_____?
(2)反应后所得溶液中溶质的质量分数为多少_____?
21.现有25 g石灰石样品,请按下面要求计算:
(1)25 g样品与足量的稀盐酸反应放出8.8 gCO2(杂质不溶于酸,且不与酸反应),请计算该样品的纯度(CaCO3的质量分数)是多少________?
(2)若将一定质量的该石灰石样品高温煅烧,有关物质质量随反应时间的变化如表所示:
时间/min t1 t2 t3 t4 t5
CO2质量/g 2.2 4.4 6.6 8.8 8.8
剩余固体质量/g 22.8 20.6 m 16.2 16.2
则m=_____,t3时剩余固体中除杂质外含有的物质是____(填化学式)。
22.小明帮爸爸给庄稼地施肥时,发现了如图所示的化肥,查阅资料得知,碳酸氢铵的化学式为 NH4HCO3,请回答:
(1)该化肥属于 (请选填“氮肥”、“磷肥”、“钾肥”、“复合肥”)。
(2)纯净的碳酸氢铵中氮元素的质量分数。(结果保留一位小数)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.C
3.B
4.D
5.B
6.D
7.A
8.B
9.A
10.A
11.B
12.C
13.(1)氯化钠在生产中可以用于化工原料生产烧碱等;在生活中可以用于调味、腌渍等
(2)汽油清洗油污是汽油溶解油污形成溶液;用洗涤剂清洗油污是洗涤剂乳化油污,把油污以小液滴形式分散到水中形成乳浊液
14. NaOH溶液与空气中的CO2反应生成了Na2CO3,Na2CO3溶液与Ba(NO3)2溶液反应生成了BaCO3白色沉淀 ,
15. Na2SO4 Ba(OH)2 Mg(NO3)2 CuCl2
16. 干冰 有刺激性气味(氨味) CuO+2HNO3==Cu(NO3)2+H2O 复分解
17. NH4HCO3 KMnO4 NaCl Fe
18. 稀盐酸(或稀硫酸,合理即可) 超过26g的氯化钠(合理即可) 100g溶质质量分数为5%的氯化钠溶液
19. 2H2O22H2O+O2↑ A、B、C 检查装置气密性 Ca(OH)2+CO2═CaCO3↓+H2O C
20.(1)85.1%(2)10.53%
21.(1)80%(2)18.4;CaCO3和CaO
22.(1)氮肥;(2)17.7%
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
