第6章常用的金属和盐巩固训练九年级化学沪教版(上海)第二学期(含答案)
文档属性
| 名称 | 第6章常用的金属和盐巩固训练九年级化学沪教版(上海)第二学期(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 120.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-19 13:15:22 | ||
图片预览


文档简介
第6章常用的金属和盐巩固训练 九年级化学沪教版(上海)第二学期
一、单选题
1.下列属于缓慢氧化的是( )
A.动植物的呼吸 B.活性炭净水
C.木材燃烧 D.火药爆炸
2.下列措施中,不能防止金属制品锈蚀的是( )
A.在表面刷漆 B.在表面涂油 C.在表面镀铬 D.用湿布擦拭
3.下列物质的名称或俗名,属同一种物质的是
A.生石灰 熟石灰 消石灰 B.冰 干冰 可燃冰
C.烧碱 苛性钠 火碱 D.石灰石 熟石灰 大理石
4.下列归类正确的是
选项 归类 内容
A 化石燃料 煤、酒精、可燃冰
B 常见溶液 碘酒、食盐水、波尔多液
C 合成材料 涤纶、聚乙烯、合成橡胶
D 复合肥料 KNO3、CO(NH2)2、(NH4)2HPO4
A.A B.B C.C D.D
5.下列反应属于置换反应的是( )
A.
B.
C.
D.
6.将一定量的铁粉放入硝酸银溶液中,充分反应后过滤,下列有关说法错误的是( )
A.滤渣中一定含有银 B.滤渣中可能含有铁
C.滤液一定呈浅绿色 D.滤液中一定不含硝酸银
7.如图是某化学兴趣小组设计的观察铁制品锈蚀的实验装置。下列相关叙述中正确的是( )
①一段时间后,铁丝会由下向上出现锈蚀现象
②一段时间后,水面处铁丝锈蚀严重
③一段时间后,塑料瓶会变膨胀,因为铁生锈要放热
④一段时间后,塑料瓶会变瘪,因为铁生锈与空气有关
A.①② B.②④ C.②③ D.③④
8.两个烧杯中装有等质量的金属锌和镁,然后分别逐渐加入同浓度的稀硫酸,产生氢气的质量与加入硫酸的质量关系如图所示。下列说法正确的是
A.该图反映出镁比锌的金属活动性强
B.a点时,两个烧杯中的酸都恰好完全反应
C.b点时,两个烧杯中产生氢气的质量相等
D.c点时,两个烧杯中都有金属剩余
9.将一定质量的铁粉加入到Mg(NO3)2、AgNO3的混合溶液中,充分反应后过滤,得到滤液和滤渣。向滤液中加入稀盐酸,无明显现象。下列叙述正确的是( )
A.滤液中一定含有Mg2+和Fe3+
B.滤液中含有Mg2+和Ag+
C.滤渣中一定含有Ag
D.滤渣中可能含有Mg
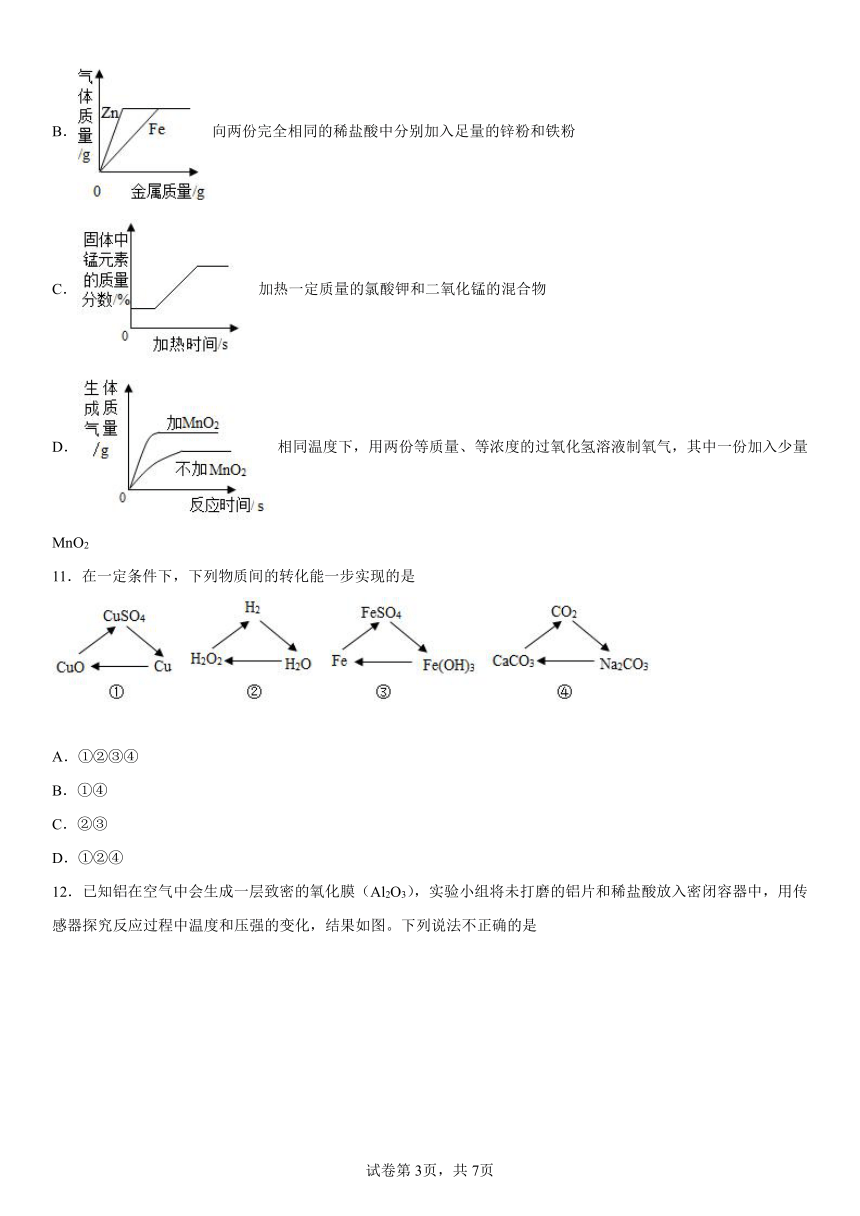
10.下列所示的四个图像,能正确反映对应变化关系的是( )
A.电解水
B.向两份完全相同的稀盐酸中分别加入足量的锌粉和铁粉
C.加热一定质量的氯酸钾和二氧化锰的混合物
D.相同温度下,用两份等质量、等浓度的过氧化氢溶液制氧气,其中一份加入少量MnO2
11.在一定条件下,下列物质间的转化能一步实现的是
A.①②③④
B.①④
C.②③
D.①②④
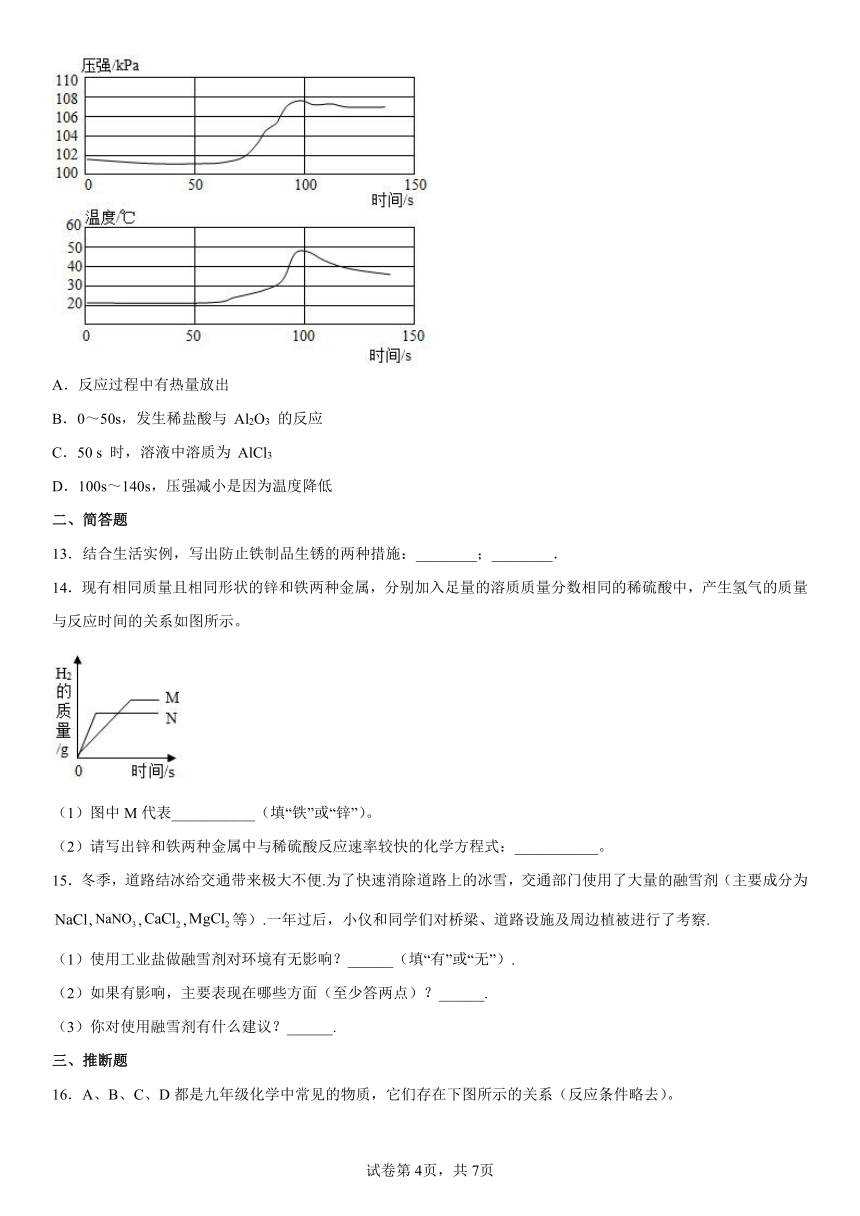
12.已知铝在空气中会生成一层致密的氧化膜(Al2O3),实验小组将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化,结果如图。下列说法不正确的是
A.反应过程中有热量放出
B.0~50s,发生稀盐酸与 Al2O3 的反应
C.50 s 时,溶液中溶质为 AlCl3
D.100s~140s,压强减小是因为温度降低
二、简答题
13.结合生活实例,写出防止铁制品生锈的两种措施:________;________.
14.现有相同质量且相同形状的锌和铁两种金属,分别加入足量的溶质质量分数相同的稀硫酸中,产生氢气的质量与反应时间的关系如图所示。
(1)图中M代表___________(填“铁”或“锌”)。
(2)请写出锌和铁两种金属中与稀硫酸反应速率较快的化学方程式:___________。
15.冬季,道路结冰给交通带来极大不便.为了快速消除道路上的冰雪,交通部门使用了大量的融雪剂(主要成分为,,,等).一年过后,小仪和同学们对桥梁、道路设施及周边植被进行了考察.
(1)使用工业盐做融雪剂对环境有无影响?______(填“有”或“无”).
(2)如果有影响,主要表现在哪些方面(至少答两点)?______.
(3)你对使用融雪剂有什么建议?______.
三、推断题
16.A、B、C、D都是九年级化学中常见的物质,它们存在下图所示的关系(反应条件略去)。
(1)若A为二氧化碳,C为水,则D的化学式为 _____ 。
(2)若A为常见金属,C为气体单质,则B的化学式 _____ 。
(3)若A为蓝色溶液,C为蓝色沉淀,则B的化学式为 _____ 。
(4)若A为一种可燃物,任写一个符合该反应的化学方程式 _____ 。
17.2022年第24届冬季奥运会将在我国的北京市和张家口市联合举行。如图所示“五环”中相交两环中的物质间能够发生化学反应,其中A、B、C、D分别是Fe、Na2SO4、Ba(OH)2、O2中的一种,A可以供给呼吸。
(1)D的化学式_________。
(2)B与HCl反应的化学方程式为_________。
(3)C与D反应的化学方程式为_________。
(4)请写出一种和B、C、D属不同类别的物质,且能和盐酸反应物质的化学式为_________。
四、实验题
18.根据图回答问题:
(1)由实验1得到的结论是 ______________________________ 。为确保实验成功,操作时需注意的问题是 ________________________________________________ 。
(2)实验2的目的是 _________________________________ 。
(3)实验3中发生反应的化学方程式为 ____________________________ ,当观察到溶液由红色变为无色后,小明想知道反应后溶液中除NaCl外,是否还含有其它溶质(不考虑酚酞),于是他向反应后的溶液中加入一种试剂,从而得出了结论。小明加入的试剂可能是 _____________________ 。
19.在研究金属化学性质的实验时,有的同学发现镁和铁都可以与酸反应,但反应的快慢有显差异,为了进一步了解影响金属与酸反应速率的因素,同学们提出问题并进行探究。
【提出问题】酸的浓度、金属的种类、金属的形状是否会影响金属与酸反应的快慢?
【进行实验】分别取20mL盐酸、2g金属。
实验编号 盐酸的浓度 金属种类 金属形状 收集50mL氢气所需要的时间/s
① 10% 镁 粉状 60
② 10% 铁 片状 120
③ 10% 镁 片状 102
④ 20% 铁 片状 110
【解释与结论】
(1)镁与盐酸反应的实验现象是固体逐渐消失、放出大量热、__________。
(2)写出金属铁与盐酸发生的化学反应方程式__________。
(3)对比实验①和③,得到的结论是___________。
(4)要比较不同种类的金属对反应快慢的影响,应选择的实验编号是_________。
(5)由上述实验可推知,影响金属与酸反应快慢的因素是________。
【反思与评价】
(6)该实验除了用收集等体积氢气所用时间来衡量反应的快慢外,其他实验方法是_______。
20.如图是初中化学常用实验装置(夹持装置已省略)。
(1)仪器a的名称是______________。
(2)该装置用于实验室制取CO2:装置甲中发生反应的化学方程式为______________。
(3)该装置用于实验室制取干燥的O2:乙中存放的试剂为______________。检验丙中气体是否收集满的方法是_____________________。
(4)该装置用于实验室制取干燥的H2:对装置所作的简单改动可以是______________。
(5)该装置用于混合物中物质含量测定:在丙装置后连接量气装置,取10.0g黄铜(铜锌合金)粉末于锥形瓶中,加入足量稀硫酸,待完全反应后,根据气体体积换算得到生成的氢气质量为0.1g,则该混合物中铜的质量分数为多少?(写出计算过程)________________
五、计算题
21.草木灰是农家肥料,其主要成分是碳酸钾。某化学兴趣小组进行如下实验,以下是他们的实验过程及数据(假设杂质不与稀盐酸反应,生成的气体全部逸出)。请你回答下列问题:
(1)碳酸钾中钾元素、碳元素、氧元素的质量比为______。
(2)反应生成的气体质量为________g。
(3)稀盐酸中溶质质量分数是______?
22.将铜粉和镁粉的混合物12g加入到49g稀硫酸中,恰好完全反应。滤出不溶物,将其洗净、干燥,在空气中充分灼烧后,所得固体的质量也是12g。
(1)求原混合物中镁的质量分数。
(2)求完全反应后所得溶液中溶质的质量分数。(结果保留1位小数)
23.我国是世界钢铁产量最大的国家,炼铁的主要原料是铁矿石。用赤铁矿石(主要成分为Fe2O3)炼铁的反应原理为: 。
(1)求Fe2O3中铁元素的质量分数。
(2)根据化学方程式计算:用含Fe2O360%的赤铁矿石800 t,理论上可炼出纯铁多少吨?
24.某氯化钠溶液中含有氯化镁(MgCl2),学习小组为测定其中氯化镁的质量分数,在50.0g该溶液中加入50.0g氢氧化钠溶液恰好完全反应,经测定生成沉淀的质量为2.9g。请回答下列问题:
(1)反应后溶液的质量为 g。
(2)求原氯化钠溶液中氯化镁的质量分数(写出计算过程)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.D
3.C
4.C
5.C
6.D
7.B
8.D
9.C
10.C
11.B
12.C
13. 涂防锈漆 烧制搪瓷
14. 铁 Zn+H2SO4=ZnSO4+H2↑
15. 有 水质污染、铁制品腐蚀、土壤污染等 铲除部分冰雪再使用少量融雪剂或用化肥做融雪剂等
16. CaCO3或Na2CO3 H2SO4或HCl NaOH或Ca(OH)2 (其他合理答案也可以)
17. Na2SO4 Fe+2HCl=FeCl2+H2↑ Na2SO4+Ba(OH)2= BaSO4↓+2NaOH Fe2O3
18. 二氧化碳不燃烧也不支持燃烧,密度比空气大 沿蜡烛对面一侧烧杯内壁缓缓倾倒二氧化碳 探究反应物的状态对反应速率的影响 紫色石蕊溶液(或锌等活泼金属或碳酸钠溶液等)
19.(1)产生气泡
(2)
(3)金属的形状会影响金属与酸反应的速率
(4)②③##③②
(5)酸的浓度、金属种类、金属形状
(6)单位时间内收集的气体体积
20. 分液漏斗 CaCO3+2HCl=CaCl2+H2O+CO2↑ 浓硫酸 将带火星的木条放在丙装置右侧导管口,若木条复燃,则集满 将原来乙装置短导管与丙装置长导管相连的胶皮管拆开,改成用胶皮管将乙装置的短导管与丙装置的短导管相连 67.5%(详见解析)
21.(1)39:6:24;(2)8.8g;(3)14.6%
22.(1)20%;(2)23.4%
23.(1)
(2)解:800 t矿石中Fe2O3的质量为800 t×60%=480 t
设理论上可炼出纯铁的质量为x
答:理论上可炼出纯铁336 t。
24.(1)97.1
(2)解:设原氯化钠溶液中氯化镁的质量分数为x
得x=9.5%
答:原氯化钠溶液中氯化镁的质量分数为9.5%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列属于缓慢氧化的是( )
A.动植物的呼吸 B.活性炭净水
C.木材燃烧 D.火药爆炸
2.下列措施中,不能防止金属制品锈蚀的是( )
A.在表面刷漆 B.在表面涂油 C.在表面镀铬 D.用湿布擦拭
3.下列物质的名称或俗名,属同一种物质的是
A.生石灰 熟石灰 消石灰 B.冰 干冰 可燃冰
C.烧碱 苛性钠 火碱 D.石灰石 熟石灰 大理石
4.下列归类正确的是
选项 归类 内容
A 化石燃料 煤、酒精、可燃冰
B 常见溶液 碘酒、食盐水、波尔多液
C 合成材料 涤纶、聚乙烯、合成橡胶
D 复合肥料 KNO3、CO(NH2)2、(NH4)2HPO4
A.A B.B C.C D.D
5.下列反应属于置换反应的是( )
A.
B.
C.
D.
6.将一定量的铁粉放入硝酸银溶液中,充分反应后过滤,下列有关说法错误的是( )
A.滤渣中一定含有银 B.滤渣中可能含有铁
C.滤液一定呈浅绿色 D.滤液中一定不含硝酸银
7.如图是某化学兴趣小组设计的观察铁制品锈蚀的实验装置。下列相关叙述中正确的是( )
①一段时间后,铁丝会由下向上出现锈蚀现象
②一段时间后,水面处铁丝锈蚀严重
③一段时间后,塑料瓶会变膨胀,因为铁生锈要放热
④一段时间后,塑料瓶会变瘪,因为铁生锈与空气有关
A.①② B.②④ C.②③ D.③④
8.两个烧杯中装有等质量的金属锌和镁,然后分别逐渐加入同浓度的稀硫酸,产生氢气的质量与加入硫酸的质量关系如图所示。下列说法正确的是
A.该图反映出镁比锌的金属活动性强
B.a点时,两个烧杯中的酸都恰好完全反应
C.b点时,两个烧杯中产生氢气的质量相等
D.c点时,两个烧杯中都有金属剩余
9.将一定质量的铁粉加入到Mg(NO3)2、AgNO3的混合溶液中,充分反应后过滤,得到滤液和滤渣。向滤液中加入稀盐酸,无明显现象。下列叙述正确的是( )
A.滤液中一定含有Mg2+和Fe3+
B.滤液中含有Mg2+和Ag+
C.滤渣中一定含有Ag
D.滤渣中可能含有Mg
10.下列所示的四个图像,能正确反映对应变化关系的是( )
A.电解水
B.向两份完全相同的稀盐酸中分别加入足量的锌粉和铁粉
C.加热一定质量的氯酸钾和二氧化锰的混合物
D.相同温度下,用两份等质量、等浓度的过氧化氢溶液制氧气,其中一份加入少量MnO2
11.在一定条件下,下列物质间的转化能一步实现的是
A.①②③④
B.①④
C.②③
D.①②④
12.已知铝在空气中会生成一层致密的氧化膜(Al2O3),实验小组将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化,结果如图。下列说法不正确的是
A.反应过程中有热量放出
B.0~50s,发生稀盐酸与 Al2O3 的反应
C.50 s 时,溶液中溶质为 AlCl3
D.100s~140s,压强减小是因为温度降低
二、简答题
13.结合生活实例,写出防止铁制品生锈的两种措施:________;________.
14.现有相同质量且相同形状的锌和铁两种金属,分别加入足量的溶质质量分数相同的稀硫酸中,产生氢气的质量与反应时间的关系如图所示。
(1)图中M代表___________(填“铁”或“锌”)。
(2)请写出锌和铁两种金属中与稀硫酸反应速率较快的化学方程式:___________。
15.冬季,道路结冰给交通带来极大不便.为了快速消除道路上的冰雪,交通部门使用了大量的融雪剂(主要成分为,,,等).一年过后,小仪和同学们对桥梁、道路设施及周边植被进行了考察.
(1)使用工业盐做融雪剂对环境有无影响?______(填“有”或“无”).
(2)如果有影响,主要表现在哪些方面(至少答两点)?______.
(3)你对使用融雪剂有什么建议?______.
三、推断题
16.A、B、C、D都是九年级化学中常见的物质,它们存在下图所示的关系(反应条件略去)。
(1)若A为二氧化碳,C为水,则D的化学式为 _____ 。
(2)若A为常见金属,C为气体单质,则B的化学式 _____ 。
(3)若A为蓝色溶液,C为蓝色沉淀,则B的化学式为 _____ 。
(4)若A为一种可燃物,任写一个符合该反应的化学方程式 _____ 。
17.2022年第24届冬季奥运会将在我国的北京市和张家口市联合举行。如图所示“五环”中相交两环中的物质间能够发生化学反应,其中A、B、C、D分别是Fe、Na2SO4、Ba(OH)2、O2中的一种,A可以供给呼吸。
(1)D的化学式_________。
(2)B与HCl反应的化学方程式为_________。
(3)C与D反应的化学方程式为_________。
(4)请写出一种和B、C、D属不同类别的物质,且能和盐酸反应物质的化学式为_________。
四、实验题
18.根据图回答问题:
(1)由实验1得到的结论是 ______________________________ 。为确保实验成功,操作时需注意的问题是 ________________________________________________ 。
(2)实验2的目的是 _________________________________ 。
(3)实验3中发生反应的化学方程式为 ____________________________ ,当观察到溶液由红色变为无色后,小明想知道反应后溶液中除NaCl外,是否还含有其它溶质(不考虑酚酞),于是他向反应后的溶液中加入一种试剂,从而得出了结论。小明加入的试剂可能是 _____________________ 。
19.在研究金属化学性质的实验时,有的同学发现镁和铁都可以与酸反应,但反应的快慢有显差异,为了进一步了解影响金属与酸反应速率的因素,同学们提出问题并进行探究。
【提出问题】酸的浓度、金属的种类、金属的形状是否会影响金属与酸反应的快慢?
【进行实验】分别取20mL盐酸、2g金属。
实验编号 盐酸的浓度 金属种类 金属形状 收集50mL氢气所需要的时间/s
① 10% 镁 粉状 60
② 10% 铁 片状 120
③ 10% 镁 片状 102
④ 20% 铁 片状 110
【解释与结论】
(1)镁与盐酸反应的实验现象是固体逐渐消失、放出大量热、__________。
(2)写出金属铁与盐酸发生的化学反应方程式__________。
(3)对比实验①和③,得到的结论是___________。
(4)要比较不同种类的金属对反应快慢的影响,应选择的实验编号是_________。
(5)由上述实验可推知,影响金属与酸反应快慢的因素是________。
【反思与评价】
(6)该实验除了用收集等体积氢气所用时间来衡量反应的快慢外,其他实验方法是_______。
20.如图是初中化学常用实验装置(夹持装置已省略)。
(1)仪器a的名称是______________。
(2)该装置用于实验室制取CO2:装置甲中发生反应的化学方程式为______________。
(3)该装置用于实验室制取干燥的O2:乙中存放的试剂为______________。检验丙中气体是否收集满的方法是_____________________。
(4)该装置用于实验室制取干燥的H2:对装置所作的简单改动可以是______________。
(5)该装置用于混合物中物质含量测定:在丙装置后连接量气装置,取10.0g黄铜(铜锌合金)粉末于锥形瓶中,加入足量稀硫酸,待完全反应后,根据气体体积换算得到生成的氢气质量为0.1g,则该混合物中铜的质量分数为多少?(写出计算过程)________________
五、计算题
21.草木灰是农家肥料,其主要成分是碳酸钾。某化学兴趣小组进行如下实验,以下是他们的实验过程及数据(假设杂质不与稀盐酸反应,生成的气体全部逸出)。请你回答下列问题:
(1)碳酸钾中钾元素、碳元素、氧元素的质量比为______。
(2)反应生成的气体质量为________g。
(3)稀盐酸中溶质质量分数是______?
22.将铜粉和镁粉的混合物12g加入到49g稀硫酸中,恰好完全反应。滤出不溶物,将其洗净、干燥,在空气中充分灼烧后,所得固体的质量也是12g。
(1)求原混合物中镁的质量分数。
(2)求完全反应后所得溶液中溶质的质量分数。(结果保留1位小数)
23.我国是世界钢铁产量最大的国家,炼铁的主要原料是铁矿石。用赤铁矿石(主要成分为Fe2O3)炼铁的反应原理为: 。
(1)求Fe2O3中铁元素的质量分数。
(2)根据化学方程式计算:用含Fe2O360%的赤铁矿石800 t,理论上可炼出纯铁多少吨?
24.某氯化钠溶液中含有氯化镁(MgCl2),学习小组为测定其中氯化镁的质量分数,在50.0g该溶液中加入50.0g氢氧化钠溶液恰好完全反应,经测定生成沉淀的质量为2.9g。请回答下列问题:
(1)反应后溶液的质量为 g。
(2)求原氯化钠溶液中氯化镁的质量分数(写出计算过程)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.D
3.C
4.C
5.C
6.D
7.B
8.D
9.C
10.C
11.B
12.C
13. 涂防锈漆 烧制搪瓷
14. 铁 Zn+H2SO4=ZnSO4+H2↑
15. 有 水质污染、铁制品腐蚀、土壤污染等 铲除部分冰雪再使用少量融雪剂或用化肥做融雪剂等
16. CaCO3或Na2CO3 H2SO4或HCl NaOH或Ca(OH)2 (其他合理答案也可以)
17. Na2SO4 Fe+2HCl=FeCl2+H2↑ Na2SO4+Ba(OH)2= BaSO4↓+2NaOH Fe2O3
18. 二氧化碳不燃烧也不支持燃烧,密度比空气大 沿蜡烛对面一侧烧杯内壁缓缓倾倒二氧化碳 探究反应物的状态对反应速率的影响 紫色石蕊溶液(或锌等活泼金属或碳酸钠溶液等)
19.(1)产生气泡
(2)
(3)金属的形状会影响金属与酸反应的速率
(4)②③##③②
(5)酸的浓度、金属种类、金属形状
(6)单位时间内收集的气体体积
20. 分液漏斗 CaCO3+2HCl=CaCl2+H2O+CO2↑ 浓硫酸 将带火星的木条放在丙装置右侧导管口,若木条复燃,则集满 将原来乙装置短导管与丙装置长导管相连的胶皮管拆开,改成用胶皮管将乙装置的短导管与丙装置的短导管相连 67.5%(详见解析)
21.(1)39:6:24;(2)8.8g;(3)14.6%
22.(1)20%;(2)23.4%
23.(1)
(2)解:800 t矿石中Fe2O3的质量为800 t×60%=480 t
设理论上可炼出纯铁的质量为x
答:理论上可炼出纯铁336 t。
24.(1)97.1
(2)解:设原氯化钠溶液中氯化镁的质量分数为x
得x=9.5%
答:原氯化钠溶液中氯化镁的质量分数为9.5%。
答案第1页,共2页
答案第1页,共2页
