专题8《金属和金属材料》同步练习题九年级化学仁爱版下册(含答案)
文档属性
| 名称 | 专题8《金属和金属材料》同步练习题九年级化学仁爱版下册(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 113.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-19 13:17:09 | ||
图片预览


文档简介
专题8《金属和金属材料》同步练习题九年级化学仁爱版下册
一、单选题
1.下列有关金属的说法正确的是( )
A.钢的含碳量比生铁的含碳量高
B.防止金属锈蚀是保护金属资源的有效途径
C.镁带在空气中燃烧,发出耀眼白光,生成黑色固体
D.铝制品不需要涂保护层来防腐蚀,因为常温下铝不与氧气反应
2.下列关于合金的说法正确的是
A.合金不属于金属材料
B.合金的硬度一般比各成分金属大
C.合金属于金属单质
D.多数合金的熔点高于组成它的成分金属
3.下列与金属相关的说法正确的是
A.生铁和钢性能完全相同
B.炼铁过程只发生物理变化
C.常温下所有金属均为固态
D.铁在潮湿的空气中易生锈
4.下列四种金属中,能与稀H2SO4反应放出H2的是( )
A.Cu B.Ag C.Zn D.Hg
5.锡(Sn)是“五金”之一,它的金属活动顺序位于铁和铜之间,则下列反应一定不会发生的是
A.Mg+Sn(NO3)2═Mg(NO3)2+Sn
B.Sn+H2SO4═SnSO4+H2↑
C.Sn+Hg(NO3)2═Sn(NO3)2+Hg
D.Sn+ZnSO4═SnSO4+Zn
6.工业上用100 t含氧化铁(Fe2O3)80%的赤铁矿石,理论上可炼出含铁96%的生铁的质量是( )
A.56 t B.58.3 t C.70 t D.72.9 t
7.下列物质间的转化一步就能实现的是
A.CaCO3→Na2CO3 B. C.CO2→O2 D.H2O2→H2
8.向AgNO3、Cu(NO3)2的混合溶液中加入一定量的锌粉,充分反应,过滤。下面对反应结果的判断,不正确的是
A.若反应后溶液为蓝色,滤渣中一定不含有Zn
B.若反应后溶液为蓝色,滤渣中一定含有Ag,可能含有Cu
C.若反应后溶液为无色,滤渣中一定含有Ag和Cu
D.若反应后溶液为无色,滤渣中一定不含有Zn
9.有X、Y、Z三种金属,X在常温下就能与氧气反应,Y、Z在常温下几乎不与氧气反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Z表面有银析出,而Y没有变化。根据以上实验事实,判断X、Y、Z三种金属的活动性由强到弱的顺序正确的是
A.X、Y、Z B.X、Z、Y
C.Y、Z、X D.Z、Y、X
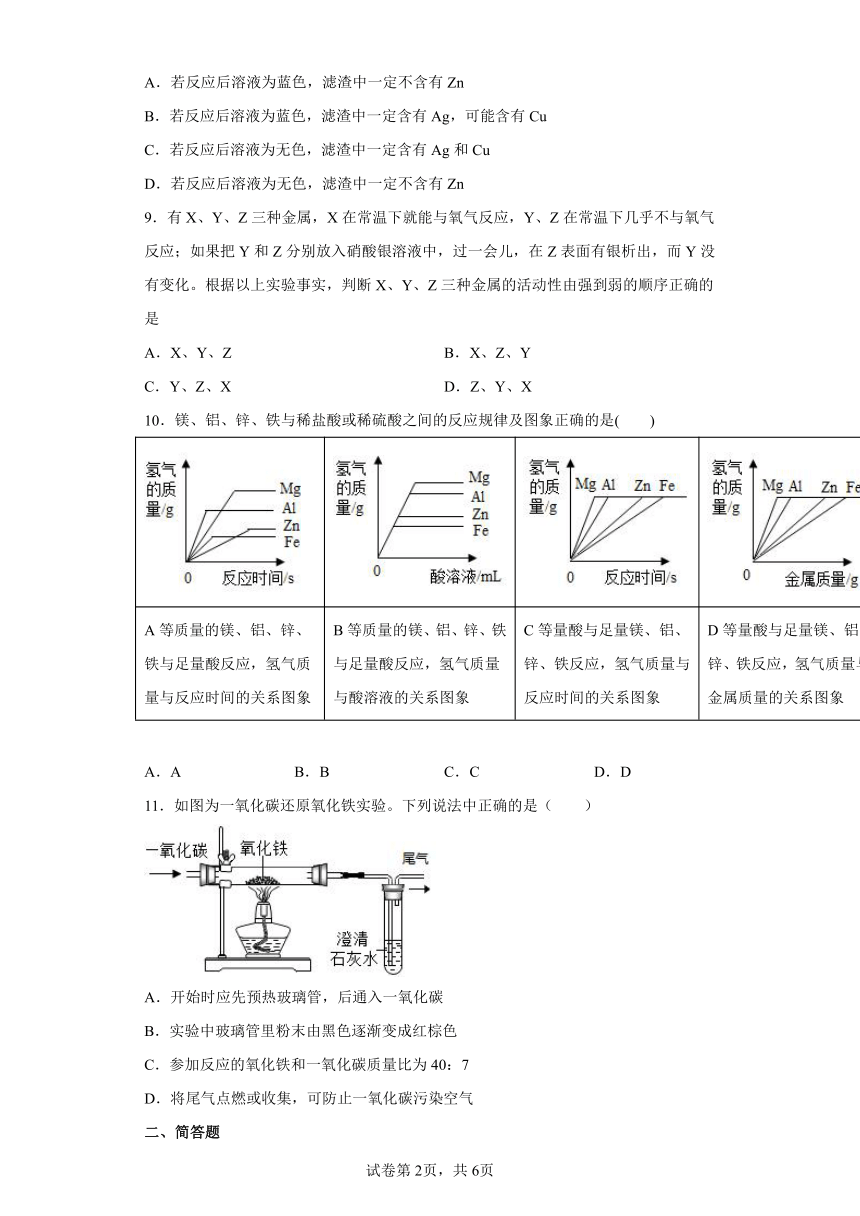
10.镁、铝、锌、铁与稀盐酸或稀硫酸之间的反应规律及图象正确的是( )
A等质量的镁、铝、锌、铁与足量酸反应,氢气质量与反应时间的关系图象 B等质量的镁、铝、锌、铁与足量酸反应,氢气质量与酸溶液的关系图象 C等量酸与足量镁、铝、锌、铁反应,氢气质量与反应时间的关系图象 D等量酸与足量镁、铝、锌、铁反应,氢气质量与金属质量的关系图象
A.A B.B C.C D.D
11.如图为一氧化碳还原氧化铁实验。下列说法中正确的是( )
A.开始时应先预热玻璃管,后通入一氧化碳
B.实验中玻璃管里粉末由黑色逐渐变成红棕色
C.参加反应的氧化铁和一氧化碳质量比为40:7
D.将尾气点燃或收集,可防止一氧化碳污染空气
二、简答题
12.调查显示不锈钢保温杯存在重金属迁移的风险,实验员用醋酸(HAc)溶液代替果汁进行实验后发现,锰元素最高超标34倍,好奇的小汪同学上网找到资料:①不锈钢中往往加入锰铬镍等金属加强耐腐蚀性.②锰属于比较活泼的金属,易溶于酸性溶液生成二价锰盐.
(1)有关不锈钢的描述下列说法正确的是______.
A是一种合金 B属于金属材料 C是一种混合物 D是一种化合物
(2)实验中锰和醋酸发生的化学方程式为______.
13.某化学小组向Cu(NO3)2和Zn(NO3)2的混合溶液中加入一定量的Mg粉,充分反应后过滤。
(1)若向滤渣中加入稀盐酸,有气泡冒出。请分析滤渣的成分。
(2)若滤液呈蓝色,则滤液中的溶质有哪些?(写化学式)
三、推断题
14.A、B、C、D、E是初中化学常见的物质。其中,单质B是一种常见且用途广泛的金属,B元素在地壳中含量仅次于铝,已知金属B能发生如图一系列变化:
(1)发生反应①的条件是___________。
(2)D物质的用途是___________。
(3)反应③的化学方程式为___________,其基本反应类型为___________。
(4)反应④的现象为___________。
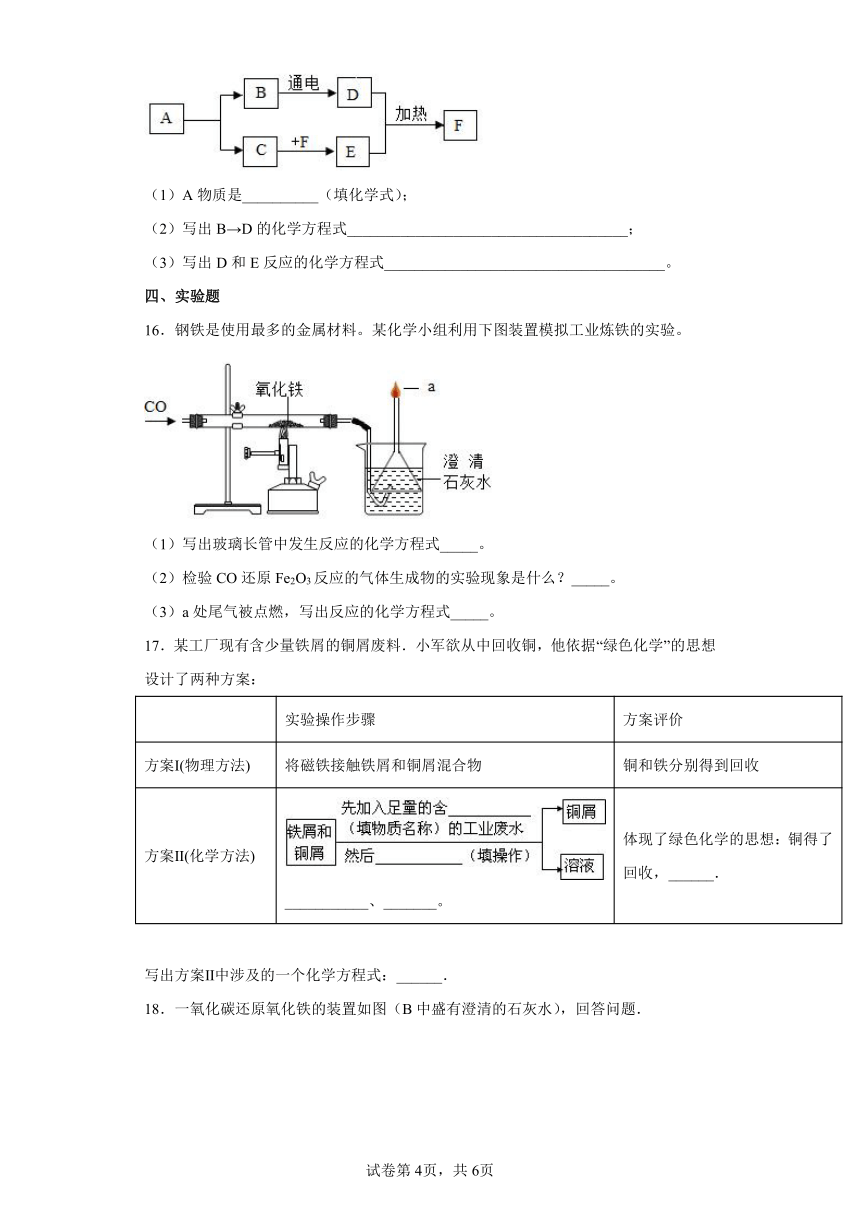
15.A、B、C、D、E、F是初中化学常见的物质,A、B是含有相同元素的无色液体,D是最轻的气体,F是红色固体单质。根据右图的相互转化关系判断。
(1)A物质是__________(填化学式);
(2)写出B→D的化学方程式_____________________________________;
(3)写出D和E反应的化学方程式_____________________________________。
四、实验题
16.钢铁是使用最多的金属材料。某化学小组利用下图装置模拟工业炼铁的实验。
(1)写出玻璃长管中发生反应的化学方程式_____。
(2)检验CO还原Fe2O3反应的气体生成物的实验现象是什么?_____。
(3)a处尾气被点燃,写出反应的化学方程式_____。
17.某工厂现有含少量铁屑的铜屑废料.小军欲从中回收铜,他依据“绿色化学”的思想设计了两种方案:
实验操作步骤 方案评价
方案Ⅰ(物理方法) 将磁铁接触铁屑和铜屑混合物 铜和铁分别得到回收
方案Ⅱ(化学方法) ___________、_______。 体现了绿色化学的思想:铜得了回收,______.
写出方案Ⅱ中涉及的一个化学方程式:______.
18.一氧化碳还原氧化铁的装置如图(B中盛有澄清的石灰水),回答问题.
(1)写出A中发生反应的化学方程式.________
(2)C装置的作用是________
(3)为探究锌、铁、铜的活动性顺序,某同学设计了一组实验:
①锌片浸入稀硫酸中
②铜片浸入稀硫酸中
③锌片浸入硫酸亚铁溶液
请补充一个实验来证明三种金属活动性顺序(写出实验步骤、现象)________.
结论:锌、铁、铜的活泼性顺序为.
五、计算题
19.某同学欲测定生铁中铁的质量分数,他称取样品11.5g,加入足量溶质质量分数为10%的稀硫酸充分反应(杂质不溶于水,也不与稀硫酸反应),产生气体的质量与所加稀硫酸的质量关系如图所示,请回答:
(1)恰好完全反应时生成氢气的质量为 g。
(2)该样品中铁的质量分数?(精确到0.1%)。
(3)图中m的值。
20.将一定质量的金属锌(Zn)投入到100g稀硫酸(H2SO4)中恰好完全反应,放出气体的质量与反应时间的关系如图所示。
回答以下问题:
(1)完全反应后生成的氢气(H2)的质量是多少?
(2)所用稀H2SO4中溶质的质量分数。
21.某兴趣小组按照图所示实验过程测定一黄铜(铜锌合 金)样品中铜的质量分数。实验过程中,用电子天平测得不同时刻装置及药品质量随时间变化的数据,相关数据见下表。请计算:
时刻 t0 t1 t1 t3 t4
装置及药品质量/g 180.0 200.0 199.9 199.8 199.8
(1)共生成气体_____g。
(2)计算黄铜样品中铜的质量分数_____。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.B
3.D
4.C
5.D
6.B
7.C
8.D
9.B
10.C
11.D
12. ABC Mn+2HAc=Mn(Ac)2+H2↑
13.(1)一定含有Cu、Zn,可能含有Mg
(2)Cu(NO3)2、Zn(NO3)2、Mg(NO3)2
14.(1)与水、氧气共同接触
(2)做燃料、冶炼金属等
(3) 置换反应
(4)剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体
15. H2O2 2H2O2H2↑+O2↑
16. 烧杯中澄清的石灰水变浑浊
17. 硫酸(或盐酸,或硫酸铜,或氯化铜,或硝酸铜) 过滤 废物利用(或减少污染,或充分利用资料等) H2SO4+Fe=FeSO4+H2↑(或Fe+CuSO4=FeSO4+Cu)
18. 点燃尾气,防止污染空气 将铁片浸入硫酸铜溶液中,铁片表面有红色固体析出(或将铁片浸入稀硫酸中,有气泡产生,但产生气泡的速度比锌片慢)
19.(1)0.4;
(2)解:设该样品中铁的质量分数为x,消耗硫酸的质量为y
x≈97.4%
y=19.6g;
(3)图中m=19.6g÷10%=196g。
答:该样品中铁的质量分数为97.4%,m=196g。
20.0.4;19.6%
21.(1)0.2(2)67.5%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列有关金属的说法正确的是( )
A.钢的含碳量比生铁的含碳量高
B.防止金属锈蚀是保护金属资源的有效途径
C.镁带在空气中燃烧,发出耀眼白光,生成黑色固体
D.铝制品不需要涂保护层来防腐蚀,因为常温下铝不与氧气反应
2.下列关于合金的说法正确的是
A.合金不属于金属材料
B.合金的硬度一般比各成分金属大
C.合金属于金属单质
D.多数合金的熔点高于组成它的成分金属
3.下列与金属相关的说法正确的是
A.生铁和钢性能完全相同
B.炼铁过程只发生物理变化
C.常温下所有金属均为固态
D.铁在潮湿的空气中易生锈
4.下列四种金属中,能与稀H2SO4反应放出H2的是( )
A.Cu B.Ag C.Zn D.Hg
5.锡(Sn)是“五金”之一,它的金属活动顺序位于铁和铜之间,则下列反应一定不会发生的是
A.Mg+Sn(NO3)2═Mg(NO3)2+Sn
B.Sn+H2SO4═SnSO4+H2↑
C.Sn+Hg(NO3)2═Sn(NO3)2+Hg
D.Sn+ZnSO4═SnSO4+Zn
6.工业上用100 t含氧化铁(Fe2O3)80%的赤铁矿石,理论上可炼出含铁96%的生铁的质量是( )
A.56 t B.58.3 t C.70 t D.72.9 t
7.下列物质间的转化一步就能实现的是
A.CaCO3→Na2CO3 B. C.CO2→O2 D.H2O2→H2
8.向AgNO3、Cu(NO3)2的混合溶液中加入一定量的锌粉,充分反应,过滤。下面对反应结果的判断,不正确的是
A.若反应后溶液为蓝色,滤渣中一定不含有Zn
B.若反应后溶液为蓝色,滤渣中一定含有Ag,可能含有Cu
C.若反应后溶液为无色,滤渣中一定含有Ag和Cu
D.若反应后溶液为无色,滤渣中一定不含有Zn
9.有X、Y、Z三种金属,X在常温下就能与氧气反应,Y、Z在常温下几乎不与氧气反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Z表面有银析出,而Y没有变化。根据以上实验事实,判断X、Y、Z三种金属的活动性由强到弱的顺序正确的是
A.X、Y、Z B.X、Z、Y
C.Y、Z、X D.Z、Y、X
10.镁、铝、锌、铁与稀盐酸或稀硫酸之间的反应规律及图象正确的是( )
A等质量的镁、铝、锌、铁与足量酸反应,氢气质量与反应时间的关系图象 B等质量的镁、铝、锌、铁与足量酸反应,氢气质量与酸溶液的关系图象 C等量酸与足量镁、铝、锌、铁反应,氢气质量与反应时间的关系图象 D等量酸与足量镁、铝、锌、铁反应,氢气质量与金属质量的关系图象
A.A B.B C.C D.D
11.如图为一氧化碳还原氧化铁实验。下列说法中正确的是( )
A.开始时应先预热玻璃管,后通入一氧化碳
B.实验中玻璃管里粉末由黑色逐渐变成红棕色
C.参加反应的氧化铁和一氧化碳质量比为40:7
D.将尾气点燃或收集,可防止一氧化碳污染空气
二、简答题
12.调查显示不锈钢保温杯存在重金属迁移的风险,实验员用醋酸(HAc)溶液代替果汁进行实验后发现,锰元素最高超标34倍,好奇的小汪同学上网找到资料:①不锈钢中往往加入锰铬镍等金属加强耐腐蚀性.②锰属于比较活泼的金属,易溶于酸性溶液生成二价锰盐.
(1)有关不锈钢的描述下列说法正确的是______.
A是一种合金 B属于金属材料 C是一种混合物 D是一种化合物
(2)实验中锰和醋酸发生的化学方程式为______.
13.某化学小组向Cu(NO3)2和Zn(NO3)2的混合溶液中加入一定量的Mg粉,充分反应后过滤。
(1)若向滤渣中加入稀盐酸,有气泡冒出。请分析滤渣的成分。
(2)若滤液呈蓝色,则滤液中的溶质有哪些?(写化学式)
三、推断题
14.A、B、C、D、E是初中化学常见的物质。其中,单质B是一种常见且用途广泛的金属,B元素在地壳中含量仅次于铝,已知金属B能发生如图一系列变化:
(1)发生反应①的条件是___________。
(2)D物质的用途是___________。
(3)反应③的化学方程式为___________,其基本反应类型为___________。
(4)反应④的现象为___________。
15.A、B、C、D、E、F是初中化学常见的物质,A、B是含有相同元素的无色液体,D是最轻的气体,F是红色固体单质。根据右图的相互转化关系判断。
(1)A物质是__________(填化学式);
(2)写出B→D的化学方程式_____________________________________;
(3)写出D和E反应的化学方程式_____________________________________。
四、实验题
16.钢铁是使用最多的金属材料。某化学小组利用下图装置模拟工业炼铁的实验。
(1)写出玻璃长管中发生反应的化学方程式_____。
(2)检验CO还原Fe2O3反应的气体生成物的实验现象是什么?_____。
(3)a处尾气被点燃,写出反应的化学方程式_____。
17.某工厂现有含少量铁屑的铜屑废料.小军欲从中回收铜,他依据“绿色化学”的思想设计了两种方案:
实验操作步骤 方案评价
方案Ⅰ(物理方法) 将磁铁接触铁屑和铜屑混合物 铜和铁分别得到回收
方案Ⅱ(化学方法) ___________、_______。 体现了绿色化学的思想:铜得了回收,______.
写出方案Ⅱ中涉及的一个化学方程式:______.
18.一氧化碳还原氧化铁的装置如图(B中盛有澄清的石灰水),回答问题.
(1)写出A中发生反应的化学方程式.________
(2)C装置的作用是________
(3)为探究锌、铁、铜的活动性顺序,某同学设计了一组实验:
①锌片浸入稀硫酸中
②铜片浸入稀硫酸中
③锌片浸入硫酸亚铁溶液
请补充一个实验来证明三种金属活动性顺序(写出实验步骤、现象)________.
结论:锌、铁、铜的活泼性顺序为.
五、计算题
19.某同学欲测定生铁中铁的质量分数,他称取样品11.5g,加入足量溶质质量分数为10%的稀硫酸充分反应(杂质不溶于水,也不与稀硫酸反应),产生气体的质量与所加稀硫酸的质量关系如图所示,请回答:
(1)恰好完全反应时生成氢气的质量为 g。
(2)该样品中铁的质量分数?(精确到0.1%)。
(3)图中m的值。
20.将一定质量的金属锌(Zn)投入到100g稀硫酸(H2SO4)中恰好完全反应,放出气体的质量与反应时间的关系如图所示。
回答以下问题:
(1)完全反应后生成的氢气(H2)的质量是多少?
(2)所用稀H2SO4中溶质的质量分数。
21.某兴趣小组按照图所示实验过程测定一黄铜(铜锌合 金)样品中铜的质量分数。实验过程中,用电子天平测得不同时刻装置及药品质量随时间变化的数据,相关数据见下表。请计算:
时刻 t0 t1 t1 t3 t4
装置及药品质量/g 180.0 200.0 199.9 199.8 199.8
(1)共生成气体_____g。
(2)计算黄铜样品中铜的质量分数_____。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.B
3.D
4.C
5.D
6.B
7.C
8.D
9.B
10.C
11.D
12. ABC Mn+2HAc=Mn(Ac)2+H2↑
13.(1)一定含有Cu、Zn,可能含有Mg
(2)Cu(NO3)2、Zn(NO3)2、Mg(NO3)2
14.(1)与水、氧气共同接触
(2)做燃料、冶炼金属等
(3) 置换反应
(4)剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体
15. H2O2 2H2O2H2↑+O2↑
16. 烧杯中澄清的石灰水变浑浊
17. 硫酸(或盐酸,或硫酸铜,或氯化铜,或硝酸铜) 过滤 废物利用(或减少污染,或充分利用资料等) H2SO4+Fe=FeSO4+H2↑(或Fe+CuSO4=FeSO4+Cu)
18. 点燃尾气,防止污染空气 将铁片浸入硫酸铜溶液中,铁片表面有红色固体析出(或将铁片浸入稀硫酸中,有气泡产生,但产生气泡的速度比锌片慢)
19.(1)0.4;
(2)解:设该样品中铁的质量分数为x,消耗硫酸的质量为y
x≈97.4%
y=19.6g;
(3)图中m=19.6g÷10%=196g。
答:该样品中铁的质量分数为97.4%,m=196g。
20.0.4;19.6%
21.(1)0.2(2)67.5%
答案第1页,共2页
答案第1页,共2页
