浙教版2022学年九上科学期末复习课件一:酸碱盐综合(课件 26张ppt)
文档属性
| 名称 | 浙教版2022学年九上科学期末复习课件一:酸碱盐综合(课件 26张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-12-19 09:15:06 | ||
图片预览







文档简介
(共26张PPT)
浙教版 科学(初中)
九上期末复习课(一)
酸
指示剂
活泼金属
金属氧化物
碱
盐
1、酸的通性
指
示
剂
非
金
属
氧
化
物
酸
某
些
盐
碱
使石蕊变蓝酚酞变红
盐+水
盐+水
盐+碱
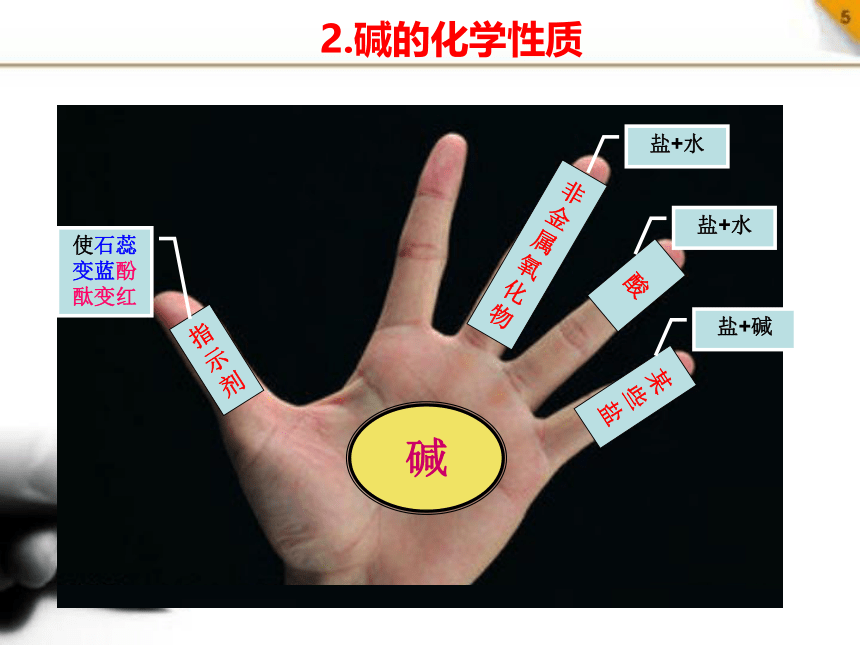
2.碱的化学性质
一、酸碱反应
酸跟碱作用生成盐和水的反应叫酸碱反应。
OH_
+
H+
H2O
=
实质:
二、酸碱反应的应用
1. 改善土壤的酸性。
2. 处理工业废水
3. 精制石油时,中和过量的酸。
4. 用氢氧化铝来中和胃中过量的酸
5. 调配食物
3.酸碱中和反应
中和反应生成盐和水,但生成盐和水的反应,不一定是中和反应
中和反应是复分解反应,但复分解反应不一定是中和反应
以下复分解反应中,哪些是中和反应?
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
BaCl2 + H2SO4 = BaSO4 ↓ + 2HCl
① Cu(OH)2 + H2SO4 =CuSO4 +2 H2O
② BaCl2 + Na2SO4 = BaSO4 ↓ + 2NaCl
⑤ 2HNO3 + Cu(OH)2 = Cu(NO3)2 + 2H2 O
④ BaCO3 + 2HNO3 = Ba(NO3)2+ H2 O +CO2↑
③ 2HCl + CaCO3 = CaCl2 + H2O + CO2↑
⑥ NaOH + HCl = NaCl + H2O
⑦ 2NaOH + H2SO4 = Na2SO4 + 2H2O
中和反应:①⑤⑥⑦
复分解
中和
因此,复分解反应不一定是中和反应,中和反应一定是复分解反应
若把水、酸性溶液和碱性溶液两两混合,溶液pH会如何变化呢
溶液A
溶液B
7
pH
加溶液B质量
0
水中加酸
水中加碱
酸中加水
碱中加水
酸中加碱
碱中加酸
4.盐的制取
1、酸+金属=盐+氢气
2、酸+金属氧化物=盐+水
7、盐+盐=新盐+新盐
8、金属+盐=新金属+新盐
6、碱+酸性氧化物=盐+水
5、碱+盐=新碱+新盐
4、酸+盐=新酸+新盐
3、酸+碱=盐+水
制取盐的途径:
化肥
化肥的种类 常见化肥 在植物生长中的作用 缺乏时的表现
氮肥
(含有氮元素的化肥) 常见的氮肥有NH4NO3、CO(NH2)2、和NH4HCO3等 氮肥含有组成叶绿素的重要元素,能促使农作物的茎叶生长茂盛 植物缺氮元素时叶片发黄,生长缓慢,光合作用减慢
钾肥
(含有钾元素的化肥) 常见的钾肥有K2CO3、K2SO4和KCl等 能促进农作物生长旺盛,茎杆粗壮,增强抗病虫害能力,促进糖和淀粉的生成 植物缺钾元素时茎细小,叶片有褐斑,易倒伏。
磷肥
(含有磷元素的化肥) 常见的磷肥有过磷酸钙[CaSO4和Ca(H2PO4)2的混合物 能促进农作物根系发达,增强吸收养分和抗寒抗旱能力,促进作物穗数增多,籽粒饱满 植物缺磷元素时根短小,叶片暗绿带红。过量会引起作物贪青晚熟
复合肥
(含N、P、K三种营养元素中的两张或三种) 常见的复合肥有KNO3、K3PO4、(NH4)3PO4等 具有氮肥、磷肥、钾肥两重或多重功效
先加入硝酸酸化溶液,然后加入硝酸银,若有氯离子存在,会生成白色的氯化银沉淀。
Ag+ + Cl- = AgCl ↓
NH4+的检验:
向溶液中滴加NaOH溶液,产生刺激性气味的气体,将湿润的红色石蕊试纸置于试管口,能使湿润的红色石蕊试纸变蓝。
NH4+ + OH- = NH3 ↑ + H2O
Cl-的检验:
SO4 2- 的检验:
先加入盐酸酸化,再加入氯化钡,若有硫酸根存在,会生成白色的硫酸钡沉淀。
Ba2+ + SO4 2- = BaSO4 ↓
离子的检验
1.在某溶液中滴加用盐酸酸化的BaCl2溶液有白色沉淀产生,该溶液中( )
A. 一定含有SO42-
B. 一定含有Ag+
C . 一定含有Ag+和 SO42-
D. 可能含有Ag+或 SO42-
D
【基础过关】
2.如图所示小试管中盛有几毫升水,与大试管连通的U形细玻璃管内放有少量水(已染成红色)。如沿试管壁小心地慢慢注入3毫升浓硫酸,静置片刻后,U形细玻璃管中可观察到的液面现象是( )
A. 左高右低
B. 左低右高
C. 左右一样高
D. 来回振动
B
【基础过关】
3.甲、乙两化工分布在某排污渠两岸(如图所示),箭头代表水流方向.若甲厂附近a处水样经检测含有的阴离子是OH﹣、SO42﹣,c处水样经检测pH=7且只含有少量的NaCl.则乙厂排放到b处水中的物质可能是( )
A.BaCl2、HCl B.H2SO4、Ba(NO3)2
C.MgSO4、NaCl D.H2SO4、MgCl2
A
【基础过关】
【基础过关】
4.研究氢氧化钠性质实验中的部分实验及现象记录如下,其中现象不合理的是( )
序号 实 验 现 象A
A 将氢氧化钠固体放在表面皿上,放置一会儿 固体受潮,逐渐溶解
B 向盛有氢氧化钠溶液的试管中滴入无色酚酞试液 溶液变红
C 向盛有氢氧化钠溶液的试管中滴加稀盐酸 有氯化钠生成
D 向盛有氢氧化钠溶液的试管中滴加硫酸铜溶液 产生蓝色沉淀
C
5.下列选项中所列物质均不会和NaOH溶液反应的一组是( )
A. HNO3、NO、SO2、HCl、KCl
B. KNO3、NaCl、NH4Cl、NO2、SO2
C. KOH、BaCl2、KCl、NaNO3
D. K2CO3、K2SO4、CuCl2、NaNO3
C
【基础过关】
【基础过关】
6.将稀盐酸分别滴入NaOH溶液和NaCl溶液中,充分混合后均无明显现象。混合后相关变化的微观示意图如下,下列说法正确的是( )
A.物质间均未发生化学反应
B.变化中都有新物质产生
C.混合后溶液酸碱性都不变
D.图甲可表示酸碱反应的实质
D
1.某同学在家中找到一种白色粉末,到学校实验室进行以下实验,实验过程及现象如图,对此粉末成分判断正确的是( )
A.该粉末可能是CaCO3
B.该粉末一定是碱
C.该粉末可能是Na2CO3
D.该粉末中一定含有CO32-
C
【提高训练】
2.如图是稀HCl和NaOH溶液反应的pH变化曲线图,据图分析能得出的结论正确是( )
A.该反应是稀HCl滴到NaOH溶液中
B.a克是指加入NaOH溶液的质量
C.A点时,溶液的溶质为NaOH、NaCl
D.B点表示稀盐酸和加入的NaOH溶液质量一定相同
B
【提高训练】
【提高训练】
3.将等质量的CaCO3(块状)和Na2CO3(粉末),分别浸入一定量10%盐酸和10%硫酸溶液中,产生CO2的质量随时间变化曲线如图所示,下列说法正确的是( )
A.CaCO3一定没有剩余
B.消耗HCl与H2SO4的质量比为1:1
C.消耗CaCO3与Na2CO3的质量比为1:1
D.反应产生水的质量相等
D
【提高训练】
4.某化学兴趣小组的同学发现,上个月做实验用的NaOH溶液忘记了盖瓶盖。甲、乙两同学为探究该溶液是否变质,该溶液中的溶质是什么,分别进行了实验并提出以下猜想:
①该溶液没有变质,溶液中溶质只有NaOH
②该溶液部分变质,溶液中溶质有NaOH和Na2CO3
③该溶液全部变质,溶液中溶质只有Na2CO3
查阅资料:Na2CO3溶液显碱性,能使无色酚酞溶液变红,而BaCl2溶液显中性。
实验设计:
【提高训练】
【提高训练】
(1)由甲、乙两同学的实验,可知猜想①一定不正确,该溶液已_______(选填“部分”或“全部”)变质。
(2)写出乙同学实验中生成白色沉淀的化学方程式
___________________________________。
(3) 同学(选填“甲”或“乙”)不能得出正确的实验结论,其理由是_____________________________________________________________________________________。
部分
碳酸钠溶液也呈碱性,也能使酚酞溶液变红色,无法确定该溶液是部分变质还是全部变质
BaCl2+Na2CO3=== BaCO3↓+ 2NaCl
甲
【提高训练】
5、室温下,乙同学将盐酸慢慢滴入装有氢氧化钠稀溶液的烧杯中,利用温度计测出烧杯中溶液的温度随时间的变化曲线如图:
①该曲线说明中和反应是_______(填“吸热”或“放热”)反应,B点后溶液温度逐渐下降的原因是___________________________________________________________。
②B点对应溶液的溶质成分是_______,B到A的过程中溶液的pH逐渐_______(填“增大”“减小”或“无变化”)。
③该实验不能用固体氢氧化钠代替氢氧化钠溶液的原因是______________________________________________。
放热
酸碱反应完全,加入的盐酸冷却溶液,同时由于散热,溶液温度降至室温
减小
NaCl
固体氢氧化钠溶于水放出热量,会对实验造成干扰
6. 为了探究氢氧化钡溶液和硫酸钠溶液反应后所得滤液X的成分,同学们做了以下实验:取50克滤液于烧杯中,先向烧杯中滴加溶质质量分数为6%的硫酸镁溶液20克,接着向烧杯中滴加稀硫酸。加入溶液的质量与烧杯内沉淀的质量关系如图所示。
【提高训练】
【提高训练】
(1)滤液X的pH_______7(选填“大于”、“等于”或“小于”)。
(2)CD段发生反应的化学方程式为___________________________。
(3)滤液X中含有的溶质是__________________。
(4)滴加入30克稀硫酸时,烧杯中沉淀的质量m2的值为多少?(写出计算过程)
大于
Mg(OH)2+H2SO4=== MgSO4+2H2O
Ba(OH)2和 NaOH
【提高训练】
7.小科为测定某石灰石样品(主要成分为碳酸钙,其它成分不与稀盐酸反应)中碳酸钙的含量,利用气密性良好的图甲装置进行实验:①称取石灰石样品6克,加入锥形瓶中,塞紧瓶塞,从左侧持续缓慢鼓入空气;②一段时间后打开分液漏斗活塞,注入足量的稀盐酸,开始计时;③待装置D总质量不再增加时停止鼓入空气。实验过程中测得装置D增加的质量随时间变化图像如图乙。(碱石灰能吸收二氧化碳和水)
【提高训练】
(1)根据图乙,运用化学方程式计算该石灰石样品中碳酸钙的质量分数。(计算结果精确到 0.1%)
浙教版 科学(初中)
九上期末复习课(一)
酸
指示剂
活泼金属
金属氧化物
碱
盐
1、酸的通性
指
示
剂
非
金
属
氧
化
物
酸
某
些
盐
碱
使石蕊变蓝酚酞变红
盐+水
盐+水
盐+碱
2.碱的化学性质
一、酸碱反应
酸跟碱作用生成盐和水的反应叫酸碱反应。
OH_
+
H+
H2O
=
实质:
二、酸碱反应的应用
1. 改善土壤的酸性。
2. 处理工业废水
3. 精制石油时,中和过量的酸。
4. 用氢氧化铝来中和胃中过量的酸
5. 调配食物
3.酸碱中和反应
中和反应生成盐和水,但生成盐和水的反应,不一定是中和反应
中和反应是复分解反应,但复分解反应不一定是中和反应
以下复分解反应中,哪些是中和反应?
Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
BaCl2 + H2SO4 = BaSO4 ↓ + 2HCl
① Cu(OH)2 + H2SO4 =CuSO4 +2 H2O
② BaCl2 + Na2SO4 = BaSO4 ↓ + 2NaCl
⑤ 2HNO3 + Cu(OH)2 = Cu(NO3)2 + 2H2 O
④ BaCO3 + 2HNO3 = Ba(NO3)2+ H2 O +CO2↑
③ 2HCl + CaCO3 = CaCl2 + H2O + CO2↑
⑥ NaOH + HCl = NaCl + H2O
⑦ 2NaOH + H2SO4 = Na2SO4 + 2H2O
中和反应:①⑤⑥⑦
复分解
中和
因此,复分解反应不一定是中和反应,中和反应一定是复分解反应
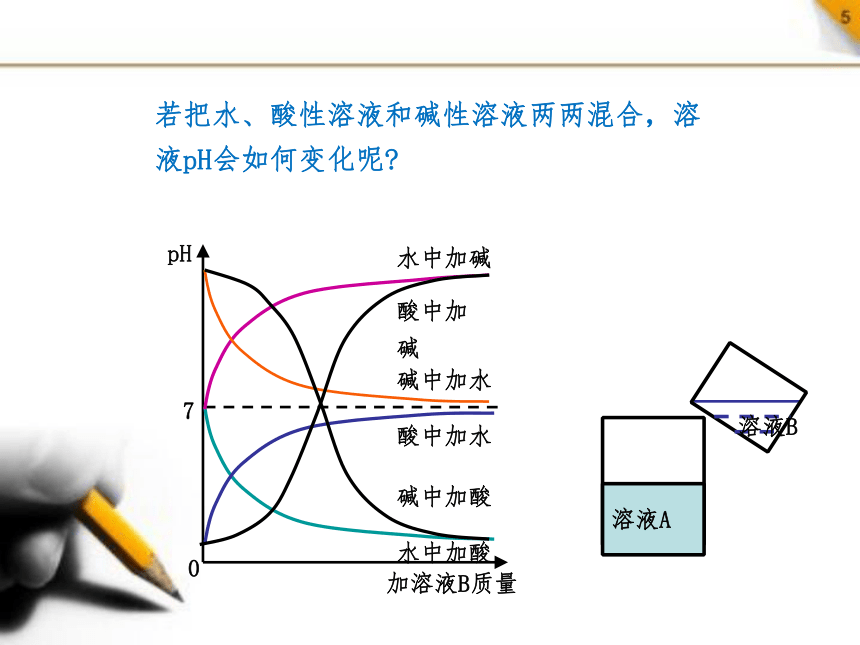
若把水、酸性溶液和碱性溶液两两混合,溶液pH会如何变化呢
溶液A
溶液B
7
pH
加溶液B质量
0
水中加酸
水中加碱
酸中加水
碱中加水
酸中加碱
碱中加酸
4.盐的制取
1、酸+金属=盐+氢气
2、酸+金属氧化物=盐+水
7、盐+盐=新盐+新盐
8、金属+盐=新金属+新盐
6、碱+酸性氧化物=盐+水
5、碱+盐=新碱+新盐
4、酸+盐=新酸+新盐
3、酸+碱=盐+水
制取盐的途径:
化肥
化肥的种类 常见化肥 在植物生长中的作用 缺乏时的表现
氮肥
(含有氮元素的化肥) 常见的氮肥有NH4NO3、CO(NH2)2、和NH4HCO3等 氮肥含有组成叶绿素的重要元素,能促使农作物的茎叶生长茂盛 植物缺氮元素时叶片发黄,生长缓慢,光合作用减慢
钾肥
(含有钾元素的化肥) 常见的钾肥有K2CO3、K2SO4和KCl等 能促进农作物生长旺盛,茎杆粗壮,增强抗病虫害能力,促进糖和淀粉的生成 植物缺钾元素时茎细小,叶片有褐斑,易倒伏。
磷肥
(含有磷元素的化肥) 常见的磷肥有过磷酸钙[CaSO4和Ca(H2PO4)2的混合物 能促进农作物根系发达,增强吸收养分和抗寒抗旱能力,促进作物穗数增多,籽粒饱满 植物缺磷元素时根短小,叶片暗绿带红。过量会引起作物贪青晚熟
复合肥
(含N、P、K三种营养元素中的两张或三种) 常见的复合肥有KNO3、K3PO4、(NH4)3PO4等 具有氮肥、磷肥、钾肥两重或多重功效
先加入硝酸酸化溶液,然后加入硝酸银,若有氯离子存在,会生成白色的氯化银沉淀。
Ag+ + Cl- = AgCl ↓
NH4+的检验:
向溶液中滴加NaOH溶液,产生刺激性气味的气体,将湿润的红色石蕊试纸置于试管口,能使湿润的红色石蕊试纸变蓝。
NH4+ + OH- = NH3 ↑ + H2O
Cl-的检验:
SO4 2- 的检验:
先加入盐酸酸化,再加入氯化钡,若有硫酸根存在,会生成白色的硫酸钡沉淀。
Ba2+ + SO4 2- = BaSO4 ↓
离子的检验
1.在某溶液中滴加用盐酸酸化的BaCl2溶液有白色沉淀产生,该溶液中( )
A. 一定含有SO42-
B. 一定含有Ag+
C . 一定含有Ag+和 SO42-
D. 可能含有Ag+或 SO42-
D
【基础过关】
2.如图所示小试管中盛有几毫升水,与大试管连通的U形细玻璃管内放有少量水(已染成红色)。如沿试管壁小心地慢慢注入3毫升浓硫酸,静置片刻后,U形细玻璃管中可观察到的液面现象是( )
A. 左高右低
B. 左低右高
C. 左右一样高
D. 来回振动
B
【基础过关】
3.甲、乙两化工分布在某排污渠两岸(如图所示),箭头代表水流方向.若甲厂附近a处水样经检测含有的阴离子是OH﹣、SO42﹣,c处水样经检测pH=7且只含有少量的NaCl.则乙厂排放到b处水中的物质可能是( )
A.BaCl2、HCl B.H2SO4、Ba(NO3)2
C.MgSO4、NaCl D.H2SO4、MgCl2
A
【基础过关】
【基础过关】
4.研究氢氧化钠性质实验中的部分实验及现象记录如下,其中现象不合理的是( )
序号 实 验 现 象A
A 将氢氧化钠固体放在表面皿上,放置一会儿 固体受潮,逐渐溶解
B 向盛有氢氧化钠溶液的试管中滴入无色酚酞试液 溶液变红
C 向盛有氢氧化钠溶液的试管中滴加稀盐酸 有氯化钠生成
D 向盛有氢氧化钠溶液的试管中滴加硫酸铜溶液 产生蓝色沉淀
C
5.下列选项中所列物质均不会和NaOH溶液反应的一组是( )
A. HNO3、NO、SO2、HCl、KCl
B. KNO3、NaCl、NH4Cl、NO2、SO2
C. KOH、BaCl2、KCl、NaNO3
D. K2CO3、K2SO4、CuCl2、NaNO3
C
【基础过关】
【基础过关】
6.将稀盐酸分别滴入NaOH溶液和NaCl溶液中,充分混合后均无明显现象。混合后相关变化的微观示意图如下,下列说法正确的是( )
A.物质间均未发生化学反应
B.变化中都有新物质产生
C.混合后溶液酸碱性都不变
D.图甲可表示酸碱反应的实质
D
1.某同学在家中找到一种白色粉末,到学校实验室进行以下实验,实验过程及现象如图,对此粉末成分判断正确的是( )
A.该粉末可能是CaCO3
B.该粉末一定是碱
C.该粉末可能是Na2CO3
D.该粉末中一定含有CO32-
C
【提高训练】
2.如图是稀HCl和NaOH溶液反应的pH变化曲线图,据图分析能得出的结论正确是( )
A.该反应是稀HCl滴到NaOH溶液中
B.a克是指加入NaOH溶液的质量
C.A点时,溶液的溶质为NaOH、NaCl
D.B点表示稀盐酸和加入的NaOH溶液质量一定相同
B
【提高训练】
【提高训练】
3.将等质量的CaCO3(块状)和Na2CO3(粉末),分别浸入一定量10%盐酸和10%硫酸溶液中,产生CO2的质量随时间变化曲线如图所示,下列说法正确的是( )
A.CaCO3一定没有剩余
B.消耗HCl与H2SO4的质量比为1:1
C.消耗CaCO3与Na2CO3的质量比为1:1
D.反应产生水的质量相等
D
【提高训练】
4.某化学兴趣小组的同学发现,上个月做实验用的NaOH溶液忘记了盖瓶盖。甲、乙两同学为探究该溶液是否变质,该溶液中的溶质是什么,分别进行了实验并提出以下猜想:
①该溶液没有变质,溶液中溶质只有NaOH
②该溶液部分变质,溶液中溶质有NaOH和Na2CO3
③该溶液全部变质,溶液中溶质只有Na2CO3
查阅资料:Na2CO3溶液显碱性,能使无色酚酞溶液变红,而BaCl2溶液显中性。
实验设计:
【提高训练】
【提高训练】
(1)由甲、乙两同学的实验,可知猜想①一定不正确,该溶液已_______(选填“部分”或“全部”)变质。
(2)写出乙同学实验中生成白色沉淀的化学方程式
___________________________________。
(3) 同学(选填“甲”或“乙”)不能得出正确的实验结论,其理由是_____________________________________________________________________________________。
部分
碳酸钠溶液也呈碱性,也能使酚酞溶液变红色,无法确定该溶液是部分变质还是全部变质
BaCl2+Na2CO3=== BaCO3↓+ 2NaCl
甲
【提高训练】
5、室温下,乙同学将盐酸慢慢滴入装有氢氧化钠稀溶液的烧杯中,利用温度计测出烧杯中溶液的温度随时间的变化曲线如图:
①该曲线说明中和反应是_______(填“吸热”或“放热”)反应,B点后溶液温度逐渐下降的原因是___________________________________________________________。
②B点对应溶液的溶质成分是_______,B到A的过程中溶液的pH逐渐_______(填“增大”“减小”或“无变化”)。
③该实验不能用固体氢氧化钠代替氢氧化钠溶液的原因是______________________________________________。
放热
酸碱反应完全,加入的盐酸冷却溶液,同时由于散热,溶液温度降至室温
减小
NaCl
固体氢氧化钠溶于水放出热量,会对实验造成干扰
6. 为了探究氢氧化钡溶液和硫酸钠溶液反应后所得滤液X的成分,同学们做了以下实验:取50克滤液于烧杯中,先向烧杯中滴加溶质质量分数为6%的硫酸镁溶液20克,接着向烧杯中滴加稀硫酸。加入溶液的质量与烧杯内沉淀的质量关系如图所示。
【提高训练】
【提高训练】
(1)滤液X的pH_______7(选填“大于”、“等于”或“小于”)。
(2)CD段发生反应的化学方程式为___________________________。
(3)滤液X中含有的溶质是__________________。
(4)滴加入30克稀硫酸时,烧杯中沉淀的质量m2的值为多少?(写出计算过程)
大于
Mg(OH)2+H2SO4=== MgSO4+2H2O
Ba(OH)2和 NaOH
【提高训练】
7.小科为测定某石灰石样品(主要成分为碳酸钙,其它成分不与稀盐酸反应)中碳酸钙的含量,利用气密性良好的图甲装置进行实验:①称取石灰石样品6克,加入锥形瓶中,塞紧瓶塞,从左侧持续缓慢鼓入空气;②一段时间后打开分液漏斗活塞,注入足量的稀盐酸,开始计时;③待装置D总质量不再增加时停止鼓入空气。实验过程中测得装置D增加的质量随时间变化图像如图乙。(碱石灰能吸收二氧化碳和水)
【提高训练】
(1)根据图乙,运用化学方程式计算该石灰石样品中碳酸钙的质量分数。(计算结果精确到 0.1%)
同课章节目录
