初中科学八年级上册华师大版期末复习必刷题 专题五 物质的构成(含解析)
文档属性
| 名称 | 初中科学八年级上册华师大版期末复习必刷题 专题五 物质的构成(含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 327.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-12-20 19:55:38 | ||
图片预览




文档简介
八上期末复习必刷题
专题五 物质的构成
一、单选题
1.碳单质除了金刚石、石墨、C60外,科学家们还合成了C70、C90、C240等,由此做出如下推测:①同元素可以形成多种单质:②单质可能存在复杂的分子结构:③单质的研究具有广阔的前景,其中正确的是( )
A.① B.①③ C.②③ D.①②③
2.能证明澄清透明的矿泉水是混合物的实验是( )
A.取一滴矿泉水在普通显微镜下观察
B.通入直流电
C.仔细品尝矿泉水的味道
D.取1~2滴矿泉水滴在玻璃片上蒸发
3.如图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是( )
A.决定该原子种类的粒子是b B.原子的质量集中在a和c上
C.原子中b与c的数目一定相同 D.原子中a与c的数目一定相同
4.下列叙述正确的是( )
A.若两种微粒的核外电子数相同,这两种微粒一定是同种元素
B.若两种微粒的质子数相同,这两种微粒一定是同种元素
C.若两种微粒是同种元素,这两种微粒的质子数一定相同
D.若两种微粒是同种元素,这两种微粒的最外层电子数一定相同
5.分子和原子的主要区别是( )
A.分子大,原子小
B.分子在化学反应中可以再分,而原子不能
C.分子能构成物质,而原子不能
D.构成物质的分子之间有作用力,而原子没有
6.下列符号既可表示一个原子,又可表示一种元素,还能表示一种物质的是( )
A.N B.Mg C.O2 D.H
7.1854年法国化学家德维尔在实验室中意外地发现一种新元素。已知该元素的一个原子中含有40个微粒,其中14个微粒不带电,则该原子的相对原子质量是( )
A.27 B.26 C.54 D.34
8.PLA是一种新型可降解塑料,以乳酸(C3H6O3)为主要原料聚合而成,下列有关乳酸的说法错误的是( )
A.乳酸是由碳、氢、氧三种元素组成
B.乳酸中含有12个原子
C.乳酸的式量是90
D.乳酸中氧元素的质量分数最大
9.石墨烯是由碳原子构成的只有一层原子厚度的晶体。自然界中本来就存在石墨烯,也可以用机械剥离法从石墨材料中将石墨烯剥离出来。石墨烯具有许多“极端”的物理性质。石墨烯的强度比最好的钢铁强100倍,石墨烯是世界上导电性最好的材料。下列关于石墨烯的说法中,不正确的是( )
A.石墨烯是一种新型金属材料
B.石墨烯是由碳元素组成的单质
C.用机械剥离法制备石墨烯属于物理变化
D.石墨烯有许多“极端”的物理性质,是因为其具有特殊的结构
10.下列有关金刚石、石墨、C60、木炭的说法错误的是( )
A.金刚石可用于制作切割工具
B.C60是一种新型的化合物
C.石墨具有优良的导电性,可用作电极材料
D.木炭疏松多孔,具有吸附能力
11.质量相同的甲、乙两种物质从固态开始加热,它们在相同时间内吸收的热量相等,加热时间都为6min,它们的温度随时间变化的图像如图所示。下列说法正确的是( )
A.甲在3~6min内是液态
B.甲是晶体,乙是非晶体
C.在4~6min内,甲不吸收热量,所以温度不变
D.在固态时,甲的吸热本领小于乙
12.在化学知识中有很多的“相等”。下列说法中不正确的是( )
A.化学反应前后原子的个数相等
B.化合物中元素化合价的正价总数和负价总数相等
C.化学反应前后元素的种类相等
D.在原子中,原子核内质子数和中子数相等
13.下列推理合理的是( )
A.因为离子是带电的微粒,所以带电的微粒一定是离子
B.因为同种分子构成的物质是纯净物,所以纯净物一定是由分子构成的
C.因为单质中只含一种元素,所以只含一种元素的纯净物一定是单质
D.因为在同一化合物中,金属元素显正价,所以非金属元素一定显负价
14.学习化学要善于发现规律,例如:水(H2O)→过氧化氢(H2O2);氧化钠(Na2O)→过氧化钠(Na2O2)。那么按照这样的规律,过氧化钡的化学式为:( )
A.BaO2 B.Ba2O2 C.BaO D.2BaO
15.若元素X只有一种化合价,下列化学式中错误的是( )
A.X2O3 B.X2S3 C.X2Cl3 D.X(NO3)3
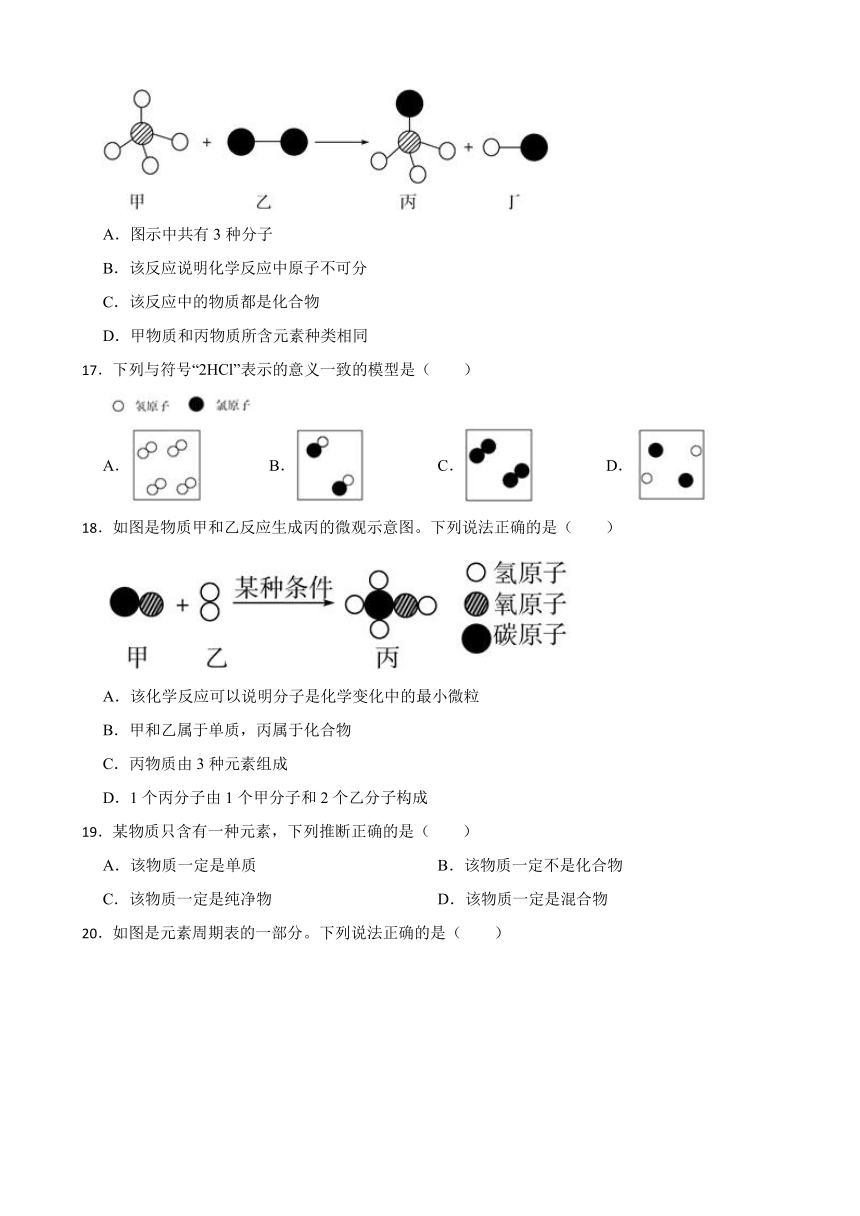
16.已知两种物质发生化学反应的微观示意图如图(一种小球代表一种原子,小球间的短线表示原子的结合)。下列说法正确的是( )
A.图示中共有3种分子
B.该反应说明化学反应中原子不可分
C.该反应中的物质都是化合物
D.甲物质和丙物质所含元素种类相同
17.下列与符号“2HCl”表示的意义一致的模型是( )
A. B. C. D.
18.如图是物质甲和乙反应生成丙的微观示意图。下列说法正确的是( )
A.该化学反应可以说明分子是化学变化中的最小微粒
B.甲和乙属于单质,丙属于化合物
C.丙物质由3种元素组成
D.1个丙分子由1个甲分子和2个乙分子构成
19.某物质只含有一种元素,下列推断正确的是( )
A.该物质一定是单质 B.该物质一定不是化合物
C.该物质一定是纯净物 D.该物质一定是混合物
20.如图是元素周期表的一部分。下列说法正确的是( )
A.硼为金属元素 B.碳的原子序数是12.01
C.铝是地壳中含量最高的元素 D.三种原子中质量最大的是铝
21.下列元素分类正确的是( )
A.金属元素:钙、镁、钡、铜、铁、汞
B.非金属元素:碳、氢、氧、氮、磷、金
C.稀有气体元素:氦、氖、氩、氪、氯、氡
D.人体必需的微量元素:铁、碘、氟、硒、钙、铅
22.下列过程中,水分子发生了变化的是( )
A.水蒸气遇冷凝结成水 B.蔗糖和水混合后得到糖水
C.水通电变成氢气和氧气 D.湿衣服晾干
23.如图是在标准大气压下,某种物质的温度随时间变化的图象。下列说法中错误的是( )
A.该物质是晶体
B.整个过程中,该物质出现两次状态变化
C.该物质的熔点和沸点分别是0℃和100℃
D.在BC段和DE段,该物质温度保持不变,没有吸热
24.下列说法中,正确的是 ( )
A.从溶液中结晶析出的晶体都含结晶水
B.饱和溶液冷却析出晶体后的溶液一定是饱和的
C.结晶水合物中含有水分子,所以它是混合物
D.若硝酸钾溶液中混有少量的氯化钠,可通过蒸发溶剂的方法分离
25.喜树中含有一种被称为喜树碱的生物碱,这种碱的相对分子质量在300~400之间,实验分析得知其元素组成为:C占69.0%、O占18.4%,且O含量为H的4倍,其余为N,则一个喜树碱分子中含有的原子总数为( )
A.42 B.43 C.44 D.45
二、填空题
26.如图是自来水的生产过程。据图回答:
(1)该过程中使用的净水方法有 。
①沉淀 ②过滤 ③蒸馏 ④结晶
(2)现在很多家庭在家中自来水出口加装净水装置,清除水中有害物质,可直接输出符合国家标准的饮用水,该饮用水属于 。(选填“混合物”或“纯净物”)
27.如图是元素周期表的一部分。根据图片信息可以知道:
(1)氧元素在图乙中的 位置 (填图乙中的序号)。
(2)氧元素可以与图乙中的元素⑥组成多种物质,请写出其中一种物质的化学式: 。
28.如图所示,下列容器中分别盛有不同的物质,回答下列问题(填数字):
其中属于混合物的是 ,属于化合物的是 .
29.小潘同学做了一个实验,在距一支粉笔的粗端2cm处点上一滴蓝墨水,将粉笔插入盛有酒精的培养皿中。过一段时间发现随着酒精的上升,蓝墨水在粉笔上不断移动,最后蓝墨水在粉笔上形成两个比较明显的区域(如图所示)。试根据上述现象回答问题:
(1)蓝墨水属于 (选填“纯净物”或“混合物”)
(2)要去除硝酸钾中含有的少量氯化钠可采用 (填序号) 。
A.沉淀法 B.过滤法
C.蒸发溶剂 D.冷却热饱和溶液
30.滨江区中小学校都安装了直饮水机,其主要工作流程如图。
(1)①的作用是__________。
A.杀菌消毒 B.吸附杂质
(2)直饮水机使用方便,只要将它与自来水管对接,清除水中的有害物质(如细菌等),便得到直饮水。 直饮水属于 (填“混合物”或“纯净物”)。
三、解答题
31.探究海波(化学式:Na2S2O3)熔化规律时,小科记录的实验数据如下表所示。
时间/min 0 1 2 3 4 5 6 7 8 9 10 11 12
温度/℃ 40 42 44 46 48 48 48 48 48 48 50 53 56
请根据上述信息回答下列问题。
(1)海波这种物质由钠、硫、氧这三种 (选填“原子”“元素”“分子”)组成,它的式量等于 。
(2)由上述数据可以推断,海波属于 (选填“晶体”、“非晶体”);
(3)当实验进行到11 min,它处于 态。(选填“固”或“液”)
32.小强因感冒到医院看病,医生给他输液时,要用到生理盐水,如图所示是医生给他用的一瓶生理盐水标签,请根据标签给出的数据回答下列问题(设生理盐水的密度为1.0x103千克/米)
(1)生理盐水属于 (选填“纯净物”或“混合物”)
(2)若以每分钟100滴(20滴约为1毫升)的速率给小李静脉输液,则输完这瓶生理盐水约需要 分钟。
(3)输液过程中,小李想到了如下的几个问题,请通过计算帮助解决:这瓶生理盐水的溶质质量分数为多少 如果用质量分数为10%的氯化钠溶液来配制这样一瓶生理盐水,需要10%的氯化钠溶液多少克
33.人体缺乏维生素C(简写“Vc”)就会患坏血病。下图为某种“维生素C”的说明书的一部分,试分析问答:(相对原子质量:)
维生素C(白色) 化学式:C6H8O6 每片100mg,含Vc不少于10% 一日三次,每次xx片,饭后服用
(1)“Vc”的相对分子质量是 ; “Vc”中碳、氢、氧元素的质量比是 。
(2)若正常成年人每天最低需要补充“Vc”60mg。
①当“Vc”完全由图中“维生素C”来补充时,
②则每次至少服用 片;
③当“Vc”完全由某种蔬菜(每100g这种蔬菜含“Vc”15mg) 来补充时,则每天至少应该食用这种蔬菜 g。
34.化学家Tim Richard将分子结构简式像小狗的某有机物(如图所示),取名为“小狗烯”(化学式为C26H26),请计算:
(1)“小狗烯”的式量是 。
(2)“小狗烯”中碳元素和氢元素的质量比 。(填最简整数比)
(3)33.8g“小狗烯”中含碳元素 g。
(4)如图所示,碱性品红(化学式C20H20ClN3)用于棉、人造纤维、纸张、皮革的印染,也用于喷漆、墨水等。现有“小狗烯”和碱性品红的混合物,经测定:含碳元素的质量为120g,则含氢元素的质量为多少克?
答案
1.D 2.D 3.D 4.C 5.B
6.B 7.A 8.B 9.A 10.B
11.D 12.D 13.C 14.A 15.C
16.B 17.B 18.C 19.B 20.D
21.A 22.C 23.D 24.B 25.A
26.(1)①② (2)混合物
27.(1)③ (2)SO2或SO3
28.②③;④
29.(1)混合物 (2)D
30.(1)B
(2)混合物
31.(1)元素;158
(2)晶体
(3)液
32.(1)混合物
(2)100
(3)这瓶生理盐水的质量为:m=ρV=1g/cm3×500cm3=500g;
那么它的溶质质量分数为:;
需要10%的氯化钠溶液质量为:4.5g÷10%=45g。
33.(1)176;9:1:12
(2)2;400
34.(1)338
(2)12∶1
(3)31.2
(4)小狗烯和碱性品红中碳氢原子个数比都是1∶1,所以质量比为12∶1,设氢元素质量为x。
= ,x=10g
解析
1.D
【分析】根据题目提供的信息分析判断。【解答】①从元素组成和单质的概念分析可知,C60、C90、C240都是C元素组成的不同单质,故①正确;
②根据分子的概念可知,这些单质都是有不同结构的物质,其中的C240肯定是非常复杂的分子,故②正确;
③从我们课本熟悉的C60可知,这些新物质都有着特殊的性质,所以研究这些物质前景广阔,故③正确。
那么正确的是①②③。
故选D。
2.D
【分析】只由一种物质组成纯净物,由两种或多种物质组成混合物。
【解答】A.取一滴矿泉水在普通显微镜下观察,根本无法观察到水中存在不同的分子,即不能证明存在矿物质,故A不合题意;
B.通入直流电,水会分解为氢气和氧气,只能说明水由氢元素和氧元素组成,不能说明水中存在可溶性的物质,故B不合题意;
C.仔细品尝矿泉水的味道,几乎没有任何味道,不能证明水中存在可溶性的物质,故C不合题意;
D.取1~2滴矿泉水滴在玻璃片上蒸发,最终在玻璃片上看到析出的固体,这说明水中存在可溶性的物质,即矿泉水为混合物,故D符合题意。
故选D。
3.D
【分析】原子中间为原子核,原子核由带正电的质子和不带电的中子构成,核外是绕核高速旋转的带负电的电子,据此分析判断。
【解答】根据图片可知,a为电子、b为中子,c为质子。
A.不同的原子,原子序数不同;因为质子数=原子序数,所以决定原子种类的粒子是c,故A错误;
B.电子几乎没有质量,原子的质量集中在中子b和质子c上,故B错误;
C.在原子中,中子和质子的个数不一定相等,故C错误;
D.在原子中,正电荷数和负电荷数相等,即质子和电子的个数一定相同,故D正确。
故选D。
4.C
【分析】(1)原子得失电子后形成离子,即离子的核外电子数可以改变;
(2)微粒可以为原子、分子或原子团;
(3)元素是具有相同核电荷数的同一类原子的统称;
(4)若两种微粒是同种元素,则质子数一定相同同。
【解答】A.电子数相同的微粒不一定是同一种元素,如K+和Ca2+,故A错误;
B.微粒可能为原子、分子、离子等,如Na+、NH4+的质子数都是11,HF、Ne的质子数都是10,但不是同种元素,故B错误;
C.元素是具有相同核电荷数(即核内质子数)的同一类原子的总称,故若两种微粒只含一种元素,则这两种微粒的原子核中质子数一定相同,故C正确;
D.两种微粒是同种元素,这两种微粒的最外层电子数不一定相同,比如钠原子和钠离子的最外层电子数不同,故D错误。
故选C。
5.B
【分析】根据对分子和原子的认识分析判断。
【解答】A.分子由原子构成,但是不同原子的大小不同,因此分子不一定比原子大,故A错误;
B.分子在化学反应中可以再分,而原子不能,故B正确;
C.分子和原子都是构成物质的基本微粒,故C错误;
D.分子之间存在作用力,原子之间也存在作用力,故D错误。
故选B。
6.B
【分析】分析各个选项中符号的意义即可。
【解答】A.N的意义:①氮元素;②一个氮原子,但是氮气用N2表示,故A错误;
B.Mg的意义:①镁元素;②一个镁原子;③单质镁,故B正确;
C.O2的意义:①一个氧分子;②氧气,但是不能表示氧原子,故C错误;
D.H的意义:①一个氢原子;②氢元素,但是不能表示氢气(H2),故D错误。
故选B。
7.A
【分析】原子内部的微粒包括电子、质子和中子;质子数等于核外电子数;中子不带电,据此分析计算。
【解答】因为中子不带电,所以该原子内部有14个中子,
那么质子数和核外电子数的和就是:40-14=26。
因为质子数和核外电子数相等,
所以质子数为:26÷2=13。
因为相对原子质量=质子数+中子数,
所以该原子的相对原子质量为:13+14=27。
故选A。
8.B
【分析】(1)在化学式中,一种符号代表一种元素;
(2)化学式中,元素符号右下角的数字就是该种原子的个数;
(3)式量等于相对原子质量和个数的乘积之和;
(4)根据质量分数=可知,同种分子,相对原子质量和个数的乘积越大,质量分数越大。
【解答】A.根据化学式C3H6O3可知,乳酸由碳、氢和氧三种元素组成,故A正确不合题意;
B.根据化学式C3H6O3可知,乳酸分子原子个数为:3+6+3=12,而不是乳酸中,故B错误符合题意;
C.乳酸的数量为:12×3+1×6+16×3=90,故C正确不合题意;
D.碳氢氧三种元素的相对原子质量和个数的乘积之比:(12×3):(1×6):(16×3)=6:1:8,因此氧元素的质量分数最大,故D正确不合题意。
故选B。
9.A
【分析】(1)金属材料是指具有光泽、延展性、容易导电、传热等性质的材料;
(2)只由一种元素组成的纯净物叫单质;
(3)物理变化和化学变化的区别:有无新物质生成;
(4)结构决定性质,性质决定用途。
【解答】A.石墨烯没有金属材料的光泽和延展性,不是金属材料,故A错误符合题意;
B.石墨烯是由碳元素组成的单质,故B正确不合题意;
C.用机械剥离法制备石墨烯,只是改变了碳的存在状态,没有新物质生成,属于物理变化,故C正确不合题;
D.石墨烯有许多“极端”的物理性质,是因为其具有特殊的结构,故D正确不合题意。
故选A。
10.B
【分析】(1)金刚石是自然界硬度最大的物质;
(2)只由一种元素组成的纯净物叫单质,有多种元素组成的叫化合物;
(3)根据石墨的特点分析;
(4)根据木炭的特点分析。
【解答】A.金刚石的硬度大,可用于制作切割工具,故A正确不合题意;
B.C60只由一种碳元素组成,是单质,而不是化合物,故B错误符合题意;
C.石墨具有优良的导电性,可用作电极材料,故C正确不合题意;
D.木炭疏松多孔,具有吸附能力,故D正确不合题意。
故选B。
11.D
【分析】(1)晶体的温度在熔点时,可能是固态,可能是液体,也可能是固液混合态;
(2)有熔点的为晶体,没有熔点的为非晶体;
(3)根据晶体熔化的特点判断;
(4)根据公式Q=cm△t可知,质量相同的物质吸收相同的热量时,吸热能力与升高的温度成反比。
【解答】A.根据图片可知,甲有熔点为晶体,3~6min内温度等于熔点,处于熔化状态,那么它应该是固液混合态,故A错误;
B.甲有熔点,为晶体;乙没有熔点,为非晶体,故B错误;
C.在4~6min内,甲不断吸收热量,但温度不变,故C错误;
D.固态时,加热2min,甲升高的温度大于乙升高的温度,根据公式Q=cm△t可知,甲的比热容小于乙,即甲的吸热本领小于乙,故D正确。
故选D。
12.D
【分析】根据化学反应前后原子种类、个数不变及化合物中元素化合价代数和为0分析。
【解答】A、 化学反应前后原子的个数和种类都不变,不符合题意;
B、 化合物中元素化合价代数和为0,即正价总数和负价总数相等 ,不符合题意;
C、 化学反应前后元素的种类不变,不符合题意;
D、 在原子中,原子核内质子数和中子数不一定相等,符合题意;
故选D。
13.C
【分析】A、根据质子、电子等为带电微粒分析;
B、根据物质由分子或原子或离子构成分析;
C、根据单质的定义分析;
D、根据非金属元素可能是正价可能是负价分析。
【解答】A、 带电的微粒不一定是离子,如质子和电子也带电,不符合题意;
B、 纯净物不一定是由分子构成的 ,也可能是原子或离子构成,不符合题意;
C、 单质中只含一种元素,只含一种元素的纯净物一定是单质 ,符合题意;
D、化合物中, 非金属元素不一定显负价,可能显正价,如二氧化碳中碳元素为+4价,不符合题意;
故选C。
14.A
【分析】化合物化学式的书写一般规律:先读后写,后读先写;金属在前,非金属在后;氧化物中氧在后,原子个数不能漏,正负化合价代数和为零。
【解答】 过氧化钡中氧元素为-1价,钡元素为+2价,由过氧化钡化学式为 BaO2 ;
故选A。
15.C
【分析】根据化合物中元素化合价代数和为0分析。
【解答】 X2O3 、 X(NO3)3 、 X2S3 中X都为+3价, X2Cl3 中X不为+3价,所以 X2Cl3化学式错误;
故选C。
16.B
【分析】根据图示涉及四种物质、化学反应实质、由不同种元素组成的纯净物为化合物分析。
【解答】A、图中共有四种分子,不符合题意;
B、 该反应为原子的重新组合,能说明化学反应中原子不可分, 符合题意;
C、 该反应中的物质中乙是单质,不符合题意;
D、 甲物质两种元素组成,丙物质三种元素组成 ,不符合题意;
故选B。
17.B
【分析】根据符号表示的意义分析。
【解答】 2HCl表示2个氯化氢分子,一个氯化氢分子由一个氯原子和一个氢原子构成;
故选B。
18.C
【分析】根据题目中所给各物质的分子构成及单质和化合物的定义分析。
【解答】A、 该化学反应可以说明的子是化学变化中的最小微粒,不符合题意;
B、 甲、丙属于化合物 ,乙为单质,不符合题意;
C、丙由碳、氢、氧三种元素组成,符合题意;
D、 1个丙分子由一个碳原子、一个氧原子和四个氢原子构成,不符合题意;
故选C。
19.B
【分析】根据一种元素组成的物质可能是混合物可能是单质分析。
【解答】 某物质只含有一种元素, 若为一种物质,则为纯净物中的单质,若为多种物质混合,则为混合物,但一定不是由不同种元素组成的化合物;
故选B。
20.D
【分析】从元素周期表可以获得的信息:左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量。
【解答】A、硼为非金属元素,不符合题意;
B、 碳的原子序数是6,不符合题意;
C、 铝是地壳中含量最高的金属元素,地壳中含量最高的元素是氧元素,不符合题意;
D、相对原子质量大则原子质量大,三种原子中铝的相对原子质量最大,则质量最大的是铝 ,符合题意;
故选D。
21.A
【分析】A、根据元素名称带“钅”的为金属元素分析;
B、根据金属与金属元素分析;
C、根据稀有气体元素的种类分析;
D、根据必需的微量元素种类分析。
【解答】A、 钙、镁、钡、铜、铁、汞都属于金属元素,符合题意;
B、金属于金属元素,不符合题意;
C、 氯 不属于稀有气体元素,不符合题意;
D、铅不属于必需的微量元素,不符合题意;
故选A。
22.C
【分析】分子是保持物质化学性质的最小微粒;水分子发生了变化,即水发生了化学变化,生成了新物质,据此分析判断。
【解答】A.水蒸气遇冷凝结成水,水由气态变成液体发生液化现象,没有新物质生成,故A不合题意;
B.蔗糖和水混合后得到糖水,而糖水是混合物,没有新物质生成,水分子还是水分子,故B不合题意;
C.水通电变成氢气和氧气,有新物质生成,水分子发生了变化,生成了氢分子和氧分子,故C符合题意;
D.湿衣服晾干,水由液态变成气态发生汽化现象,没有新物质生成,故D不合题意。
故选C。
23.D
【分析】从晶体和非晶体相同点和不同点等特征切入解答即可。
【解答】A、该物质由固定的熔化温度,因此属于晶体,A不符合题意;
B、由图可知,整个过程中物质出现两次状态变化,B不符合题意;
C、该物质在0℃时熔化,在100℃沸腾,因此说明该物质的熔点和沸点分别是0℃和100℃,C不符合题意;
D、该物质属于晶体,而晶体熔化过程中的特点是吸热温度不变,D符合题意。
故答案为:D
24.B
【分析】(1)根据析出晶体的特征分析;
(2)如果溶液中有晶体存在,那么溶液肯定饱和;否则,无法判断溶液是否饱和;
(3)由两种或多种物质组成的叫混合物;
(4)溶解度受温度影响变化明显的物质,可以采用冷却热饱和溶液的方式析出;而溶解度随温度变化不明显的物质,可以使用蒸发溶剂的方式析出。
【解答】A.从溶液中结晶析出的晶体不一定含结晶水,例如氯化钠,故A错误;
B.饱和溶液冷却析出晶体后的溶液一定是饱和的,故B正确;
C.结晶水合物中含有水分子,但是它们是一种物质,不是两种物质,所以它是纯净物,故C错误;
D.若硝酸钾溶液中混有少量的氯化钠,可通过冷却热饱和溶液的方法分离,故D错误。
故选B。
25.A
【分析】根据元素的含量来计算物质的化学式,然后利用化学式可知物质的构成,则可判断分子中的原子总数。本题考查学生利用元素的质量分数来计算得出物质的化学式,再利用化学式判断物质的构成即可解答,计算较复杂。
【解答】解:由O占18.4%,且O含量为H的4倍,
则H元素的含量为4.6%,
N元素的含量为1-69%-4.6%-18.4%=8%,
则该物质中C、H、O、N的原子个数比为 ,
则该物质的化学式为(C10H8O2N)n,
又碱的相对分子质量在300~400之间,
300<(12×10+1×8+16×2+14)×n<400,
则n=2符合,
即物质的化学式为C20H16O4N2,
则1个分子中含有20+16+4+2=42个原子。
故答案为:A
26.(1)①②
(2)混合物
【分析】(1)根据水的净化方法和过程分析;
(2)只由一种物质组成的叫纯净物,由多种物质组成的叫混合物。
【解答】(1)根据图片可知,该过程中使用的净水方法有沉淀和过滤,故选①②;
(2)净化后的水中仍然存在大量的可溶性的矿物质,因此该饮用水属于混合物。
27.(1)③
(2)SO2或SO3
【分析】(1)在元素周期表中,左上角的数字就是原子序数,也就是它在元素周期表中的位置;
(2)根据图片确定元素⑥的名称,再确定它和氧元素组成化合物的名字和化学式。
【解答】(1)根据甲图可知,左上角的数字为8,即氧元素的原子序数为8,第一行有2种元素,那么它应该在周期表第二行的第6个位置,故选③;
(2)根据图片可知,元素⑥为硫元素,它和氧元素可以生成二氧化硫或三氧化硫气体,写作SO2或SO3。
28.②③;④
【分析】只由一种物质组成的叫纯净物,由不同元素组成的纯净物叫化合物。由两种或多种物质组成混合物。
【解答】①氧气和液氧为同种物质,因为只由一种元素组成,所以为单质;
②氧气和臭氧为两种不同物质,所以混合物;
③二氧化碳和一氧化碳为两种不同物质,所以为混合物;
④冰和水为同一种物质,因为由两种元素组成,所以为化合物。
则属于混合物的是②③,属于化合物的是④。
29.(1)混合物
(2)D
【分析】(1)只有一种物质组成纯净物,由多组物质组成混合物。
(2)根据物质的溶解度随温度的变化规律确定结晶的方法。
【解答】(1)蓝墨水是由水和蓝色颜料组成的,属于混合物;
(2)硝酸钾的溶解度随温度的升高而迅速增大,而氯化钠的溶解度几乎不受温度的影响,则要去除硝酸钾中含有的少量氯化钠的方法为冷却热饱和溶液,故选D。
30.(1)B
(2)混合物
【分析】(1)根据活性炭的特点和用途解答;
(2)由多种物质组成的物质叫混合物;由一致物质组成的叫纯净物。
【解答】(1)碳罐中的活性炭疏松多孔,具有很强的吸附性,可以吸附水中的杂质,故选B;
(2)直饮水中仍然存在大量的可溶性的矿物质,因此属于混合物。
31.(1)元素;158
(2)晶体
(3)液
【分析】(1)从宏观上看,物质由元素组成;从微观上看,物质由分子或原子构成;元素是具有相同核电荷数的同一类原子的统称。化学式的式量等于组成原子的相对原子质量与个数的乘积之和。
(2)晶体有熔点,而非晶体没有熔点;
(3)晶体在熔化前为固态,熔化中为固液混合态,熔化后为液态,据此分析解答。
【解答】(1)根据化学式 Na2S2O3 可知,海波这种物质由钠、硫、氧这三种元素组成。它的式量是:23×2+32×2+16×3=158。
(2)根据表格可知,在加热过程中,有一段时间海波的温度保持48℃不变,即海波有熔点,因此它是晶体。
(3)根据表格可知,0~4min内,海波还未熔化,为固态;4~9min内,海波正在熔化,为固液混合态;9~12min内,海波完全熔化,为液态,即第11min时,它处于液态。
32.(1)混合物
(2)100
(3)这瓶生理盐水的质量为:m=ρV=1g/cm3×500cm3=500g;
那么它的溶质质量分数为:;
需要10%的氯化钠溶液质量为:4.5g÷10%=45g。
【分析】(1)由两种或多种物质组成的叫混合物;
(2)首先计算出每分钟输入的药液的体积,再用总体积除以每分钟输入的体积得到输完需要的时间;
(3)首先根据m=ρV计算出这瓶生理盐水的质量,再根据计算出溶质的质量分数。
稀释前后,溶质的质量保持不变,据此根据溶液质量=计算出即可。
【解答】(1)生理盐水由水和氯化钠组成,为混合物。
(2)每分钟输入的药液体积:=5mL;
那么输完整瓶药液的时间:。
(3)这瓶生理盐水的质量为:m=ρV=1g/cm3×500cm3=500g;
那么它的溶质质量分数为:;
需要10%的氯化钠溶液质量为:4.5g÷10%=45g。
33.(1)176;9:1:12
(2)2;400
【分析】(1)相对分子质量等于相对原子质量和个数的乘积之和;元素的质量之比等于相对原子质量与个数的乘积之比;
(2)②用维C药片的质量×质量分数计算出一片药中Vc的质量,然后用每天需要的Vc质量除以它计算出一天需要的片数,再除以每天三次计算出每次服用的片数;
③Vc的质量与蔬菜的质量成正比,据此列出方程计算每天食用蔬菜的量即可。
【解答】(1)根据化学式C6H8O6可知,Vc的相对分子质量为:12×6+1×8+16×6=176;
“Vc”中碳、氢、氧元素的质量比是:(12×6):(1×8):(16×6)=9:1:12;
(2)②每片药片中Vc的质量为:100mg×10%=10mg;
每天需要药片的数量:60mg÷10mg=6;
每次需要药片的数量:6÷3=2;
③设每天至少食用这种蔬菜的质量为x,
;
解得:x=400g。
34.(1)338
(2)12∶1
(3)31.2
(4)小狗烯和碱性品红中碳氢原子个数比都是1∶1,所以质量比为12∶1,设氢元素质量为x。
= ,x=10g
【解答】(1)“小狗烯”的式量:12×26+1×26=338;
(2)“小狗烯”中碳元素和氢元素的质量比:(12×26)∶(1×16)=12∶1。
(3)33.8g“小狗烯”中含碳元素为33.8g× ×100%=31.2g。
(4)小狗烯和碱性品红中碳氢原子个数比都是1∶1,所以质量比为12∶1,设氢元素质量为x。
= ,
解得:x=10g。
【分析】(1)化学式的式量等于相对原子质量和个数的乘积之和;
(2)元素的质量之比等于相对原子质量和个数的乘积之比;
(3)碳元素的质量=小狗烯的质量×碳元素的质量分数;
(4)观察两种物质的化学式,找到碳氢两种元素的质量之比,然后列式计算出氢元素的质量即可。
专题五 物质的构成
一、单选题
1.碳单质除了金刚石、石墨、C60外,科学家们还合成了C70、C90、C240等,由此做出如下推测:①同元素可以形成多种单质:②单质可能存在复杂的分子结构:③单质的研究具有广阔的前景,其中正确的是( )
A.① B.①③ C.②③ D.①②③
2.能证明澄清透明的矿泉水是混合物的实验是( )
A.取一滴矿泉水在普通显微镜下观察
B.通入直流电
C.仔细品尝矿泉水的味道
D.取1~2滴矿泉水滴在玻璃片上蒸发
3.如图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是( )
A.决定该原子种类的粒子是b B.原子的质量集中在a和c上
C.原子中b与c的数目一定相同 D.原子中a与c的数目一定相同
4.下列叙述正确的是( )
A.若两种微粒的核外电子数相同,这两种微粒一定是同种元素
B.若两种微粒的质子数相同,这两种微粒一定是同种元素
C.若两种微粒是同种元素,这两种微粒的质子数一定相同
D.若两种微粒是同种元素,这两种微粒的最外层电子数一定相同
5.分子和原子的主要区别是( )
A.分子大,原子小
B.分子在化学反应中可以再分,而原子不能
C.分子能构成物质,而原子不能
D.构成物质的分子之间有作用力,而原子没有
6.下列符号既可表示一个原子,又可表示一种元素,还能表示一种物质的是( )
A.N B.Mg C.O2 D.H
7.1854年法国化学家德维尔在实验室中意外地发现一种新元素。已知该元素的一个原子中含有40个微粒,其中14个微粒不带电,则该原子的相对原子质量是( )
A.27 B.26 C.54 D.34
8.PLA是一种新型可降解塑料,以乳酸(C3H6O3)为主要原料聚合而成,下列有关乳酸的说法错误的是( )
A.乳酸是由碳、氢、氧三种元素组成
B.乳酸中含有12个原子
C.乳酸的式量是90
D.乳酸中氧元素的质量分数最大
9.石墨烯是由碳原子构成的只有一层原子厚度的晶体。自然界中本来就存在石墨烯,也可以用机械剥离法从石墨材料中将石墨烯剥离出来。石墨烯具有许多“极端”的物理性质。石墨烯的强度比最好的钢铁强100倍,石墨烯是世界上导电性最好的材料。下列关于石墨烯的说法中,不正确的是( )
A.石墨烯是一种新型金属材料
B.石墨烯是由碳元素组成的单质
C.用机械剥离法制备石墨烯属于物理变化
D.石墨烯有许多“极端”的物理性质,是因为其具有特殊的结构
10.下列有关金刚石、石墨、C60、木炭的说法错误的是( )
A.金刚石可用于制作切割工具
B.C60是一种新型的化合物
C.石墨具有优良的导电性,可用作电极材料
D.木炭疏松多孔,具有吸附能力
11.质量相同的甲、乙两种物质从固态开始加热,它们在相同时间内吸收的热量相等,加热时间都为6min,它们的温度随时间变化的图像如图所示。下列说法正确的是( )
A.甲在3~6min内是液态
B.甲是晶体,乙是非晶体
C.在4~6min内,甲不吸收热量,所以温度不变
D.在固态时,甲的吸热本领小于乙
12.在化学知识中有很多的“相等”。下列说法中不正确的是( )
A.化学反应前后原子的个数相等
B.化合物中元素化合价的正价总数和负价总数相等
C.化学反应前后元素的种类相等
D.在原子中,原子核内质子数和中子数相等
13.下列推理合理的是( )
A.因为离子是带电的微粒,所以带电的微粒一定是离子
B.因为同种分子构成的物质是纯净物,所以纯净物一定是由分子构成的
C.因为单质中只含一种元素,所以只含一种元素的纯净物一定是单质
D.因为在同一化合物中,金属元素显正价,所以非金属元素一定显负价
14.学习化学要善于发现规律,例如:水(H2O)→过氧化氢(H2O2);氧化钠(Na2O)→过氧化钠(Na2O2)。那么按照这样的规律,过氧化钡的化学式为:( )
A.BaO2 B.Ba2O2 C.BaO D.2BaO
15.若元素X只有一种化合价,下列化学式中错误的是( )
A.X2O3 B.X2S3 C.X2Cl3 D.X(NO3)3
16.已知两种物质发生化学反应的微观示意图如图(一种小球代表一种原子,小球间的短线表示原子的结合)。下列说法正确的是( )
A.图示中共有3种分子
B.该反应说明化学反应中原子不可分
C.该反应中的物质都是化合物
D.甲物质和丙物质所含元素种类相同
17.下列与符号“2HCl”表示的意义一致的模型是( )
A. B. C. D.
18.如图是物质甲和乙反应生成丙的微观示意图。下列说法正确的是( )
A.该化学反应可以说明分子是化学变化中的最小微粒
B.甲和乙属于单质,丙属于化合物
C.丙物质由3种元素组成
D.1个丙分子由1个甲分子和2个乙分子构成
19.某物质只含有一种元素,下列推断正确的是( )
A.该物质一定是单质 B.该物质一定不是化合物
C.该物质一定是纯净物 D.该物质一定是混合物
20.如图是元素周期表的一部分。下列说法正确的是( )
A.硼为金属元素 B.碳的原子序数是12.01
C.铝是地壳中含量最高的元素 D.三种原子中质量最大的是铝
21.下列元素分类正确的是( )
A.金属元素:钙、镁、钡、铜、铁、汞
B.非金属元素:碳、氢、氧、氮、磷、金
C.稀有气体元素:氦、氖、氩、氪、氯、氡
D.人体必需的微量元素:铁、碘、氟、硒、钙、铅
22.下列过程中,水分子发生了变化的是( )
A.水蒸气遇冷凝结成水 B.蔗糖和水混合后得到糖水
C.水通电变成氢气和氧气 D.湿衣服晾干
23.如图是在标准大气压下,某种物质的温度随时间变化的图象。下列说法中错误的是( )
A.该物质是晶体
B.整个过程中,该物质出现两次状态变化
C.该物质的熔点和沸点分别是0℃和100℃
D.在BC段和DE段,该物质温度保持不变,没有吸热
24.下列说法中,正确的是 ( )
A.从溶液中结晶析出的晶体都含结晶水
B.饱和溶液冷却析出晶体后的溶液一定是饱和的
C.结晶水合物中含有水分子,所以它是混合物
D.若硝酸钾溶液中混有少量的氯化钠,可通过蒸发溶剂的方法分离
25.喜树中含有一种被称为喜树碱的生物碱,这种碱的相对分子质量在300~400之间,实验分析得知其元素组成为:C占69.0%、O占18.4%,且O含量为H的4倍,其余为N,则一个喜树碱分子中含有的原子总数为( )
A.42 B.43 C.44 D.45
二、填空题
26.如图是自来水的生产过程。据图回答:
(1)该过程中使用的净水方法有 。
①沉淀 ②过滤 ③蒸馏 ④结晶
(2)现在很多家庭在家中自来水出口加装净水装置,清除水中有害物质,可直接输出符合国家标准的饮用水,该饮用水属于 。(选填“混合物”或“纯净物”)
27.如图是元素周期表的一部分。根据图片信息可以知道:
(1)氧元素在图乙中的 位置 (填图乙中的序号)。
(2)氧元素可以与图乙中的元素⑥组成多种物质,请写出其中一种物质的化学式: 。
28.如图所示,下列容器中分别盛有不同的物质,回答下列问题(填数字):
其中属于混合物的是 ,属于化合物的是 .
29.小潘同学做了一个实验,在距一支粉笔的粗端2cm处点上一滴蓝墨水,将粉笔插入盛有酒精的培养皿中。过一段时间发现随着酒精的上升,蓝墨水在粉笔上不断移动,最后蓝墨水在粉笔上形成两个比较明显的区域(如图所示)。试根据上述现象回答问题:
(1)蓝墨水属于 (选填“纯净物”或“混合物”)
(2)要去除硝酸钾中含有的少量氯化钠可采用 (填序号) 。
A.沉淀法 B.过滤法
C.蒸发溶剂 D.冷却热饱和溶液
30.滨江区中小学校都安装了直饮水机,其主要工作流程如图。
(1)①的作用是__________。
A.杀菌消毒 B.吸附杂质
(2)直饮水机使用方便,只要将它与自来水管对接,清除水中的有害物质(如细菌等),便得到直饮水。 直饮水属于 (填“混合物”或“纯净物”)。
三、解答题
31.探究海波(化学式:Na2S2O3)熔化规律时,小科记录的实验数据如下表所示。
时间/min 0 1 2 3 4 5 6 7 8 9 10 11 12
温度/℃ 40 42 44 46 48 48 48 48 48 48 50 53 56
请根据上述信息回答下列问题。
(1)海波这种物质由钠、硫、氧这三种 (选填“原子”“元素”“分子”)组成,它的式量等于 。
(2)由上述数据可以推断,海波属于 (选填“晶体”、“非晶体”);
(3)当实验进行到11 min,它处于 态。(选填“固”或“液”)
32.小强因感冒到医院看病,医生给他输液时,要用到生理盐水,如图所示是医生给他用的一瓶生理盐水标签,请根据标签给出的数据回答下列问题(设生理盐水的密度为1.0x103千克/米)
(1)生理盐水属于 (选填“纯净物”或“混合物”)
(2)若以每分钟100滴(20滴约为1毫升)的速率给小李静脉输液,则输完这瓶生理盐水约需要 分钟。
(3)输液过程中,小李想到了如下的几个问题,请通过计算帮助解决:这瓶生理盐水的溶质质量分数为多少 如果用质量分数为10%的氯化钠溶液来配制这样一瓶生理盐水,需要10%的氯化钠溶液多少克
33.人体缺乏维生素C(简写“Vc”)就会患坏血病。下图为某种“维生素C”的说明书的一部分,试分析问答:(相对原子质量:)
维生素C(白色) 化学式:C6H8O6 每片100mg,含Vc不少于10% 一日三次,每次xx片,饭后服用
(1)“Vc”的相对分子质量是 ; “Vc”中碳、氢、氧元素的质量比是 。
(2)若正常成年人每天最低需要补充“Vc”60mg。
①当“Vc”完全由图中“维生素C”来补充时,
②则每次至少服用 片;
③当“Vc”完全由某种蔬菜(每100g这种蔬菜含“Vc”15mg) 来补充时,则每天至少应该食用这种蔬菜 g。
34.化学家Tim Richard将分子结构简式像小狗的某有机物(如图所示),取名为“小狗烯”(化学式为C26H26),请计算:
(1)“小狗烯”的式量是 。
(2)“小狗烯”中碳元素和氢元素的质量比 。(填最简整数比)
(3)33.8g“小狗烯”中含碳元素 g。
(4)如图所示,碱性品红(化学式C20H20ClN3)用于棉、人造纤维、纸张、皮革的印染,也用于喷漆、墨水等。现有“小狗烯”和碱性品红的混合物,经测定:含碳元素的质量为120g,则含氢元素的质量为多少克?
答案
1.D 2.D 3.D 4.C 5.B
6.B 7.A 8.B 9.A 10.B
11.D 12.D 13.C 14.A 15.C
16.B 17.B 18.C 19.B 20.D
21.A 22.C 23.D 24.B 25.A
26.(1)①② (2)混合物
27.(1)③ (2)SO2或SO3
28.②③;④
29.(1)混合物 (2)D
30.(1)B
(2)混合物
31.(1)元素;158
(2)晶体
(3)液
32.(1)混合物
(2)100
(3)这瓶生理盐水的质量为:m=ρV=1g/cm3×500cm3=500g;
那么它的溶质质量分数为:;
需要10%的氯化钠溶液质量为:4.5g÷10%=45g。
33.(1)176;9:1:12
(2)2;400
34.(1)338
(2)12∶1
(3)31.2
(4)小狗烯和碱性品红中碳氢原子个数比都是1∶1,所以质量比为12∶1,设氢元素质量为x。
= ,x=10g
解析
1.D
【分析】根据题目提供的信息分析判断。【解答】①从元素组成和单质的概念分析可知,C60、C90、C240都是C元素组成的不同单质,故①正确;
②根据分子的概念可知,这些单质都是有不同结构的物质,其中的C240肯定是非常复杂的分子,故②正确;
③从我们课本熟悉的C60可知,这些新物质都有着特殊的性质,所以研究这些物质前景广阔,故③正确。
那么正确的是①②③。
故选D。
2.D
【分析】只由一种物质组成纯净物,由两种或多种物质组成混合物。
【解答】A.取一滴矿泉水在普通显微镜下观察,根本无法观察到水中存在不同的分子,即不能证明存在矿物质,故A不合题意;
B.通入直流电,水会分解为氢气和氧气,只能说明水由氢元素和氧元素组成,不能说明水中存在可溶性的物质,故B不合题意;
C.仔细品尝矿泉水的味道,几乎没有任何味道,不能证明水中存在可溶性的物质,故C不合题意;
D.取1~2滴矿泉水滴在玻璃片上蒸发,最终在玻璃片上看到析出的固体,这说明水中存在可溶性的物质,即矿泉水为混合物,故D符合题意。
故选D。
3.D
【分析】原子中间为原子核,原子核由带正电的质子和不带电的中子构成,核外是绕核高速旋转的带负电的电子,据此分析判断。
【解答】根据图片可知,a为电子、b为中子,c为质子。
A.不同的原子,原子序数不同;因为质子数=原子序数,所以决定原子种类的粒子是c,故A错误;
B.电子几乎没有质量,原子的质量集中在中子b和质子c上,故B错误;
C.在原子中,中子和质子的个数不一定相等,故C错误;
D.在原子中,正电荷数和负电荷数相等,即质子和电子的个数一定相同,故D正确。
故选D。
4.C
【分析】(1)原子得失电子后形成离子,即离子的核外电子数可以改变;
(2)微粒可以为原子、分子或原子团;
(3)元素是具有相同核电荷数的同一类原子的统称;
(4)若两种微粒是同种元素,则质子数一定相同同。
【解答】A.电子数相同的微粒不一定是同一种元素,如K+和Ca2+,故A错误;
B.微粒可能为原子、分子、离子等,如Na+、NH4+的质子数都是11,HF、Ne的质子数都是10,但不是同种元素,故B错误;
C.元素是具有相同核电荷数(即核内质子数)的同一类原子的总称,故若两种微粒只含一种元素,则这两种微粒的原子核中质子数一定相同,故C正确;
D.两种微粒是同种元素,这两种微粒的最外层电子数不一定相同,比如钠原子和钠离子的最外层电子数不同,故D错误。
故选C。
5.B
【分析】根据对分子和原子的认识分析判断。
【解答】A.分子由原子构成,但是不同原子的大小不同,因此分子不一定比原子大,故A错误;
B.分子在化学反应中可以再分,而原子不能,故B正确;
C.分子和原子都是构成物质的基本微粒,故C错误;
D.分子之间存在作用力,原子之间也存在作用力,故D错误。
故选B。
6.B
【分析】分析各个选项中符号的意义即可。
【解答】A.N的意义:①氮元素;②一个氮原子,但是氮气用N2表示,故A错误;
B.Mg的意义:①镁元素;②一个镁原子;③单质镁,故B正确;
C.O2的意义:①一个氧分子;②氧气,但是不能表示氧原子,故C错误;
D.H的意义:①一个氢原子;②氢元素,但是不能表示氢气(H2),故D错误。
故选B。
7.A
【分析】原子内部的微粒包括电子、质子和中子;质子数等于核外电子数;中子不带电,据此分析计算。
【解答】因为中子不带电,所以该原子内部有14个中子,
那么质子数和核外电子数的和就是:40-14=26。
因为质子数和核外电子数相等,
所以质子数为:26÷2=13。
因为相对原子质量=质子数+中子数,
所以该原子的相对原子质量为:13+14=27。
故选A。
8.B
【分析】(1)在化学式中,一种符号代表一种元素;
(2)化学式中,元素符号右下角的数字就是该种原子的个数;
(3)式量等于相对原子质量和个数的乘积之和;
(4)根据质量分数=可知,同种分子,相对原子质量和个数的乘积越大,质量分数越大。
【解答】A.根据化学式C3H6O3可知,乳酸由碳、氢和氧三种元素组成,故A正确不合题意;
B.根据化学式C3H6O3可知,乳酸分子原子个数为:3+6+3=12,而不是乳酸中,故B错误符合题意;
C.乳酸的数量为:12×3+1×6+16×3=90,故C正确不合题意;
D.碳氢氧三种元素的相对原子质量和个数的乘积之比:(12×3):(1×6):(16×3)=6:1:8,因此氧元素的质量分数最大,故D正确不合题意。
故选B。
9.A
【分析】(1)金属材料是指具有光泽、延展性、容易导电、传热等性质的材料;
(2)只由一种元素组成的纯净物叫单质;
(3)物理变化和化学变化的区别:有无新物质生成;
(4)结构决定性质,性质决定用途。
【解答】A.石墨烯没有金属材料的光泽和延展性,不是金属材料,故A错误符合题意;
B.石墨烯是由碳元素组成的单质,故B正确不合题意;
C.用机械剥离法制备石墨烯,只是改变了碳的存在状态,没有新物质生成,属于物理变化,故C正确不合题;
D.石墨烯有许多“极端”的物理性质,是因为其具有特殊的结构,故D正确不合题意。
故选A。
10.B
【分析】(1)金刚石是自然界硬度最大的物质;
(2)只由一种元素组成的纯净物叫单质,有多种元素组成的叫化合物;
(3)根据石墨的特点分析;
(4)根据木炭的特点分析。
【解答】A.金刚石的硬度大,可用于制作切割工具,故A正确不合题意;
B.C60只由一种碳元素组成,是单质,而不是化合物,故B错误符合题意;
C.石墨具有优良的导电性,可用作电极材料,故C正确不合题意;
D.木炭疏松多孔,具有吸附能力,故D正确不合题意。
故选B。
11.D
【分析】(1)晶体的温度在熔点时,可能是固态,可能是液体,也可能是固液混合态;
(2)有熔点的为晶体,没有熔点的为非晶体;
(3)根据晶体熔化的特点判断;
(4)根据公式Q=cm△t可知,质量相同的物质吸收相同的热量时,吸热能力与升高的温度成反比。
【解答】A.根据图片可知,甲有熔点为晶体,3~6min内温度等于熔点,处于熔化状态,那么它应该是固液混合态,故A错误;
B.甲有熔点,为晶体;乙没有熔点,为非晶体,故B错误;
C.在4~6min内,甲不断吸收热量,但温度不变,故C错误;
D.固态时,加热2min,甲升高的温度大于乙升高的温度,根据公式Q=cm△t可知,甲的比热容小于乙,即甲的吸热本领小于乙,故D正确。
故选D。
12.D
【分析】根据化学反应前后原子种类、个数不变及化合物中元素化合价代数和为0分析。
【解答】A、 化学反应前后原子的个数和种类都不变,不符合题意;
B、 化合物中元素化合价代数和为0,即正价总数和负价总数相等 ,不符合题意;
C、 化学反应前后元素的种类不变,不符合题意;
D、 在原子中,原子核内质子数和中子数不一定相等,符合题意;
故选D。
13.C
【分析】A、根据质子、电子等为带电微粒分析;
B、根据物质由分子或原子或离子构成分析;
C、根据单质的定义分析;
D、根据非金属元素可能是正价可能是负价分析。
【解答】A、 带电的微粒不一定是离子,如质子和电子也带电,不符合题意;
B、 纯净物不一定是由分子构成的 ,也可能是原子或离子构成,不符合题意;
C、 单质中只含一种元素,只含一种元素的纯净物一定是单质 ,符合题意;
D、化合物中, 非金属元素不一定显负价,可能显正价,如二氧化碳中碳元素为+4价,不符合题意;
故选C。
14.A
【分析】化合物化学式的书写一般规律:先读后写,后读先写;金属在前,非金属在后;氧化物中氧在后,原子个数不能漏,正负化合价代数和为零。
【解答】 过氧化钡中氧元素为-1价,钡元素为+2价,由过氧化钡化学式为 BaO2 ;
故选A。
15.C
【分析】根据化合物中元素化合价代数和为0分析。
【解答】 X2O3 、 X(NO3)3 、 X2S3 中X都为+3价, X2Cl3 中X不为+3价,所以 X2Cl3化学式错误;
故选C。
16.B
【分析】根据图示涉及四种物质、化学反应实质、由不同种元素组成的纯净物为化合物分析。
【解答】A、图中共有四种分子,不符合题意;
B、 该反应为原子的重新组合,能说明化学反应中原子不可分, 符合题意;
C、 该反应中的物质中乙是单质,不符合题意;
D、 甲物质两种元素组成,丙物质三种元素组成 ,不符合题意;
故选B。
17.B
【分析】根据符号表示的意义分析。
【解答】 2HCl表示2个氯化氢分子,一个氯化氢分子由一个氯原子和一个氢原子构成;
故选B。
18.C
【分析】根据题目中所给各物质的分子构成及单质和化合物的定义分析。
【解答】A、 该化学反应可以说明的子是化学变化中的最小微粒,不符合题意;
B、 甲、丙属于化合物 ,乙为单质,不符合题意;
C、丙由碳、氢、氧三种元素组成,符合题意;
D、 1个丙分子由一个碳原子、一个氧原子和四个氢原子构成,不符合题意;
故选C。
19.B
【分析】根据一种元素组成的物质可能是混合物可能是单质分析。
【解答】 某物质只含有一种元素, 若为一种物质,则为纯净物中的单质,若为多种物质混合,则为混合物,但一定不是由不同种元素组成的化合物;
故选B。
20.D
【分析】从元素周期表可以获得的信息:左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量。
【解答】A、硼为非金属元素,不符合题意;
B、 碳的原子序数是6,不符合题意;
C、 铝是地壳中含量最高的金属元素,地壳中含量最高的元素是氧元素,不符合题意;
D、相对原子质量大则原子质量大,三种原子中铝的相对原子质量最大,则质量最大的是铝 ,符合题意;
故选D。
21.A
【分析】A、根据元素名称带“钅”的为金属元素分析;
B、根据金属与金属元素分析;
C、根据稀有气体元素的种类分析;
D、根据必需的微量元素种类分析。
【解答】A、 钙、镁、钡、铜、铁、汞都属于金属元素,符合题意;
B、金属于金属元素,不符合题意;
C、 氯 不属于稀有气体元素,不符合题意;
D、铅不属于必需的微量元素,不符合题意;
故选A。
22.C
【分析】分子是保持物质化学性质的最小微粒;水分子发生了变化,即水发生了化学变化,生成了新物质,据此分析判断。
【解答】A.水蒸气遇冷凝结成水,水由气态变成液体发生液化现象,没有新物质生成,故A不合题意;
B.蔗糖和水混合后得到糖水,而糖水是混合物,没有新物质生成,水分子还是水分子,故B不合题意;
C.水通电变成氢气和氧气,有新物质生成,水分子发生了变化,生成了氢分子和氧分子,故C符合题意;
D.湿衣服晾干,水由液态变成气态发生汽化现象,没有新物质生成,故D不合题意。
故选C。
23.D
【分析】从晶体和非晶体相同点和不同点等特征切入解答即可。
【解答】A、该物质由固定的熔化温度,因此属于晶体,A不符合题意;
B、由图可知,整个过程中物质出现两次状态变化,B不符合题意;
C、该物质在0℃时熔化,在100℃沸腾,因此说明该物质的熔点和沸点分别是0℃和100℃,C不符合题意;
D、该物质属于晶体,而晶体熔化过程中的特点是吸热温度不变,D符合题意。
故答案为:D
24.B
【分析】(1)根据析出晶体的特征分析;
(2)如果溶液中有晶体存在,那么溶液肯定饱和;否则,无法判断溶液是否饱和;
(3)由两种或多种物质组成的叫混合物;
(4)溶解度受温度影响变化明显的物质,可以采用冷却热饱和溶液的方式析出;而溶解度随温度变化不明显的物质,可以使用蒸发溶剂的方式析出。
【解答】A.从溶液中结晶析出的晶体不一定含结晶水,例如氯化钠,故A错误;
B.饱和溶液冷却析出晶体后的溶液一定是饱和的,故B正确;
C.结晶水合物中含有水分子,但是它们是一种物质,不是两种物质,所以它是纯净物,故C错误;
D.若硝酸钾溶液中混有少量的氯化钠,可通过冷却热饱和溶液的方法分离,故D错误。
故选B。
25.A
【分析】根据元素的含量来计算物质的化学式,然后利用化学式可知物质的构成,则可判断分子中的原子总数。本题考查学生利用元素的质量分数来计算得出物质的化学式,再利用化学式判断物质的构成即可解答,计算较复杂。
【解答】解:由O占18.4%,且O含量为H的4倍,
则H元素的含量为4.6%,
N元素的含量为1-69%-4.6%-18.4%=8%,
则该物质中C、H、O、N的原子个数比为 ,
则该物质的化学式为(C10H8O2N)n,
又碱的相对分子质量在300~400之间,
300<(12×10+1×8+16×2+14)×n<400,
则n=2符合,
即物质的化学式为C20H16O4N2,
则1个分子中含有20+16+4+2=42个原子。
故答案为:A
26.(1)①②
(2)混合物
【分析】(1)根据水的净化方法和过程分析;
(2)只由一种物质组成的叫纯净物,由多种物质组成的叫混合物。
【解答】(1)根据图片可知,该过程中使用的净水方法有沉淀和过滤,故选①②;
(2)净化后的水中仍然存在大量的可溶性的矿物质,因此该饮用水属于混合物。
27.(1)③
(2)SO2或SO3
【分析】(1)在元素周期表中,左上角的数字就是原子序数,也就是它在元素周期表中的位置;
(2)根据图片确定元素⑥的名称,再确定它和氧元素组成化合物的名字和化学式。
【解答】(1)根据甲图可知,左上角的数字为8,即氧元素的原子序数为8,第一行有2种元素,那么它应该在周期表第二行的第6个位置,故选③;
(2)根据图片可知,元素⑥为硫元素,它和氧元素可以生成二氧化硫或三氧化硫气体,写作SO2或SO3。
28.②③;④
【分析】只由一种物质组成的叫纯净物,由不同元素组成的纯净物叫化合物。由两种或多种物质组成混合物。
【解答】①氧气和液氧为同种物质,因为只由一种元素组成,所以为单质;
②氧气和臭氧为两种不同物质,所以混合物;
③二氧化碳和一氧化碳为两种不同物质,所以为混合物;
④冰和水为同一种物质,因为由两种元素组成,所以为化合物。
则属于混合物的是②③,属于化合物的是④。
29.(1)混合物
(2)D
【分析】(1)只有一种物质组成纯净物,由多组物质组成混合物。
(2)根据物质的溶解度随温度的变化规律确定结晶的方法。
【解答】(1)蓝墨水是由水和蓝色颜料组成的,属于混合物;
(2)硝酸钾的溶解度随温度的升高而迅速增大,而氯化钠的溶解度几乎不受温度的影响,则要去除硝酸钾中含有的少量氯化钠的方法为冷却热饱和溶液,故选D。
30.(1)B
(2)混合物
【分析】(1)根据活性炭的特点和用途解答;
(2)由多种物质组成的物质叫混合物;由一致物质组成的叫纯净物。
【解答】(1)碳罐中的活性炭疏松多孔,具有很强的吸附性,可以吸附水中的杂质,故选B;
(2)直饮水中仍然存在大量的可溶性的矿物质,因此属于混合物。
31.(1)元素;158
(2)晶体
(3)液
【分析】(1)从宏观上看,物质由元素组成;从微观上看,物质由分子或原子构成;元素是具有相同核电荷数的同一类原子的统称。化学式的式量等于组成原子的相对原子质量与个数的乘积之和。
(2)晶体有熔点,而非晶体没有熔点;
(3)晶体在熔化前为固态,熔化中为固液混合态,熔化后为液态,据此分析解答。
【解答】(1)根据化学式 Na2S2O3 可知,海波这种物质由钠、硫、氧这三种元素组成。它的式量是:23×2+32×2+16×3=158。
(2)根据表格可知,在加热过程中,有一段时间海波的温度保持48℃不变,即海波有熔点,因此它是晶体。
(3)根据表格可知,0~4min内,海波还未熔化,为固态;4~9min内,海波正在熔化,为固液混合态;9~12min内,海波完全熔化,为液态,即第11min时,它处于液态。
32.(1)混合物
(2)100
(3)这瓶生理盐水的质量为:m=ρV=1g/cm3×500cm3=500g;
那么它的溶质质量分数为:;
需要10%的氯化钠溶液质量为:4.5g÷10%=45g。
【分析】(1)由两种或多种物质组成的叫混合物;
(2)首先计算出每分钟输入的药液的体积,再用总体积除以每分钟输入的体积得到输完需要的时间;
(3)首先根据m=ρV计算出这瓶生理盐水的质量,再根据计算出溶质的质量分数。
稀释前后,溶质的质量保持不变,据此根据溶液质量=计算出即可。
【解答】(1)生理盐水由水和氯化钠组成,为混合物。
(2)每分钟输入的药液体积:=5mL;
那么输完整瓶药液的时间:。
(3)这瓶生理盐水的质量为:m=ρV=1g/cm3×500cm3=500g;
那么它的溶质质量分数为:;
需要10%的氯化钠溶液质量为:4.5g÷10%=45g。
33.(1)176;9:1:12
(2)2;400
【分析】(1)相对分子质量等于相对原子质量和个数的乘积之和;元素的质量之比等于相对原子质量与个数的乘积之比;
(2)②用维C药片的质量×质量分数计算出一片药中Vc的质量,然后用每天需要的Vc质量除以它计算出一天需要的片数,再除以每天三次计算出每次服用的片数;
③Vc的质量与蔬菜的质量成正比,据此列出方程计算每天食用蔬菜的量即可。
【解答】(1)根据化学式C6H8O6可知,Vc的相对分子质量为:12×6+1×8+16×6=176;
“Vc”中碳、氢、氧元素的质量比是:(12×6):(1×8):(16×6)=9:1:12;
(2)②每片药片中Vc的质量为:100mg×10%=10mg;
每天需要药片的数量:60mg÷10mg=6;
每次需要药片的数量:6÷3=2;
③设每天至少食用这种蔬菜的质量为x,
;
解得:x=400g。
34.(1)338
(2)12∶1
(3)31.2
(4)小狗烯和碱性品红中碳氢原子个数比都是1∶1,所以质量比为12∶1,设氢元素质量为x。
= ,x=10g
【解答】(1)“小狗烯”的式量:12×26+1×26=338;
(2)“小狗烯”中碳元素和氢元素的质量比:(12×26)∶(1×16)=12∶1。
(3)33.8g“小狗烯”中含碳元素为33.8g× ×100%=31.2g。
(4)小狗烯和碱性品红中碳氢原子个数比都是1∶1,所以质量比为12∶1,设氢元素质量为x。
= ,
解得:x=10g。
【分析】(1)化学式的式量等于相对原子质量和个数的乘积之和;
(2)元素的质量之比等于相对原子质量和个数的乘积之比;
(3)碳元素的质量=小狗烯的质量×碳元素的质量分数;
(4)观察两种物质的化学式,找到碳氢两种元素的质量之比,然后列式计算出氢元素的质量即可。
同课章节目录
- 第1章 运动和力
- 1 机械运动
- 2 力
- 3 几种常见的力
- 4 运动和力
- 5 二力平衡的条件
- 第2章 压力 压强
- 1 压强
- 2 液体内部的压强
- 3 大气压强
- 4 流体的压强与流速的关系
- 第3章 浮力
- 1 密度
- 2 浮力
- 3 阿基米德原理
- 4 物体浮沉条件及其应用
- 第4章 植物的物质和能量的转化
- 1 绿色开花植物的营养器官
- 2 水在植物体中的代谢
- 3 无机盐在植物体内的代谢
- 4 植物的光合作用和呼吸作用
- 第5章 人体的物质和能量的转化
- 1 食物的消化和吸收
- 2 人体的呼吸
- 3 人体内的物质运输
- 4 人体的排泄
- 5 人体生命活动过程中物质和能量的转化
- 第6章 物质的构成
- 1 构成物质的微粒
- 2 元素
- 3 物质的分类
- 4 化学式
- 5 固态物质
