专题8《金属和金属材料》章末复习题- 九年级化学仁爱版下册(含答案)
文档属性
| 名称 | 专题8《金属和金属材料》章末复习题- 九年级化学仁爱版下册(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 101.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-19 21:13:01 | ||
图片预览

文档简介
专题8《金属和金属材料》章末复习题九年级化学仁爱版下册
一、单选题
1.下列是常见的金属活动性顺序
以下判断不正确的是( )
A.X可与Y(NO3)2溶液反应 B.X可与盐酸反应
C.Y可与AgNO3溶液反应 D.Y可与稀H2SO4反应
2.下列物质中,常温下呈黄色的是
A.金 B.铁 C.碘 D.硫酸铜晶体
3.下列有关金属及合金的说法错误的是( )
A.常温下所有的金属都是固体
B.铁制品在潮湿的空气中易生锈
C.生铁和不锈钢都是金属材料
D.铝片表面易生成致密的氧化膜
4.金属、金属材料的性质在很大程度上决定了它们的用途。下列说法中不正确的是
A.不锈钢抗腐蚀性好,常用于制造医疗器械
B.铁具有良好的导热性,可以用于制造炊具
C.铝合金轻而坚韧,可作为汽车、飞机和火箭的制作材料
D.钛合金的熔点低、密度大,常用作导弹和通讯设备的制作材料
5.2018年5月我国自主建造的第一艘航母下海,为保证航母的使用寿命,下列防锈措施不可行的是
A.用抗锈蚀性能优异的合金制造航母零部件 B.刷防锈漆
C.船体表面镀一层黄金 D.给某些部位涂油
6.将一定质量的铁粉加入到Mg(NO3)2、AgNO3的混合溶液中,充分反应后过滤,得到滤液和滤渣。向滤液中加入稀盐酸,无明显现象。下列叙述正确的是( )
A.滤液中一定含有Mg2+和Fe3+
B.滤液中含有Mg2+和Ag+
C.滤渣中一定含有Ag
D.滤渣中可能含有Mg
7.下列关于金属材料的说法中,不正确的是( )
A.常温下,铝能与空气中的氧气反应,在其表面生成致密的氧化铝薄膜
B.铁在干燥的空气中容易生锈
C.硬铝(铝合金)的硬度大于纯铝
D.金属资源的回收利用既保护了环境,又节约了金属资源
8.已知化学反应:X+YSO4 = Y+XSO4,根据此反应信息判断正确的是( )
A.X一定是金属铁 B.Y一定是金属铜
C.X的金属活动性比Y强 D.Y的金属活动性比X强
9.现有X、Y、Z三种金属,如果把X、Y和Z分别放入稀硫酸中,X和Z溶解并产生气体,Y无变化;如果把X放入Z的盐溶液中,过一会儿,在X的表面有Z析出。根据以上实验事实,判断X、Y和Z的金属活动性顺序( )
A.X>Y>Z B.Y>Z>X C.X>Z>Y D.Z>X>Y
10.某同学为了测定铜镁合金样品中铜的质量分数,将100g稀盐酸分2次加入到盛有5g该样品的烧杯中,所得数据如下表,则下列说法中错误的是
次数 实验前 第1次 第2次
加入稀盐酸的质量/g 0 50 50
剩余固体的质量/g 5 3 2
A.第1次加入稀盐酸后剩余固体中还有镁
B.第2次所加入的稀盐酸未反应完
C.每50g稀盐酸和1g镁恰好完全反应
D.合金样品中铜的质量分数为40%
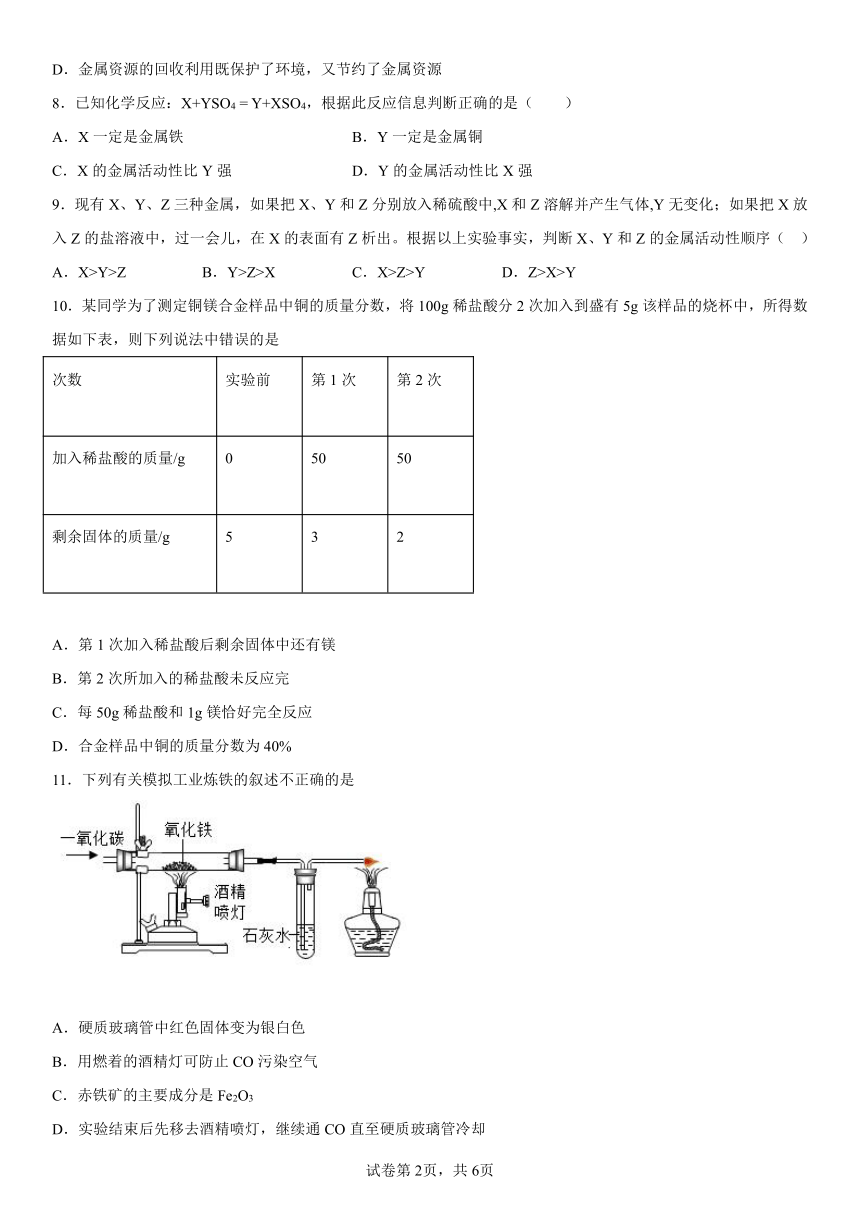
11.下列有关模拟工业炼铁的叙述不正确的是
A.硬质玻璃管中红色固体变为银白色
B.用燃着的酒精灯可防止CO污染空气
C.赤铁矿的主要成分是Fe2O3
D.实验结束后先移去酒精喷灯,继续通CO直至硬质玻璃管冷却
二、简答题
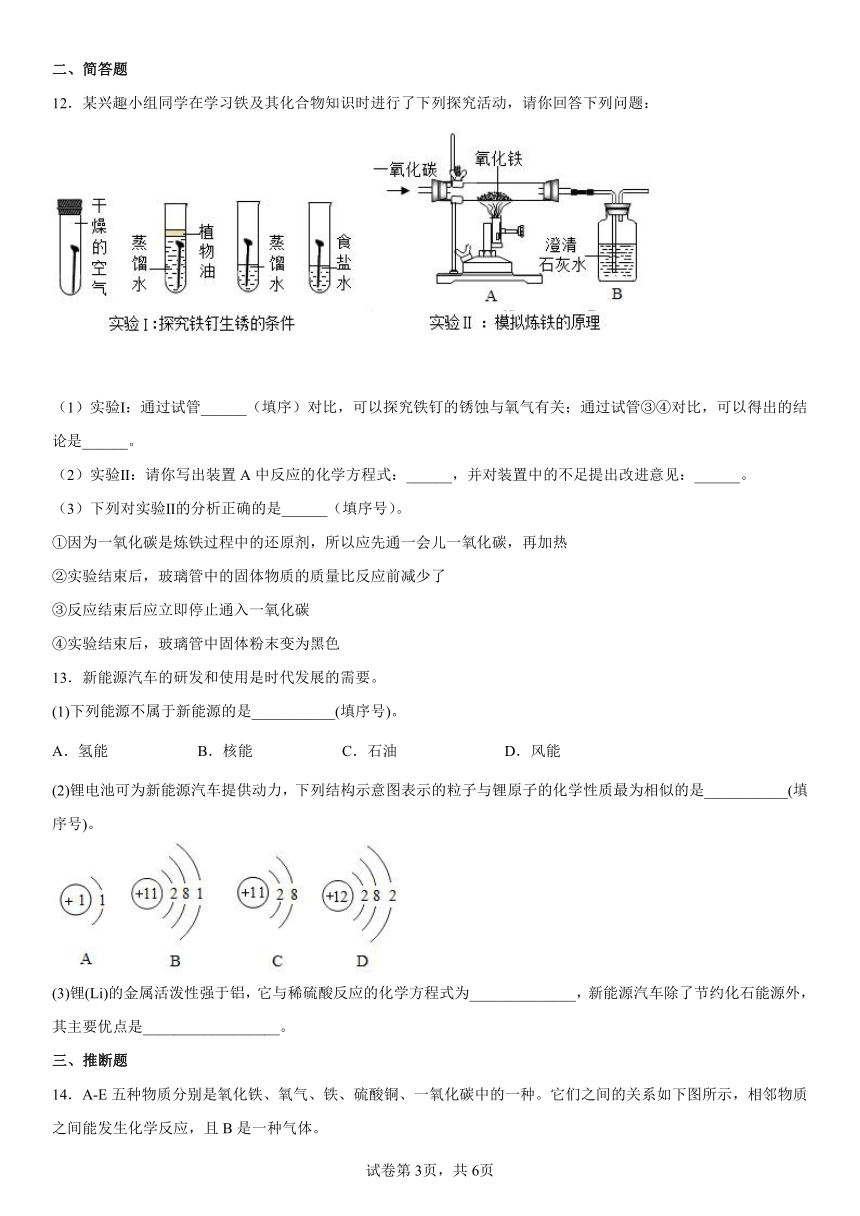
12.某兴趣小组同学在学习铁及其化合物知识时进行了下列探究活动,请你回答下列问题:
(1)实验Ⅰ:通过试管______(填序)对比,可以探究铁钉的锈蚀与氧气有关;通过试管③④对比,可以得出的结论是______。
(2)实验Ⅱ:请你写出装置A中反应的化学方程式:______,并对装置中的不足提出改进意见:______。
(3)下列对实验Ⅱ的分析正确的是______(填序号)。
①因为一氧化碳是炼铁过程中的还原剂,所以应先通一会儿一氧化碳,再加热
②实验结束后,玻璃管中的固体物质的质量比反应前减少了
③反应结束后应立即停止通入一氧化碳
④实验结束后,玻璃管中固体粉末变为黑色
13.新能源汽车的研发和使用是时代发展的需要。
(1)下列能源不属于新能源的是___________(填序号)。
A.氢能 B.核能 C.石油 D.风能
(2)锂电池可为新能源汽车提供动力,下列结构示意图表示的粒子与锂原子的化学性质最为相似的是___________(填序号)。
(3)锂(Li)的金属活泼性强于铝,它与稀硫酸反应的化学方程式为______________,新能源汽车除了节约化石能源外,其主要优点是__________________。
三、推断题
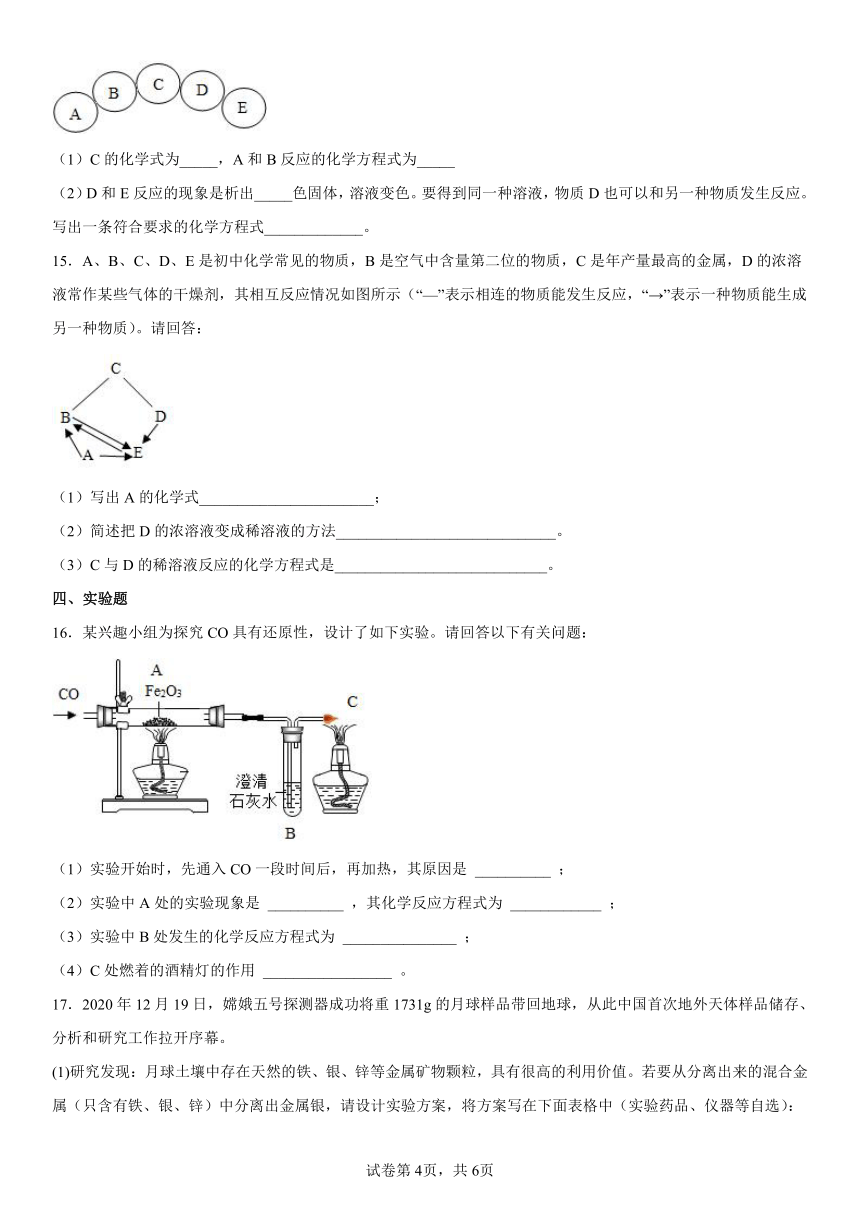
14.A-E五种物质分别是氧化铁、氧气、铁、硫酸铜、一氧化碳中的一种。它们之间的关系如下图所示,相邻物质之间能发生化学反应,且B是一种气体。
(1)C的化学式为_____,A和B反应的化学方程式为_____
(2)D和E反应的现象是析出_____色固体,溶液变色。要得到同一种溶液,物质D也可以和另一种物质发生反应。写出一条符合要求的化学方程式_____________。
15.A、B、C、D、E是初中化学常见的物质,B是空气中含量第二位的物质,C是年产量最高的金属,D的浓溶液常作某些气体的干燥剂,其相互反应情况如图所示(“—”表示相连的物质能发生反应,“→”表示一种物质能生成另一种物质)。请回答:
(1)写出A的化学式_______________________;
(2)简述把D的浓溶液变成稀溶液的方法_____________________________。
(3)C与D的稀溶液反应的化学方程式是____________________________。
四、实验题
16.某兴趣小组为探究CO具有还原性,设计了如下实验。请回答以下有关问题:
(1)实验开始时,先通入CO一段时间后,再加热,其原因是 __________ ;
(2)实验中A处的实验现象是 __________ ,其化学反应方程式为 ____________ ;
(3)实验中B处发生的化学反应方程式为 _______________ ;
(4)C处燃着的酒精灯的作用 _________________ 。
17.2020年12月19日,嫦娥五号探测器成功将重1731g的月球样品带回地球,从此中国首次地外天体样品储存、分析和研究工作拉开序幕。
(1)研究发现:月球土壤中存在天然的铁、银、锌等金属矿物颗粒,具有很高的利用价值。若要从分离出来的混合金属(只含有铁、银、锌)中分离出金属银,请设计实验方案,将方案写在下面表格中(实验药品、仪器等自选):
操作步骤 化学方程式
______ ①______ ②______
(2)若用稀盐酸比较锌、铁的金属活动性强弱,应将形状、大小相同的金属(均己打磨),与相同温度的等体积盐酸反应外,你认为还需要控制的变量有______。
18.现有银、铜、铁三种金属,某研究小组的同学为探究银、铜、铁的金属活动性顺序,设计了三个实验:I.将铁片浸入稀硫酸中;II.将银片浸入稀硫酸中;Ⅲ.将铁片浸入硫酸铜溶液中。
(1)实验I的现象是:有气泡产生,溶液由无色逐渐变为浅绿色。反应的化学方程式为____________________。
(2)上述三个实验还不能完全证明三种金属的活动性顺序,请你补充一个实验来达到实验目的(写出实验操作和现象)______________。根据以上探究,三种金属的活动性由强到弱的顺序是_______________。
(3)将银、铜、铁中的两种金属分别放入__________溶液中,即可验证这三种金属的活动性强弱。
(4)将铜片加热,铜片表面变黑。同学们设计如下实验证明此黑色物质是氧化铜。
①实验操作 ②实验现象
剪下一片变黑的铜片,放入试管中,加入足量的_______________溶液。 铜片表面的黑色物质全部消失,露出红色的铜,溶液变为_________色。
五、计算题
19.黄铜是铜和锌的合金。某化学兴趣小组的同学欲测定实验室中某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。称量10g粉末状黄铜样品放入烧杯中,将150g稀硫酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
第一次 第二次 第三次
加入稀硫酸的质量(g) 50 50 50
生成氢气的质量(g) 0.04 0.04 0.02
(1)反应共产生氢气的质量为_____g。
(2)此黄铜样品中铜的质量分数是少?(写出计算过程)
(3)当加入稀硫酸的质量大于_____g时,烧杯中所得溶液中的溶质有两种。
20.为了测定某黄铜样品中铜的质量分数(黄铜样品是由铜、锌组成),某化学小组进行了如下实验:
(1)配制上述质量分数为14.6%的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是 ;
(2)黄铜样品是铜的质量分数是 ;
(3)向过滤后所得滤液中加入87.4g水,则最终所得溶液中溶质的质量分数是多少?(写出计算过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.A
3.A
4.D
5.C
6.C
7.B
8.C
9.C
10.C
11.A
12. ②③ 食盐可以加速铁钉生锈 在B装置后加一个燃着的酒精灯进行尾气处理 ②④
13. C B 2Li+H2SO4=Li2SO4+H2↑ 无污染
14. O2 红 Fe+H2SO4=H2↑+FeSO4 /Fe+HgSO4=Hg+FeSO4
15. H2O2 把浓硫酸沿着烧杯壁缓缓注入水中,并用玻璃棒不断搅拌 Fe + H2SO4 =FeSO4 + H2↑
16. 排出装置中的空气,防止爆炸(意思正确可给分) 红色固体变黑色 Fe2O3+3CO 2Fe+3CO2 Ca(OH)2+CO2=CaCO3↓+H2O 防止污染空气(其他合理答案也给分)
17.(1) 将混合金属加入足量稀盐酸(或稀硫酸),充分反应后过滤、洗涤、烘干,则得到金属银。 (或;)
(2)等浓度的盐酸
18. Fe+H2SO4=FeSO4+H2↑ 将铜片浸入硝酸银溶液中,过一会取出,铜片表面有银白色物质析出 Fe>Cu>Ag CuCl2[或CuSO4、Cu(NO3)2等] 稀硫酸(或稀盐酸) 蓝
19.(1)0.1
(2)设锌质量为x,
x=3.25g,
此黄铜样品中铜的质量分数是:,
答:此黄铜样品中铜的质量分数是67.5%,
(3)125
20.(1)40g
(2)87%
(3)向过滤后所得滤液中加入87.4g水,则最终所得溶液中溶质的质量分数为×100%=13.6%;
答:最终所得溶液中溶质的质量分数是13.6%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列是常见的金属活动性顺序
以下判断不正确的是( )
A.X可与Y(NO3)2溶液反应 B.X可与盐酸反应
C.Y可与AgNO3溶液反应 D.Y可与稀H2SO4反应
2.下列物质中,常温下呈黄色的是
A.金 B.铁 C.碘 D.硫酸铜晶体
3.下列有关金属及合金的说法错误的是( )
A.常温下所有的金属都是固体
B.铁制品在潮湿的空气中易生锈
C.生铁和不锈钢都是金属材料
D.铝片表面易生成致密的氧化膜
4.金属、金属材料的性质在很大程度上决定了它们的用途。下列说法中不正确的是
A.不锈钢抗腐蚀性好,常用于制造医疗器械
B.铁具有良好的导热性,可以用于制造炊具
C.铝合金轻而坚韧,可作为汽车、飞机和火箭的制作材料
D.钛合金的熔点低、密度大,常用作导弹和通讯设备的制作材料
5.2018年5月我国自主建造的第一艘航母下海,为保证航母的使用寿命,下列防锈措施不可行的是
A.用抗锈蚀性能优异的合金制造航母零部件 B.刷防锈漆
C.船体表面镀一层黄金 D.给某些部位涂油
6.将一定质量的铁粉加入到Mg(NO3)2、AgNO3的混合溶液中,充分反应后过滤,得到滤液和滤渣。向滤液中加入稀盐酸,无明显现象。下列叙述正确的是( )
A.滤液中一定含有Mg2+和Fe3+
B.滤液中含有Mg2+和Ag+
C.滤渣中一定含有Ag
D.滤渣中可能含有Mg
7.下列关于金属材料的说法中,不正确的是( )
A.常温下,铝能与空气中的氧气反应,在其表面生成致密的氧化铝薄膜
B.铁在干燥的空气中容易生锈
C.硬铝(铝合金)的硬度大于纯铝
D.金属资源的回收利用既保护了环境,又节约了金属资源
8.已知化学反应:X+YSO4 = Y+XSO4,根据此反应信息判断正确的是( )
A.X一定是金属铁 B.Y一定是金属铜
C.X的金属活动性比Y强 D.Y的金属活动性比X强
9.现有X、Y、Z三种金属,如果把X、Y和Z分别放入稀硫酸中,X和Z溶解并产生气体,Y无变化;如果把X放入Z的盐溶液中,过一会儿,在X的表面有Z析出。根据以上实验事实,判断X、Y和Z的金属活动性顺序( )
A.X>Y>Z B.Y>Z>X C.X>Z>Y D.Z>X>Y
10.某同学为了测定铜镁合金样品中铜的质量分数,将100g稀盐酸分2次加入到盛有5g该样品的烧杯中,所得数据如下表,则下列说法中错误的是
次数 实验前 第1次 第2次
加入稀盐酸的质量/g 0 50 50
剩余固体的质量/g 5 3 2
A.第1次加入稀盐酸后剩余固体中还有镁
B.第2次所加入的稀盐酸未反应完
C.每50g稀盐酸和1g镁恰好完全反应
D.合金样品中铜的质量分数为40%
11.下列有关模拟工业炼铁的叙述不正确的是
A.硬质玻璃管中红色固体变为银白色
B.用燃着的酒精灯可防止CO污染空气
C.赤铁矿的主要成分是Fe2O3
D.实验结束后先移去酒精喷灯,继续通CO直至硬质玻璃管冷却
二、简答题
12.某兴趣小组同学在学习铁及其化合物知识时进行了下列探究活动,请你回答下列问题:
(1)实验Ⅰ:通过试管______(填序)对比,可以探究铁钉的锈蚀与氧气有关;通过试管③④对比,可以得出的结论是______。
(2)实验Ⅱ:请你写出装置A中反应的化学方程式:______,并对装置中的不足提出改进意见:______。
(3)下列对实验Ⅱ的分析正确的是______(填序号)。
①因为一氧化碳是炼铁过程中的还原剂,所以应先通一会儿一氧化碳,再加热
②实验结束后,玻璃管中的固体物质的质量比反应前减少了
③反应结束后应立即停止通入一氧化碳
④实验结束后,玻璃管中固体粉末变为黑色
13.新能源汽车的研发和使用是时代发展的需要。
(1)下列能源不属于新能源的是___________(填序号)。
A.氢能 B.核能 C.石油 D.风能
(2)锂电池可为新能源汽车提供动力,下列结构示意图表示的粒子与锂原子的化学性质最为相似的是___________(填序号)。
(3)锂(Li)的金属活泼性强于铝,它与稀硫酸反应的化学方程式为______________,新能源汽车除了节约化石能源外,其主要优点是__________________。
三、推断题
14.A-E五种物质分别是氧化铁、氧气、铁、硫酸铜、一氧化碳中的一种。它们之间的关系如下图所示,相邻物质之间能发生化学反应,且B是一种气体。
(1)C的化学式为_____,A和B反应的化学方程式为_____
(2)D和E反应的现象是析出_____色固体,溶液变色。要得到同一种溶液,物质D也可以和另一种物质发生反应。写出一条符合要求的化学方程式_____________。
15.A、B、C、D、E是初中化学常见的物质,B是空气中含量第二位的物质,C是年产量最高的金属,D的浓溶液常作某些气体的干燥剂,其相互反应情况如图所示(“—”表示相连的物质能发生反应,“→”表示一种物质能生成另一种物质)。请回答:
(1)写出A的化学式_______________________;
(2)简述把D的浓溶液变成稀溶液的方法_____________________________。
(3)C与D的稀溶液反应的化学方程式是____________________________。
四、实验题
16.某兴趣小组为探究CO具有还原性,设计了如下实验。请回答以下有关问题:
(1)实验开始时,先通入CO一段时间后,再加热,其原因是 __________ ;
(2)实验中A处的实验现象是 __________ ,其化学反应方程式为 ____________ ;
(3)实验中B处发生的化学反应方程式为 _______________ ;
(4)C处燃着的酒精灯的作用 _________________ 。
17.2020年12月19日,嫦娥五号探测器成功将重1731g的月球样品带回地球,从此中国首次地外天体样品储存、分析和研究工作拉开序幕。
(1)研究发现:月球土壤中存在天然的铁、银、锌等金属矿物颗粒,具有很高的利用价值。若要从分离出来的混合金属(只含有铁、银、锌)中分离出金属银,请设计实验方案,将方案写在下面表格中(实验药品、仪器等自选):
操作步骤 化学方程式
______ ①______ ②______
(2)若用稀盐酸比较锌、铁的金属活动性强弱,应将形状、大小相同的金属(均己打磨),与相同温度的等体积盐酸反应外,你认为还需要控制的变量有______。
18.现有银、铜、铁三种金属,某研究小组的同学为探究银、铜、铁的金属活动性顺序,设计了三个实验:I.将铁片浸入稀硫酸中;II.将银片浸入稀硫酸中;Ⅲ.将铁片浸入硫酸铜溶液中。
(1)实验I的现象是:有气泡产生,溶液由无色逐渐变为浅绿色。反应的化学方程式为____________________。
(2)上述三个实验还不能完全证明三种金属的活动性顺序,请你补充一个实验来达到实验目的(写出实验操作和现象)______________。根据以上探究,三种金属的活动性由强到弱的顺序是_______________。
(3)将银、铜、铁中的两种金属分别放入__________溶液中,即可验证这三种金属的活动性强弱。
(4)将铜片加热,铜片表面变黑。同学们设计如下实验证明此黑色物质是氧化铜。
①实验操作 ②实验现象
剪下一片变黑的铜片,放入试管中,加入足量的_______________溶液。 铜片表面的黑色物质全部消失,露出红色的铜,溶液变为_________色。
五、计算题
19.黄铜是铜和锌的合金。某化学兴趣小组的同学欲测定实验室中某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。称量10g粉末状黄铜样品放入烧杯中,将150g稀硫酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
第一次 第二次 第三次
加入稀硫酸的质量(g) 50 50 50
生成氢气的质量(g) 0.04 0.04 0.02
(1)反应共产生氢气的质量为_____g。
(2)此黄铜样品中铜的质量分数是少?(写出计算过程)
(3)当加入稀硫酸的质量大于_____g时,烧杯中所得溶液中的溶质有两种。
20.为了测定某黄铜样品中铜的质量分数(黄铜样品是由铜、锌组成),某化学小组进行了如下实验:
(1)配制上述质量分数为14.6%的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是 ;
(2)黄铜样品是铜的质量分数是 ;
(3)向过滤后所得滤液中加入87.4g水,则最终所得溶液中溶质的质量分数是多少?(写出计算过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.A
3.A
4.D
5.C
6.C
7.B
8.C
9.C
10.C
11.A
12. ②③ 食盐可以加速铁钉生锈 在B装置后加一个燃着的酒精灯进行尾气处理 ②④
13. C B 2Li+H2SO4=Li2SO4+H2↑ 无污染
14. O2 红 Fe+H2SO4=H2↑+FeSO4 /Fe+HgSO4=Hg+FeSO4
15. H2O2 把浓硫酸沿着烧杯壁缓缓注入水中,并用玻璃棒不断搅拌 Fe + H2SO4 =FeSO4 + H2↑
16. 排出装置中的空气,防止爆炸(意思正确可给分) 红色固体变黑色 Fe2O3+3CO 2Fe+3CO2 Ca(OH)2+CO2=CaCO3↓+H2O 防止污染空气(其他合理答案也给分)
17.(1) 将混合金属加入足量稀盐酸(或稀硫酸),充分反应后过滤、洗涤、烘干,则得到金属银。 (或;)
(2)等浓度的盐酸
18. Fe+H2SO4=FeSO4+H2↑ 将铜片浸入硝酸银溶液中,过一会取出,铜片表面有银白色物质析出 Fe>Cu>Ag CuCl2[或CuSO4、Cu(NO3)2等] 稀硫酸(或稀盐酸) 蓝
19.(1)0.1
(2)设锌质量为x,
x=3.25g,
此黄铜样品中铜的质量分数是:,
答:此黄铜样品中铜的质量分数是67.5%,
(3)125
20.(1)40g
(2)87%
(3)向过滤后所得滤液中加入87.4g水,则最终所得溶液中溶质的质量分数为×100%=13.6%;
答:最终所得溶液中溶质的质量分数是13.6%。
答案第1页,共2页
答案第1页,共2页
