第三节 海水“制碱”课件 -2022-2023学年九年级鲁教版化学下册(共23张PPT)
文档属性
| 名称 | 第三节 海水“制碱”课件 -2022-2023学年九年级鲁教版化学下册(共23张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-20 08:24:50 | ||
图片预览






文档简介
(共23张PPT)
第三节 海水“制碱”
第八单元 海水中的化学
PART
01
PART
02
认识纯碱等盐类物质的重要性质
知道工业制取纯碱的化学反应原理
学习目标
PART
03
了解纯碱在日常生活或工农业生产中的应用
侯氏制碱法是由中国化学工程师侯德榜先生所发明的一种高效,低成本的制碱方法,打破了当时欧美对制碱业的垄断,在人类化学工业史上写下了光辉的一页。侯德榜是中国化学工业的奠基人,纯碱工业的创始人。
氨碱法(侯氏制碱法)制纯碱——Na2CO3
原理(步骤):
盐水
饱和食盐水
精制
吸氨
碳酸化
碳酸氢钠
纯碱
过滤
热解
饱和氨盐水
一、氨碱法制纯碱
通入氨气
通入二氧化碳
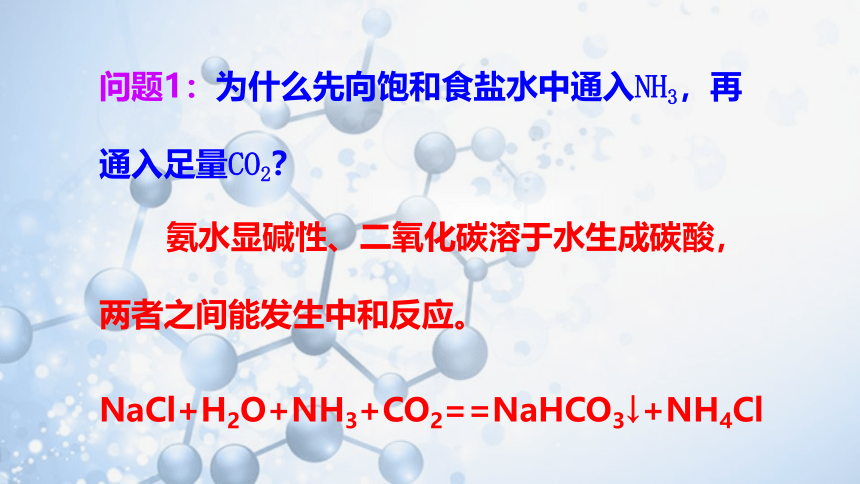
NaCl+H2O+NH3+CO2==NaHCO3↓+NH4Cl
氨水显碱性、二氧化碳溶于水生成碳酸,两者之间能发生中和反应。
问题1:为什么先向饱和食盐水中通入NH3,再通入足量CO2?
2NaHCO3 = Na2CO3+H2O+CO2↑
△
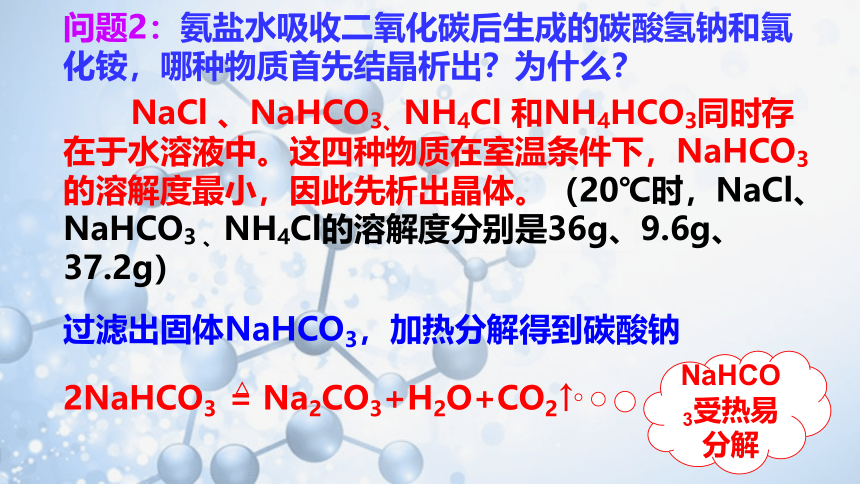
NaCl 、NaHCO3、NH4Cl 和NH4HCO3同时存在于水溶液中。这四种物质在室温条件下,NaHCO3的溶解度最小,因此先析出晶体。(20℃时,NaCl、NaHCO3 、NH4Cl的溶解度分别是36g、9.6g、37.2g)
问题2:氨盐水吸收二氧化碳后生成的碳酸氢钠和氯化铵,哪种物质首先结晶析出?为什么?
过滤出固体NaHCO3,加热分解得到碳酸钠
NaHCO3受热易分解
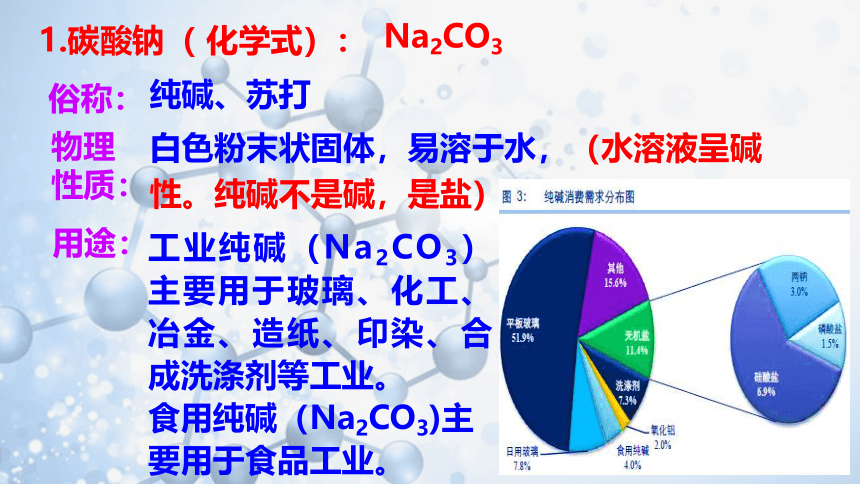
1.碳酸钠( 化学式):
俗称:
纯碱、苏打
白色粉末状固体,易溶于水,(水溶液呈碱性。纯碱不是碱,是盐)
Na2CO3
工业纯碱(Na2CO3)主要用于玻璃、化工、冶金、造纸、印染、合成洗涤剂等工业。
食用纯碱(Na2CO3)主要用于食品工业。
物理
性质:
用途:
2.碳酸氢钠 ( )
化学式:
物理
性质:
用途:
化学
性质:
NaHCO3
白色粉末状固体,易溶于水(其水溶液呈碱性)。
作发酵粉、治疗胃酸过多、制造饮料、灭火器中二氧化碳发生剂等。
2NaHCO3 = Na2CO3 + H2O + CO2↑
NaHCO3 + HCl = NaCl + H2O + CO2↑
小苏打的主要成分,又称酸式碳酸钠
实验:取少量碳酸钠固体放入试管中加少量蒸
馏水后振荡,观察溶解情况,再滴入酚酞试液。
现象: 。
可见,碳酸钠 (填“难”或“易”)溶于水,溶液呈 性。
固体溶解,试液变红
碱
1.与指示剂的作用
易
二、纯碱的性质
实验探究
2.与盐酸和稀硫酸的反应
2HCl+Na2CO3=2NaCl+H2O+CO2↑
H2SO4+Na2CO3=Na2SO4+H2O+CO2↑
问题3:如何鉴别碳酸根离子
取样品于试管中,滴加稀盐酸,可
观察到有气泡产生,将产生的气体通入澄清的石灰水中,若石灰水变浑浊,则样品中有碳酸根离子。
右图如果改滴入硫酸,现象是否相同?
3.与氢氧化钙的反应
Ca(OH)2+Na2CO3=CaCO3 ↓+2NaOH
(工业制取氢氧化钠)
4.与氯化钡的反应
Na2CO3+BaCl2=BaCO3↓+2NaCl
现象:生成白色沉淀
现象:生成白色沉淀
复分解反应
1.实质:酸、碱、盐之间在水溶液中解离出的离子相互结合,生成沉淀、气体或水的过程
2.字母表达式:
3.酸、碱、盐之间发生的反应为复分解反应,这一类的反应有一个非常重要的特点:
反应前后各元素的化合价保持不变.
AD + CB
AB + CD
4.复分解反应发生的条件:
反应类型 反应物条件 生成物条件
1
2 3 4 5 须二者
都可溶
有沉淀、气体或水生成
碱 + 盐
盐 + 盐
盐 + 酸
酸 + 碱
酸+金属氧化物
对二者
无要求
典型例题
知识点一:Na2CO3的性质
【典例1】(2022巴中)取少量实验室制取CO2后的废液,向其中加入紫色石蕊溶液变成红色。现另取一定质量的废液于烧杯中,向其中逐渐加入碳酸钠粉末,如图:横坐标表示加入的碳酸钠粉末的质量,根据图像判断,纵坐标可能表示( )
A. 溶液中溶剂的质量 B. 烧杯中固体的质量
C. 溶液的pH D. 溶液中溶质的质量
B
知识点二:复分解反应
【典例2】(2022临沂改编)下列化学反应中,属于复分解反应的是( )
A. Ca(OH)2 + CO2 = CaCO ↓ + 2H2O
B. 2KMnO4 △ K2MnO4 +MnO2 + O2↑
C. CaO + H2O = Ca(OH)2
D. 2HCl+Na2CO3=2NaCl+H2O+CO2↑
D
课堂达标
1. (2022宁夏)分类法在科学研究中具有广泛的应用。下列对物质分类正确的是( )
A. 纯碱、烧碱都属于碱 B. 黄铜、氧化铜都属于金属材料
C. 一氧化碳、酒精都属于有机物 D. 硝酸钾、磷酸二氢铵都属于复合肥料
2. (2022湖北黄石)下列分类不正确的是( )
A. 氢气------单质 B. NaHCO3------酸
C. 氢氧化钙------碱 D. C6H12O6------有机物
D
B
3. (2022益阳)用盐酸除去水垢中Mg(OH)2的化学方程式为
Mg(OH)2+2HCl=MgCl2+2H2O。该反应属于( )
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
4.(2022邵阳)推理是化学学习中常用的思维方式。下列推理正确的是( )
A. 原子是不显电性的粒子,不显电性的粒子一定是原子
B. 碳酸钠俗称纯碱,能使酚酞溶液变红,所以碳酸钠属于碱
C. 氧化物中一定含有氧元素,含氧元素的化合物一定是氧化物
D. 中和反应一定生成盐和水,生成盐和水的反应不一定是中和反应
D
C
5.(2022贺州)“灭火弹”是一种常见的灭火器材,主要分为沙石灭火弹和干粉灭火弹。目前市场上的灭火弹主要以干粉为主、超细干粉灭火剂是目前国内外已查明的灭火剂中,灭火浓度最低,灭火效能最高,灭火速度最快的一种,且灭火时不会造成火场中人员中毒或窒息死亡。在扑灭森林大火时,可以选用引燃式超细干粉灭火弹。
根据内容回答下列问题:
(1)常见灭火弹主要分为沙石灭火弹和______ 。
(2)超细干粉灭火剂的特点有______。
A. 灭火浓度最低 B. 灭火效能最高
C. 灭火速度最快 D. 会造成人员伤亡
(3)某种干粉灭火剂的主要成分是NaHCO3,遇热时NaHCO3会分解生成Na2CO3并放出CO2气体,写出该反应的化学方程式:______ 。
(4)“森林防火,人人有责”。请你对预防森林火灾提一条建设性意见 。
干粉灭火弹
ABC
2NaHCO3 Δ Na2CO3 + H2O + CO2↑
严禁携带火种进山等
6. (2022烟台)我国化学家侯德榜先生创立的联合制碱法,将碱厂与氨厂联合,既提高效益又减少污染,促进了世界制碱工业的发展。联合制碱法的模拟流程如图一所示。
三种盐的溶解度随温度变化的曲线如图二所示。吸氨碳化塔中温度控制在30℃~35℃,
其中主要发生的反应是NH3+CO2+H2O+NaCl═NaHCO3+NH4Cl。
(1)氨厂的原料N2来自于空气。分离液态空气是利用空气中各成分的 不同。
(2)通常状况下,NH3的溶解度远大于CO2的溶解度。为了提高产率,吸氨碳化塔中
应该先通入的是 (填“NH3”或“CO2”)。
(3)加热NaHCO3制得纯碱的化学方程式是
。
(4)结合图二分析,吸氨碳化塔中析出NaHCO3固体的主要原因是 (填序号)。
①溶剂质量减少;
②NaHCO3难溶于水;
③30℃~35℃时,NaCl、NaHCO3、NH4Cl的溶解度相比较,NaHCO3的溶解度最小,易达到饱和而析出
(5)氨厂生产的NH3溶于水后得到的氨水可以做 肥(填化肥类别)。碱厂与氨厂联合后,用NH4Cl代替氨水做化肥,其优势是 (答一点即可)。
沸点
NH3
2NaHCO3 Δ Na2CO3 + H2O + CO2↑
③
氮
肥效高
7. (2022贵州铜仁)1921年,正在美国留学的侯德榜先生为了发展我国的民族工业毅然回国,在当时艰苦的条件下,成功摸索和改进了西方的制碱方法,发明了联合制碱法(又称侯氏制碱法),其主要制备流程如下
(1)上述流程中氨气可用氢气和氮气合成,工业上获得氮气的方法______ 。
(2)操作①的名称______。
(3)写出反应Ⅰ的化学方程式______ 。
(4)写出工业上用纯碱制烧碱的化学方程式______ 。
过滤
分离液态空气法
NaCl+H2O+NH3+CO2==NaHCO3↓+NH4Cl
Ca(OH)2+Na2CO3=CaCO3 ↓+2NaOH
8. (2022聊城)实际生产的纯碱产品中往往会含有少量的氯化钠,化学实践小组的同学通过实验来测定某品牌工业品纯碱的指标等级。
实践小组成员进行的实
验和有关数据如下图所示。
(1)实验过程中滴加几滴酚酞试液的目的是______。
(2)通过计算判断该品牌工业品纯碱属于哪一指标等级。(写出计算过程,结果数值四舍五入精确到0.1%)
国家标准规定工业品纯碱指标等级 指标项目 指标 I类 Ⅱ类 Ⅲ类 优等品 一等品 优等品 合格品
总碱量(Na2CO3计)%≥ 99.2 98.8 99.1 98.0
【答案】(1)检验碳酸钠是否完全反应
(2)解:生成二氧化碳的质量为:
21.4g+100g-112.6g=8.8g
设该品牌工业品纯碱中碳酸钠的质量为x
2HCl+Na2CO3=2NaCl+H2O+CO2↑
106 44
x 8.8g
106/44 = x/8.8g
x=21.2g
纯碱中碳酸钠的质量分数为:21.2g/21.4g×100%=99.1%
依据题意可知,该品牌工业品纯碱总碱量为99.1%,属于Ⅲ类
优等品。
答:该品牌工业品纯碱属于Ⅲ类优等品。
课堂小结
1.工业上以食盐为原料,通过氨碱法来制取纯碱
2.碳酸钠能够与大部分酸及某些碱、盐发生反应
3.纯碱和小苏打在生产和生活中都具有重要的用途
4.酸、碱、盐之间在水溶液中发生的复分解反应的实质是它们的离子相互结合成沉淀、气体或水的过程。
第三节 海水“制碱”
第八单元 海水中的化学
PART
01
PART
02
认识纯碱等盐类物质的重要性质
知道工业制取纯碱的化学反应原理
学习目标
PART
03
了解纯碱在日常生活或工农业生产中的应用
侯氏制碱法是由中国化学工程师侯德榜先生所发明的一种高效,低成本的制碱方法,打破了当时欧美对制碱业的垄断,在人类化学工业史上写下了光辉的一页。侯德榜是中国化学工业的奠基人,纯碱工业的创始人。
氨碱法(侯氏制碱法)制纯碱——Na2CO3
原理(步骤):
盐水
饱和食盐水
精制
吸氨
碳酸化
碳酸氢钠
纯碱
过滤
热解
饱和氨盐水
一、氨碱法制纯碱
通入氨气
通入二氧化碳
NaCl+H2O+NH3+CO2==NaHCO3↓+NH4Cl
氨水显碱性、二氧化碳溶于水生成碳酸,两者之间能发生中和反应。
问题1:为什么先向饱和食盐水中通入NH3,再通入足量CO2?
2NaHCO3 = Na2CO3+H2O+CO2↑
△
NaCl 、NaHCO3、NH4Cl 和NH4HCO3同时存在于水溶液中。这四种物质在室温条件下,NaHCO3的溶解度最小,因此先析出晶体。(20℃时,NaCl、NaHCO3 、NH4Cl的溶解度分别是36g、9.6g、37.2g)
问题2:氨盐水吸收二氧化碳后生成的碳酸氢钠和氯化铵,哪种物质首先结晶析出?为什么?
过滤出固体NaHCO3,加热分解得到碳酸钠
NaHCO3受热易分解
1.碳酸钠( 化学式):
俗称:
纯碱、苏打
白色粉末状固体,易溶于水,(水溶液呈碱性。纯碱不是碱,是盐)
Na2CO3
工业纯碱(Na2CO3)主要用于玻璃、化工、冶金、造纸、印染、合成洗涤剂等工业。
食用纯碱(Na2CO3)主要用于食品工业。
物理
性质:
用途:
2.碳酸氢钠 ( )
化学式:
物理
性质:
用途:
化学
性质:
NaHCO3
白色粉末状固体,易溶于水(其水溶液呈碱性)。
作发酵粉、治疗胃酸过多、制造饮料、灭火器中二氧化碳发生剂等。
2NaHCO3 = Na2CO3 + H2O + CO2↑
NaHCO3 + HCl = NaCl + H2O + CO2↑
小苏打的主要成分,又称酸式碳酸钠
实验:取少量碳酸钠固体放入试管中加少量蒸
馏水后振荡,观察溶解情况,再滴入酚酞试液。
现象: 。
可见,碳酸钠 (填“难”或“易”)溶于水,溶液呈 性。
固体溶解,试液变红
碱
1.与指示剂的作用
易
二、纯碱的性质
实验探究
2.与盐酸和稀硫酸的反应
2HCl+Na2CO3=2NaCl+H2O+CO2↑
H2SO4+Na2CO3=Na2SO4+H2O+CO2↑
问题3:如何鉴别碳酸根离子
取样品于试管中,滴加稀盐酸,可
观察到有气泡产生,将产生的气体通入澄清的石灰水中,若石灰水变浑浊,则样品中有碳酸根离子。
右图如果改滴入硫酸,现象是否相同?
3.与氢氧化钙的反应
Ca(OH)2+Na2CO3=CaCO3 ↓+2NaOH
(工业制取氢氧化钠)
4.与氯化钡的反应
Na2CO3+BaCl2=BaCO3↓+2NaCl
现象:生成白色沉淀
现象:生成白色沉淀
复分解反应
1.实质:酸、碱、盐之间在水溶液中解离出的离子相互结合,生成沉淀、气体或水的过程
2.字母表达式:
3.酸、碱、盐之间发生的反应为复分解反应,这一类的反应有一个非常重要的特点:
反应前后各元素的化合价保持不变.
AD + CB
AB + CD
4.复分解反应发生的条件:
反应类型 反应物条件 生成物条件
1
2 3 4 5 须二者
都可溶
有沉淀、气体或水生成
碱 + 盐
盐 + 盐
盐 + 酸
酸 + 碱
酸+金属氧化物
对二者
无要求
典型例题
知识点一:Na2CO3的性质
【典例1】(2022巴中)取少量实验室制取CO2后的废液,向其中加入紫色石蕊溶液变成红色。现另取一定质量的废液于烧杯中,向其中逐渐加入碳酸钠粉末,如图:横坐标表示加入的碳酸钠粉末的质量,根据图像判断,纵坐标可能表示( )
A. 溶液中溶剂的质量 B. 烧杯中固体的质量
C. 溶液的pH D. 溶液中溶质的质量
B
知识点二:复分解反应
【典例2】(2022临沂改编)下列化学反应中,属于复分解反应的是( )
A. Ca(OH)2 + CO2 = CaCO ↓ + 2H2O
B. 2KMnO4 △ K2MnO4 +MnO2 + O2↑
C. CaO + H2O = Ca(OH)2
D. 2HCl+Na2CO3=2NaCl+H2O+CO2↑
D
课堂达标
1. (2022宁夏)分类法在科学研究中具有广泛的应用。下列对物质分类正确的是( )
A. 纯碱、烧碱都属于碱 B. 黄铜、氧化铜都属于金属材料
C. 一氧化碳、酒精都属于有机物 D. 硝酸钾、磷酸二氢铵都属于复合肥料
2. (2022湖北黄石)下列分类不正确的是( )
A. 氢气------单质 B. NaHCO3------酸
C. 氢氧化钙------碱 D. C6H12O6------有机物
D
B
3. (2022益阳)用盐酸除去水垢中Mg(OH)2的化学方程式为
Mg(OH)2+2HCl=MgCl2+2H2O。该反应属于( )
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
4.(2022邵阳)推理是化学学习中常用的思维方式。下列推理正确的是( )
A. 原子是不显电性的粒子,不显电性的粒子一定是原子
B. 碳酸钠俗称纯碱,能使酚酞溶液变红,所以碳酸钠属于碱
C. 氧化物中一定含有氧元素,含氧元素的化合物一定是氧化物
D. 中和反应一定生成盐和水,生成盐和水的反应不一定是中和反应
D
C
5.(2022贺州)“灭火弹”是一种常见的灭火器材,主要分为沙石灭火弹和干粉灭火弹。目前市场上的灭火弹主要以干粉为主、超细干粉灭火剂是目前国内外已查明的灭火剂中,灭火浓度最低,灭火效能最高,灭火速度最快的一种,且灭火时不会造成火场中人员中毒或窒息死亡。在扑灭森林大火时,可以选用引燃式超细干粉灭火弹。
根据内容回答下列问题:
(1)常见灭火弹主要分为沙石灭火弹和______ 。
(2)超细干粉灭火剂的特点有______。
A. 灭火浓度最低 B. 灭火效能最高
C. 灭火速度最快 D. 会造成人员伤亡
(3)某种干粉灭火剂的主要成分是NaHCO3,遇热时NaHCO3会分解生成Na2CO3并放出CO2气体,写出该反应的化学方程式:______ 。
(4)“森林防火,人人有责”。请你对预防森林火灾提一条建设性意见 。
干粉灭火弹
ABC
2NaHCO3 Δ Na2CO3 + H2O + CO2↑
严禁携带火种进山等
6. (2022烟台)我国化学家侯德榜先生创立的联合制碱法,将碱厂与氨厂联合,既提高效益又减少污染,促进了世界制碱工业的发展。联合制碱法的模拟流程如图一所示。
三种盐的溶解度随温度变化的曲线如图二所示。吸氨碳化塔中温度控制在30℃~35℃,
其中主要发生的反应是NH3+CO2+H2O+NaCl═NaHCO3+NH4Cl。
(1)氨厂的原料N2来自于空气。分离液态空气是利用空气中各成分的 不同。
(2)通常状况下,NH3的溶解度远大于CO2的溶解度。为了提高产率,吸氨碳化塔中
应该先通入的是 (填“NH3”或“CO2”)。
(3)加热NaHCO3制得纯碱的化学方程式是
。
(4)结合图二分析,吸氨碳化塔中析出NaHCO3固体的主要原因是 (填序号)。
①溶剂质量减少;
②NaHCO3难溶于水;
③30℃~35℃时,NaCl、NaHCO3、NH4Cl的溶解度相比较,NaHCO3的溶解度最小,易达到饱和而析出
(5)氨厂生产的NH3溶于水后得到的氨水可以做 肥(填化肥类别)。碱厂与氨厂联合后,用NH4Cl代替氨水做化肥,其优势是 (答一点即可)。
沸点
NH3
2NaHCO3 Δ Na2CO3 + H2O + CO2↑
③
氮
肥效高
7. (2022贵州铜仁)1921年,正在美国留学的侯德榜先生为了发展我国的民族工业毅然回国,在当时艰苦的条件下,成功摸索和改进了西方的制碱方法,发明了联合制碱法(又称侯氏制碱法),其主要制备流程如下
(1)上述流程中氨气可用氢气和氮气合成,工业上获得氮气的方法______ 。
(2)操作①的名称______。
(3)写出反应Ⅰ的化学方程式______ 。
(4)写出工业上用纯碱制烧碱的化学方程式______ 。
过滤
分离液态空气法
NaCl+H2O+NH3+CO2==NaHCO3↓+NH4Cl
Ca(OH)2+Na2CO3=CaCO3 ↓+2NaOH
8. (2022聊城)实际生产的纯碱产品中往往会含有少量的氯化钠,化学实践小组的同学通过实验来测定某品牌工业品纯碱的指标等级。
实践小组成员进行的实
验和有关数据如下图所示。
(1)实验过程中滴加几滴酚酞试液的目的是______。
(2)通过计算判断该品牌工业品纯碱属于哪一指标等级。(写出计算过程,结果数值四舍五入精确到0.1%)
国家标准规定工业品纯碱指标等级 指标项目 指标 I类 Ⅱ类 Ⅲ类 优等品 一等品 优等品 合格品
总碱量(Na2CO3计)%≥ 99.2 98.8 99.1 98.0
【答案】(1)检验碳酸钠是否完全反应
(2)解:生成二氧化碳的质量为:
21.4g+100g-112.6g=8.8g
设该品牌工业品纯碱中碳酸钠的质量为x
2HCl+Na2CO3=2NaCl+H2O+CO2↑
106 44
x 8.8g
106/44 = x/8.8g
x=21.2g
纯碱中碳酸钠的质量分数为:21.2g/21.4g×100%=99.1%
依据题意可知,该品牌工业品纯碱总碱量为99.1%,属于Ⅲ类
优等品。
答:该品牌工业品纯碱属于Ⅲ类优等品。
课堂小结
1.工业上以食盐为原料,通过氨碱法来制取纯碱
2.碳酸钠能够与大部分酸及某些碱、盐发生反应
3.纯碱和小苏打在生产和生活中都具有重要的用途
4.酸、碱、盐之间在水溶液中发生的复分解反应的实质是它们的离子相互结合成沉淀、气体或水的过程。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
