到实验室去:探究金属的性质同步练习鲁教版化学九年级下册(有答案)
文档属性
| 名称 | 到实验室去:探究金属的性质同步练习鲁教版化学九年级下册(有答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 317.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-20 16:34:10 | ||
图片预览




文档简介
到实验室去:探究金属的性质
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.某同学为探究镁、锌、铜、银的活动性顺序,设计如图试验流程:依据流程设计,下面对物质①②的选择合理的是( )
A.①稀硫酸 ②硫酸铜 B.①稀盐酸 ②硫酸锌
C.①稀盐酸 ②硫酸亚铁 D.①稀硫酸 ②氯化镁
2.一定质量的锌、铁分别和等量的盐酸反应,产生氢气质量与时间的关系如图所示,下列说法不正确的是
A.t1时,产生氢气的质量锌比铁大
B.t1时,产生氢气的速率锌比铁大
C.t2时,参加反应锌的质量与铁相同
D.t2时,锌、铁消耗的盐酸质量相同
3.探究金属活动性顺序时,将锌粒放入硫酸铜溶液中,锌粒表面有紫红色物质析出,还有无色无味气体产生的“异常”现象。推测该气体可能是
A.氢气 B.二氧化硫 C.二氧化碳 D.一氧化碳
4.下列现象和事实,可用金属活动性作合理解释的是
①金属镁在空气中比铝更容易燃烧,说明镁比铝的活动性强
②金属铝比金属锌更耐腐蚀,说明锌比铝活动性强
③用硫酸铜、石灰水配置农药波尔多液时,不能用铁制容器
④尽管金属的种类很多,但在自然界中,仅有少数金属(银、铂、金)以单质形式存在.
A.①② B.①③④ C.③④ D.①②③④
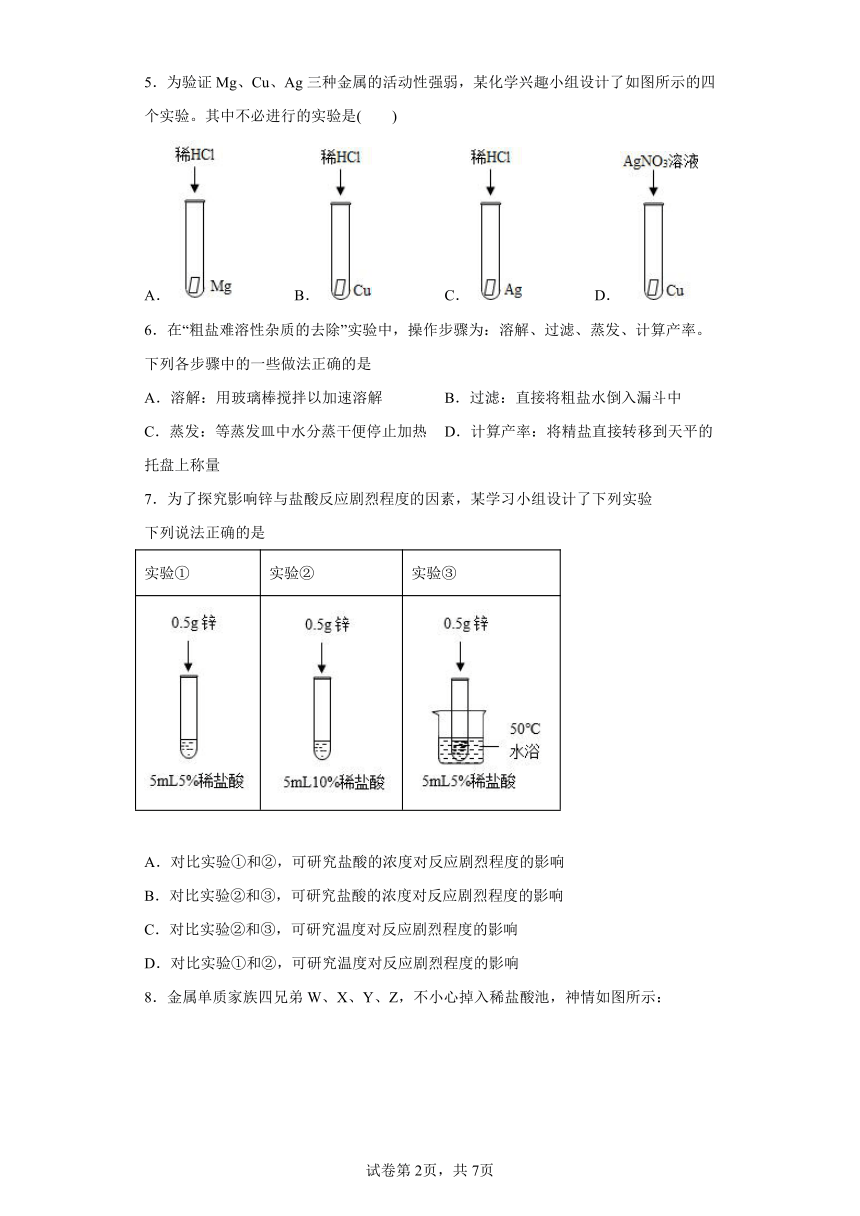
5.为验证Mg、Cu、Ag三种金属的活动性强弱,某化学兴趣小组设计了如图所示的四个实验。其中不必进行的实验是( )
A. B. C. D.
6.在“粗盐难溶性杂质的去除”实验中,操作步骤为:溶解、过滤、蒸发、计算产率。下列各步骤中的一些做法正确的是
A.溶解:用玻璃棒搅拌以加速溶解 B.过滤:直接将粗盐水倒入漏斗中
C.蒸发:等蒸发皿中水分蒸干便停止加热 D.计算产率:将精盐直接转移到天平的托盘上称量
7.为了探究影响锌与盐酸反应剧烈程度的因素,某学习小组设计了下列实验
下列说法正确的是
实验① 实验② 实验③
A.对比实验①和②,可研究盐酸的浓度对反应剧烈程度的影响
B.对比实验②和③,可研究盐酸的浓度对反应剧烈程度的影响
C.对比实验②和③,可研究温度对反应剧烈程度的影响
D.对比实验①和②,可研究温度对反应剧烈程度的影响
8.金属单质家族四兄弟W、X、Y、Z,不小心掉入稀盐酸池,神情如图所示:
则W、X、Y、Z的金属活动性顺序为
A.X>W>Z>Y B.Z>X>W>Y
C.W>X>Y>Z D.Y>Z>X>W
9.向AgNO3、Cu(NO3)2、Zn(NO3)2混合液中,加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,有气体生成,则滤出的固体中一定有
A.Ag、Cu、Zn B.Cu、Zn、Fe
C.Ag、Zn、Fe D.Ag.Cu、Fe
10.同学们为探究不同金属的活动性强弱,设计了如下的实验方案,下列方案中实验设计、现象、结论均正确的一组是( )
选项 实验设计 现 象 结论(金属的活动性)
A 将铝丝放入硫酸铜溶液中 无现象 Cu > Al
B 将铝丝放入硫酸镁溶液中 铝丝表面有固体析出 Al > Mg
C 分别将锌粉与铁丝放入相同 浓度的稀盐酸中 锌粉产生气泡的速率比 铁丝快 Zn > Fe
D 分别将铁丝与铜丝放入相同 浓度的稀盐酸中 铁丝表面产生气泡, 铜丝无现象 Fe > Cu
A.A B.B C.C D.D
二、填空题
11.迎香港回归,在《南京条约》议约地——南京下关区静海寺敲响了“警世钟”,铸造该钟采用的主要金属材料是__________,此金属的优点是____________________.
12.金属在生产和生活中有广泛的应用。
(1)下列金属制品中,利用金属导电性的是_________(填字母序号)。
(2)铁制品在沙漠地区不易锈蚀的原因是___________。
(3)工业上用一氧化碳和赤铁矿炼铁反应的化学方程式为________________________。
13.(1)油罐下面常有一条拖地铁链,在高层建筑的顶端都装有铁制的避雷针,这是应用了铁的________性质;铁也可以铸成铁锅,是利用了铁的________性质。
(2)铁块可变成很细的铁丝,这说明铁有________性;铁块也可以变成很薄的铁片,这说明铁有________性。
14.提纯含少量泥沙的粗盐样品,实验过程和氯化钠的溶解度数据如下:
温度 (℃) 溶解度 (g/100g水)
20 36.0
40 36.6
60 37.3
①20℃时氯化钠的溶解度是________g/100g水。
②该实验是利用泥沙难溶于水而氯化钠_______的性质进行提纯,操作Ⅲ的名称是______。
③关于蒸发叙述正确的是_______(选填编号)。
a、蒸发是通过加热的方法将水汽化除去
b、所需仪器为酒精灯、蒸发皿、温度计
c、搅拌可以防止蒸发过程中食盐飞溅
d、加热过程中用试管夹夹住蒸发皿移动,使其均匀受热
④溶解时,加入水的合适的量约为______(选填“15”、“30”或“60”)mL,理由是__________________。
15.(1)写出下列粒子符号。
①2个镁原子______;②2个钠离子______。
(2)写出相应的金属元素符号。
①熔点最低的金属元素是______;
②能在空气中形成致密氧化膜的金属元素是______;
③导电导热最好的金属元素是______。
三、综合应用题
16.某兴趣小组为探究“氧化铁和铜粉”混合物中铜的质量分数,称取一定质量的混合物,按照下图实验装置进行实验:
(1)实验时要“先通一氧化碳气体,后加热”的目的是____________。
(2)装置A中发生反应的方程式为____________。
(3)实验装置B中的现象是__________________,发生反应的化学方程式为_________________。
(4)该装置的设计有一明显不当之处,你的改进方案是____________________。
[定量分析]
该兴趣小组按照科学的方案完成实验后,对充分反应后的管内固体X进行如下后续实验探究:
回答下列问题:
(1)写出固体X与稀盐酸反应的方程式:___________________________________。
(2)如何证明固体C已经洗涤干净?_______________________________________。
(3)有色溶液B中含有的溶质:______________(填化学式)。
(4)根据以上实验流程,计算原混合物“氧化铁和铜粉”中铜的质量分数为_______。
17.金属及金属材料在生产、生活中应用广泛。
(1)下列生活用品中,主要利用金属导热性的是________(填序号)。
(2)银、铁、铜是日常生活中经常接触到的三种金属。对Ag、Fe、Cu三种金属活动性顺序的探究,下列所选试剂组不可行的是________。
①Fe、Ag、CuSO4溶液
②Cu、Ag、FeSO4溶液
③Cu、FeSO4溶液、AgNO3溶液
(3)日常生活中,铁制品生锈是铁与__________和__________发生反应;用于铁栏杆外层防止其生锈的涂料中的“银粉”大多是金属________的粉末。
(4)明明在学习金属的化学性质时,做了如下探究实验:
向硝酸银、硝酸铜、硝酸亚铁的混合溶液中加入一定质量的锌粉,反应停止后过滤,洗涤,得滤渣A和滤液B。向滤渣A中加入稀盐酸,有气泡冒出。则滤渣A中一定有________;滤液B中一定没有的金属离子是________。
(5)钢铁是使用最多的金属。工业上常用赤铁矿石炼铁,某炼铁厂每天消耗含氧化铁80%的赤铁矿500 t,该厂每天最多能炼出含杂质3%的生铁多少吨________。?(结果精确到0.1 t)
18.不少同学都被蚊虫叮咬过,感觉又痛又痒。从化学课上得知:蚊虫叮咬时能在皮肤内分泌出蚁酸刺激皮肤。查阅资料:蚁酸是一种有机酸,化学名称叫做甲酸,化学式为HCOOH,通常是一种无色易挥发的液体,它在浓硫酸存在时加热发生如下反应:HCOOHCO↑+H2O。某化学兴趣小组同学决定使用下图仪器或装置利用甲酸制取CO,并进行CO还原Fe2O3(Fe2O3样品中杂质不参加反应)的探究实验。[来自:中国学考]
请回答下列问题:
(1)用甲酸滴入浓硫酸的方法制取CO,应选用的发生装置是 ______ (填代号,下同);要除去CO中含有的少量甲酸蒸汽,最好选用上图中的 ________ 进行洗气;检验CO还原Fe2O3的气体产物应选用 _______ 装置,需检验的气体应从 _____ 管口进入。
(2)写出CO还原Fe2O3的化学方程式 _________ 。
(3)从开始加热到实验结束,Fe2O3粉末的颜色是如何变化的? ________ 。
(4)CO有毒,从环保角度看,如何处理该实验的尾气? ________ 。
(5)【拓展延伸】①当你被蚊虫叮咬后,在叮咬处涂抹一些物质可减轻痛痒。下列物质中,你不会选择的物质是 ________ 。
A氨水 B食醋 C肥皂水 D苏打水
②向某溶液中加入蚁酸有气泡产生,该气体能使澄清石灰水变浑浊,则该溶液中溶质的化学式可能是 ________ (只写一种)。
(6)利用以上装置可以测定Fe2O3样品中Fe2O3的质量分数。测定方法是:取10.0g Fe2O3样品做实验,先称量样品和玻璃管的总质量为60.0g,待样品完全反应并冷却后,在称量玻璃管和剩余固体的总质量为57.6g。求该样品中Fe2O3的质量分数是多少? ______
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.C
3.A
4.B
5.C
6.A
7.A
8.B
9.D
10.D
11. 铜 铜在金属活动顺序表中排在H之后,化学性质稳定,可长期保存
12.(1)C (2)没有水分
(3)3CO+Fe2O32Fe+3CO2
13. 导电 导热 延 展
14. 36.0 易溶于水 过滤 ac 30 20℃时,氯化钠的溶解度为36g/100g水,实验中称取的粗盐质量为10g,加入约30mL水既可使粗盐中的氯 化钠充分溶解,又不会因加水过多而影响后续蒸发 操作的效率
15.
16. 排尽玻璃管内的空气,防止加热时发生爆炸 石灰水变浑浊 将尾气点燃(用气球收集) 取最后的洗涤液滴加紫色石蕊试液,看是否变红,若不变红,说明已洗干净 FeCl2、HCl 20%
17. A ② 氧气 水蒸气 铝 银、铜和铁 Cu2+和Ag+ 288.7 t。
18. ② ③ ④ F 3CO+Fe2O32Fe+3CO2 由红棕色变为黑色 将尾气点燃或用气球收集 B Na2CO3(或其它可溶性碳酸盐、酸式碳酸盐等) 80%
解:设氧化铁质量为x。
Fe2O3的质量分数是
答:质量分数80%。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.某同学为探究镁、锌、铜、银的活动性顺序,设计如图试验流程:依据流程设计,下面对物质①②的选择合理的是( )
A.①稀硫酸 ②硫酸铜 B.①稀盐酸 ②硫酸锌
C.①稀盐酸 ②硫酸亚铁 D.①稀硫酸 ②氯化镁
2.一定质量的锌、铁分别和等量的盐酸反应,产生氢气质量与时间的关系如图所示,下列说法不正确的是
A.t1时,产生氢气的质量锌比铁大
B.t1时,产生氢气的速率锌比铁大
C.t2时,参加反应锌的质量与铁相同
D.t2时,锌、铁消耗的盐酸质量相同
3.探究金属活动性顺序时,将锌粒放入硫酸铜溶液中,锌粒表面有紫红色物质析出,还有无色无味气体产生的“异常”现象。推测该气体可能是
A.氢气 B.二氧化硫 C.二氧化碳 D.一氧化碳
4.下列现象和事实,可用金属活动性作合理解释的是
①金属镁在空气中比铝更容易燃烧,说明镁比铝的活动性强
②金属铝比金属锌更耐腐蚀,说明锌比铝活动性强
③用硫酸铜、石灰水配置农药波尔多液时,不能用铁制容器
④尽管金属的种类很多,但在自然界中,仅有少数金属(银、铂、金)以单质形式存在.
A.①② B.①③④ C.③④ D.①②③④
5.为验证Mg、Cu、Ag三种金属的活动性强弱,某化学兴趣小组设计了如图所示的四个实验。其中不必进行的实验是( )
A. B. C. D.
6.在“粗盐难溶性杂质的去除”实验中,操作步骤为:溶解、过滤、蒸发、计算产率。下列各步骤中的一些做法正确的是
A.溶解:用玻璃棒搅拌以加速溶解 B.过滤:直接将粗盐水倒入漏斗中
C.蒸发:等蒸发皿中水分蒸干便停止加热 D.计算产率:将精盐直接转移到天平的托盘上称量
7.为了探究影响锌与盐酸反应剧烈程度的因素,某学习小组设计了下列实验
下列说法正确的是
实验① 实验② 实验③
A.对比实验①和②,可研究盐酸的浓度对反应剧烈程度的影响
B.对比实验②和③,可研究盐酸的浓度对反应剧烈程度的影响
C.对比实验②和③,可研究温度对反应剧烈程度的影响
D.对比实验①和②,可研究温度对反应剧烈程度的影响
8.金属单质家族四兄弟W、X、Y、Z,不小心掉入稀盐酸池,神情如图所示:
则W、X、Y、Z的金属活动性顺序为
A.X>W>Z>Y B.Z>X>W>Y
C.W>X>Y>Z D.Y>Z>X>W
9.向AgNO3、Cu(NO3)2、Zn(NO3)2混合液中,加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,有气体生成,则滤出的固体中一定有
A.Ag、Cu、Zn B.Cu、Zn、Fe
C.Ag、Zn、Fe D.Ag.Cu、Fe
10.同学们为探究不同金属的活动性强弱,设计了如下的实验方案,下列方案中实验设计、现象、结论均正确的一组是( )
选项 实验设计 现 象 结论(金属的活动性)
A 将铝丝放入硫酸铜溶液中 无现象 Cu > Al
B 将铝丝放入硫酸镁溶液中 铝丝表面有固体析出 Al > Mg
C 分别将锌粉与铁丝放入相同 浓度的稀盐酸中 锌粉产生气泡的速率比 铁丝快 Zn > Fe
D 分别将铁丝与铜丝放入相同 浓度的稀盐酸中 铁丝表面产生气泡, 铜丝无现象 Fe > Cu
A.A B.B C.C D.D
二、填空题
11.迎香港回归,在《南京条约》议约地——南京下关区静海寺敲响了“警世钟”,铸造该钟采用的主要金属材料是__________,此金属的优点是____________________.
12.金属在生产和生活中有广泛的应用。
(1)下列金属制品中,利用金属导电性的是_________(填字母序号)。
(2)铁制品在沙漠地区不易锈蚀的原因是___________。
(3)工业上用一氧化碳和赤铁矿炼铁反应的化学方程式为________________________。
13.(1)油罐下面常有一条拖地铁链,在高层建筑的顶端都装有铁制的避雷针,这是应用了铁的________性质;铁也可以铸成铁锅,是利用了铁的________性质。
(2)铁块可变成很细的铁丝,这说明铁有________性;铁块也可以变成很薄的铁片,这说明铁有________性。
14.提纯含少量泥沙的粗盐样品,实验过程和氯化钠的溶解度数据如下:
温度 (℃) 溶解度 (g/100g水)
20 36.0
40 36.6
60 37.3
①20℃时氯化钠的溶解度是________g/100g水。
②该实验是利用泥沙难溶于水而氯化钠_______的性质进行提纯,操作Ⅲ的名称是______。
③关于蒸发叙述正确的是_______(选填编号)。
a、蒸发是通过加热的方法将水汽化除去
b、所需仪器为酒精灯、蒸发皿、温度计
c、搅拌可以防止蒸发过程中食盐飞溅
d、加热过程中用试管夹夹住蒸发皿移动,使其均匀受热
④溶解时,加入水的合适的量约为______(选填“15”、“30”或“60”)mL,理由是__________________。
15.(1)写出下列粒子符号。
①2个镁原子______;②2个钠离子______。
(2)写出相应的金属元素符号。
①熔点最低的金属元素是______;
②能在空气中形成致密氧化膜的金属元素是______;
③导电导热最好的金属元素是______。
三、综合应用题
16.某兴趣小组为探究“氧化铁和铜粉”混合物中铜的质量分数,称取一定质量的混合物,按照下图实验装置进行实验:
(1)实验时要“先通一氧化碳气体,后加热”的目的是____________。
(2)装置A中发生反应的方程式为____________。
(3)实验装置B中的现象是__________________,发生反应的化学方程式为_________________。
(4)该装置的设计有一明显不当之处,你的改进方案是____________________。
[定量分析]
该兴趣小组按照科学的方案完成实验后,对充分反应后的管内固体X进行如下后续实验探究:
回答下列问题:
(1)写出固体X与稀盐酸反应的方程式:___________________________________。
(2)如何证明固体C已经洗涤干净?_______________________________________。
(3)有色溶液B中含有的溶质:______________(填化学式)。
(4)根据以上实验流程,计算原混合物“氧化铁和铜粉”中铜的质量分数为_______。
17.金属及金属材料在生产、生活中应用广泛。
(1)下列生活用品中,主要利用金属导热性的是________(填序号)。
(2)银、铁、铜是日常生活中经常接触到的三种金属。对Ag、Fe、Cu三种金属活动性顺序的探究,下列所选试剂组不可行的是________。
①Fe、Ag、CuSO4溶液
②Cu、Ag、FeSO4溶液
③Cu、FeSO4溶液、AgNO3溶液
(3)日常生活中,铁制品生锈是铁与__________和__________发生反应;用于铁栏杆外层防止其生锈的涂料中的“银粉”大多是金属________的粉末。
(4)明明在学习金属的化学性质时,做了如下探究实验:
向硝酸银、硝酸铜、硝酸亚铁的混合溶液中加入一定质量的锌粉,反应停止后过滤,洗涤,得滤渣A和滤液B。向滤渣A中加入稀盐酸,有气泡冒出。则滤渣A中一定有________;滤液B中一定没有的金属离子是________。
(5)钢铁是使用最多的金属。工业上常用赤铁矿石炼铁,某炼铁厂每天消耗含氧化铁80%的赤铁矿500 t,该厂每天最多能炼出含杂质3%的生铁多少吨________。?(结果精确到0.1 t)
18.不少同学都被蚊虫叮咬过,感觉又痛又痒。从化学课上得知:蚊虫叮咬时能在皮肤内分泌出蚁酸刺激皮肤。查阅资料:蚁酸是一种有机酸,化学名称叫做甲酸,化学式为HCOOH,通常是一种无色易挥发的液体,它在浓硫酸存在时加热发生如下反应:HCOOHCO↑+H2O。某化学兴趣小组同学决定使用下图仪器或装置利用甲酸制取CO,并进行CO还原Fe2O3(Fe2O3样品中杂质不参加反应)的探究实验。[来自:中国学考]
请回答下列问题:
(1)用甲酸滴入浓硫酸的方法制取CO,应选用的发生装置是 ______ (填代号,下同);要除去CO中含有的少量甲酸蒸汽,最好选用上图中的 ________ 进行洗气;检验CO还原Fe2O3的气体产物应选用 _______ 装置,需检验的气体应从 _____ 管口进入。
(2)写出CO还原Fe2O3的化学方程式 _________ 。
(3)从开始加热到实验结束,Fe2O3粉末的颜色是如何变化的? ________ 。
(4)CO有毒,从环保角度看,如何处理该实验的尾气? ________ 。
(5)【拓展延伸】①当你被蚊虫叮咬后,在叮咬处涂抹一些物质可减轻痛痒。下列物质中,你不会选择的物质是 ________ 。
A氨水 B食醋 C肥皂水 D苏打水
②向某溶液中加入蚁酸有气泡产生,该气体能使澄清石灰水变浑浊,则该溶液中溶质的化学式可能是 ________ (只写一种)。
(6)利用以上装置可以测定Fe2O3样品中Fe2O3的质量分数。测定方法是:取10.0g Fe2O3样品做实验,先称量样品和玻璃管的总质量为60.0g,待样品完全反应并冷却后,在称量玻璃管和剩余固体的总质量为57.6g。求该样品中Fe2O3的质量分数是多少? ______
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.C
3.A
4.B
5.C
6.A
7.A
8.B
9.D
10.D
11. 铜 铜在金属活动顺序表中排在H之后,化学性质稳定,可长期保存
12.(1)C (2)没有水分
(3)3CO+Fe2O32Fe+3CO2
13. 导电 导热 延 展
14. 36.0 易溶于水 过滤 ac 30 20℃时,氯化钠的溶解度为36g/100g水,实验中称取的粗盐质量为10g,加入约30mL水既可使粗盐中的氯 化钠充分溶解,又不会因加水过多而影响后续蒸发 操作的效率
15.
16. 排尽玻璃管内的空气,防止加热时发生爆炸 石灰水变浑浊 将尾气点燃(用气球收集) 取最后的洗涤液滴加紫色石蕊试液,看是否变红,若不变红,说明已洗干净 FeCl2、HCl 20%
17. A ② 氧气 水蒸气 铝 银、铜和铁 Cu2+和Ag+ 288.7 t。
18. ② ③ ④ F 3CO+Fe2O32Fe+3CO2 由红棕色变为黑色 将尾气点燃或用气球收集 B Na2CO3(或其它可溶性碳酸盐、酸式碳酸盐等) 80%
解:设氧化铁质量为x。
Fe2O3的质量分数是
答:质量分数80%。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
