1.3.1烷烃及其性质 课件 2022-2023学年高二化学鲁科版(2019)选择性必修3(21张ppt)
文档属性
| 名称 | 1.3.1烷烃及其性质 课件 2022-2023学年高二化学鲁科版(2019)选择性必修3(21张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-21 11:06:49 | ||
图片预览








文档简介
(共21张PPT)
烷烃及其性质
烷烃结构及物理性质
烃
链烃(脂肪烃)
环烃
芳香烃
脂环烃
烷烃 例CH3—CH2—CH3
烯烃 例CH2=CH2
炔烃 例CH≡CH
环烷烃
环烯烃等
苯及其同系物
多环芳香烃:
萘、联苯等
CH2—CH3
∣ ∣
CH2—CH2
CH—CH2
‖ ∣
CH—CH2
知识复习:烃的分类
1.1烷烃的组成和结构特点
烷烃
组成:只含 两种元素
结构特点:分子中碳原子之间以 结合成碳链,碳原子
剩余的价键与 的链烃,属于脂肪烃
通式:______________
C、H
单键
氢原子结合
CnH2n+2(n≥1)
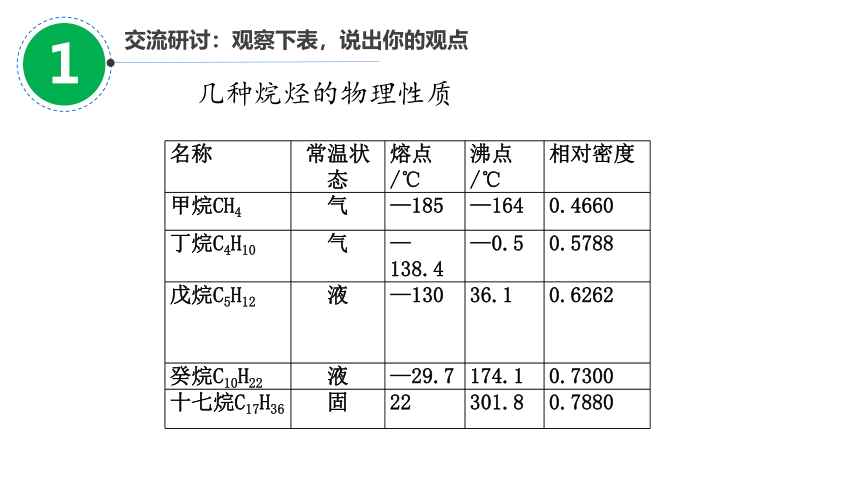
交流研讨:观察下表,说出你的观点
几种烷烃的物理性质
名称 常温状态 熔点/℃ 沸点/℃ 相对密度
甲烷CH4 气 —185 —164 0.4660
丁烷C4H10 气 —138.4 —0.5 0.5788
戊烷C5H12 液 —130 36.1 0.6262
癸烷C10H22 液 —29.7 174.1 0.7300
十七烷C17H36 固 22 301.8 0.7880
⑷.烷烃、烯烃和炔烃具有相似的物理性质
①、烷烃、烯烃和炔烃均为无色物质,不溶于水而易溶于苯、乙醚等有机溶剂,密度比水小。
②、在室温下,链状的烷烃、烯烃和炔烃分子中有1∽4个碳原子时均为气态;随着分子中碳原子数增加,链烃的熔沸点升高、密度增大,其状态逐渐由液态过渡到固态,分子中有5∽16个碳原子时为液态(特例:新戊烷为气体);分子中有大于等于17个碳原子时为固态。
③烃的含碳量:分子中随C原子数增加,烷烃含碳量升高;烯烃含碳量不变;炔烃、苯的同系物含碳量降低。
1.2烷烃的物理性质
物理性质 变化规律
状态 常温常压下的状态随碳原子数增加由 态逐渐过渡到 态、
态。当碳原子数小于或等于4时,烷烃在常温下呈气态
溶解性 不溶于 ,易溶于__________
熔点、沸点 随碳原子数的增加,熔点、沸点逐渐 ,同种烷烃的不同异构体中,支链越多,熔点、沸点越低
密度 随碳原子数的增加,密度逐渐 ,但比水的___
气
液
固
水
有机溶剂
升高
增大
小
正误判断
(1)在烷烃分子中,所有的碳碳键都是碳碳单键( )
(2)烷烃分子中所有化学键都是极性共价键( )
(3)甲烷、乙烷常温下为气态,符合CnH2n+2的烃常温下也均为气态( )
(4)所有饱和烃都属于烷烃( )
(5)分子式符合CnH2n+2(n≥1)的烃一定是烷烃( )
√
×
×
×
√
迁移应用
1.下列关于CH4和CH3CH(CH3)CH2CH3的叙述正确的是
A.均能用CnH2n+2通式来表示
B.与所有烷烃互为同素异形体
C.因为它们的结构相似,所以它们的化学性质相似,物理性质相同
D.通常状况下,它们都是气态烷烃
√
迁移应用
2.下列烷烃中,沸点最高的是
A.2-甲基丙烷 B.2,2-二甲基丙烷
C.正己烷 D.2-甲基戊烷
√
烷烃的化学性质
2.1 烷烃的化学性质
稳定性
KMnO4溶液
溴水
CH4
滴有石蕊的酸溶液
滴有石蕊的碱溶液
结论:
常温下烷烃不活泼,与强酸、强碱、溴水、KMnO4溶液都不反应。
1.稳定性
因为烷烃分子中碳氢键和碳碳单键的键能较高,所以常温下烷烃很不活泼,与 、 、 和 等都不发生反应。
2.与卤素单质的取代反应
(1)在 照射条件下,烷烃能与Cl2、Br2等卤素单质发生取代反应。
写出丙烷在光照条件下与Cl2生成一氯代物的化学方程式:
强酸
强碱
强氧化剂
还原剂
紫外线(或强烈日光)
_________________________________________
______________________________________。
取代反应
CH4 + Cl2 CH3Cl + HCl
光照
结论:
光照条件下,烷烃能与Cl2、Br2等卤素单质发生取代反应
注意:
反应条件:
反应的特点:
反应产物:
定量关系:
光照、卤素单质
H被卤素原子逐步取代,多步反应同时进行
混合物(多种卤代烃),不适宜制备卤代烃
每1molH被取代,需1molCl2,生成1molHCl
CH3CH3 + Cl2 CH3CH2Cl + HCl
光照
练习
1、光照条件下,将1 mol甲烷和1 mol氯气混合充分反应后,得到的产物为( )
A.CH3Cl、HCl
B.HCl、CCl4
C.CH3Cl、CH2Cl2
D.CH3Cl、CH2Cl2、CHCl3、CCl4、HCl
D
2.1 烷烃的化学性质
CH4+2O2 CO2+2H2O
点燃
现象:火焰明亮且呈淡蓝色
CnH2n+2 + ( )O2 nCO2 + (n+1)H2O
3n+1
2
点燃
烷烃的燃烧通式
注:含碳量越高,火焰越明亮,黑烟越浓
3.与氧气的反应
判断正误
(1)在烷烃分子中,所有的化学键都是单键( )
(2)烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去( )
(3)分子通式为CnH2n+2的烃不一定是烷烃( )
√
×
×
解析 烷烃中只含有碳碳单键(甲烷除外)、碳氢单键,故正确;
解析 烷烃均不能被酸性高锰酸钾溶液氧化,故错误;
解析 分子通式为CnH2n+2的烃,一定属于烷烃,故错误;
(1)烷烃与卤素单质的发生取代反应得到的产物不只是一卤代物,烷烃分子中的所有氢原子都可被卤素原子取代。
(2)烷烃与Cl2发生取代反应时,消耗氯气的物质的量等于被取代的氢原子的物质的量,还等于生成HCl的物质的量。
归纳总结
练习
1.下列关于丙烷结构、性质的推断正确的是
A.丙烷能使溴水、酸性KMnO4溶液褪色
B.丙烷可与氯水发生取代反应
C.丙烷的3个碳原子不在同一直线上
D.丙烷可与强酸或强碱反应
√
练习
根据以上数据推断丙烷的沸点可能是
A.约-40 ℃ B.低于-162 ℃
C.低于-89 ℃ D.高于36 ℃
2.几种烷烃的沸点如下:
解析 烷烃同系物的沸点随分子中碳原子个数的增加而升高,因此丙烷的沸点介于乙烷和丁烷之间,故选A。
物质 甲烷 乙烷 丁烷 戊烷
沸点/℃ -162 -89 -1 36
√
谢谢观看
烷烃及其性质
烷烃结构及物理性质
烃
链烃(脂肪烃)
环烃
芳香烃
脂环烃
烷烃 例CH3—CH2—CH3
烯烃 例CH2=CH2
炔烃 例CH≡CH
环烷烃
环烯烃等
苯及其同系物
多环芳香烃:
萘、联苯等
CH2—CH3
∣ ∣
CH2—CH2
CH—CH2
‖ ∣
CH—CH2
知识复习:烃的分类
1.1烷烃的组成和结构特点
烷烃
组成:只含 两种元素
结构特点:分子中碳原子之间以 结合成碳链,碳原子
剩余的价键与 的链烃,属于脂肪烃
通式:______________
C、H
单键
氢原子结合
CnH2n+2(n≥1)
交流研讨:观察下表,说出你的观点
几种烷烃的物理性质
名称 常温状态 熔点/℃ 沸点/℃ 相对密度
甲烷CH4 气 —185 —164 0.4660
丁烷C4H10 气 —138.4 —0.5 0.5788
戊烷C5H12 液 —130 36.1 0.6262
癸烷C10H22 液 —29.7 174.1 0.7300
十七烷C17H36 固 22 301.8 0.7880
⑷.烷烃、烯烃和炔烃具有相似的物理性质
①、烷烃、烯烃和炔烃均为无色物质,不溶于水而易溶于苯、乙醚等有机溶剂,密度比水小。
②、在室温下,链状的烷烃、烯烃和炔烃分子中有1∽4个碳原子时均为气态;随着分子中碳原子数增加,链烃的熔沸点升高、密度增大,其状态逐渐由液态过渡到固态,分子中有5∽16个碳原子时为液态(特例:新戊烷为气体);分子中有大于等于17个碳原子时为固态。
③烃的含碳量:分子中随C原子数增加,烷烃含碳量升高;烯烃含碳量不变;炔烃、苯的同系物含碳量降低。
1.2烷烃的物理性质
物理性质 变化规律
状态 常温常压下的状态随碳原子数增加由 态逐渐过渡到 态、
态。当碳原子数小于或等于4时,烷烃在常温下呈气态
溶解性 不溶于 ,易溶于__________
熔点、沸点 随碳原子数的增加,熔点、沸点逐渐 ,同种烷烃的不同异构体中,支链越多,熔点、沸点越低
密度 随碳原子数的增加,密度逐渐 ,但比水的___
气
液
固
水
有机溶剂
升高
增大
小
正误判断
(1)在烷烃分子中,所有的碳碳键都是碳碳单键( )
(2)烷烃分子中所有化学键都是极性共价键( )
(3)甲烷、乙烷常温下为气态,符合CnH2n+2的烃常温下也均为气态( )
(4)所有饱和烃都属于烷烃( )
(5)分子式符合CnH2n+2(n≥1)的烃一定是烷烃( )
√
×
×
×
√
迁移应用
1.下列关于CH4和CH3CH(CH3)CH2CH3的叙述正确的是
A.均能用CnH2n+2通式来表示
B.与所有烷烃互为同素异形体
C.因为它们的结构相似,所以它们的化学性质相似,物理性质相同
D.通常状况下,它们都是气态烷烃
√
迁移应用
2.下列烷烃中,沸点最高的是
A.2-甲基丙烷 B.2,2-二甲基丙烷
C.正己烷 D.2-甲基戊烷
√
烷烃的化学性质
2.1 烷烃的化学性质
稳定性
KMnO4溶液
溴水
CH4
滴有石蕊的酸溶液
滴有石蕊的碱溶液
结论:
常温下烷烃不活泼,与强酸、强碱、溴水、KMnO4溶液都不反应。
1.稳定性
因为烷烃分子中碳氢键和碳碳单键的键能较高,所以常温下烷烃很不活泼,与 、 、 和 等都不发生反应。
2.与卤素单质的取代反应
(1)在 照射条件下,烷烃能与Cl2、Br2等卤素单质发生取代反应。
写出丙烷在光照条件下与Cl2生成一氯代物的化学方程式:
强酸
强碱
强氧化剂
还原剂
紫外线(或强烈日光)
_________________________________________
______________________________________。
取代反应
CH4 + Cl2 CH3Cl + HCl
光照
结论:
光照条件下,烷烃能与Cl2、Br2等卤素单质发生取代反应
注意:
反应条件:
反应的特点:
反应产物:
定量关系:
光照、卤素单质
H被卤素原子逐步取代,多步反应同时进行
混合物(多种卤代烃),不适宜制备卤代烃
每1molH被取代,需1molCl2,生成1molHCl
CH3CH3 + Cl2 CH3CH2Cl + HCl
光照
练习
1、光照条件下,将1 mol甲烷和1 mol氯气混合充分反应后,得到的产物为( )
A.CH3Cl、HCl
B.HCl、CCl4
C.CH3Cl、CH2Cl2
D.CH3Cl、CH2Cl2、CHCl3、CCl4、HCl
D
2.1 烷烃的化学性质
CH4+2O2 CO2+2H2O
点燃
现象:火焰明亮且呈淡蓝色
CnH2n+2 + ( )O2 nCO2 + (n+1)H2O
3n+1
2
点燃
烷烃的燃烧通式
注:含碳量越高,火焰越明亮,黑烟越浓
3.与氧气的反应
判断正误
(1)在烷烃分子中,所有的化学键都是单键( )
(2)烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去( )
(3)分子通式为CnH2n+2的烃不一定是烷烃( )
√
×
×
解析 烷烃中只含有碳碳单键(甲烷除外)、碳氢单键,故正确;
解析 烷烃均不能被酸性高锰酸钾溶液氧化,故错误;
解析 分子通式为CnH2n+2的烃,一定属于烷烃,故错误;
(1)烷烃与卤素单质的发生取代反应得到的产物不只是一卤代物,烷烃分子中的所有氢原子都可被卤素原子取代。
(2)烷烃与Cl2发生取代反应时,消耗氯气的物质的量等于被取代的氢原子的物质的量,还等于生成HCl的物质的量。
归纳总结
练习
1.下列关于丙烷结构、性质的推断正确的是
A.丙烷能使溴水、酸性KMnO4溶液褪色
B.丙烷可与氯水发生取代反应
C.丙烷的3个碳原子不在同一直线上
D.丙烷可与强酸或强碱反应
√
练习
根据以上数据推断丙烷的沸点可能是
A.约-40 ℃ B.低于-162 ℃
C.低于-89 ℃ D.高于36 ℃
2.几种烷烃的沸点如下:
解析 烷烃同系物的沸点随分子中碳原子个数的增加而升高,因此丙烷的沸点介于乙烷和丁烷之间,故选A。
物质 甲烷 乙烷 丁烷 戊烷
沸点/℃ -162 -89 -1 36
√
谢谢观看
