人教版化学必修一4.2元素周期律 课件.pptx(19张ppt)
文档属性
| 名称 | 人教版化学必修一4.2元素周期律 课件.pptx(19张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 32.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-21 11:15:51 | ||
图片预览



文档简介
(共19张PPT)
吴 彦
元素周期律
——元素周期律的应用
第四章 物质结构 元素周期律
第二节 元素周期律(2)
一、发展中的元素周期表
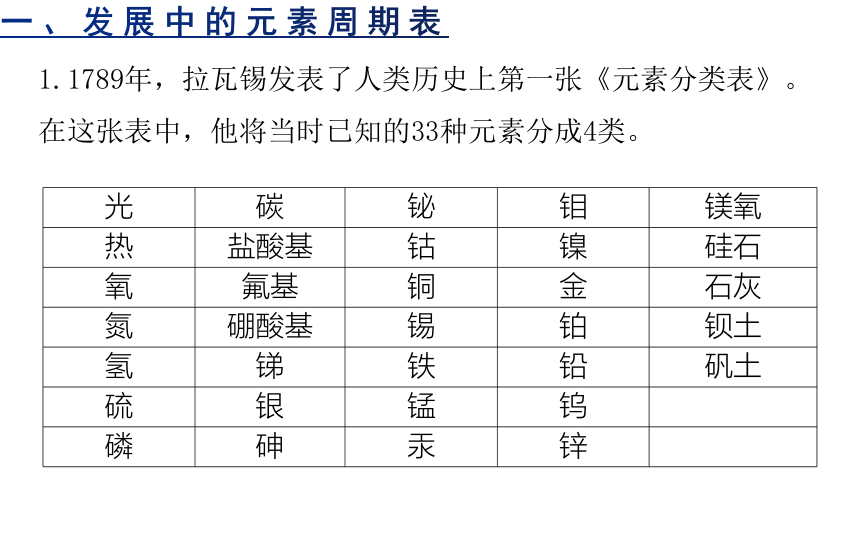
1.1789年,拉瓦锡发表了人类历史上第一张《元素分类表》。在这张表中,他将当时已知的33种元素分成4类。
光 碳 铋 钼 镁氧
热 盐酸基 钴 镍 硅石
氧 氟基 铜 金 石灰
氮 硼酸基 锡 铂 钡土
氢 锑 铁 铅 矾土
硫 银 锰 钨
磷 砷 汞 锌
一、发展中的元素周期表
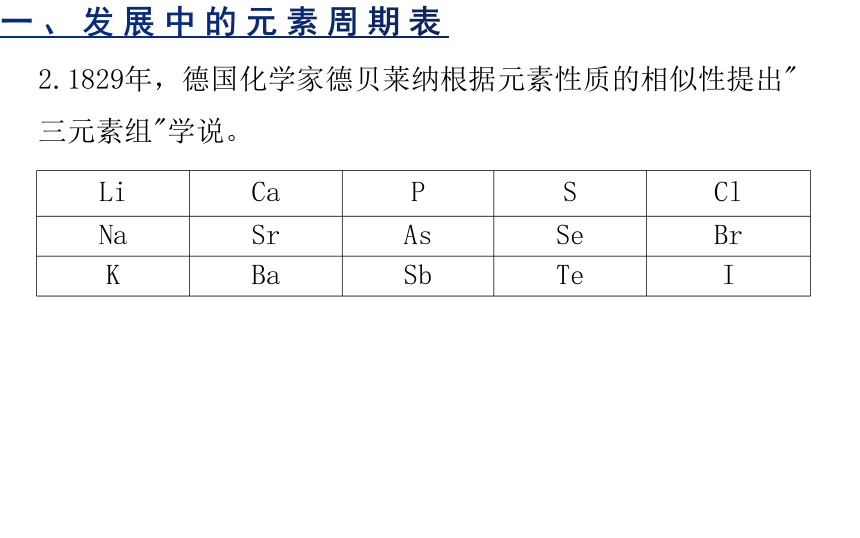
2.1829年,德国化学家德贝莱纳根据元素性质的相似性提出"三元素组"学说。
Li Ca P S Cl
Na Sr As Se Br
K Ba Sb Te I
一、发展中的元素周期表
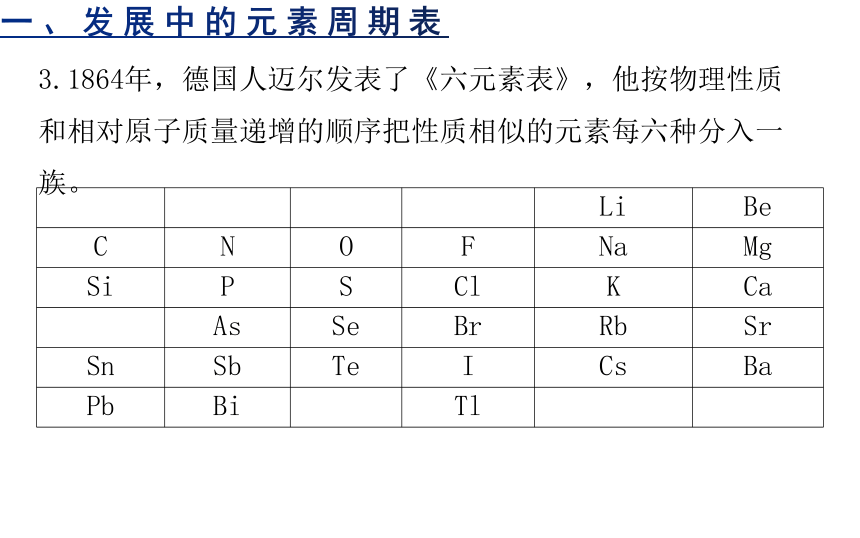
3.1864年,德国人迈尔发表了《六元素表》,他按物理性质和相对原子质量递增的顺序把性质相似的元素每六种分入一族。
Li Be
C N O F Na Mg
Si P S Cl K Ca
As Se Br Rb Sr
Sn Sb Te I Cs Ba
Pb Bi Tl
一、发展中的元素周期表
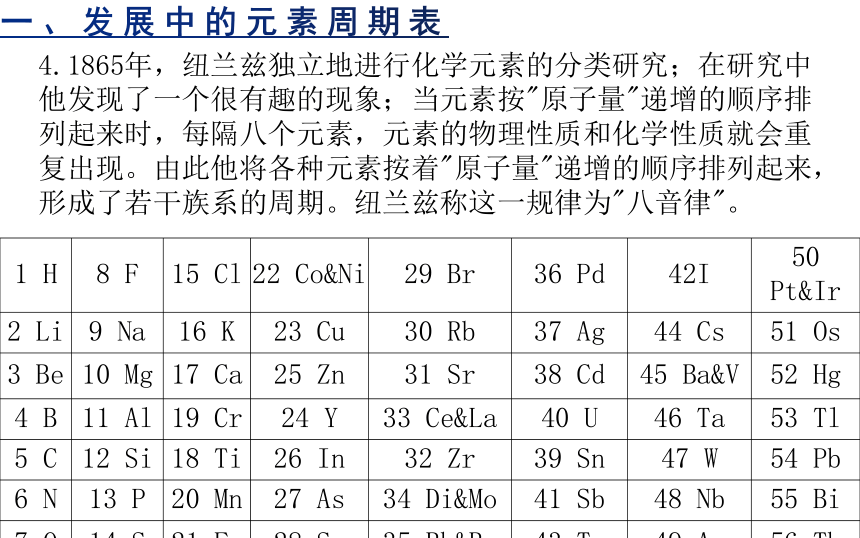
4.1865年,纽兰兹独立地进行化学元素的分类研究;在研究中他发现了一个很有趣的现象;当元素按"原子量"递增的顺序排列起来时,每隔八个元素,元素的物理性质和化学性质就会重复出现。由此他将各种元素按着"原子量"递增的顺序排列起来,形成了若干族系的周期。纽兰兹称这一规律为"八音律"。
1 H 8 F 15 Cl 22 Co&Ni 29 Br 36 Pd 42I 50 Pt&Ir
2 Li 9 Na 16 K 23 Cu 30 Rb 37 Ag 44 Cs 51 Os
3 Be 10 Mg 17 Ca 25 Zn 31 Sr 38 Cd 45 Ba&V 52 Hg
4 B 11 Al 19 Cr 24 Y 33 Ce&La 40 U 46 Ta 53 Tl
5 C 12 Si 18 Ti 26 In 32 Zr 39 Sn 47 W 54 Pb
6 N 13 P 20 Mn 27 As 34 Di&Mo 41 Sb 48 Nb 55 Bi
7 O 14 S 21 Fe 28 Se 35 Rh&Ru 43 Te 49 Au 56 Th
一、发展中的元素周期表
5.1869年,俄国人门捷列夫依据相对原子质量递增的顺序构建元素周期表。
二、建构"位置-结构-性质"认识模型
任务1:探寻主族元素在元素周期表中位置与其原子结构的关系
画出11-17号元素原子结构示意图,说出它们在元素周期表中的位置(第 周期 A族)。
周期、主族序数与原子结构中的哪些量有关系
周期数等于电子层数,主族序数等于最外层电子数,原子结构与元素在元素周期表中的位置可以相互推理确定。
二、建构"位置-结构-性质"认识模型
总结比较元素的非金属性和金属性强弱的方法
1.比较金属性强弱(一般情况下):
(1)单质与水(或酸)反应生成氢气的难易程度(金属性越强反应越容易);
(2)最高价氧化物的水化物——氢氧化物的碱性强弱(金属性越强氢氧化物的碱性越强)。
2.比较非金属性强弱(一般情况下):
(1)单质与氢气反应生成气态氢化物的难易程度(非金属性越强反应越容易);
(2)最高价氧化物水化物的酸性强弱(非金属性越强酸性越强);
(3)气态氢化物的稳定性(非金属性越强气态氢化物越稳定)。
短周期元素的最高价氧化物的水化物中酸性最强的是什么
气态氢化物稳定性最强的是什么
短周期元素的最高价氧化物的水化物中碱性最强的是什么?
HClO4
HF
NaOH
二、建构"位置-结构-性质"认识模型
任务2:探究主族元素主要化合价(最高正价和最低负价)与最外层电子数的关系
主族元素的化合价的规律
1.同周期由左向右主族元素的最高正价逐渐由+1价升高至7价(O无最高正价,F无正价);
2.同主族元素的最高正价和最低负价相同(注意O和F);
3.主族元素的最高正价等于该元素原子的最外层电子数,也等于其主族序数;
4.非金属元素的最高正价和最低负价的绝对值之和等于 8(H 的最低负价为-1)。
二、建构"位置-结构-性质"认识模型
任务2:探究主族元素主要化合价(最高正价和最低负价)与最外层电子数的关系
已知某元素原子结构示意图 ,请说出其在元素周期表中的位置,推测其主要化合价和可能的化学性质。
根据该元素的电子层数确定其在第四周期,根据最外层7个电子判定在ⅦA族,是溴元素。最高正价=最外层电子数=7,最低负价=最外层电子数-8,所以是-1价。因为比氯多一个电子层(最外层电子数相同),原子核对最外层电子吸引力减弱,非金属性比氯要弱,可以用HClO4酸性比 HBrO4强,HCl稳定性比 HBr强等证据说明。
二、建构"位置-结构-性质"认识模型
任务2:探究主族元素主要化合价(最高正价和最低负价)与最外层电子数的关系
根据元素周期表和元素周期律,互相交流讨论,预测硒及其化合物的性质,填写在下表中。
元素名称 硒 元素符号 Se
原子序数 34 金属还是非金属
原子结构示意图
最高正价 最低负价
常见中间价 气态氢化物化学式
最高价氧化物 最高价氧化物对应的水化物
与硫酸酸性比较 与硫化氢稳定性比较
三、建构"位置-结构-性质"认识模型
任务1:门捷列夫元素周期表的形成与作用
1869年门捷列夫构建的元素周期表(1871年改成横式),将已知的63种元素按相对原子质量递增顺序进行了排列,但他感觉到有的元素之间存在不连续性,如铝的下方应该有一个与铝类似的元素“类铝”,并预测了这个元素的性质。想知道元素周期表有什么作用吗
Ti 50 Zr 90 180
V 51 Nb 94 Ta 182
Cr 52 Mo 96 W 186
Mn 53 Rh 104.4 Pt 197.4
Fe 56 Ru 104.4 Ir 198
Ni=Co 59 Pd 106.6 Os 199
H 1 Cu 63.4 Ag 108 Hg 200
Be 9.4 Mg 24 Zn 65.2 Cd 112
B 11 Al 27 68 Ur 116 Au 197
C 12 Si 28 70 Sn 118
N 14 P 31 As 75 Sb 122 Bi 210
O 16 S 32 Se 79.4 Te 128
F 19 Cl 35.5 Br 80 I 127
Li 7 Na 23 K 38 Rb 85.4 Ca 133 TI 204
Ca 40 Sr 87.5 Ba 137 Pb 207
45 Ce 92
Er 56 La 94
Yt 60 Di 95
In 75.6 Th 118
三、建构"位置-结构-性质"认识模型
任务2:探究新版元素周期表对生产生活的作用
1.金属一般有良好的导电性,非金属一般导电性较差,半导体材料元素通常在元素周期表的哪个区域?
2.MnO2、Fe、Cu等常用作化学研究或工业生产中的催化剂,这些物质所含金属元素又在元素周期表的什么区域
元素周期表中金属元素与非金属元素分界线附近的元素单质或化合物往往是半导体材料的探寻区域,硅谷(信息)时代就从这里开始。
非金属区域元素一般有利于研究新型除虫剂或除草剂,也许未来还是人类治病药物的改良选择。
过渡元素种类特别多,不仅是催化剂,耐高温、耐腐蚀的合金元素的来源,还可能用于开创能源时代、航天时代......
三、建构"位置-结构-性质"认识模型
任务2:探究新版元素周期表对生产生活的作用
分界线附近的元素,既能表现出一定的金属性,又能表现出一定的非金属性;
这些元素的金属性和非金属性之间没有严格的界线。
族
周期
1
2
3
4
5
6
7
IA IIA IIIA IVA VA VIA VIIA 0
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
稀有气体元素
B
Al
Si
Ga
Ge
As
Te
Sb
Po
At
三、建构"位置-结构-性质"认识模型
任务2:探究新版元素周期表对生产生活的作用
绘制元素推断的应用模型
1.由元素原子或离子的核外电子排布推断
2.由元素单质或化合物的性质(特性)推断
3.由元素在元素周期表中的位置推断
陌生元素单质及化合物的特性
某种熟悉元素
类比
推知
原子结构
推知
在元素周期表中的位置
核外电子排布
电子层数、最外层电子数
推知
推知
周期序数、主族序数
推知
单质及化合物的性质
元素在元素周期表中的位置
推知
周期序数、主族序数
推知
原子结构:电子层数和最外层电子数
元素、单质及其化合物的性质
三、建构"位置-结构-性质"认识模型
任务3:畅想未来的元素周期表
1.随着新元素不断的被发现或合成,可以预言119号元素的出现,那么,它将填充在元素周期表的什么位置?可能的原子结构是什么样的?
2.第8、9、10 周期分别可以填充多少种元素?169号元素会在什么位置
3.还有没有未被发现的稀有气体元素?
课堂总结
今日作业
学案【巩固训练】部分
结构
电子层数
最外层电子数
位置
性质
周期数
族序数
物理性质
化学性质
体现
决定
反映
决定
体现
吴 彦
元素周期律
——元素周期律的应用
第四章 物质结构 元素周期律
第二节 元素周期律(2)
一、发展中的元素周期表
1.1789年,拉瓦锡发表了人类历史上第一张《元素分类表》。在这张表中,他将当时已知的33种元素分成4类。
光 碳 铋 钼 镁氧
热 盐酸基 钴 镍 硅石
氧 氟基 铜 金 石灰
氮 硼酸基 锡 铂 钡土
氢 锑 铁 铅 矾土
硫 银 锰 钨
磷 砷 汞 锌
一、发展中的元素周期表
2.1829年,德国化学家德贝莱纳根据元素性质的相似性提出"三元素组"学说。
Li Ca P S Cl
Na Sr As Se Br
K Ba Sb Te I
一、发展中的元素周期表
3.1864年,德国人迈尔发表了《六元素表》,他按物理性质和相对原子质量递增的顺序把性质相似的元素每六种分入一族。
Li Be
C N O F Na Mg
Si P S Cl K Ca
As Se Br Rb Sr
Sn Sb Te I Cs Ba
Pb Bi Tl
一、发展中的元素周期表
4.1865年,纽兰兹独立地进行化学元素的分类研究;在研究中他发现了一个很有趣的现象;当元素按"原子量"递增的顺序排列起来时,每隔八个元素,元素的物理性质和化学性质就会重复出现。由此他将各种元素按着"原子量"递增的顺序排列起来,形成了若干族系的周期。纽兰兹称这一规律为"八音律"。
1 H 8 F 15 Cl 22 Co&Ni 29 Br 36 Pd 42I 50 Pt&Ir
2 Li 9 Na 16 K 23 Cu 30 Rb 37 Ag 44 Cs 51 Os
3 Be 10 Mg 17 Ca 25 Zn 31 Sr 38 Cd 45 Ba&V 52 Hg
4 B 11 Al 19 Cr 24 Y 33 Ce&La 40 U 46 Ta 53 Tl
5 C 12 Si 18 Ti 26 In 32 Zr 39 Sn 47 W 54 Pb
6 N 13 P 20 Mn 27 As 34 Di&Mo 41 Sb 48 Nb 55 Bi
7 O 14 S 21 Fe 28 Se 35 Rh&Ru 43 Te 49 Au 56 Th
一、发展中的元素周期表
5.1869年,俄国人门捷列夫依据相对原子质量递增的顺序构建元素周期表。
二、建构"位置-结构-性质"认识模型
任务1:探寻主族元素在元素周期表中位置与其原子结构的关系
画出11-17号元素原子结构示意图,说出它们在元素周期表中的位置(第 周期 A族)。
周期、主族序数与原子结构中的哪些量有关系
周期数等于电子层数,主族序数等于最外层电子数,原子结构与元素在元素周期表中的位置可以相互推理确定。
二、建构"位置-结构-性质"认识模型
总结比较元素的非金属性和金属性强弱的方法
1.比较金属性强弱(一般情况下):
(1)单质与水(或酸)反应生成氢气的难易程度(金属性越强反应越容易);
(2)最高价氧化物的水化物——氢氧化物的碱性强弱(金属性越强氢氧化物的碱性越强)。
2.比较非金属性强弱(一般情况下):
(1)单质与氢气反应生成气态氢化物的难易程度(非金属性越强反应越容易);
(2)最高价氧化物水化物的酸性强弱(非金属性越强酸性越强);
(3)气态氢化物的稳定性(非金属性越强气态氢化物越稳定)。
短周期元素的最高价氧化物的水化物中酸性最强的是什么
气态氢化物稳定性最强的是什么
短周期元素的最高价氧化物的水化物中碱性最强的是什么?
HClO4
HF
NaOH
二、建构"位置-结构-性质"认识模型
任务2:探究主族元素主要化合价(最高正价和最低负价)与最外层电子数的关系
主族元素的化合价的规律
1.同周期由左向右主族元素的最高正价逐渐由+1价升高至7价(O无最高正价,F无正价);
2.同主族元素的最高正价和最低负价相同(注意O和F);
3.主族元素的最高正价等于该元素原子的最外层电子数,也等于其主族序数;
4.非金属元素的最高正价和最低负价的绝对值之和等于 8(H 的最低负价为-1)。
二、建构"位置-结构-性质"认识模型
任务2:探究主族元素主要化合价(最高正价和最低负价)与最外层电子数的关系
已知某元素原子结构示意图 ,请说出其在元素周期表中的位置,推测其主要化合价和可能的化学性质。
根据该元素的电子层数确定其在第四周期,根据最外层7个电子判定在ⅦA族,是溴元素。最高正价=最外层电子数=7,最低负价=最外层电子数-8,所以是-1价。因为比氯多一个电子层(最外层电子数相同),原子核对最外层电子吸引力减弱,非金属性比氯要弱,可以用HClO4酸性比 HBrO4强,HCl稳定性比 HBr强等证据说明。
二、建构"位置-结构-性质"认识模型
任务2:探究主族元素主要化合价(最高正价和最低负价)与最外层电子数的关系
根据元素周期表和元素周期律,互相交流讨论,预测硒及其化合物的性质,填写在下表中。
元素名称 硒 元素符号 Se
原子序数 34 金属还是非金属
原子结构示意图
最高正价 最低负价
常见中间价 气态氢化物化学式
最高价氧化物 最高价氧化物对应的水化物
与硫酸酸性比较 与硫化氢稳定性比较
三、建构"位置-结构-性质"认识模型
任务1:门捷列夫元素周期表的形成与作用
1869年门捷列夫构建的元素周期表(1871年改成横式),将已知的63种元素按相对原子质量递增顺序进行了排列,但他感觉到有的元素之间存在不连续性,如铝的下方应该有一个与铝类似的元素“类铝”,并预测了这个元素的性质。想知道元素周期表有什么作用吗
Ti 50 Zr 90 180
V 51 Nb 94 Ta 182
Cr 52 Mo 96 W 186
Mn 53 Rh 104.4 Pt 197.4
Fe 56 Ru 104.4 Ir 198
Ni=Co 59 Pd 106.6 Os 199
H 1 Cu 63.4 Ag 108 Hg 200
Be 9.4 Mg 24 Zn 65.2 Cd 112
B 11 Al 27 68 Ur 116 Au 197
C 12 Si 28 70 Sn 118
N 14 P 31 As 75 Sb 122 Bi 210
O 16 S 32 Se 79.4 Te 128
F 19 Cl 35.5 Br 80 I 127
Li 7 Na 23 K 38 Rb 85.4 Ca 133 TI 204
Ca 40 Sr 87.5 Ba 137 Pb 207
45 Ce 92
Er 56 La 94
Yt 60 Di 95
In 75.6 Th 118
三、建构"位置-结构-性质"认识模型
任务2:探究新版元素周期表对生产生活的作用
1.金属一般有良好的导电性,非金属一般导电性较差,半导体材料元素通常在元素周期表的哪个区域?
2.MnO2、Fe、Cu等常用作化学研究或工业生产中的催化剂,这些物质所含金属元素又在元素周期表的什么区域
元素周期表中金属元素与非金属元素分界线附近的元素单质或化合物往往是半导体材料的探寻区域,硅谷(信息)时代就从这里开始。
非金属区域元素一般有利于研究新型除虫剂或除草剂,也许未来还是人类治病药物的改良选择。
过渡元素种类特别多,不仅是催化剂,耐高温、耐腐蚀的合金元素的来源,还可能用于开创能源时代、航天时代......
三、建构"位置-结构-性质"认识模型
任务2:探究新版元素周期表对生产生活的作用
分界线附近的元素,既能表现出一定的金属性,又能表现出一定的非金属性;
这些元素的金属性和非金属性之间没有严格的界线。
族
周期
1
2
3
4
5
6
7
IA IIA IIIA IVA VA VIA VIIA 0
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
稀有气体元素
B
Al
Si
Ga
Ge
As
Te
Sb
Po
At
三、建构"位置-结构-性质"认识模型
任务2:探究新版元素周期表对生产生活的作用
绘制元素推断的应用模型
1.由元素原子或离子的核外电子排布推断
2.由元素单质或化合物的性质(特性)推断
3.由元素在元素周期表中的位置推断
陌生元素单质及化合物的特性
某种熟悉元素
类比
推知
原子结构
推知
在元素周期表中的位置
核外电子排布
电子层数、最外层电子数
推知
推知
周期序数、主族序数
推知
单质及化合物的性质
元素在元素周期表中的位置
推知
周期序数、主族序数
推知
原子结构:电子层数和最外层电子数
元素、单质及其化合物的性质
三、建构"位置-结构-性质"认识模型
任务3:畅想未来的元素周期表
1.随着新元素不断的被发现或合成,可以预言119号元素的出现,那么,它将填充在元素周期表的什么位置?可能的原子结构是什么样的?
2.第8、9、10 周期分别可以填充多少种元素?169号元素会在什么位置
3.还有没有未被发现的稀有气体元素?
课堂总结
今日作业
学案【巩固训练】部分
结构
电子层数
最外层电子数
位置
性质
周期数
族序数
物理性质
化学性质
体现
决定
反映
决定
体现
