第3章 不同聚集状态的物质与性质 检测题(含解析)
文档属性
| 名称 | 第3章 不同聚集状态的物质与性质 检测题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 17:53:11 | ||
图片预览



文档简介
第3章 不同聚集状态的物质与性质检测题
一、单选题
1.下列关于金属键或金属的性质说法正确的是
①金属的导电性是由金属阳离子和自由电子的定向移动实现的
②金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
③、、的沸点依次升高
④金属键没有方向性和饱和性,金属中的电子在整个三维空间运动,属于整个金属
A.①② B.②③ C.③④ D.①④
2.我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时发生的反应为2KNO3+S+3CK2S+N2↑+3CO2↑。生成物K2S的晶体结构如图。
下列有关说法错误的是
A.反应产物中有两种非极性分子
B.1molCO2和1molN2含有的π键数目之比为1:1
C.K2S晶体中阴、阳离子的配位数分别为4和8
D.若K2S晶体的晶胞边长为anm,则该晶体的密度为g·cm-3
3.下列说法错误的是
A.分子晶体中一定存在分子间作用力
B.共价晶体中只含有共价键
C.任何晶体中,若含有阳离子就一定含有阴离子
D.单质的晶体中一定不存在离子键
4.科研人员研制出由18个碳原子构成的环碳分子(如图所示),下列说法正确的是
A.是一种共价化合物 B.硬度大、熔点高
C.与乙炔互为同系物 D.与互为同素异形体
5.关于晶体,下列有关叙述不正确的是
A.利用超分子的分子识别特征,可以分离C60和C70
B.晶体内部离子在微观空间呈周期性有序排列,使晶体具有各向异性
C.可通过X-射线衍射实验区分晶体和非晶体
D.“硅-炭黑晶体管”为一种新型材料,硅、炭黑均属于晶体
6.下列叙述中正确的个数有
①氧原子的电子排布图:最外层违背了泡利原理
②处于最低能量状态原子叫基态原子,1s22s22p→1s22s22p过程中形成的是发射光谱
③H2O比H2S稳定是因为水分子间存在氢键
④第四周期元素中,未成对电子数最多的元素位于钾元素后面第五位
⑤NCl3中N-Cl键的键长比CCl4中C-Cl键的键长短
⑥卤素单质、卤素氢化物、卤素碳化物(CX4)的熔、沸点均随着相对分子质量的增大而升高
⑦主族元素的电负性越大,其元素原子的第一电离能一定越大
⑧在任何情况下,都是σ键比π键强度大
⑨晶胞是晶体中最小的平行六面体
⑩只要分子的空间结构为平面三角形,中心原子均为sp2杂化
电负性的大小可以作为判断元素非金属性强弱的依据
A.4个 B.1个 C.2个 D.3个
7.卤族元素随核电荷数的增加,下列叙述正确的是
A.单质的颜色逐渐变浅 B.氢卤酸的酸性逐渐增强
C.单质的熔点逐渐降低 D.单质的氧化性逐渐增强
8.单质不可能形成
A.离子晶体 B.原子晶体 C.分子晶体 D.金属晶体
9.下面的排序不正确的是
A.晶体沸点由低到高:CF4<CCl4<CBr4 B.晶格能由大到小: NaF> NaCl> NaBr
C.硬度由大到小:金刚石>碳化硅>晶体硅 D.熔点由高到低:Na>Mg>Al
10.磷化硼(BP)有良好的透光性,用于光学吸收的研究及用作超硬的无机材料等。其晶胞结构如下图所示,下列有关说法正确的是
A.磷化硼晶体的熔点高、硬度大
B.B配位数是4,P的配位数是2
C.BP属于离子晶体
D.B的杂化方式为sp2,P的杂化方式为sp3
11.几种物质的熔点和沸点的数据如表,下列有关判断错误的是
NaCl MgCl2 AlCl3 SiCl4 单质M
熔点/℃ 801 712 190 -70 2300
沸点/℃ 1465 1412 178 57.6 2500
注:AlCl3的熔点在2.02×105Pa条件下测定。A.常温下,SiCl4为液态 B.单质M可能是共价晶体
C.熔沸点:MgOMgCl2
12.下列说法正确的是
A.2p和3p轨道形状均为哑铃形,能量也相等
B.金属离子的电荷越多、半径越小,金属晶体的熔点越低
C.石墨转化为金刚石既有共价键的断裂和生成,没有破坏分子间作用力
D.DNA分子两条长链中的碱基以氢键互补配对形成双螺旋结构,使遗传信息得以精准复制
13.下列各组物质的性质排序正确的是
A.硬度:Li>Na>K>Rb
B.沸点:CF4>CCl4>CBr4>CI4
C.熔点:碳化硅<晶体硅<金刚石
D.熔点:NaF <NaCl<NaBr<NaI
14.晶体的性质与晶体类型密切相关,下列关于晶体的描述不正确的是
A.结构相似的共价晶体,原子半径越小,晶体的硬度和熔沸点越高
B.某无色晶体能溶于水,质硬而脆,熔点为801℃,熔化状态下能导电,则该晶体可能为离子晶体
C.易溶于CS2,液态时不导电,水溶液能导电的晶体为分子晶体
D.含有阳离子的晶体不一定是金属晶体,金属晶体都具有较高的熔点、良好的导电性和延展性
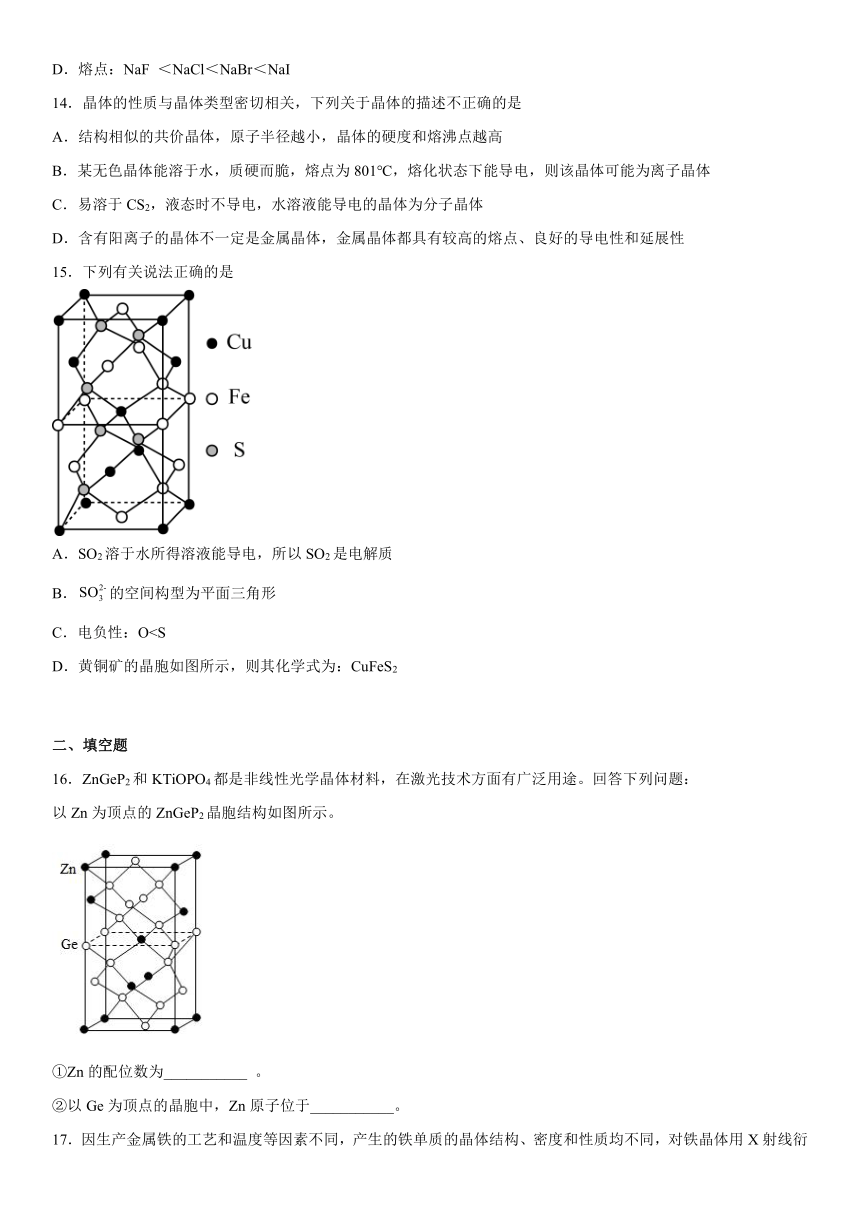
15.下列有关说法正确的是
A.SO2溶于水所得溶液能导电,所以SO2是电解质
B.的空间构型为平面三角形
C.电负性:OD.黄铜矿的晶胞如图所示,则其化学式为:CuFeS2
二、填空题
16.ZnGeP2和KTiOPO4都是非线性光学晶体材料,在激光技术方面有广泛用途。回答下列问题:
以Zn为顶点的ZnGeP2晶胞结构如图所示。
①Zn的配位数为___________ 。
②以Ge为顶点的晶胞中,Zn原子位于___________。
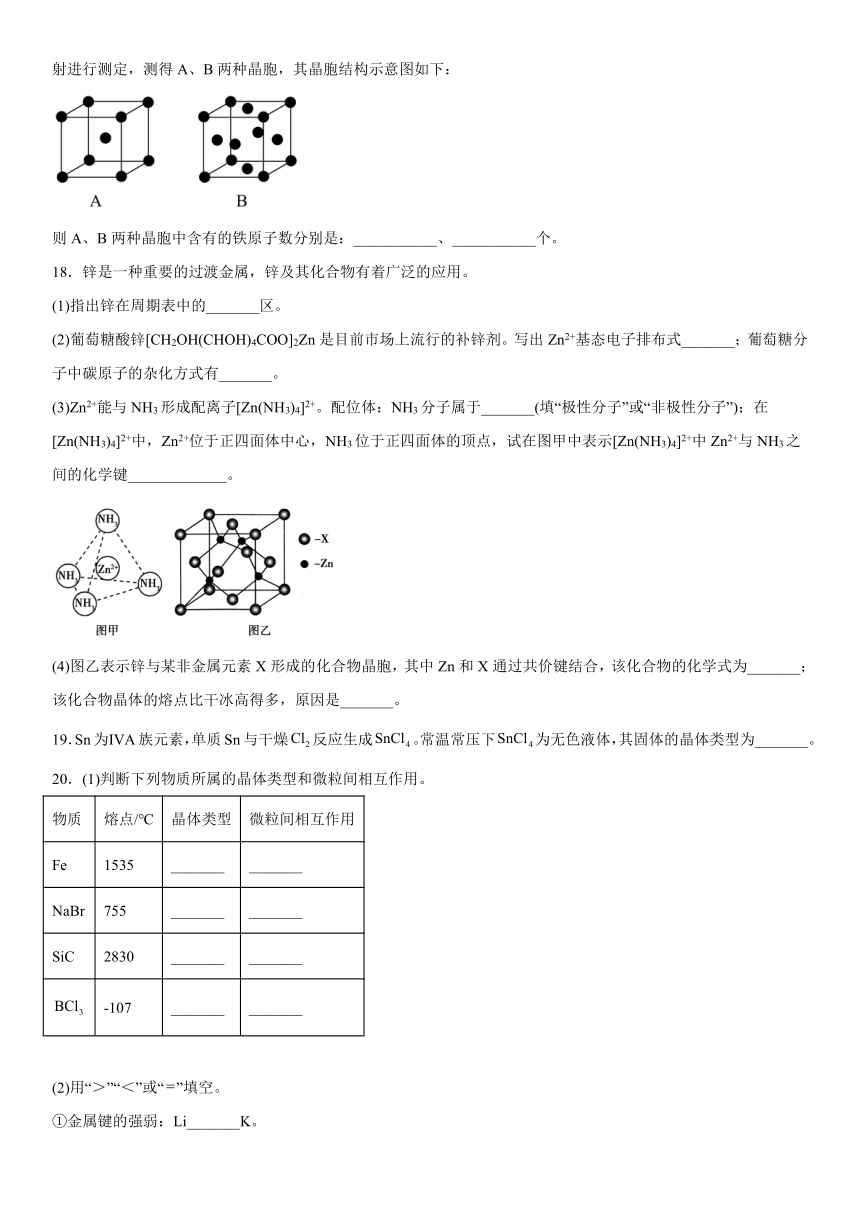
17.因生产金属铁的工艺和温度等因素不同,产生的铁单质的晶体结构、密度和性质均不同,对铁晶体用X射线衍射进行测定,测得A、B两种晶胞,其晶胞结构示意图如下:
则A、B两种晶胞中含有的铁原子数分别是:___________、___________个。
18.锌是一种重要的过渡金属,锌及其化合物有着广泛的应用。
(1)指出锌在周期表中的_______区。
(2)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式_______;葡萄糖分子中碳原子的杂化方式有_______。
(3)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体:NH3分子属于_______(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,NH3位于正四面体的顶点,试在图甲中表示[Zn(NH3)4]2+中Zn2+与NH3之间的化学键_____________。
(4)图乙表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为_______;该化合物晶体的熔点比干冰高得多,原因是_______。
19.Sn为ⅣA族元素,单质Sn与干燥反应生成。常温常压下为无色液体,其固体的晶体类型为_______。
20.(1)判断下列物质所属的晶体类型和微粒间相互作用。
物质 熔点/℃ 晶体类型 微粒间相互作用
Fe 1535 _______ _______
NaBr 755 _______ _______
SiC 2830 _______ _______
-107 _______ _______
(2)用“>”“<”或“”填空。
①金属键的强弱:Li_______K。
②晶格能的大小:KCl_______NaCl。
③晶体熔点的高低:SiO2_______SO2。
④水溶性的大小:CH4_______HCl。
21.(1)在下列物质中,_______(填序号,下同)是晶体,_______是非晶体。
①塑料 ②明矾 ③松香 ④玻璃 ⑤CuSO4·5H2O ⑥冰糖 ⑦石蜡 ⑧单晶硅 ⑨铝块 ⑩橡胶
(2)晶体和非晶体在外形上有差别,晶体都具有__________,而非晶体______________;另外非晶体具有物理性质__________的特点,而晶体具有物理性质__________的特点。
(3)判断物质是晶体还是非晶体,比较正确的方法是__________(填序号)。
①从外形上来判断
②从各向异性或各向同性上来判断
③从导电性能来判断
④从有无固定熔点来判断
22.一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子CH3NH,其晶胞如图(b)所示。其中Pb2+与图(a)中_______的空间位置相同;若晶胞参数为a nm,则晶体密度为_______ g/cm3 (列出计算式,设NA为阿伏加德罗常数的值)。
23.GaN是研制微电子器件、光电子器件的第三代半导体材料。
(1)基态Ga的核外电子排布为,转化为下列激发态时所需能量最少的是_______(填标号)。
A. B.
C. D.
(2)与家同主族的B具有缺电子性,硼氢化钠()是有机合成中重要的还原剂,其阴离子的立体构型为_______。另一种含硼的阴离子的结构如图所示,其中B原子的杂化方式为_______。
(3)GaN、GaP、GaAs熔融状态均不导电,据此判断它们是_______(填“共价”或“离子”)化合物,它们的晶体结构与金刚石相似,其熔点如下表所示,试分析GaN、CaP、GaAs熔点依次降低的原因:_______。
物质 GaN CaP GaAs
熔点/℃ 1700 1480 1238
(4)GaAs的晶胞结构如图甲所示,将Mn掺杂到GaAs的晶体中得到稀磁性半导体材料如图乙所示。
①图甲中,GaAs的相对分子质量为M,晶体密度为,表示阿伏加德罗常数的值,则晶胞中距离最近的两个Ga原子间距离为_______ nm(列出计算式)。
②图乙中掺杂Mn之后,晶体中Mn、Ga、As的原子个数比为_______。
24.如图为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为___________。
25.钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长为,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为___________,与K紧邻的O个数为___________。
(2)在晶胞结构的另一种表示中,Ⅰ处于各顶角位置,则K处于___________位置,O处于___________位置。
参考答案:
1.C
【解析】①金属的导电性是在外加电场的作用下,自由电子发生定向移动实现的,而金属阳离子并没有移动,因此①错误;
②金属键是金属阳离子和自由电子之间存在的强烈的相互作用,并非仅存在静电吸引作用,因此②错误;
③一般情况下,金属阳离子所带电荷数越多,半径越小,金属键越强,金属单质的熔、沸点越高,硬度越大,、、三种离子的半径依次减小、离子所带电荷数依次增多,金属键越来越强,因此③正确;
④金属键没有方向性和饱和性,所有电子在三维空间运动,属于整个金属,因此④正确;
故选:C。
2.C
【解析】A.反应产物N2、CO2中的正负电荷中心重合,均为非极性分子,选项A正确;
B.CO2、N2的结构式分别为O=C=O、NN ,双键、三键中有1个σ键,其余为键,则1mol 和1mol 含有的键数目之比为1:1,选项B正确;
C.由图示可知, 晶体中阴离子和阳离子的配位数分别为8和4,选项C错误;
D.若晶体的晶胞边长为anm,根据均摊法,晶胞中含有K+、S2-的数目分别为8、84,则该晶体的密度为=g·cm-3,选项D正确;
答案选C。
3.C
【解析】A.能将分子聚集在一起的作用力为分子间作用力,分子晶体中一定存在分子间作用力,故A正确;
B.共价晶体中只含有共价键,比如原子晶体含有共价键,共价晶体中一定不含离子键和金属键,故B正确;
C.晶体中若含有阳离子,不一定含有阴离子,比如金属晶体,含有阳离子和电子,故C错误;
D.单质的晶体中一定不存在离子键,有离子键必然有阳离子和阴离子,则一定为化合物,故D正确。
综上所述,答案为C。
4.D
【解析】A.该物质的化学式为C18,是由C元素组成的单质,故A错误;
B.该物质由C18分子构成,硬度小、熔点低,故B错误;
C.该物质是C元素组成的单质,乙炔是化合物,不是同系物,故C错误;
D.该物质与都是由C元素组成的不同单质,互为同素异形体,故D正确;
选D。
5.D
【解析】A.将C60和C70的混合物,加入一种空腔大小适合C60的杯酚中,杯酚像个碗似的、把C60装起来,不能装下C70,加入甲苯溶剂,甲苯将未装入碗里的C70溶解了,过滤后分离C70,再向不容物中加入氯仿,氯仿溶解杯酚而将不溶解的C60释放出来并沉淀——利用超分子的分子识别特征,利用杯酚、可以分离C60和C70,A正确;
B. 晶体具有自范性,晶体内部离子在微观空间呈周期性有序排列,使晶体具有各向异性,B正确;
C. 可通过X-射线衍射实验区分晶体和非晶体,例如:石英玻璃为非晶体,水晶的粉末是晶体,用X射线衍射摄取石英玻璃和水晶的粉末得到的图谱是不同的,C正确;
D.炭黑属于非晶体,D不正确;
答案选D。
6.A
【解析】①泡利不相容原理又称泡利原理,是指确定的-一个原子轨道上最多可容纳两个电子,而这两个电子的自旋方向必须相反,同时要遵循洪特规则,即电子分布到原子轨道时,优先以自旋相同的方式分别占据不同的轨道,因为这种排布方式原子的总能量最低,则氧原子的电子排布图:,最外层违背了洪特规则,故①错误;
②处于最低能量状态原子叫基态原子,处于高能级的原子或分子在向较低能级跃迁时产生辐射,将多余的能量发射出去形成的光谱叫发射光谱,1s22s22p→1s22s22p过程中,由于p能级有三个相同的轨道,能量大小相同,即Px=Py=Pz,不能形成的发射光谱,故②错误;
③因为O的非金属性比S大,所以H2O比H2S稳定,故③错误;
④第四周期元素中,未成对电子数最多的元素的基态原子中价电子排布式为3d54s1,为Cr元素,位于第四周期第VIB族,K、Cr元素之间有第ⅡA族、第ⅢB族、第IVB族、第VB族,所以第四周期未成对电子数最多的元素位于钾元素后面的第五位, 故④正确;
⑤氮元素和碳元素同周期,同周期从左至右原子半径依次减小,则氮原子半径小于碳原子半径, NCl3中N-Cl键的键长比CCl4中C-Cl键的键长短,故⑤正确;
⑥卤素氢化物中的HF分子间存在氢键,其熔沸点大于其他HCI、HBr、 HI,故⑥错误;
⑦主族元素原子的第一电离能、 电负性变化趋势基本-致,但电离能变化有特例,如第一电离能:ON,故⑦错误;
⑧虽然从重叠的角度分析,σ键重叠度比π键大,所以σ键比π键强度大,但N2分子中存在的N≡N键能比3个N-N键能大,也比一个N-N和一个N=N键能加起来要大,就说明N=N中的π键比σ键强,故⑧错误;
⑨晶胞是晶体中最小的重复单元,故⑨错误;
⑩只要中心原子均为sp2杂化,分子的空间结构为平面三角形,故⑩正确;
电负性指元素的原子在化合物中吸引电子能力的强弱,其变化规律与非金属性一致, 故可以用来判断非金属性强弱,故 正确;
故正确的是:④⑤⑩ ;
故答案为A。
7.B
【解析】A.卤族元素由上到下,单质的颜色逐渐加深,故A错误;
B.卤族元素由上到下,核电荷数逐渐增多,原子半径逐渐增大,原子核对外层电子的引力逐渐减小,H-X键的键能逐渐减小,HX电离出H+越来越容易,故氢卤酸的酸性依次增强,故B正确;
C.卤族元素单质都是分子晶体,组成结构相似,相对分子质量越大,范德华力越强,熔沸点越高,所以卤族元素单质的熔点随着核电荷数的增加逐渐升高,故C错误;
D.卤族元素非金属性随核电荷数增大而减弱,其单质的氧化性随核电荷数增大逐渐减弱,故D错误;
答案选B。
8.A
【解析】分子、原子都可以构成单质;所有金属单质都可以形成金属晶体;离子晶体是阴阳离子之间通过离子键形成的晶体,故不可能是单质构成的晶体。
故选A。
9.D
【解析】A.四种分子晶体的组成和结构相似,分子的相对分子质量越大,分子间作用力越大,则晶体的熔沸点越高,则晶体熔点由低到高; CF4<CCl4<CBr4, 故A正确;
B.先比较电荷数的晶格能大,而如果电荷数一样多比较核间距,核间距大的晶格能小,即离子半径小的晶格能大,则晶格能由大到小; NaF> NaCl> NaBr,故B正确;
C.原子半径Si > C>N ,三者都为原子晶体,原子半径越大,共价键的键能越小,则硬度越小,即硬度由大到小;刚石>碳化硅>晶体硅,故C正确;
D.Na、Mg、Al原子半径依次减小,属离子电荷逐渐增多,金属键逐渐增强,则熔点由高到低: Al> Mg > Na, 故D错误。
故选D。
10.A
【解析】A.磷化硼晶体是由原子通过共价键形成立体网状结构,属于共价晶体。由于共价键是一种强烈的相互作用,断裂消耗很高能量,因此该物质的熔点高、硬度大,A正确;
B.根据晶体结构可知:B原子配位数是4,P原子配位数也是4个,B错误;
C.磷化硼晶体是由B、P原子通过共价键形成立体网状结构,属于共价晶体,而不是原子晶体,C错误;
D.在BP晶体中,每个原子都是形成4个共价键,因此B、P原子的杂化类型都是sp3杂化,D错误;
故合理选项是A。
11.C
【解析】A.由表格中的信息可知,SiCl4熔点为-70℃,沸点57.6℃,故常温的时候为液体,A正确;
B.单质B的熔沸点很高,所以单质B是原子晶体,B正确;
C.这两者都是离子晶体,其中镁离子的半径小,氧离子半径较小,故氧化镁的晶格能大,熔沸点高,C错误;
D.离子晶体的离子键越强,熔沸点越高,由表中数据可以知道,NaCl的熔、沸点均比MgCl2高,所以NaCl晶体中的离子键应比MgCl2的强,D正确;
故选C。
12.D
【解析】A.2p和3p轨道形状均为哑铃形,但二者位于不同的能层,3p轨道的能量高于2p,A错误;
B.金属离子的电荷越多、半径越小,金属键越强,熔点越高,B错误;
C.石墨属于层状结构晶体,每层石墨原子间为共价键,层与层之间为分子间作用力,金刚石只含有共价键,因而石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏,C错误;
D.DNA分子的两条长链中的碱基以氢键互补配对形成双螺旋结构,DNA复制时,在有关酶的作用下,两条链的配对碱基之间的氢键断裂,碱基暴露出来,形成了两条模板链,以半保留的方式进行复制,使遗传信息得以精准复制,D正确;
综上所述答案为D。
13.A
【解析】A.碱金属元素的硬度从上到下依次变软,故顺序正确,A正确;
B.分子的沸点与相对分子质量有关,相对分子质量越大熔沸点越高,故正确的顺序为:CF4<CCl4<CBr4<CI4,B错误;
C.原子晶体的熔点与键长有关,键长越短,熔点越高,键长C-C<C-Si<Si-Si,故正确的顺序为:金刚石>碳化硅>晶体硅,C错误;
D.离子半径越小、离子键越强,则晶格能越大,F、Cl、Br、I的离子半径在增大,则晶格能由大到小:NaF>NaCl>NaBr>NaI,熔点由高到低顺序是NaF>NaCl>NaBr>NaI,D错误;
故选A。
14.D
【解析】A.结构相似的共价晶体,原子半径越小,则共价键的键长越短,键能越大,晶体的硬度和熔沸点越高,A正确;
B.某无色晶体能溶于水,则应不是金属晶体,质硬而脆,熔点为801℃,熔沸点较高,应不是分子晶体,熔化状态下能导电,应为离子晶体,B正确;
C.易溶于CS2,根据“相似相溶”原理推测应具有分子结构,液态时不导电,说明不是离子晶体或金属晶体,水溶液能导电,则应为分子晶体,C正确;
D.金属晶体不一定有较高的熔点,如金属晶体Hg,常温下为液体,熔点较低,D错误;
综上所述答案为D。
15.D
【解析】A.二氧化硫溶于水得到的溶液能导电,但电离出阴阳离子的物质是亚硫酸而不是二氧化硫,所以二氧化硫是非电解质,故A错误;
B.SO32-的价层电子对数为3+×(6+2 3×2)=4,故S原子的杂化类型为sp3杂化,但由于S有一对孤电子对,故其空间构型为三角锥,故B错误;
C.非金属性越强,电负性越大,同一主族元素从上到下电负性逐渐变小,则电负性O>S,故C错误;
D.在该晶胞中含有的Cu原子个数:8×+4×+1=4,含有的Fe原子个数为:4×+6×=4,含有的S原子个数为8个,故晶体的化学式为最简比即CuFeS2,故D正确;
故选:D。
16. 4 棱心、面心
【解析】①以体心的Zn为例,距离其最近且距离相等的原子有4个,所以配位数为4;
②结合晶胞结构示意图可知,若以以Ge为顶点的晶胞中,Zn原子位于棱心、面心。
17. 2 4
【解析】A晶胞中铁原子在8个顶点和1个中心,则含有铁原子是8×+1=2个;B晶胞中铁原子在8个顶点和6个面心,含有铁原子为8×+6×=4个。
18. ds 1s22s22p63s23p63d10或[Ar]3d10 sp2和sp3 极性分子 ZnX 该化合物是原子晶体,而干冰是分子晶体
【解析】(1)Zn元素是30号元素,位于周期表中的ds区,故答案为:ds ;
(2)Zn元素是30号元素,Zn原子的核外电子排布式为1s22s22p63s23p63d104s2,故Zn2+的基态电子排布式为1s22s22p63s23p63d10或[Ar]3d10,葡萄糖分子中-CHO中的C原子成2个单键、1个C=O,杂化轨道数为3,采取sp2杂化,其它C原子成4个单键,杂化轨道数为4,采取sp3杂化;故答案为:1s22s22p63s23p63d10或[Ar]3d10;sp2和sp3;
(3)NH3分子呈三角锥形,N原子最外层有一对未成键电子,是极性分子。在[Zn(NH3)4]2+中,Zn2+有空轨道,N有孤对电子,Zn2+与NH3分子之间存在配位键,故答案为:极性分子;;
(4)由晶胞结构可知,晶胞中Zn原子处于晶胞内部,晶胞中含有4个Zn原子,X原子处于顶点与面心,晶胞中X原子数目为8×+6×=4,故该化合物化学式为ZnX,晶胞中Zn和X通过共价键结合,故该晶体通过共价键形成的空间网状结构,属于原子晶体,干冰属于分子晶体,故该化合物的熔点比干冰高,故答案为:ZnX;该化合物是原子晶体,而干冰是分子晶体。
19.分子晶体
【解析】常温常压下为无色液体,说明其熔点很低,可推知其为分子晶体。
20. 金属晶体 金属键 离子晶体 离子键 原子晶体 共价键 分子晶体 分子间作用力 > < > <
【解析】(1)Fe是常见金属单质,属于金属晶体,金属晶体中的作用力为金属键;
NaBr由和构成,熔点较高,属于离子晶体,离子晶体中的作用力为离子键;
SiC由Si原子和C原子构成,熔点非常高,属于原子晶体,原子晶体中原子间的作用力为共价键;
BCl3由分子构成,熔点很低,属于分子晶体,分子晶体中的作用力为分子间作用力;
(2)①Li和K都是金属晶体,Li原子和K原子的最外层电子数相同,而Li原子半径更小,因而Li的金属键更强;
②KCl和NaCl是堆积方式相同的离子晶体,半径更大,因而KCl的晶格能更小;
③SiO2是原子晶体,SO2是分子晶体,原子晶体的熔点高得多;
④CH4是非极性分子,HCl和H2O都是极性分子,根据相似相容,HCl和H2O之间的作用力比CH4和H2O之间强得多,因而HCl的溶解度更大。
21. ②⑤⑥⑧⑨ ①③④⑦⑩ 规则的几何外形 没有规则的几何外形 各向同性 各向异性 ②④
【解析】(1)明矾是KAl(SO4)2·12H2O,它和CuSO4·5H2O、冰糖、单晶硅、铝块都是晶体,即②⑤⑥⑧⑨;塑料、松香、玻璃、石蜡、橡胶都是非晶体,即①③④⑦⑩;
(2)晶体和非晶体在外形上有差别,晶体都具有规则的几何外形;而非晶体没有规则的几何外形;另外非晶体具有物理性质各向同性的特点,而晶体具有物理性质各向异性的特点;
(3)晶体的重要特征就是各向异性和有固定的熔点,因此判断物质是晶体还是非晶体可②从各向异性或各向同性上来判断,④从有无固定熔点来判,即②④。
22. Ti4+
【解析】距离最近的是处于面心的,的配位数为6,图(a)中的配位数也为6,其与图(b)中的空间位置相同;
根据均摊法,1个晶胞中含有的个数为,;的个数为,的个数为1,化学式为,摩尔质量为,一个晶胞的质量为,体积为,则晶体密度为。
23.(1)B
(2) 正四面体形 、
(3) 共价 它们均为原子(共价)晶体,由于N,P、As的原子半径依次增大,故Ga-N、Ga-P、Ga-As的键长依次增大,共价键越长键能越小,故导致GaN、GaP、GaAs熔点依次降低
(4) 5:27:32
【解析】(1)由题干信息可知,A、B中只有一个4s上的电子跃近到4p上,C,D中有两个4s上的电子跃迁到4p上,故A、B需要的能量小于C、D,而A中4p上的2个电子占有一个轨道,B中4p上的2个电子分别占有不同的轨道,故B的能量比A低,故B所示发生的跃迁所需能量最低,故答案为B;
(2)的杂化轨道数=4,采用sp3杂化,杂化轨道空间现状为正四面体型,B周围孤电子对数为0,故其空间构型与杂化轨道空间现状相同为正四面体型,由图可知该结构上、下两个位置的B周围有四个氧,其杂化轨道数为4,故这两个位置B为sp3杂化,左右两边的B周围有三个氧,其杂化轨道数为3,是sp2杂化,故B原子的杂化方式有sp3和sp2。
(3)GaN、GaP、GaAs熔融状态均不导电,说明它们中没有那、阳离子,故据此判新它们是共价化合物,它们的晶体结构与金刚石相似,说明它们均为原子(共价)晶体,GaN、GaP、GaAs熔点分别为1700℃、1480℃、1238℃,且N、P、As原子半径增大,Ga-N 、Ga-P、Ga-As键长逐渐增大,键能减小,断裂化学键需要的能量小,因此熔点降低;
(4)用均摊法计算,有8个Ga元素的微粒处于顶点,同时为8个晶胞所共享,每个微粒有属于该晶胞;有6个Ga元素的微粒处于面心,同时为2个晶胞所共享,每个微粒有,属于该晶胞Ga元素的微粒总数为;有4个As元素的微粒处于晶胞内部,都属于该晶胞;图甲中,GaAs的相对分于质量为M,晶体密度为,表示阿伏加德罗常数的值,则晶胞边长为,图可知晶胞中距离最近的两个Ga原子间距离为面对角线的一半,故有。掺杂Mn原子后,原来As原子个数不变,任为4,将一个顶点的Ga原子和一个面心的Ga原子替换成Mn原子,故Mn原子个数为,Ga原子数变为,晶体中Mn、Ga、As的原子个数比为。
【点睛】本题考查化学选修3《物质结构与性质》的相关知识,以填空方式考查,常涉及如下高频考点:原子结构与元素的性质(基态微粒的电子排布式、电离能及电负性的比较)、元素周期律;分子结构与性质(化学键类型、原子的杂化方式、分子空间构型的分析与判断);晶体结构与性质(晶体类型、性质及与粒子间作用的关系、以晶胞为单位的密度、微粒间距与微粒质量的关系计算及化学式分析等)。只有掌握这些,才可以更好的解决物质结构的问题。
24.S8相对分子质量大,分子间范德华力强
【解析】分子晶体熔沸点与范德华力成正比,范德华力与相对分子质量成正比,据此分析解答。
【解析】S8和二氧化硫都是分子晶体,S8相对分子质量大于SO2,所以分子间作用力:S8大于SO2,则S8熔点和沸点要比二氧化硫的熔点和沸点高很多,故答案为:S8相对分子质量大,分子间范德华力强。
25. 0.315 12 体心 棱心
【解析】(1)二者间的最短距离为晶胞面对角线长的一半,即。O位于面心,K位于定点,则与钾紧邻的氧原子有12个。
(2)在KIO3晶胞结构的另一种表示中,I位于各顶角位置,个数为8=1,则K也为1个,应为于体心,O处于棱心。
一、单选题
1.下列关于金属键或金属的性质说法正确的是
①金属的导电性是由金属阳离子和自由电子的定向移动实现的
②金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
③、、的沸点依次升高
④金属键没有方向性和饱和性,金属中的电子在整个三维空间运动,属于整个金属
A.①② B.②③ C.③④ D.①④
2.我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时发生的反应为2KNO3+S+3CK2S+N2↑+3CO2↑。生成物K2S的晶体结构如图。
下列有关说法错误的是
A.反应产物中有两种非极性分子
B.1molCO2和1molN2含有的π键数目之比为1:1
C.K2S晶体中阴、阳离子的配位数分别为4和8
D.若K2S晶体的晶胞边长为anm,则该晶体的密度为g·cm-3
3.下列说法错误的是
A.分子晶体中一定存在分子间作用力
B.共价晶体中只含有共价键
C.任何晶体中,若含有阳离子就一定含有阴离子
D.单质的晶体中一定不存在离子键
4.科研人员研制出由18个碳原子构成的环碳分子(如图所示),下列说法正确的是
A.是一种共价化合物 B.硬度大、熔点高
C.与乙炔互为同系物 D.与互为同素异形体
5.关于晶体,下列有关叙述不正确的是
A.利用超分子的分子识别特征,可以分离C60和C70
B.晶体内部离子在微观空间呈周期性有序排列,使晶体具有各向异性
C.可通过X-射线衍射实验区分晶体和非晶体
D.“硅-炭黑晶体管”为一种新型材料,硅、炭黑均属于晶体
6.下列叙述中正确的个数有
①氧原子的电子排布图:最外层违背了泡利原理
②处于最低能量状态原子叫基态原子,1s22s22p→1s22s22p过程中形成的是发射光谱
③H2O比H2S稳定是因为水分子间存在氢键
④第四周期元素中,未成对电子数最多的元素位于钾元素后面第五位
⑤NCl3中N-Cl键的键长比CCl4中C-Cl键的键长短
⑥卤素单质、卤素氢化物、卤素碳化物(CX4)的熔、沸点均随着相对分子质量的增大而升高
⑦主族元素的电负性越大,其元素原子的第一电离能一定越大
⑧在任何情况下,都是σ键比π键强度大
⑨晶胞是晶体中最小的平行六面体
⑩只要分子的空间结构为平面三角形,中心原子均为sp2杂化
电负性的大小可以作为判断元素非金属性强弱的依据
A.4个 B.1个 C.2个 D.3个
7.卤族元素随核电荷数的增加,下列叙述正确的是
A.单质的颜色逐渐变浅 B.氢卤酸的酸性逐渐增强
C.单质的熔点逐渐降低 D.单质的氧化性逐渐增强
8.单质不可能形成
A.离子晶体 B.原子晶体 C.分子晶体 D.金属晶体
9.下面的排序不正确的是
A.晶体沸点由低到高:CF4<CCl4<CBr4 B.晶格能由大到小: NaF> NaCl> NaBr
C.硬度由大到小:金刚石>碳化硅>晶体硅 D.熔点由高到低:Na>Mg>Al
10.磷化硼(BP)有良好的透光性,用于光学吸收的研究及用作超硬的无机材料等。其晶胞结构如下图所示,下列有关说法正确的是
A.磷化硼晶体的熔点高、硬度大
B.B配位数是4,P的配位数是2
C.BP属于离子晶体
D.B的杂化方式为sp2,P的杂化方式为sp3
11.几种物质的熔点和沸点的数据如表,下列有关判断错误的是
NaCl MgCl2 AlCl3 SiCl4 单质M
熔点/℃ 801 712 190 -70 2300
沸点/℃ 1465 1412 178 57.6 2500
注:AlCl3的熔点在2.02×105Pa条件下测定。A.常温下,SiCl4为液态 B.单质M可能是共价晶体
C.熔沸点:MgO
12.下列说法正确的是
A.2p和3p轨道形状均为哑铃形,能量也相等
B.金属离子的电荷越多、半径越小,金属晶体的熔点越低
C.石墨转化为金刚石既有共价键的断裂和生成,没有破坏分子间作用力
D.DNA分子两条长链中的碱基以氢键互补配对形成双螺旋结构,使遗传信息得以精准复制
13.下列各组物质的性质排序正确的是
A.硬度:Li>Na>K>Rb
B.沸点:CF4>CCl4>CBr4>CI4
C.熔点:碳化硅<晶体硅<金刚石
D.熔点:NaF <NaCl<NaBr<NaI
14.晶体的性质与晶体类型密切相关,下列关于晶体的描述不正确的是
A.结构相似的共价晶体,原子半径越小,晶体的硬度和熔沸点越高
B.某无色晶体能溶于水,质硬而脆,熔点为801℃,熔化状态下能导电,则该晶体可能为离子晶体
C.易溶于CS2,液态时不导电,水溶液能导电的晶体为分子晶体
D.含有阳离子的晶体不一定是金属晶体,金属晶体都具有较高的熔点、良好的导电性和延展性
15.下列有关说法正确的是
A.SO2溶于水所得溶液能导电,所以SO2是电解质
B.的空间构型为平面三角形
C.电负性:O
二、填空题
16.ZnGeP2和KTiOPO4都是非线性光学晶体材料,在激光技术方面有广泛用途。回答下列问题:
以Zn为顶点的ZnGeP2晶胞结构如图所示。
①Zn的配位数为___________ 。
②以Ge为顶点的晶胞中,Zn原子位于___________。
17.因生产金属铁的工艺和温度等因素不同,产生的铁单质的晶体结构、密度和性质均不同,对铁晶体用X射线衍射进行测定,测得A、B两种晶胞,其晶胞结构示意图如下:
则A、B两种晶胞中含有的铁原子数分别是:___________、___________个。
18.锌是一种重要的过渡金属,锌及其化合物有着广泛的应用。
(1)指出锌在周期表中的_______区。
(2)葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式_______;葡萄糖分子中碳原子的杂化方式有_______。
(3)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体:NH3分子属于_______(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,NH3位于正四面体的顶点,试在图甲中表示[Zn(NH3)4]2+中Zn2+与NH3之间的化学键_____________。
(4)图乙表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为_______;该化合物晶体的熔点比干冰高得多,原因是_______。
19.Sn为ⅣA族元素,单质Sn与干燥反应生成。常温常压下为无色液体,其固体的晶体类型为_______。
20.(1)判断下列物质所属的晶体类型和微粒间相互作用。
物质 熔点/℃ 晶体类型 微粒间相互作用
Fe 1535 _______ _______
NaBr 755 _______ _______
SiC 2830 _______ _______
-107 _______ _______
(2)用“>”“<”或“”填空。
①金属键的强弱:Li_______K。
②晶格能的大小:KCl_______NaCl。
③晶体熔点的高低:SiO2_______SO2。
④水溶性的大小:CH4_______HCl。
21.(1)在下列物质中,_______(填序号,下同)是晶体,_______是非晶体。
①塑料 ②明矾 ③松香 ④玻璃 ⑤CuSO4·5H2O ⑥冰糖 ⑦石蜡 ⑧单晶硅 ⑨铝块 ⑩橡胶
(2)晶体和非晶体在外形上有差别,晶体都具有__________,而非晶体______________;另外非晶体具有物理性质__________的特点,而晶体具有物理性质__________的特点。
(3)判断物质是晶体还是非晶体,比较正确的方法是__________(填序号)。
①从外形上来判断
②从各向异性或各向同性上来判断
③从导电性能来判断
④从有无固定熔点来判断
22.一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子CH3NH,其晶胞如图(b)所示。其中Pb2+与图(a)中_______的空间位置相同;若晶胞参数为a nm,则晶体密度为_______ g/cm3 (列出计算式,设NA为阿伏加德罗常数的值)。
23.GaN是研制微电子器件、光电子器件的第三代半导体材料。
(1)基态Ga的核外电子排布为,转化为下列激发态时所需能量最少的是_______(填标号)。
A. B.
C. D.
(2)与家同主族的B具有缺电子性,硼氢化钠()是有机合成中重要的还原剂,其阴离子的立体构型为_______。另一种含硼的阴离子的结构如图所示,其中B原子的杂化方式为_______。
(3)GaN、GaP、GaAs熔融状态均不导电,据此判断它们是_______(填“共价”或“离子”)化合物,它们的晶体结构与金刚石相似,其熔点如下表所示,试分析GaN、CaP、GaAs熔点依次降低的原因:_______。
物质 GaN CaP GaAs
熔点/℃ 1700 1480 1238
(4)GaAs的晶胞结构如图甲所示,将Mn掺杂到GaAs的晶体中得到稀磁性半导体材料如图乙所示。
①图甲中,GaAs的相对分子质量为M,晶体密度为,表示阿伏加德罗常数的值,则晶胞中距离最近的两个Ga原子间距离为_______ nm(列出计算式)。
②图乙中掺杂Mn之后,晶体中Mn、Ga、As的原子个数比为_______。
24.如图为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为___________。
25.钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长为,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为___________,与K紧邻的O个数为___________。
(2)在晶胞结构的另一种表示中,Ⅰ处于各顶角位置,则K处于___________位置,O处于___________位置。
参考答案:
1.C
【解析】①金属的导电性是在外加电场的作用下,自由电子发生定向移动实现的,而金属阳离子并没有移动,因此①错误;
②金属键是金属阳离子和自由电子之间存在的强烈的相互作用,并非仅存在静电吸引作用,因此②错误;
③一般情况下,金属阳离子所带电荷数越多,半径越小,金属键越强,金属单质的熔、沸点越高,硬度越大,、、三种离子的半径依次减小、离子所带电荷数依次增多,金属键越来越强,因此③正确;
④金属键没有方向性和饱和性,所有电子在三维空间运动,属于整个金属,因此④正确;
故选:C。
2.C
【解析】A.反应产物N2、CO2中的正负电荷中心重合,均为非极性分子,选项A正确;
B.CO2、N2的结构式分别为O=C=O、NN ,双键、三键中有1个σ键,其余为键,则1mol 和1mol 含有的键数目之比为1:1,选项B正确;
C.由图示可知, 晶体中阴离子和阳离子的配位数分别为8和4,选项C错误;
D.若晶体的晶胞边长为anm,根据均摊法,晶胞中含有K+、S2-的数目分别为8、84,则该晶体的密度为=g·cm-3,选项D正确;
答案选C。
3.C
【解析】A.能将分子聚集在一起的作用力为分子间作用力,分子晶体中一定存在分子间作用力,故A正确;
B.共价晶体中只含有共价键,比如原子晶体含有共价键,共价晶体中一定不含离子键和金属键,故B正确;
C.晶体中若含有阳离子,不一定含有阴离子,比如金属晶体,含有阳离子和电子,故C错误;
D.单质的晶体中一定不存在离子键,有离子键必然有阳离子和阴离子,则一定为化合物,故D正确。
综上所述,答案为C。
4.D
【解析】A.该物质的化学式为C18,是由C元素组成的单质,故A错误;
B.该物质由C18分子构成,硬度小、熔点低,故B错误;
C.该物质是C元素组成的单质,乙炔是化合物,不是同系物,故C错误;
D.该物质与都是由C元素组成的不同单质,互为同素异形体,故D正确;
选D。
5.D
【解析】A.将C60和C70的混合物,加入一种空腔大小适合C60的杯酚中,杯酚像个碗似的、把C60装起来,不能装下C70,加入甲苯溶剂,甲苯将未装入碗里的C70溶解了,过滤后分离C70,再向不容物中加入氯仿,氯仿溶解杯酚而将不溶解的C60释放出来并沉淀——利用超分子的分子识别特征,利用杯酚、可以分离C60和C70,A正确;
B. 晶体具有自范性,晶体内部离子在微观空间呈周期性有序排列,使晶体具有各向异性,B正确;
C. 可通过X-射线衍射实验区分晶体和非晶体,例如:石英玻璃为非晶体,水晶的粉末是晶体,用X射线衍射摄取石英玻璃和水晶的粉末得到的图谱是不同的,C正确;
D.炭黑属于非晶体,D不正确;
答案选D。
6.A
【解析】①泡利不相容原理又称泡利原理,是指确定的-一个原子轨道上最多可容纳两个电子,而这两个电子的自旋方向必须相反,同时要遵循洪特规则,即电子分布到原子轨道时,优先以自旋相同的方式分别占据不同的轨道,因为这种排布方式原子的总能量最低,则氧原子的电子排布图:,最外层违背了洪特规则,故①错误;
②处于最低能量状态原子叫基态原子,处于高能级的原子或分子在向较低能级跃迁时产生辐射,将多余的能量发射出去形成的光谱叫发射光谱,1s22s22p→1s22s22p过程中,由于p能级有三个相同的轨道,能量大小相同,即Px=Py=Pz,不能形成的发射光谱,故②错误;
③因为O的非金属性比S大,所以H2O比H2S稳定,故③错误;
④第四周期元素中,未成对电子数最多的元素的基态原子中价电子排布式为3d54s1,为Cr元素,位于第四周期第VIB族,K、Cr元素之间有第ⅡA族、第ⅢB族、第IVB族、第VB族,所以第四周期未成对电子数最多的元素位于钾元素后面的第五位, 故④正确;
⑤氮元素和碳元素同周期,同周期从左至右原子半径依次减小,则氮原子半径小于碳原子半径, NCl3中N-Cl键的键长比CCl4中C-Cl键的键长短,故⑤正确;
⑥卤素氢化物中的HF分子间存在氢键,其熔沸点大于其他HCI、HBr、 HI,故⑥错误;
⑦主族元素原子的第一电离能、 电负性变化趋势基本-致,但电离能变化有特例,如第一电离能:O
⑧虽然从重叠的角度分析,σ键重叠度比π键大,所以σ键比π键强度大,但N2分子中存在的N≡N键能比3个N-N键能大,也比一个N-N和一个N=N键能加起来要大,就说明N=N中的π键比σ键强,故⑧错误;
⑨晶胞是晶体中最小的重复单元,故⑨错误;
⑩只要中心原子均为sp2杂化,分子的空间结构为平面三角形,故⑩正确;
电负性指元素的原子在化合物中吸引电子能力的强弱,其变化规律与非金属性一致, 故可以用来判断非金属性强弱,故 正确;
故正确的是:④⑤⑩ ;
故答案为A。
7.B
【解析】A.卤族元素由上到下,单质的颜色逐渐加深,故A错误;
B.卤族元素由上到下,核电荷数逐渐增多,原子半径逐渐增大,原子核对外层电子的引力逐渐减小,H-X键的键能逐渐减小,HX电离出H+越来越容易,故氢卤酸的酸性依次增强,故B正确;
C.卤族元素单质都是分子晶体,组成结构相似,相对分子质量越大,范德华力越强,熔沸点越高,所以卤族元素单质的熔点随着核电荷数的增加逐渐升高,故C错误;
D.卤族元素非金属性随核电荷数增大而减弱,其单质的氧化性随核电荷数增大逐渐减弱,故D错误;
答案选B。
8.A
【解析】分子、原子都可以构成单质;所有金属单质都可以形成金属晶体;离子晶体是阴阳离子之间通过离子键形成的晶体,故不可能是单质构成的晶体。
故选A。
9.D
【解析】A.四种分子晶体的组成和结构相似,分子的相对分子质量越大,分子间作用力越大,则晶体的熔沸点越高,则晶体熔点由低到高; CF4<CCl4<CBr4, 故A正确;
B.先比较电荷数的晶格能大,而如果电荷数一样多比较核间距,核间距大的晶格能小,即离子半径小的晶格能大,则晶格能由大到小; NaF> NaCl> NaBr,故B正确;
C.原子半径Si > C>N ,三者都为原子晶体,原子半径越大,共价键的键能越小,则硬度越小,即硬度由大到小;刚石>碳化硅>晶体硅,故C正确;
D.Na、Mg、Al原子半径依次减小,属离子电荷逐渐增多,金属键逐渐增强,则熔点由高到低: Al> Mg > Na, 故D错误。
故选D。
10.A
【解析】A.磷化硼晶体是由原子通过共价键形成立体网状结构,属于共价晶体。由于共价键是一种强烈的相互作用,断裂消耗很高能量,因此该物质的熔点高、硬度大,A正确;
B.根据晶体结构可知:B原子配位数是4,P原子配位数也是4个,B错误;
C.磷化硼晶体是由B、P原子通过共价键形成立体网状结构,属于共价晶体,而不是原子晶体,C错误;
D.在BP晶体中,每个原子都是形成4个共价键,因此B、P原子的杂化类型都是sp3杂化,D错误;
故合理选项是A。
11.C
【解析】A.由表格中的信息可知,SiCl4熔点为-70℃,沸点57.6℃,故常温的时候为液体,A正确;
B.单质B的熔沸点很高,所以单质B是原子晶体,B正确;
C.这两者都是离子晶体,其中镁离子的半径小,氧离子半径较小,故氧化镁的晶格能大,熔沸点高,C错误;
D.离子晶体的离子键越强,熔沸点越高,由表中数据可以知道,NaCl的熔、沸点均比MgCl2高,所以NaCl晶体中的离子键应比MgCl2的强,D正确;
故选C。
12.D
【解析】A.2p和3p轨道形状均为哑铃形,但二者位于不同的能层,3p轨道的能量高于2p,A错误;
B.金属离子的电荷越多、半径越小,金属键越强,熔点越高,B错误;
C.石墨属于层状结构晶体,每层石墨原子间为共价键,层与层之间为分子间作用力,金刚石只含有共价键,因而石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏,C错误;
D.DNA分子的两条长链中的碱基以氢键互补配对形成双螺旋结构,DNA复制时,在有关酶的作用下,两条链的配对碱基之间的氢键断裂,碱基暴露出来,形成了两条模板链,以半保留的方式进行复制,使遗传信息得以精准复制,D正确;
综上所述答案为D。
13.A
【解析】A.碱金属元素的硬度从上到下依次变软,故顺序正确,A正确;
B.分子的沸点与相对分子质量有关,相对分子质量越大熔沸点越高,故正确的顺序为:CF4<CCl4<CBr4<CI4,B错误;
C.原子晶体的熔点与键长有关,键长越短,熔点越高,键长C-C<C-Si<Si-Si,故正确的顺序为:金刚石>碳化硅>晶体硅,C错误;
D.离子半径越小、离子键越强,则晶格能越大,F、Cl、Br、I的离子半径在增大,则晶格能由大到小:NaF>NaCl>NaBr>NaI,熔点由高到低顺序是NaF>NaCl>NaBr>NaI,D错误;
故选A。
14.D
【解析】A.结构相似的共价晶体,原子半径越小,则共价键的键长越短,键能越大,晶体的硬度和熔沸点越高,A正确;
B.某无色晶体能溶于水,则应不是金属晶体,质硬而脆,熔点为801℃,熔沸点较高,应不是分子晶体,熔化状态下能导电,应为离子晶体,B正确;
C.易溶于CS2,根据“相似相溶”原理推测应具有分子结构,液态时不导电,说明不是离子晶体或金属晶体,水溶液能导电,则应为分子晶体,C正确;
D.金属晶体不一定有较高的熔点,如金属晶体Hg,常温下为液体,熔点较低,D错误;
综上所述答案为D。
15.D
【解析】A.二氧化硫溶于水得到的溶液能导电,但电离出阴阳离子的物质是亚硫酸而不是二氧化硫,所以二氧化硫是非电解质,故A错误;
B.SO32-的价层电子对数为3+×(6+2 3×2)=4,故S原子的杂化类型为sp3杂化,但由于S有一对孤电子对,故其空间构型为三角锥,故B错误;
C.非金属性越强,电负性越大,同一主族元素从上到下电负性逐渐变小,则电负性O>S,故C错误;
D.在该晶胞中含有的Cu原子个数:8×+4×+1=4,含有的Fe原子个数为:4×+6×=4,含有的S原子个数为8个,故晶体的化学式为最简比即CuFeS2,故D正确;
故选:D。
16. 4 棱心、面心
【解析】①以体心的Zn为例,距离其最近且距离相等的原子有4个,所以配位数为4;
②结合晶胞结构示意图可知,若以以Ge为顶点的晶胞中,Zn原子位于棱心、面心。
17. 2 4
【解析】A晶胞中铁原子在8个顶点和1个中心,则含有铁原子是8×+1=2个;B晶胞中铁原子在8个顶点和6个面心,含有铁原子为8×+6×=4个。
18. ds 1s22s22p63s23p63d10或[Ar]3d10 sp2和sp3 极性分子 ZnX 该化合物是原子晶体,而干冰是分子晶体
【解析】(1)Zn元素是30号元素,位于周期表中的ds区,故答案为:ds ;
(2)Zn元素是30号元素,Zn原子的核外电子排布式为1s22s22p63s23p63d104s2,故Zn2+的基态电子排布式为1s22s22p63s23p63d10或[Ar]3d10,葡萄糖分子中-CHO中的C原子成2个单键、1个C=O,杂化轨道数为3,采取sp2杂化,其它C原子成4个单键,杂化轨道数为4,采取sp3杂化;故答案为:1s22s22p63s23p63d10或[Ar]3d10;sp2和sp3;
(3)NH3分子呈三角锥形,N原子最外层有一对未成键电子,是极性分子。在[Zn(NH3)4]2+中,Zn2+有空轨道,N有孤对电子,Zn2+与NH3分子之间存在配位键,故答案为:极性分子;;
(4)由晶胞结构可知,晶胞中Zn原子处于晶胞内部,晶胞中含有4个Zn原子,X原子处于顶点与面心,晶胞中X原子数目为8×+6×=4,故该化合物化学式为ZnX,晶胞中Zn和X通过共价键结合,故该晶体通过共价键形成的空间网状结构,属于原子晶体,干冰属于分子晶体,故该化合物的熔点比干冰高,故答案为:ZnX;该化合物是原子晶体,而干冰是分子晶体。
19.分子晶体
【解析】常温常压下为无色液体,说明其熔点很低,可推知其为分子晶体。
20. 金属晶体 金属键 离子晶体 离子键 原子晶体 共价键 分子晶体 分子间作用力 > < > <
【解析】(1)Fe是常见金属单质,属于金属晶体,金属晶体中的作用力为金属键;
NaBr由和构成,熔点较高,属于离子晶体,离子晶体中的作用力为离子键;
SiC由Si原子和C原子构成,熔点非常高,属于原子晶体,原子晶体中原子间的作用力为共价键;
BCl3由分子构成,熔点很低,属于分子晶体,分子晶体中的作用力为分子间作用力;
(2)①Li和K都是金属晶体,Li原子和K原子的最外层电子数相同,而Li原子半径更小,因而Li的金属键更强;
②KCl和NaCl是堆积方式相同的离子晶体,半径更大,因而KCl的晶格能更小;
③SiO2是原子晶体,SO2是分子晶体,原子晶体的熔点高得多;
④CH4是非极性分子,HCl和H2O都是极性分子,根据相似相容,HCl和H2O之间的作用力比CH4和H2O之间强得多,因而HCl的溶解度更大。
21. ②⑤⑥⑧⑨ ①③④⑦⑩ 规则的几何外形 没有规则的几何外形 各向同性 各向异性 ②④
【解析】(1)明矾是KAl(SO4)2·12H2O,它和CuSO4·5H2O、冰糖、单晶硅、铝块都是晶体,即②⑤⑥⑧⑨;塑料、松香、玻璃、石蜡、橡胶都是非晶体,即①③④⑦⑩;
(2)晶体和非晶体在外形上有差别,晶体都具有规则的几何外形;而非晶体没有规则的几何外形;另外非晶体具有物理性质各向同性的特点,而晶体具有物理性质各向异性的特点;
(3)晶体的重要特征就是各向异性和有固定的熔点,因此判断物质是晶体还是非晶体可②从各向异性或各向同性上来判断,④从有无固定熔点来判,即②④。
22. Ti4+
【解析】距离最近的是处于面心的,的配位数为6,图(a)中的配位数也为6,其与图(b)中的空间位置相同;
根据均摊法,1个晶胞中含有的个数为,;的个数为,的个数为1,化学式为,摩尔质量为,一个晶胞的质量为,体积为,则晶体密度为。
23.(1)B
(2) 正四面体形 、
(3) 共价 它们均为原子(共价)晶体,由于N,P、As的原子半径依次增大,故Ga-N、Ga-P、Ga-As的键长依次增大,共价键越长键能越小,故导致GaN、GaP、GaAs熔点依次降低
(4) 5:27:32
【解析】(1)由题干信息可知,A、B中只有一个4s上的电子跃近到4p上,C,D中有两个4s上的电子跃迁到4p上,故A、B需要的能量小于C、D,而A中4p上的2个电子占有一个轨道,B中4p上的2个电子分别占有不同的轨道,故B的能量比A低,故B所示发生的跃迁所需能量最低,故答案为B;
(2)的杂化轨道数=4,采用sp3杂化,杂化轨道空间现状为正四面体型,B周围孤电子对数为0,故其空间构型与杂化轨道空间现状相同为正四面体型,由图可知该结构上、下两个位置的B周围有四个氧,其杂化轨道数为4,故这两个位置B为sp3杂化,左右两边的B周围有三个氧,其杂化轨道数为3,是sp2杂化,故B原子的杂化方式有sp3和sp2。
(3)GaN、GaP、GaAs熔融状态均不导电,说明它们中没有那、阳离子,故据此判新它们是共价化合物,它们的晶体结构与金刚石相似,说明它们均为原子(共价)晶体,GaN、GaP、GaAs熔点分别为1700℃、1480℃、1238℃,且N、P、As原子半径增大,Ga-N 、Ga-P、Ga-As键长逐渐增大,键能减小,断裂化学键需要的能量小,因此熔点降低;
(4)用均摊法计算,有8个Ga元素的微粒处于顶点,同时为8个晶胞所共享,每个微粒有属于该晶胞;有6个Ga元素的微粒处于面心,同时为2个晶胞所共享,每个微粒有,属于该晶胞Ga元素的微粒总数为;有4个As元素的微粒处于晶胞内部,都属于该晶胞;图甲中,GaAs的相对分于质量为M,晶体密度为,表示阿伏加德罗常数的值,则晶胞边长为,图可知晶胞中距离最近的两个Ga原子间距离为面对角线的一半,故有。掺杂Mn原子后,原来As原子个数不变,任为4,将一个顶点的Ga原子和一个面心的Ga原子替换成Mn原子,故Mn原子个数为,Ga原子数变为,晶体中Mn、Ga、As的原子个数比为。
【点睛】本题考查化学选修3《物质结构与性质》的相关知识,以填空方式考查,常涉及如下高频考点:原子结构与元素的性质(基态微粒的电子排布式、电离能及电负性的比较)、元素周期律;分子结构与性质(化学键类型、原子的杂化方式、分子空间构型的分析与判断);晶体结构与性质(晶体类型、性质及与粒子间作用的关系、以晶胞为单位的密度、微粒间距与微粒质量的关系计算及化学式分析等)。只有掌握这些,才可以更好的解决物质结构的问题。
24.S8相对分子质量大,分子间范德华力强
【解析】分子晶体熔沸点与范德华力成正比,范德华力与相对分子质量成正比,据此分析解答。
【解析】S8和二氧化硫都是分子晶体,S8相对分子质量大于SO2,所以分子间作用力:S8大于SO2,则S8熔点和沸点要比二氧化硫的熔点和沸点高很多,故答案为:S8相对分子质量大,分子间范德华力强。
25. 0.315 12 体心 棱心
【解析】(1)二者间的最短距离为晶胞面对角线长的一半,即。O位于面心,K位于定点,则与钾紧邻的氧原子有12个。
(2)在KIO3晶胞结构的另一种表示中,I位于各顶角位置,个数为8=1,则K也为1个,应为于体心,O处于棱心。
