9.3溶解度同步练习京改版化学九年级下册(含答案)
文档属性
| 名称 | 9.3溶解度同步练习京改版化学九年级下册(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 129.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-21 19:12:09 | ||
图片预览


文档简介
9.3溶解度同步练习京改版化学九年级下册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.NH4Cl和KNO3的溶解度曲线如图所示。下列说法错误的是
A.KNO3的溶解度随温度的升高而增大
B.t1℃时,NH4Cl和KNO3的溶解度相等
C.KNO3中混有少量的NH4Cl,可用降温结晶的方法提纯KNO3
D.t2℃时,等质量的KNO3和NH4Cl分别配制成饱和溶液,需要水的质量相等
2.下列关于溶液的说法正确的是
A.溶液一定是无色透明的液体
B.饱和溶液降温后都有溶质结晶析出
C.碘酒溶液中,碘是溶质,酒精是溶剂
D.水加入蔗糖后形成溶液,导电性明显增强
3.下图是A、B两物质的溶解度曲线,下列信息中,正确的是
A.t1℃时,A、B两物质溶解度相同
B.t2℃时,A物质的饱和溶液中溶质的质量分数为55%
C.除去固体A中的少量杂质B可采取蒸发结晶法
D.图中阴影部分表明A、B两溶液都是饱和溶液
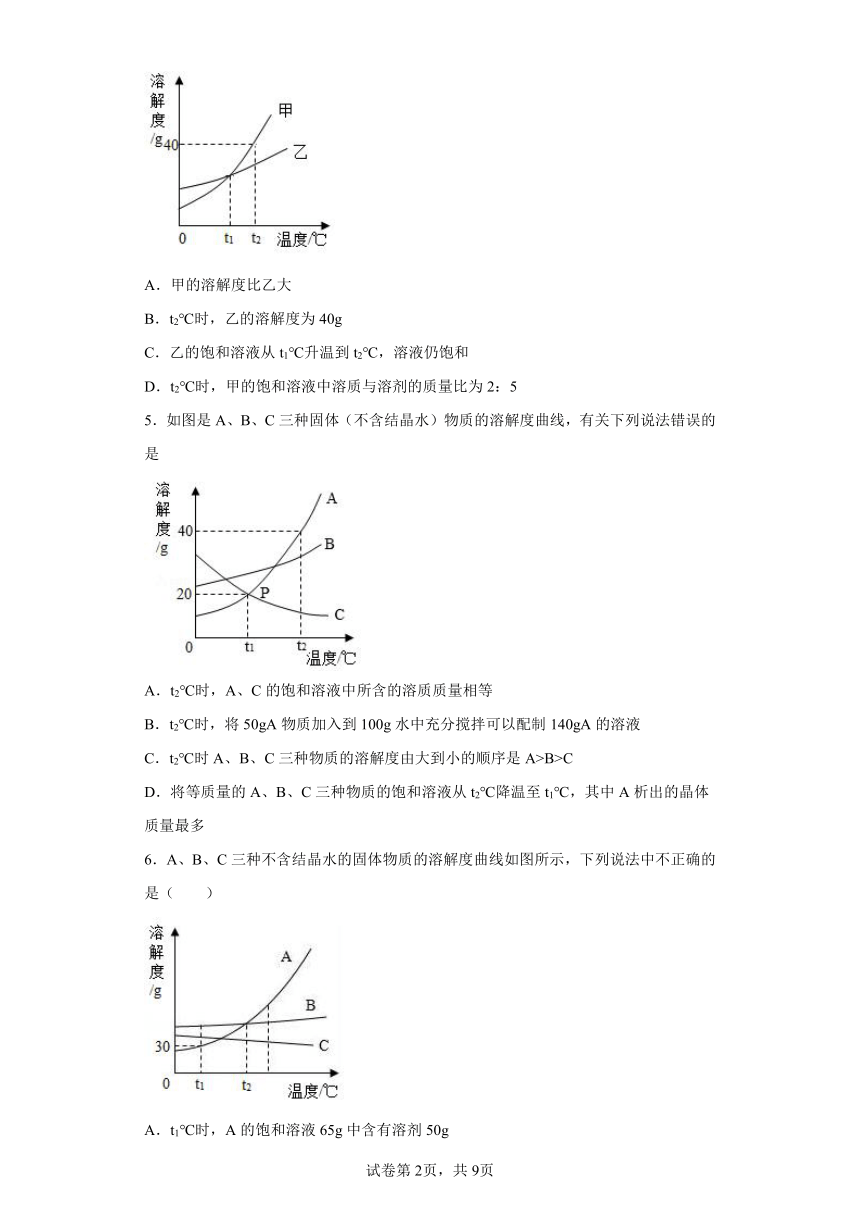
4.甲、乙的溶解度曲线如图所示。下列说法正确的是
A.甲的溶解度比乙大
B.t2℃时,乙的溶解度为40g
C.乙的饱和溶液从t1℃升温到t2℃,溶液仍饱和
D.t2℃时,甲的饱和溶液中溶质与溶剂的质量比为2:5
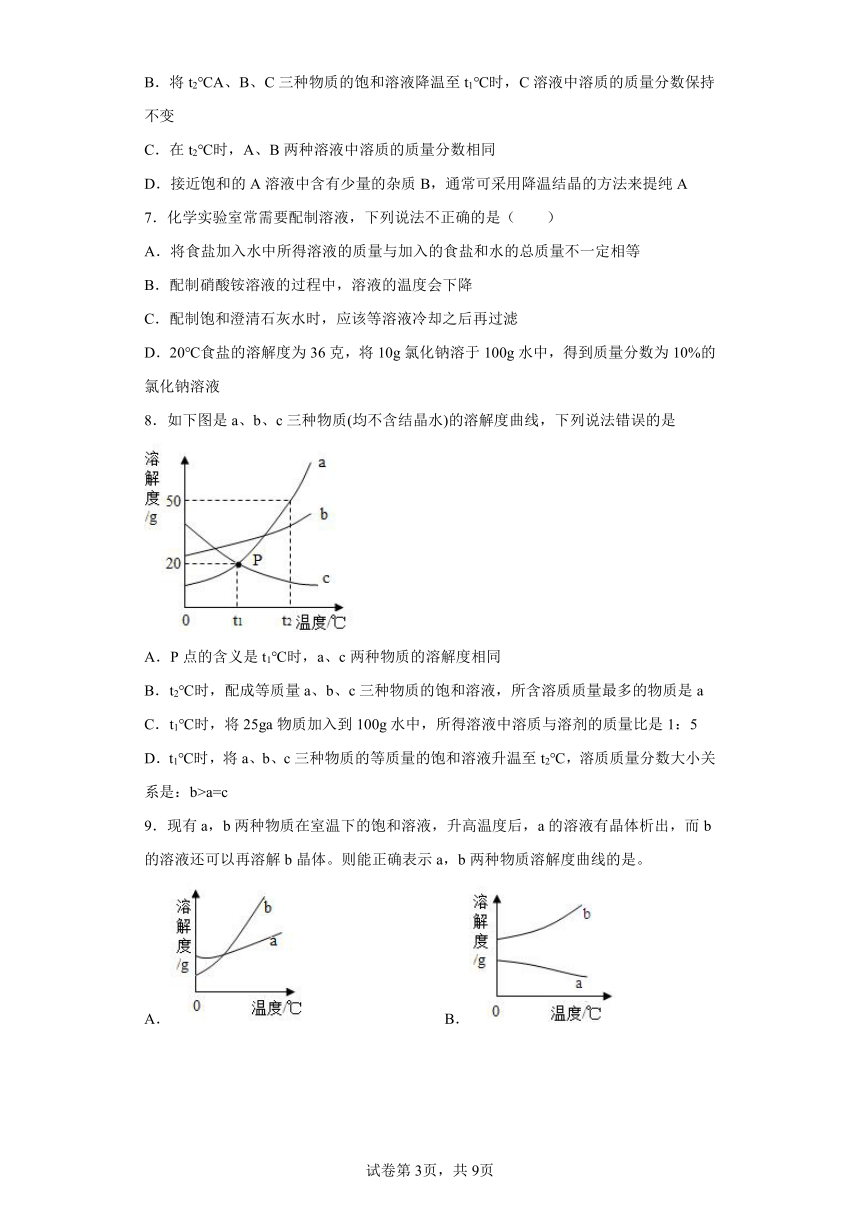
5.如图是A、B、C三种固体(不含结晶水)物质的溶解度曲线,有关下列说法错误的是
A.t2℃时,A、C的饱和溶液中所含的溶质质量相等
B.t2℃时,将50gA物质加入到100g水中充分搅拌可以配制140gA的溶液
C.t2℃时A、B、C三种物质的溶解度由大到小的顺序是A>B>C
D.将等质量的A、B、C三种物质的饱和溶液从t2℃降温至t1℃,其中A析出的晶体质量最多
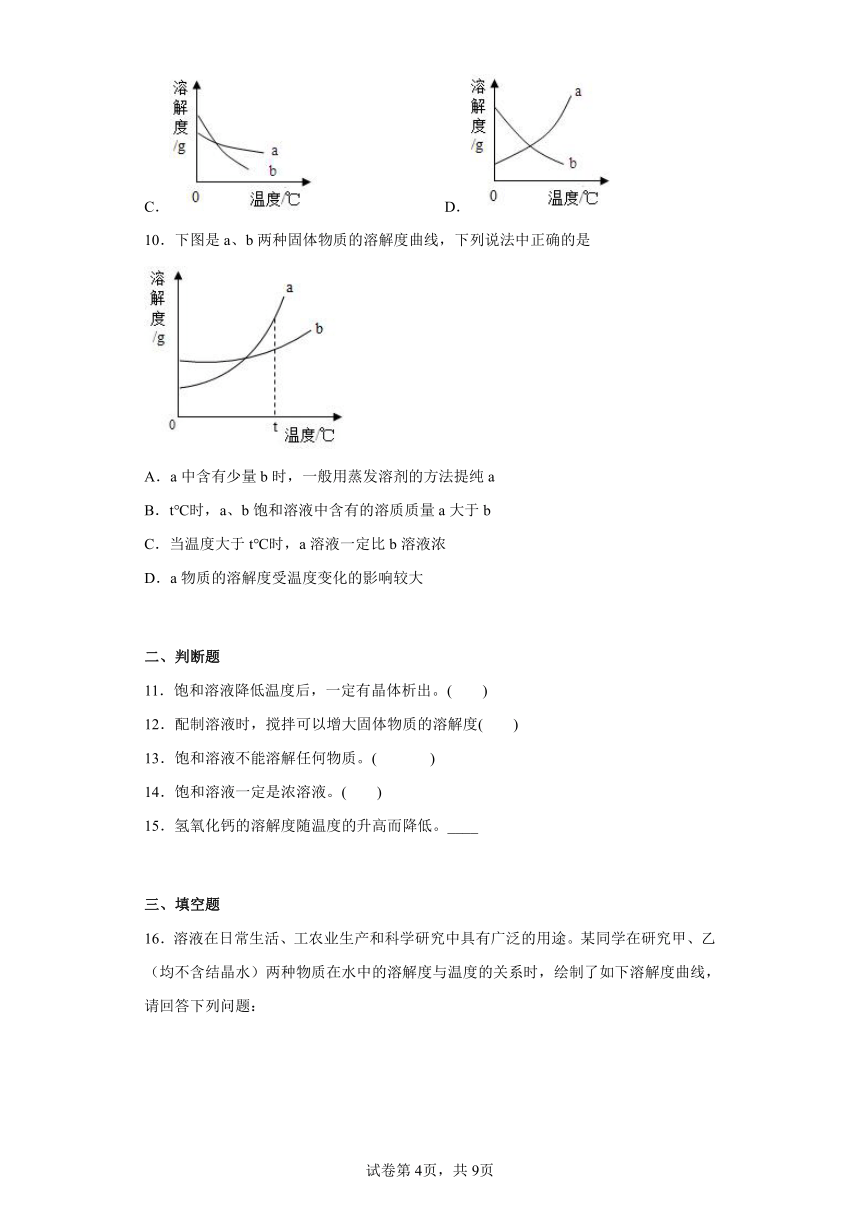
6.A、B、C三种不含结晶水的固体物质的溶解度曲线如图所示,下列说法中不正确的是( )
A.t1℃时,A的饱和溶液65g中含有溶剂50g
B.将t2℃A、B、C三种物质的饱和溶液降温至t1℃时,C溶液中溶质的质量分数保持不变
C.在t2℃时,A、B两种溶液中溶质的质量分数相同
D.接近饱和的A溶液中含有少量的杂质B,通常可采用降温结晶的方法来提纯A
7.化学实验室常需要配制溶液,下列说法不正确的是( )
A.将食盐加入水中所得溶液的质量与加入的食盐和水的总质量不一定相等
B.配制硝酸铵溶液的过程中,溶液的温度会下降
C.配制饱和澄清石灰水时,应该等溶液冷却之后再过滤
D.20℃食盐的溶解度为36克,将10g氯化钠溶于100g水中,得到质量分数为10%的氯化钠溶液
8.如下图是a、b、c三种物质(均不含结晶水)的溶解度曲线,下列说法错误的是
A.P点的含义是t1℃时,a、c两种物质的溶解度相同
B.t2℃时,配成等质量a、b、c三种物质的饱和溶液,所含溶质质量最多的物质是a
C.t1℃时,将25ga物质加入到100g水中,所得溶液中溶质与溶剂的质量比是1:5
D.t1℃时,将a、b、c三种物质的等质量的饱和溶液升温至t2℃,溶质质量分数大小关系是:b>a=c
9.现有a,b两种物质在室温下的饱和溶液,升高温度后,a的溶液有晶体析出,而b的溶液还可以再溶解b晶体。则能正确表示a,b两种物质溶解度曲线的是。
A. B.
C. D.
10.下图是a、b两种固体物质的溶解度曲线,下列说法中正确的是
A.a中含有少量b时,一般用蒸发溶剂的方法提纯a
B.t℃时,a、b饱和溶液中含有的溶质质量a大于b
C.当温度大于t℃时,a溶液一定比b溶液浓
D.a物质的溶解度受温度变化的影响较大
二、判断题
11.饱和溶液降低温度后,一定有晶体析出。( )
12.配制溶液时,搅拌可以增大固体物质的溶解度( )
13.饱和溶液不能溶解任何物质。( )
14.饱和溶液一定是浓溶液。( )
15.氢氧化钙的溶解度随温度的升高而降低。____
三、填空题
16.溶液在日常生活、工农业生产和科学研究中具有广泛的用途。某同学在研究甲、乙(均不含结晶水)两种物质在水中的溶解度与温度的关系时,绘制了如下溶解度曲线,请回答下列问题:
(1)图中M点的含义是___________。
(2)t1℃时,把含有甲、乙物质各60g的混合物投入到100g水中,升温至t2℃时,充分搅拌,趁热过滤,得到的固体是___________。(选填“甲”或“乙”)
(3)t2℃时,一定质量甲物质的饱和密液,从t2℃降温至t1℃,析出30g甲,则该溶液中溶剂水的质量为___________。
17.甲、乙两种固体物质的溶解度曲线如图所示.
(1)0℃时,甲、乙两种物质的溶解度大小关系:甲___乙(填“>”、“=”或“<”).
(2)20℃时,甲、乙两种物质的饱和溶液的溶质质量分数的关系:甲___乙(填“>”、“=”或“<”).
(3)40℃时,将160g乙物质的饱和溶液蒸发10g水时,析出的晶体的质量是___.
18.在20℃时,向质量均为50g的5份水中分别加入一定质量的氯化钾固体,然后搅拌至完全溶解得到溶液(如有不溶解的氯化钾,则过滤除去),加入氯化钾的质量与所得溶液的质量见
下表。
实验编号 1 2 3 4 5
加入氯化钾的质量/g 5 10 15 20 25
溶液的质量/g 55 60 65 67 67
(1)在20℃时,实验3所得的溶液为________溶液(填“饱和”与“不饱和”);
(2)在20℃时,实验5所得的溶液中溶质与溶剂的质量比为__________。
19.如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,回答下列问题。
(1)P点表示______。
(2)t2℃时,在温度不变的情况下要将丙的不饱和溶液变成饱和溶液的方法是______(任写一种)。
(3)t2℃时,将25 g甲固体加入50 g水中,充分溶解并恢复到原温度后,所得溶液的质量是______g。
(4)t3℃时,三种物质的溶解度由大到小的顺序为______。
(5)将t3℃时丙的饱和溶液降温到t2℃,溶液中溶质的质量分数______(填“变大”“变小”或“不变”)。
(6)甲中含有少量的乙,可通过______方法获得甲固体。
20.下列是MgSO4和KCl的溶解度表及溶解度曲线。
温度/℃ 20 30 40 50 60 70 80 90
溶解度/g MgSO4 33.7 38.9 44.5 50.6 54.6 55.8 52.9 52.2
KC1 34.0 37.0 40.0 42.6 45.5 48.3 51.1 54.0
请分析后回答下列问题:
(1)代表KCl溶解度曲线的是___________(填“甲”或“乙”)。
(2)t2的范围为___________(填字母)。
A.50-60B.60~70C.70~80D.80~90
(3)将t3℃时MgSO4的饱和溶液降温到t1℃,溶液中溶质的质量分数的变化情况是___________(填字母)。
A始终不变
B先增大后减小
C先减小后增大
D先不变后减小
E先不变后增大
四、综合应用题
21.为了增强导电性,实验室用溶质质量分数为的氢氧化钠溶液进行水的电解实验。
实验一:配制溶质质量分数为的氢氧化钠溶液。
①将烧杯放入电子天平上称量时,先要进行 _______ 操作。再将氢氧化钠固体慢慢放入烧杯内,直到电子天平显示出 ____ g数据为止。
②实际配制的溶液中溶质的质量分数小于,其原因不可能是 ____ 。
A氢氧化钠固体不纯 B固体倒入烧杯时洒落到电子天平上
C配制时所用烧杯内残留部分水 D倒入试剂瓶时有少量液体溅出
实验二:水的电解实验
③用如图装置进行水的电解实验
Ⅰ.如图试管1得到的气体是 _____ 。该反应的方程式为 __________________ 。
Ⅱ.电解水实验证明了水由 _________ 组成。
电解水过程中保持不变的微粒是 _____________ (填写微粒名称)。
Ⅲ.时,将等质量的甲、乙固体,分别加入到盛有水的烧杯中,充分搅拌后现象如图1,加热到时现象如图2(不考虑水分蒸发),甲、乙固体溶解度曲线如图3。
下列说法正确的是 ______ (填字母序号)。
A图3中N表示的是甲的溶解度曲线 B图2中甲、乙溶液的溶质质量分数相等
C图2中甲溶液是不饱和溶液 D图1中甲溶液溶质质量分数大于乙溶液溶质质量分数
22.水和水溶液与人类的生产生活关系紧密。
(1)水净化时先加入絮凝剂,沉降过滤后,通过活性炭。活性炭的作用是______。
(2)将硬水通过如图所示的阳离子交换柱后可变成软水(图中阴离子未画出),交换后的水仍然呈电中性。
①一个Ca2+可以交换出______个Na+。
②阳离子交换柱长时间使用后,Na+变少,失去软化硬水的功能而失效。利用生活中常见物质检验阳离子交换柱已失效的方法是______。
(3)20℃时打开汽水瓶盖时,有大量气泡冒出。汽水瓶盖打开前后,CO2的溶解度变化如图中的a点变化到______(选填“b”、“c”、“d”或“e”)点。
(4)甲、乙、丙三种不含结晶水的固体物质在水中的溶解度曲线如图所示,请回答下列问题。
①t1℃时,甲的饱和溶液中溶质与溶液的质量比为______。
②t2℃时,将甲、乙、丙三种物质的饱和溶液分别降温至t1℃时,所得溶液中溶质质量分数的大小关系为______。
(5)某工厂化验室用20%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40g,洗涤后的溶液呈中性。这一定量石油产品中含硫酸的质量是多少。(写出计算过程)______。
23.氯化钠是生产、生活中的一种重要化合物,应用很广泛。
(1)图甲和图乙分别是钠原子和氯原子的原子结构示意图。
①图甲中的 x=______。
②金属钠与氯气反应时,由图乙的结构可知,氯原子容易得到钠失去的 1 个电子,从而形成最外层有______个电子的相对稳定的氯离子,氯离子用化学符号表示为______。
(2)如表是氯化钠在不同温度下的溶解度数据。
温度/℃ 0 10 20 30 40 50 60 70
NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8
①30℃时,将 10g 氯化钠加入到 50g 水中,充分搅拌后,所得到的氯化钠溶液属于______(“饱和”或“不饱和”)溶液。
②医用盐水的溶质质量分数为 0.9%,现有 200mL 该盐水(假定该溶液的密度为 1.1g/mL),其中含 NaCl 的质量为______g。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.C
3.A
4.D
5.A
6.C
7.D
8.D
9.B
10.D
11.×
12.错误
13.错
14.×
15.正确
16.(1)t1℃时,甲、乙两物质溶解度相等/相同(或t1℃时,甲、乙两物质溶解度均为20g)
(2)乙
(3)50g
17. > = 6g
18. 不饱和 17:50
19.(1)在t1℃时,甲、乙、丙三种物质的溶解度相等
(2)蒸发溶剂
(3)65
(4)甲>乙>丙
(5)不变
(6)冷却热饱和溶液##降温结晶
20. 甲 D D
21. 去皮 5 D 或氢气 H、O或氢元素和氧元素 氢原子和氧原子 BC
22. 吸附水中的色素和异味 2 取交换后的水于试管中,加入适量肥皂水,振荡,若出现较多浮渣,则交换后的水仍然是硬水,说明阳离子交换柱已失效 c 1:6 乙>甲>丙 9.8g
23.(1) 1 8 Cl-
(2) 不饱和 1.98
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.NH4Cl和KNO3的溶解度曲线如图所示。下列说法错误的是
A.KNO3的溶解度随温度的升高而增大
B.t1℃时,NH4Cl和KNO3的溶解度相等
C.KNO3中混有少量的NH4Cl,可用降温结晶的方法提纯KNO3
D.t2℃时,等质量的KNO3和NH4Cl分别配制成饱和溶液,需要水的质量相等
2.下列关于溶液的说法正确的是
A.溶液一定是无色透明的液体
B.饱和溶液降温后都有溶质结晶析出
C.碘酒溶液中,碘是溶质,酒精是溶剂
D.水加入蔗糖后形成溶液,导电性明显增强
3.下图是A、B两物质的溶解度曲线,下列信息中,正确的是
A.t1℃时,A、B两物质溶解度相同
B.t2℃时,A物质的饱和溶液中溶质的质量分数为55%
C.除去固体A中的少量杂质B可采取蒸发结晶法
D.图中阴影部分表明A、B两溶液都是饱和溶液
4.甲、乙的溶解度曲线如图所示。下列说法正确的是
A.甲的溶解度比乙大
B.t2℃时,乙的溶解度为40g
C.乙的饱和溶液从t1℃升温到t2℃,溶液仍饱和
D.t2℃时,甲的饱和溶液中溶质与溶剂的质量比为2:5
5.如图是A、B、C三种固体(不含结晶水)物质的溶解度曲线,有关下列说法错误的是
A.t2℃时,A、C的饱和溶液中所含的溶质质量相等
B.t2℃时,将50gA物质加入到100g水中充分搅拌可以配制140gA的溶液
C.t2℃时A、B、C三种物质的溶解度由大到小的顺序是A>B>C
D.将等质量的A、B、C三种物质的饱和溶液从t2℃降温至t1℃,其中A析出的晶体质量最多
6.A、B、C三种不含结晶水的固体物质的溶解度曲线如图所示,下列说法中不正确的是( )
A.t1℃时,A的饱和溶液65g中含有溶剂50g
B.将t2℃A、B、C三种物质的饱和溶液降温至t1℃时,C溶液中溶质的质量分数保持不变
C.在t2℃时,A、B两种溶液中溶质的质量分数相同
D.接近饱和的A溶液中含有少量的杂质B,通常可采用降温结晶的方法来提纯A
7.化学实验室常需要配制溶液,下列说法不正确的是( )
A.将食盐加入水中所得溶液的质量与加入的食盐和水的总质量不一定相等
B.配制硝酸铵溶液的过程中,溶液的温度会下降
C.配制饱和澄清石灰水时,应该等溶液冷却之后再过滤
D.20℃食盐的溶解度为36克,将10g氯化钠溶于100g水中,得到质量分数为10%的氯化钠溶液
8.如下图是a、b、c三种物质(均不含结晶水)的溶解度曲线,下列说法错误的是
A.P点的含义是t1℃时,a、c两种物质的溶解度相同
B.t2℃时,配成等质量a、b、c三种物质的饱和溶液,所含溶质质量最多的物质是a
C.t1℃时,将25ga物质加入到100g水中,所得溶液中溶质与溶剂的质量比是1:5
D.t1℃时,将a、b、c三种物质的等质量的饱和溶液升温至t2℃,溶质质量分数大小关系是:b>a=c
9.现有a,b两种物质在室温下的饱和溶液,升高温度后,a的溶液有晶体析出,而b的溶液还可以再溶解b晶体。则能正确表示a,b两种物质溶解度曲线的是。
A. B.
C. D.
10.下图是a、b两种固体物质的溶解度曲线,下列说法中正确的是
A.a中含有少量b时,一般用蒸发溶剂的方法提纯a
B.t℃时,a、b饱和溶液中含有的溶质质量a大于b
C.当温度大于t℃时,a溶液一定比b溶液浓
D.a物质的溶解度受温度变化的影响较大
二、判断题
11.饱和溶液降低温度后,一定有晶体析出。( )
12.配制溶液时,搅拌可以增大固体物质的溶解度( )
13.饱和溶液不能溶解任何物质。( )
14.饱和溶液一定是浓溶液。( )
15.氢氧化钙的溶解度随温度的升高而降低。____
三、填空题
16.溶液在日常生活、工农业生产和科学研究中具有广泛的用途。某同学在研究甲、乙(均不含结晶水)两种物质在水中的溶解度与温度的关系时,绘制了如下溶解度曲线,请回答下列问题:
(1)图中M点的含义是___________。
(2)t1℃时,把含有甲、乙物质各60g的混合物投入到100g水中,升温至t2℃时,充分搅拌,趁热过滤,得到的固体是___________。(选填“甲”或“乙”)
(3)t2℃时,一定质量甲物质的饱和密液,从t2℃降温至t1℃,析出30g甲,则该溶液中溶剂水的质量为___________。
17.甲、乙两种固体物质的溶解度曲线如图所示.
(1)0℃时,甲、乙两种物质的溶解度大小关系:甲___乙(填“>”、“=”或“<”).
(2)20℃时,甲、乙两种物质的饱和溶液的溶质质量分数的关系:甲___乙(填“>”、“=”或“<”).
(3)40℃时,将160g乙物质的饱和溶液蒸发10g水时,析出的晶体的质量是___.
18.在20℃时,向质量均为50g的5份水中分别加入一定质量的氯化钾固体,然后搅拌至完全溶解得到溶液(如有不溶解的氯化钾,则过滤除去),加入氯化钾的质量与所得溶液的质量见
下表。
实验编号 1 2 3 4 5
加入氯化钾的质量/g 5 10 15 20 25
溶液的质量/g 55 60 65 67 67
(1)在20℃时,实验3所得的溶液为________溶液(填“饱和”与“不饱和”);
(2)在20℃时,实验5所得的溶液中溶质与溶剂的质量比为__________。
19.如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,回答下列问题。
(1)P点表示______。
(2)t2℃时,在温度不变的情况下要将丙的不饱和溶液变成饱和溶液的方法是______(任写一种)。
(3)t2℃时,将25 g甲固体加入50 g水中,充分溶解并恢复到原温度后,所得溶液的质量是______g。
(4)t3℃时,三种物质的溶解度由大到小的顺序为______。
(5)将t3℃时丙的饱和溶液降温到t2℃,溶液中溶质的质量分数______(填“变大”“变小”或“不变”)。
(6)甲中含有少量的乙,可通过______方法获得甲固体。
20.下列是MgSO4和KCl的溶解度表及溶解度曲线。
温度/℃ 20 30 40 50 60 70 80 90
溶解度/g MgSO4 33.7 38.9 44.5 50.6 54.6 55.8 52.9 52.2
KC1 34.0 37.0 40.0 42.6 45.5 48.3 51.1 54.0
请分析后回答下列问题:
(1)代表KCl溶解度曲线的是___________(填“甲”或“乙”)。
(2)t2的范围为___________(填字母)。
A.50-60B.60~70C.70~80D.80~90
(3)将t3℃时MgSO4的饱和溶液降温到t1℃,溶液中溶质的质量分数的变化情况是___________(填字母)。
A始终不变
B先增大后减小
C先减小后增大
D先不变后减小
E先不变后增大
四、综合应用题
21.为了增强导电性,实验室用溶质质量分数为的氢氧化钠溶液进行水的电解实验。
实验一:配制溶质质量分数为的氢氧化钠溶液。
①将烧杯放入电子天平上称量时,先要进行 _______ 操作。再将氢氧化钠固体慢慢放入烧杯内,直到电子天平显示出 ____ g数据为止。
②实际配制的溶液中溶质的质量分数小于,其原因不可能是 ____ 。
A氢氧化钠固体不纯 B固体倒入烧杯时洒落到电子天平上
C配制时所用烧杯内残留部分水 D倒入试剂瓶时有少量液体溅出
实验二:水的电解实验
③用如图装置进行水的电解实验
Ⅰ.如图试管1得到的气体是 _____ 。该反应的方程式为 __________________ 。
Ⅱ.电解水实验证明了水由 _________ 组成。
电解水过程中保持不变的微粒是 _____________ (填写微粒名称)。
Ⅲ.时,将等质量的甲、乙固体,分别加入到盛有水的烧杯中,充分搅拌后现象如图1,加热到时现象如图2(不考虑水分蒸发),甲、乙固体溶解度曲线如图3。
下列说法正确的是 ______ (填字母序号)。
A图3中N表示的是甲的溶解度曲线 B图2中甲、乙溶液的溶质质量分数相等
C图2中甲溶液是不饱和溶液 D图1中甲溶液溶质质量分数大于乙溶液溶质质量分数
22.水和水溶液与人类的生产生活关系紧密。
(1)水净化时先加入絮凝剂,沉降过滤后,通过活性炭。活性炭的作用是______。
(2)将硬水通过如图所示的阳离子交换柱后可变成软水(图中阴离子未画出),交换后的水仍然呈电中性。
①一个Ca2+可以交换出______个Na+。
②阳离子交换柱长时间使用后,Na+变少,失去软化硬水的功能而失效。利用生活中常见物质检验阳离子交换柱已失效的方法是______。
(3)20℃时打开汽水瓶盖时,有大量气泡冒出。汽水瓶盖打开前后,CO2的溶解度变化如图中的a点变化到______(选填“b”、“c”、“d”或“e”)点。
(4)甲、乙、丙三种不含结晶水的固体物质在水中的溶解度曲线如图所示,请回答下列问题。
①t1℃时,甲的饱和溶液中溶质与溶液的质量比为______。
②t2℃时,将甲、乙、丙三种物质的饱和溶液分别降温至t1℃时,所得溶液中溶质质量分数的大小关系为______。
(5)某工厂化验室用20%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40g,洗涤后的溶液呈中性。这一定量石油产品中含硫酸的质量是多少。(写出计算过程)______。
23.氯化钠是生产、生活中的一种重要化合物,应用很广泛。
(1)图甲和图乙分别是钠原子和氯原子的原子结构示意图。
①图甲中的 x=______。
②金属钠与氯气反应时,由图乙的结构可知,氯原子容易得到钠失去的 1 个电子,从而形成最外层有______个电子的相对稳定的氯离子,氯离子用化学符号表示为______。
(2)如表是氯化钠在不同温度下的溶解度数据。
温度/℃ 0 10 20 30 40 50 60 70
NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8
①30℃时,将 10g 氯化钠加入到 50g 水中,充分搅拌后,所得到的氯化钠溶液属于______(“饱和”或“不饱和”)溶液。
②医用盐水的溶质质量分数为 0.9%,现有 200mL 该盐水(假定该溶液的密度为 1.1g/mL),其中含 NaCl 的质量为______g。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.C
3.A
4.D
5.A
6.C
7.D
8.D
9.B
10.D
11.×
12.错误
13.错
14.×
15.正确
16.(1)t1℃时,甲、乙两物质溶解度相等/相同(或t1℃时,甲、乙两物质溶解度均为20g)
(2)乙
(3)50g
17. > = 6g
18. 不饱和 17:50
19.(1)在t1℃时,甲、乙、丙三种物质的溶解度相等
(2)蒸发溶剂
(3)65
(4)甲>乙>丙
(5)不变
(6)冷却热饱和溶液##降温结晶
20. 甲 D D
21. 去皮 5 D 或氢气 H、O或氢元素和氧元素 氢原子和氧原子 BC
22. 吸附水中的色素和异味 2 取交换后的水于试管中,加入适量肥皂水,振荡,若出现较多浮渣,则交换后的水仍然是硬水,说明阳离子交换柱已失效 c 1:6 乙>甲>丙 9.8g
23.(1) 1 8 Cl-
(2) 不饱和 1.98
答案第1页,共2页
答案第1页,共2页
