10.3金属的冶炼与防护同步练习京改版化学九年级下册(含答案)
文档属性
| 名称 | 10.3金属的冶炼与防护同步练习京改版化学九年级下册(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 654.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-21 19:20:38 | ||
图片预览




文档简介
10.3金属的冶炼与防护同步练习京改版化学九年级下册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.2019年7月1日起,《上海市生活垃圾管理条例》正式实施,下图为上海市颁布的“生活垃圾标识”,易拉罐和废旧报纸应投放到生活垃圾标识中的( )
A.可回收物 B.有害垃圾 C.湿垃圾 D.干垃圾
2.控制变量法实验探究重要方法。利用如图所示的实验能实现探究目的是( )
A.甲中①②对比可探究铁的锈蚀与植物油是否有关
B.甲中①③对比可探究铁的锈蚀与水是否有关
C.乙中铜片上的白磷与红磷实验,可探究可燃物的燃烧是否需要与氧气接触
D.乙中铜片上的白磷与热水中的白磷实验,可探究可燃物的燃烧是否需要达到着火点。
3.认识物质及其变化是化学研究的重点,下列变化体现的是化学变化的是
A.干冰升华
B.铁的生锈
C.活性炭吸附色素
D.石油分馏
4.《天工开物》对钢铁冶炼过程有如下记载。有关说法正确的是
A.“垦土拾锭”:铁元素是地壳中含量最高的金属元素
B.“淘洗铁砂”:铁矿石(主要成分为Fe2O3)能溶于水
C.“生熟炼铁”:冶炼铁过程中发生了化学变化
D.“锤锻成钢”:生铁高温锻打成钢,碳元素含量升高
5.下列有关金属的说法中正确的是( )
A.金属在自然界中都以单质形式存在
B.地壳中含量最高的金属元素是铁元素
C.武德合金熔点高,常用作保险丝
D.黄铜(锌铜合金)比纯铜的硬度大
6.下列铁的性质中,属于化学性质的是
A.银白色 B.导热性 C.延展性 D.易锈蚀
7.下列物质名称与其主要成分不相匹配的是
A.大理石――SiO2 B.赤铁矿――Fe2O3
C.铝土矿――Al2O3 D.辉铜矿――Cu2S
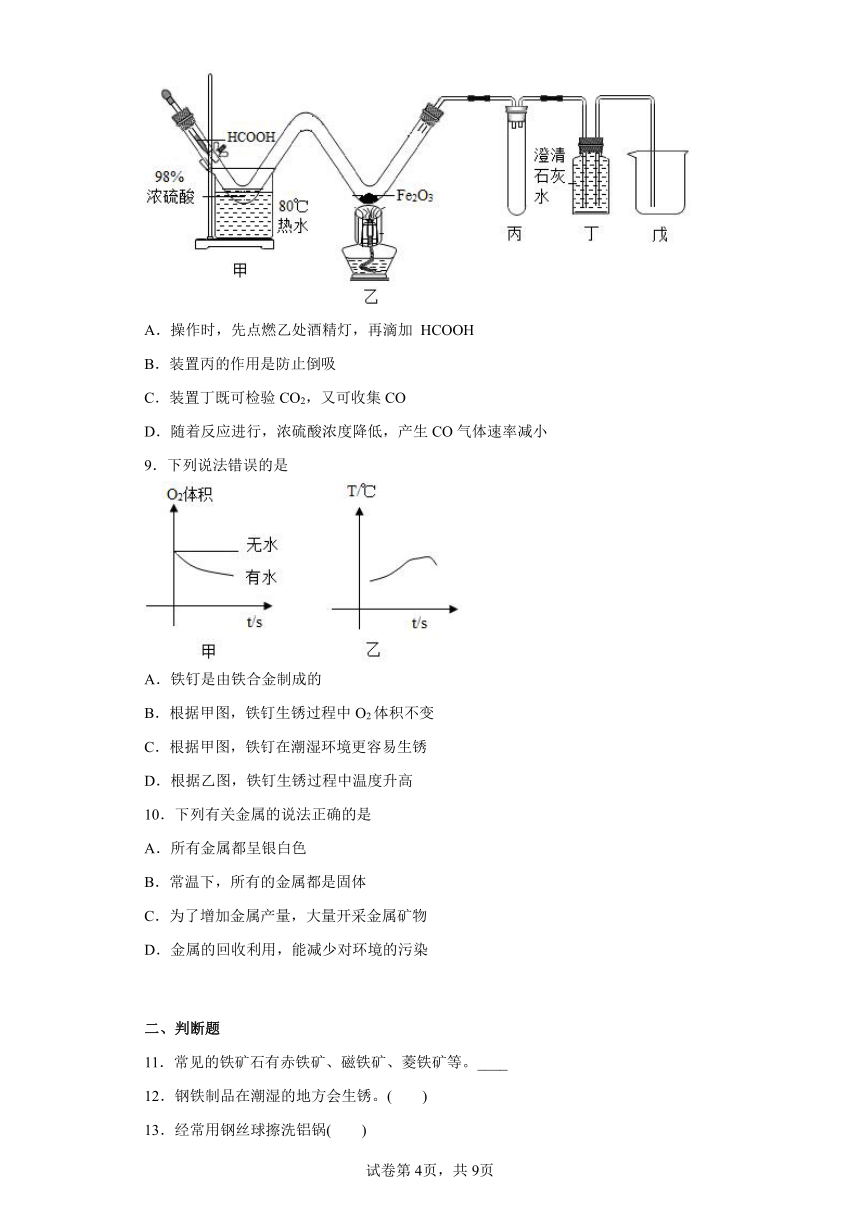
8.利用甲酸( HCOOH)与浓硫酸制备CO,并用如下实验装置验证CO的有关性质。已知: ,下列说法不正确的是
A.操作时,先点燃乙处酒精灯,再滴加 HCOOH
B.装置丙的作用是防止倒吸
C.装置丁既可检验CO2,又可收集CO
D.随着反应进行,浓硫酸浓度降低,产生CO气体速率减小
9.下列说法错误的是
A.铁钉是由铁合金制成的
B.根据甲图,铁钉生锈过程中O2体积不变
C.根据甲图,铁钉在潮湿环境更容易生锈
D.根据乙图,铁钉生锈过程中温度升高
10.下列有关金属的说法正确的是
A.所有金属都呈银白色
B.常温下,所有的金属都是固体
C.为了增加金属产量,大量开采金属矿物
D.金属的回收利用,能减少对环境的污染
二、判断题
11.常见的铁矿石有赤铁矿、磁铁矿、菱铁矿等。____
12.钢铁制品在潮湿的地方会生锈。( )
13.经常用钢丝球擦洗铝锅( )
14.一般铁制品并不耐腐蚀,比较容易生锈。___
15.高炉炼铁主要原理:在高温下,用作还原剂,夺取铁的氧化物中的氧,将铁还原出来。( )
三、填空题
16.用所学的化学知识填空
(1)空气中能供给呼吸的气体是___________
(2)生活中防止铁质栅栏生锈的一种方法是___________
(3)冰箱中放入活性炭除异味,利用了活性炭的___________性
(4)关闭燃气开关灭火,运用的原理是___________
(5)保险丝(铅锑合金)比组成它的纯金属的熔点___________
17.钢铁是应用广泛的金属材料。
(1)英国学者R 坦普尔论证了我国古代冶铁技术世界第一。早在公元前4世纪,中国已广泛利用铁矿石与木炭生产生铁,并加入“黑土”以降低生铁的熔化温度;公元前2世纪,中国人发明了“充氧”等炼钢法。
①“黑土”含有磷酸铁(FePO4),其中磷元素的化合价为 _______。
②生铁生产过程中,一氧化碳与氧化铁在高温下反应的化学方程式为 __________。
③炼钢中“充氧”的目的是降低生铁中的 _________,获得性能更好的钢。
(2)对钢铁制品进行“发蓝”处理,使表面生成一层致密的氧化膜,能有效防止钢铁锈蚀原因是_________。
18.近日狡猾的新冠病毒再次砸向我国部分省市,大家一定要少聚集、勤洗手、戴口罩!为增强口罩的密封性,均放了鼻梁条,有的鼻梁条是铝制的,金属铝常温下耐腐蚀的原因是_______;金属铁则不具有这种性质,它通常在_______情况下容易生锈;古代湿法炼铜就是利用金属铁和硫酸铜溶液的反应,两者恰好完全反应后的溶液溶质是_______(用化学式表示)。
19.金属材料在工农业生产、日常生活中有着广泛应用。
(1)铁制品锈蚀的原因主要是铁与空气中的_____和水蒸气发生了化学反应。
(2)铝制品不易锈蚀的原因是铝与氧气作用,在表面形成了致密的保护膜,这种保护膜的化学成分用化学式表示为_____。
(3)对Al、Ag、Cu三种金届活动性顺序的探究,下列所选试剂组可用的是_____。
①Al、Ag、CuSO4溶液
②Cu、Ag、Al2(SO4)3溶液
③Cu、Al2(SO4)3溶液、AgNO3溶液
20.近年来宁德汽车工业取得长足进步。
(1)下列各类汽车在使用时,对空气污染最小的是_____(填序号)。
① 汽油车 ② 柴油车 ③ 新能源纯电动汽车
(2)汽车表面喷漆可延缓汽车的锈蚀,其防锈原理是____。
(3)部分环保电动汽车使用高铁电池,其原理为高铁酸钾(K2FeO4)和单质锌作用,在释放出电能的同时生成K2ZnO2、Fe2O3及ZnO。
① 写出钾离子的符号____。
② 高铁酸钾(K2FeO4)中Fe元素的化合价为____。
③ K2ZnO2中锌元素和氧元素的质量比为____。
四、综合应用题
21.某兴趣小组开展“铁的氧化反应”相关实验探究活动。
【探究1】探究铁丝燃烧与氧气浓度的关系。在其他条件相同的情况下,取0.38mm粗的铁丝,分别在体积分数为90%、70%、65%、60%、55%的氧气中进行实验。
V(O2)% 实验现象
90% 燃烧剧烈,燃烧时间长,效果好
70% 燃烧比90%的弱,燃烧时间较长,实验成功
65% 燃烧比70%的弱,燃烧时间比70%的短,实验成功
60% 燃烧比65%的弱,燃烧时间更短,实验成功
55% 难以燃烧,只是发红
(1)实验时要在瓶底留少量的水,目的是______。
(2)欲用排水法收集一定体积分数的氧气。若集气瓶容积为250mL,收集前集气瓶中留有125mL水(其余为空气),盖上玻璃片后倒立于水槽中,排完集气瓶中的水后,收集的气体中氧气的体积分数是______(氧气在空气中的体积分数以20%进行近似计算;收集后集气瓶中残留的少量水体积忽略不计)。
(3)结合本探究,可得出铁丝燃烧剧烈程度与氧气浓度的关系是______,对燃烧条件的新认识是______。
【探究2】探究铁制品锈蚀的影响因素。已知铁制品通常含碳约2%。按图1所示装置,在广口瓶①、②、③中加入药品,采集数据,氧气的体积分数变化如图2。
(4)铁制品锈蚀是缓慢氧化的过程,是铁与氧气、水共同作用的结果。请结合图2,说明其依据:______。
(5)实验开始至约300s内,对比广口瓶②,③中氧气体积分数的变化,可以得出的结论是______。
(6)实验前需将铁粉、活性炭粉及食盐混合均匀并密封分装,密封的目的是______。
(7)欲探究纯铁粉与含少量碳的铁粉的锈蚀快慢,现用广口瓶④、⑤连接以上数据采集器,在其他条件相同的情况下完成实验,则在两个广口瓶中应分别装入的药品及用量:广口瓶④______;广口瓶⑤______。
22.小明设计了下图所示的实验装置,进行CO还原Fe2O3的实验。试回答:
(1)该装置存在一处不完善的地方是______________________。
(2)实验结束,装置冷却后A处观察到的现象是______________________;
(3)金属在生产和生活中有广泛的应用。下列金属制品中,利用金属导热性的是______________________。
A.灯泡中钨丝 B.铝导线 C.铁锅
(4)工业上用含氧化铁480t的赤铁矿为原料炼铁,最多得到多少吨的纯铁?(根据化学方程式进行计算,写出完整的计算过程) _____________
23.金属用途广泛,其结构和性质等是化学研究的重要内容。
(1)铁、铜、铝是人们广泛利用的三种金属,人类大规模开发利用这三种金属的先后顺序是____(填元素符号)。
(2)铝的活动性比铁强,但铝却能在空气中表现出好的抗腐蚀性能,为什么?
(3)某化学小组用一定量硝酸银和硝酸铜的混合溶液进行了如图实验,并对溶液 A 和固体 B 的成分进行了分析和实验探究。
①若溶液A中的溶质只有一种,请分析固体B的成分_______。
②写出探究过程中任一反应的化学方程式_______。
(4)如图为CO还原氧化铁的微型装置图。A处V型管内发生反应的化学方程式为______;从环保角度考虑,请写出一种尾气处理方法_______。
(5)黄铜是铜锌合金,常用于制造机器、电器零件等。为测定黄铜样品中铜的质量分数,取20g该黄铜样品加入到100g稀硫酸中,恰好完全反应,产生氢气0.2g。请计算该黄铜样品中铜的质量分数_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.B
3.B
4.C
5.D
6.D
7.A
8.A
9.B
10.D
11.正确
12.正确
13.错误
14.正确
15.√
16.(1)氧气
(2)刷漆
(3)吸附
(4)去除可燃物
(5)低
17.(1) +5 含碳量
(2)隔绝氧气和水
18. 表面形成致密的氧化膜,防止里面的铝继续被氧化 氧气和水 FeSO4
19. 氧气(O2) Al2O3 ①③
20. ③ 隔绝氧气和水 K+ +6 65:32
21.(1)为了防止燃烧时生成的熔融物溅落使瓶底炸裂
(2)10%
(3) 氧气浓度越高,铁丝燃烧越剧烈 氧气没有达到一定浓度,物质也不能燃烧
(4)氧气的体积分数越低,表示耗氧量越高,在有水的条件下的耗氧量高于无水条件下
(5)加入食盐水后的耗氧量增加
(6)防止与空气中的水和氧气接触,影响实验结果
(7) 5g铁粉,水10滴 5g铁粉,水10滴,0.1g碳粉
22.(1)缺少尾气的处理装置
(2)红棕色固体逐渐变成黑色
(3)C
(4)设:最多得到纯铁的质量为x
x=336t
答:最多得到336吨的纯铁。
23.(1)Cu、Fe、Al
(2)铝的化学性质比较活泼,常温下,铝能与空气中的氧气反应,在其表面形成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化
(3) Cu、Ag或Fe、Cu、Ag 或
(4)
在末端加一个燃着的酒精灯或绑一个气球
(5)解:设该样品中锌的质量为x
x=6.5g
故该黄铜中铜的质量分数为:
答:该黄铜样品中铜的质量分数为67.5%。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.2019年7月1日起,《上海市生活垃圾管理条例》正式实施,下图为上海市颁布的“生活垃圾标识”,易拉罐和废旧报纸应投放到生活垃圾标识中的( )
A.可回收物 B.有害垃圾 C.湿垃圾 D.干垃圾
2.控制变量法实验探究重要方法。利用如图所示的实验能实现探究目的是( )
A.甲中①②对比可探究铁的锈蚀与植物油是否有关
B.甲中①③对比可探究铁的锈蚀与水是否有关
C.乙中铜片上的白磷与红磷实验,可探究可燃物的燃烧是否需要与氧气接触
D.乙中铜片上的白磷与热水中的白磷实验,可探究可燃物的燃烧是否需要达到着火点。
3.认识物质及其变化是化学研究的重点,下列变化体现的是化学变化的是
A.干冰升华
B.铁的生锈
C.活性炭吸附色素
D.石油分馏
4.《天工开物》对钢铁冶炼过程有如下记载。有关说法正确的是
A.“垦土拾锭”:铁元素是地壳中含量最高的金属元素
B.“淘洗铁砂”:铁矿石(主要成分为Fe2O3)能溶于水
C.“生熟炼铁”:冶炼铁过程中发生了化学变化
D.“锤锻成钢”:生铁高温锻打成钢,碳元素含量升高
5.下列有关金属的说法中正确的是( )
A.金属在自然界中都以单质形式存在
B.地壳中含量最高的金属元素是铁元素
C.武德合金熔点高,常用作保险丝
D.黄铜(锌铜合金)比纯铜的硬度大
6.下列铁的性质中,属于化学性质的是
A.银白色 B.导热性 C.延展性 D.易锈蚀
7.下列物质名称与其主要成分不相匹配的是
A.大理石――SiO2 B.赤铁矿――Fe2O3
C.铝土矿――Al2O3 D.辉铜矿――Cu2S
8.利用甲酸( HCOOH)与浓硫酸制备CO,并用如下实验装置验证CO的有关性质。已知: ,下列说法不正确的是
A.操作时,先点燃乙处酒精灯,再滴加 HCOOH
B.装置丙的作用是防止倒吸
C.装置丁既可检验CO2,又可收集CO
D.随着反应进行,浓硫酸浓度降低,产生CO气体速率减小
9.下列说法错误的是
A.铁钉是由铁合金制成的
B.根据甲图,铁钉生锈过程中O2体积不变
C.根据甲图,铁钉在潮湿环境更容易生锈
D.根据乙图,铁钉生锈过程中温度升高
10.下列有关金属的说法正确的是
A.所有金属都呈银白色
B.常温下,所有的金属都是固体
C.为了增加金属产量,大量开采金属矿物
D.金属的回收利用,能减少对环境的污染
二、判断题
11.常见的铁矿石有赤铁矿、磁铁矿、菱铁矿等。____
12.钢铁制品在潮湿的地方会生锈。( )
13.经常用钢丝球擦洗铝锅( )
14.一般铁制品并不耐腐蚀,比较容易生锈。___
15.高炉炼铁主要原理:在高温下,用作还原剂,夺取铁的氧化物中的氧,将铁还原出来。( )
三、填空题
16.用所学的化学知识填空
(1)空气中能供给呼吸的气体是___________
(2)生活中防止铁质栅栏生锈的一种方法是___________
(3)冰箱中放入活性炭除异味,利用了活性炭的___________性
(4)关闭燃气开关灭火,运用的原理是___________
(5)保险丝(铅锑合金)比组成它的纯金属的熔点___________
17.钢铁是应用广泛的金属材料。
(1)英国学者R 坦普尔论证了我国古代冶铁技术世界第一。早在公元前4世纪,中国已广泛利用铁矿石与木炭生产生铁,并加入“黑土”以降低生铁的熔化温度;公元前2世纪,中国人发明了“充氧”等炼钢法。
①“黑土”含有磷酸铁(FePO4),其中磷元素的化合价为 _______。
②生铁生产过程中,一氧化碳与氧化铁在高温下反应的化学方程式为 __________。
③炼钢中“充氧”的目的是降低生铁中的 _________,获得性能更好的钢。
(2)对钢铁制品进行“发蓝”处理,使表面生成一层致密的氧化膜,能有效防止钢铁锈蚀原因是_________。
18.近日狡猾的新冠病毒再次砸向我国部分省市,大家一定要少聚集、勤洗手、戴口罩!为增强口罩的密封性,均放了鼻梁条,有的鼻梁条是铝制的,金属铝常温下耐腐蚀的原因是_______;金属铁则不具有这种性质,它通常在_______情况下容易生锈;古代湿法炼铜就是利用金属铁和硫酸铜溶液的反应,两者恰好完全反应后的溶液溶质是_______(用化学式表示)。
19.金属材料在工农业生产、日常生活中有着广泛应用。
(1)铁制品锈蚀的原因主要是铁与空气中的_____和水蒸气发生了化学反应。
(2)铝制品不易锈蚀的原因是铝与氧气作用,在表面形成了致密的保护膜,这种保护膜的化学成分用化学式表示为_____。
(3)对Al、Ag、Cu三种金届活动性顺序的探究,下列所选试剂组可用的是_____。
①Al、Ag、CuSO4溶液
②Cu、Ag、Al2(SO4)3溶液
③Cu、Al2(SO4)3溶液、AgNO3溶液
20.近年来宁德汽车工业取得长足进步。
(1)下列各类汽车在使用时,对空气污染最小的是_____(填序号)。
① 汽油车 ② 柴油车 ③ 新能源纯电动汽车
(2)汽车表面喷漆可延缓汽车的锈蚀,其防锈原理是____。
(3)部分环保电动汽车使用高铁电池,其原理为高铁酸钾(K2FeO4)和单质锌作用,在释放出电能的同时生成K2ZnO2、Fe2O3及ZnO。
① 写出钾离子的符号____。
② 高铁酸钾(K2FeO4)中Fe元素的化合价为____。
③ K2ZnO2中锌元素和氧元素的质量比为____。
四、综合应用题
21.某兴趣小组开展“铁的氧化反应”相关实验探究活动。
【探究1】探究铁丝燃烧与氧气浓度的关系。在其他条件相同的情况下,取0.38mm粗的铁丝,分别在体积分数为90%、70%、65%、60%、55%的氧气中进行实验。
V(O2)% 实验现象
90% 燃烧剧烈,燃烧时间长,效果好
70% 燃烧比90%的弱,燃烧时间较长,实验成功
65% 燃烧比70%的弱,燃烧时间比70%的短,实验成功
60% 燃烧比65%的弱,燃烧时间更短,实验成功
55% 难以燃烧,只是发红
(1)实验时要在瓶底留少量的水,目的是______。
(2)欲用排水法收集一定体积分数的氧气。若集气瓶容积为250mL,收集前集气瓶中留有125mL水(其余为空气),盖上玻璃片后倒立于水槽中,排完集气瓶中的水后,收集的气体中氧气的体积分数是______(氧气在空气中的体积分数以20%进行近似计算;收集后集气瓶中残留的少量水体积忽略不计)。
(3)结合本探究,可得出铁丝燃烧剧烈程度与氧气浓度的关系是______,对燃烧条件的新认识是______。
【探究2】探究铁制品锈蚀的影响因素。已知铁制品通常含碳约2%。按图1所示装置,在广口瓶①、②、③中加入药品,采集数据,氧气的体积分数变化如图2。
(4)铁制品锈蚀是缓慢氧化的过程,是铁与氧气、水共同作用的结果。请结合图2,说明其依据:______。
(5)实验开始至约300s内,对比广口瓶②,③中氧气体积分数的变化,可以得出的结论是______。
(6)实验前需将铁粉、活性炭粉及食盐混合均匀并密封分装,密封的目的是______。
(7)欲探究纯铁粉与含少量碳的铁粉的锈蚀快慢,现用广口瓶④、⑤连接以上数据采集器,在其他条件相同的情况下完成实验,则在两个广口瓶中应分别装入的药品及用量:广口瓶④______;广口瓶⑤______。
22.小明设计了下图所示的实验装置,进行CO还原Fe2O3的实验。试回答:
(1)该装置存在一处不完善的地方是______________________。
(2)实验结束,装置冷却后A处观察到的现象是______________________;
(3)金属在生产和生活中有广泛的应用。下列金属制品中,利用金属导热性的是______________________。
A.灯泡中钨丝 B.铝导线 C.铁锅
(4)工业上用含氧化铁480t的赤铁矿为原料炼铁,最多得到多少吨的纯铁?(根据化学方程式进行计算,写出完整的计算过程) _____________
23.金属用途广泛,其结构和性质等是化学研究的重要内容。
(1)铁、铜、铝是人们广泛利用的三种金属,人类大规模开发利用这三种金属的先后顺序是____(填元素符号)。
(2)铝的活动性比铁强,但铝却能在空气中表现出好的抗腐蚀性能,为什么?
(3)某化学小组用一定量硝酸银和硝酸铜的混合溶液进行了如图实验,并对溶液 A 和固体 B 的成分进行了分析和实验探究。
①若溶液A中的溶质只有一种,请分析固体B的成分_______。
②写出探究过程中任一反应的化学方程式_______。
(4)如图为CO还原氧化铁的微型装置图。A处V型管内发生反应的化学方程式为______;从环保角度考虑,请写出一种尾气处理方法_______。
(5)黄铜是铜锌合金,常用于制造机器、电器零件等。为测定黄铜样品中铜的质量分数,取20g该黄铜样品加入到100g稀硫酸中,恰好完全反应,产生氢气0.2g。请计算该黄铜样品中铜的质量分数_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.B
3.B
4.C
5.D
6.D
7.A
8.A
9.B
10.D
11.正确
12.正确
13.错误
14.正确
15.√
16.(1)氧气
(2)刷漆
(3)吸附
(4)去除可燃物
(5)低
17.(1) +5 含碳量
(2)隔绝氧气和水
18. 表面形成致密的氧化膜,防止里面的铝继续被氧化 氧气和水 FeSO4
19. 氧气(O2) Al2O3 ①③
20. ③ 隔绝氧气和水 K+ +6 65:32
21.(1)为了防止燃烧时生成的熔融物溅落使瓶底炸裂
(2)10%
(3) 氧气浓度越高,铁丝燃烧越剧烈 氧气没有达到一定浓度,物质也不能燃烧
(4)氧气的体积分数越低,表示耗氧量越高,在有水的条件下的耗氧量高于无水条件下
(5)加入食盐水后的耗氧量增加
(6)防止与空气中的水和氧气接触,影响实验结果
(7) 5g铁粉,水10滴 5g铁粉,水10滴,0.1g碳粉
22.(1)缺少尾气的处理装置
(2)红棕色固体逐渐变成黑色
(3)C
(4)设:最多得到纯铁的质量为x
x=336t
答:最多得到336吨的纯铁。
23.(1)Cu、Fe、Al
(2)铝的化学性质比较活泼,常温下,铝能与空气中的氧气反应,在其表面形成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化
(3) Cu、Ag或Fe、Cu、Ag 或
(4)
在末端加一个燃着的酒精灯或绑一个气球
(5)解:设该样品中锌的质量为x
x=6.5g
故该黄铜中铜的质量分数为:
答:该黄铜样品中铜的质量分数为67.5%。
答案第1页,共2页
答案第1页,共2页
