第十一章酸与碱同步练习京改版化学九年级下册(有答案)
文档属性
| 名称 | 第十一章酸与碱同步练习京改版化学九年级下册(有答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 172.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 00:00:00 | ||
图片预览



文档简介
第十一章酸与碱同步练习京改版化学九年级下册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列有关物质的性质与用途对应关系正确的是
A.石墨质软,可用于电池电极
B.不锈钢的硬度较大,可用于制作医疗器械
C.液态氧具有助燃性,用作火箭推进燃料
D.固体氢氧化钠有吸水性,可用作干燥剂
2.下列变化中发生化学变化的是
A.氢氧化钠固体潮解 B.白糖晶体的生成 C.明矾净水 D.探究分子的运动
A.A B.B C.C D.D
3.安全重于泰山,化学实验正确操作十分重要。下列操作错误的是
A.不用手接触药品不品尝药品 B.不慎将少量酸沾皮肤上应立即涂碳酸氢钠溶液
C.用完酒精灯必须用灯帽盖灭 D.实验室剩余药品不放回原瓶要放入指定容器中
4.下列鉴别和除杂的方法不正确的
选项 实验目的 实验方案
A 鉴别NaOH和NaCl两种固体 分别加入少量水溶解
B 鉴别 加入肥皂水
C 除去氧化铜中少量碳粉 在空气中灼烧
D 除去NaCl中的Na2CO3 加入足量稀硫酸,蒸发结晶
A.A B.B C.C D.D
5.一些食物的近似如下表所示,下列说法不正确的是
食物 葡萄汁 苹果汁 牛奶 鸡蛋清
3.5~4.5 2.9~3.3 6.3~6.6 7.6~8.0
A.上述食物中酸性最强的是苹果汁
B.胃酸过多的人应少饮葡萄汁和苹果汁
C.蚊虫叮咬处涂抹一些鸡蛋清可减轻痛痒
D.鸡蛋清和牛奶都显碱性
6.下列实验操作、实验现象与结论对应关系不正确的是
选项 实验操作 实验现象 结论
A 将硝酸铵固体放入水中 溶液温度降低 物质溶解伴随能量变化
B 将带火星的木条伸入盛有某气体的集气瓶中 木条复燃 说明该气体是氧气
C 向水中通入二氧化碳 无明显现象 二者之间不发生反应
D 取某氢氧化钠溶液样品于试管中,加入足量 稀盐酸 产生大量气泡 该氢氧化钠溶液一定变质
A.A B.B C.C D.D
7.在托盘天平的两盘上各放一个等质量的烧杯,在两个烧杯里分别加入50g溶质质量分数为14.6%的稀盐酸,将天平调节至平衡。然后向左盘烧杯中投入一定质量的碳酸钠固体,向右盘烧杯中投入一定质量的镁,均恰好完全反应,天平发生偏转。则下列各项操作中,能使天平重新达到平衡的是
A.将游码向右移动4.2g B.向右盘烧杯中再加入4g稀盐酸
C.在右盘上放4.8g镁 D.在左盘上放4g碳酸钠固体
8.物质的性质在很大程度上决定了物质的用途。下列物质的性质与用途对应关系错误的是
A.干冰升华时吸收大量的热——用于人工降雨
B.石墨具有导电性——作干电池的电极
C.浓硫酸易吸水——作某些气体的干燥剂
D.氮气难溶于水——作保护气
9.物质的用途利用其化学性质的是
A.生石灰做干燥剂 B.石墨做电极
C.稀有气体制霓虹灯 D.干冰做制冷剂
10.分析推理是化学学习过程中的常用方法,以下推理正确的是
A.单质中只含有一种元素,因此只含有一种元素的物质一定是单质
B.在同一化合物中,金属元素显正价,则非金属元素一定显负价
C.可燃物燃烧时温度需要达到着火点,所以降温至着火点以下能灭火
D.活泼金属能与稀盐酸反应产生气泡,则加入稀盐酸出现气泡的物质一定是活泼金属
二、判断题
11.测定溶液的pH时,试纸不可事先用蒸馏水润湿,因为润湿试纸相当于稀释被检验的溶液,这将导致测量不准确,若该溶液为酸性溶液,则pH偏高,若该溶液为碱性溶液,则pH偏低。测中性溶液时无影响。_____
12.鉴别稀硫酸、NaCl和KOH三种无色溶液:选用酚酞溶液( )
13.酸性溶液就一定是酸,碱性溶液就一定是碱。( )
14.酸性溶液的pH都小于7,所以酸溶液的pH一定小于7( )
15.向氢氧化钠溶液中加入盐酸后,混合溶液的温度降低( )
三、填空题
16.写出下列变化的化学方程式:
(1)用稀硫酸除铁锈:_________________________________。
(2)用氯酸钾与二氧化锰混合加热制氧气:_________________________________________。
17.请完成下列反应方程式:
(1)盐酸除铁锈______。
(2)白磷在氧气中燃烧______。
18.实验是科学探究的重要途径,请将下列有关实验问题填写完整。
(1)除去CaO中的CaCO3应该用的方法是._____。
(2)测定某溶液的pH时,先用水将pH试纸润湿会使结果_____(选填“偏大偏小”“不变”或“无法确定”)。
19.下列物质暴露在空气中质量会增加,但无新物质生成的是____;质量增加,且变质的是______。
A.浓硫酸 B.浓盐酸 C.铁 D.碳粉 E.生石灰 F.熟石灰 G.烧碱固体
20.清洁剂在日常生活中应用广泛。
(1)厨房炉具清洁剂的主要成分为NaOH,使用时要戴上橡胶手套,其原因是___________。
(2)“水垢净”的有效成分为盐酸,可去除水垢[主要成分CaCO3、Mg(OH)2],反应的化学方程式为___________(写出一个即可)。
四、综合应用题
21.碱式碳酸铜〔Cu2(OH)2CO3〕是孔雀石的主要成分,主要用于生产油漆、颜料等。兴趣小组探究碱式碳酸铜制备的最佳实验条件。
【查阅资料】碱式碳酸铜是翠绿色、难溶于水的固体,酸性条件下不稳定。
【进行实验】按下表中的数据进行图示实验,记录实验结果。
序号 CuSO4溶液体积/mL Na2CO3溶液体积/mL 水浴温度/℃ 固体颜色
i 50 60 60 蓝绿
ii 50 60 70 翠绿
iii 50 60 80 暗绿
iv 50 70 70 蓝绿
v 50 50 x 蓝绿
【解释与结论】
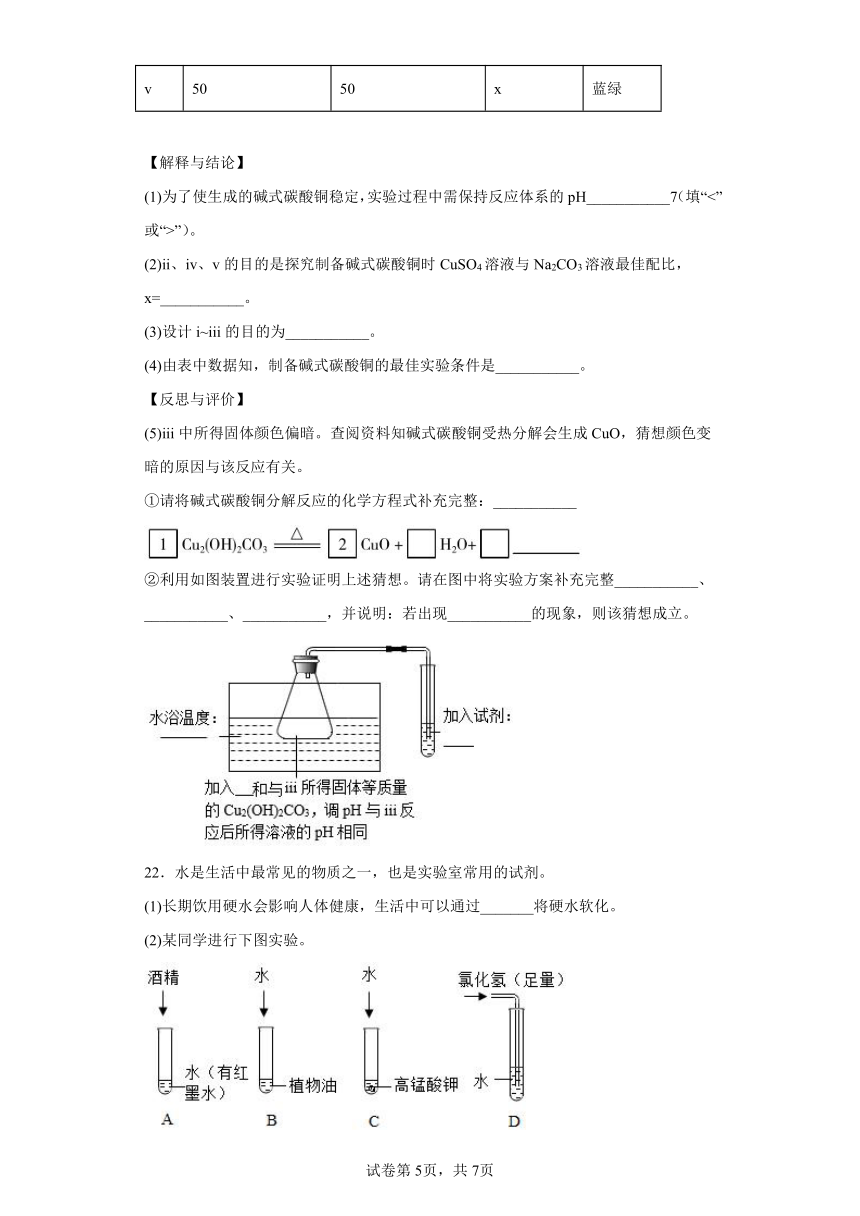
(1)为了使生成的碱式碳酸铜稳定,实验过程中需保持反应体系的pH___________7(填“<”或“>”)。
(2)ii、iv、v的目的是探究制备碱式碳酸铜时CuSO4溶液与Na2CO3溶液最佳配比,x=___________。
(3)设计i~iii的目的为___________。
(4)由表中数据知,制备碱式碳酸铜的最佳实验条件是___________。
【反思与评价】
(5)iii中所得固体颜色偏暗。查阅资料知碱式碳酸铜受热分解会生成CuO,猜想颜色变暗的原因与该反应有关。
①请将碱式碳酸铜分解反应的化学方程式补充完整:___________
②利用如图装置进行实验证明上述猜想。请在图中将实验方案补充完整___________、___________、___________,并说明:若出现___________的现象,则该猜想成立。
22.水是生活中最常见的物质之一,也是实验室常用的试剂。
(1)长期饮用硬水会影响人体健康,生活中可以通过_______将硬水软化。
(2)某同学进行下图实验。
①倾斜A试管,沿内壁缓缓加入酒精,不振荡,现象是________。
②由以上实验可知,溶质状态可以是_________。
③实验结束后,用洗涤剂洗净B试管,原理是_________。
(3)某工厂用电解水的方法制取氧气,发现氧气的产量略小于理论值,且所得氧气中有淡淡的鱼腥气味(每个具有鱼腥气味的气体分子由三个原子构成)。从元素守恒角度分析,该鱼腥气味的气体是_________(填化学式或名称)。水通电分解时没有发生变化的是_________(填序号)。
①水分子的能量
②水分子的组成和结构
③水的化学性质
④构成水分子的原子种类
(4)硫酸钠溶于水能离解出自由移动的_____、_____(填符号),因此硫酸钠溶液能导电。
(5)电解水时,在水中加入少量硫酸钠可增强导电性。某兴趣小组把4.0g硫酸钠固体加入86.8g水中,充分溶解后进行电解。一段时间后停止通电,在试管A中收集到1.2g气体(装置如图)。回答下列问题:
①B管中收集到的气体是_______,其质量是________g。
②电解后溶液中硫酸钠的质量分数是多少_____?(写出计算过程)
23.铅蓄电池的拆解、回收和利用可以减少其对环境的污染,具有重要的可持续发展意义。利用废铅蓄电池的铅膏(主要成分为PbSO4、PbO2,还有少量Pb、Al2O3)制备PbO的工艺流程如图所示。回答下列问题。
已知:Pb、PbO2不溶于NaOH溶液,也不与NaOH溶液反应。
(1)“研磨”的目的是____________。
(2)在废铅膏粉中加入NaOH溶液的作用:
①与PbSO4反应生成PbO、Na2SO4和H2O;
②与Al2O3反应生成偏铝酸钠(NaA1O2)和一种常用的溶剂,该反应的化学方程式为____________。
(3)滤液I中的阴离子除A1O2-外,还有__________(填离子符号)。
(4)PbO2、Pb→PbO的过程中,铅元素(Pb)的化合价 (填标号)。
A.升高 B.降低 C.不变
(5)在实际工业生产中废铅膏中的PbSO4与NaOH溶液反应转化生成PbO,该反应的化学方程式为。若2kgNaOH溶液与PbSO4恰好完全反应得到2.23kgPbO。请计算:
①参加反应的PbSO4的质量_____。
②所用NaOH溶液中溶质的质量分数_____。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.C
3.B
4.D
5.D
6.C
7.B
8.D
9.A
10.C
11.正确
12.错误
13.×
14.正确
15.错误
16.
17.
18. 高温煅烧(合理即可) 无法确定
19. A C EFG
20.(1)氢氧化钠具有腐蚀性
(2)CaCO3+2HCl=CaCl2+H2O+CO2↑##Mg(OH)2+2HCl=MgCl2+2H2O
21.(1)>
(2)70
(3)探究碱式碳酸铜制备的最佳水浴温度
(4)CuSO4溶液与Na2CO3溶液最佳体积比为5:6,水浴温度为70℃
(5) 1 Cu2(OH)2CO3 2CuO +1 H2O+ 1CO2↑ 80℃ 澄清石灰水 110 mL水 固体颜色变暗,澄清石灰水变浑浊
22.(1)煮沸
(2) 液体分层,上层无色下层红色 固体、液体或气体 乳化作用
(3) O3##臭氧 ④
(4) SO42-##Na+ ##Na+
(5) 氧气##O2 9.6 解:电解后硫酸钠溶液的质量为:
电解后溶液中硫酸钠的质量分数为:
答:电解后溶液中硫酸钠的质量分数5%。
23.(1)增大反应物的接触面积,提高反应速率
(2)
(3)和
(4)AB
(5) 3.03kg 40%
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列有关物质的性质与用途对应关系正确的是
A.石墨质软,可用于电池电极
B.不锈钢的硬度较大,可用于制作医疗器械
C.液态氧具有助燃性,用作火箭推进燃料
D.固体氢氧化钠有吸水性,可用作干燥剂
2.下列变化中发生化学变化的是
A.氢氧化钠固体潮解 B.白糖晶体的生成 C.明矾净水 D.探究分子的运动
A.A B.B C.C D.D
3.安全重于泰山,化学实验正确操作十分重要。下列操作错误的是
A.不用手接触药品不品尝药品 B.不慎将少量酸沾皮肤上应立即涂碳酸氢钠溶液
C.用完酒精灯必须用灯帽盖灭 D.实验室剩余药品不放回原瓶要放入指定容器中
4.下列鉴别和除杂的方法不正确的
选项 实验目的 实验方案
A 鉴别NaOH和NaCl两种固体 分别加入少量水溶解
B 鉴别 加入肥皂水
C 除去氧化铜中少量碳粉 在空气中灼烧
D 除去NaCl中的Na2CO3 加入足量稀硫酸,蒸发结晶
A.A B.B C.C D.D
5.一些食物的近似如下表所示,下列说法不正确的是
食物 葡萄汁 苹果汁 牛奶 鸡蛋清
3.5~4.5 2.9~3.3 6.3~6.6 7.6~8.0
A.上述食物中酸性最强的是苹果汁
B.胃酸过多的人应少饮葡萄汁和苹果汁
C.蚊虫叮咬处涂抹一些鸡蛋清可减轻痛痒
D.鸡蛋清和牛奶都显碱性
6.下列实验操作、实验现象与结论对应关系不正确的是
选项 实验操作 实验现象 结论
A 将硝酸铵固体放入水中 溶液温度降低 物质溶解伴随能量变化
B 将带火星的木条伸入盛有某气体的集气瓶中 木条复燃 说明该气体是氧气
C 向水中通入二氧化碳 无明显现象 二者之间不发生反应
D 取某氢氧化钠溶液样品于试管中,加入足量 稀盐酸 产生大量气泡 该氢氧化钠溶液一定变质
A.A B.B C.C D.D
7.在托盘天平的两盘上各放一个等质量的烧杯,在两个烧杯里分别加入50g溶质质量分数为14.6%的稀盐酸,将天平调节至平衡。然后向左盘烧杯中投入一定质量的碳酸钠固体,向右盘烧杯中投入一定质量的镁,均恰好完全反应,天平发生偏转。则下列各项操作中,能使天平重新达到平衡的是
A.将游码向右移动4.2g B.向右盘烧杯中再加入4g稀盐酸
C.在右盘上放4.8g镁 D.在左盘上放4g碳酸钠固体
8.物质的性质在很大程度上决定了物质的用途。下列物质的性质与用途对应关系错误的是
A.干冰升华时吸收大量的热——用于人工降雨
B.石墨具有导电性——作干电池的电极
C.浓硫酸易吸水——作某些气体的干燥剂
D.氮气难溶于水——作保护气
9.物质的用途利用其化学性质的是
A.生石灰做干燥剂 B.石墨做电极
C.稀有气体制霓虹灯 D.干冰做制冷剂
10.分析推理是化学学习过程中的常用方法,以下推理正确的是
A.单质中只含有一种元素,因此只含有一种元素的物质一定是单质
B.在同一化合物中,金属元素显正价,则非金属元素一定显负价
C.可燃物燃烧时温度需要达到着火点,所以降温至着火点以下能灭火
D.活泼金属能与稀盐酸反应产生气泡,则加入稀盐酸出现气泡的物质一定是活泼金属
二、判断题
11.测定溶液的pH时,试纸不可事先用蒸馏水润湿,因为润湿试纸相当于稀释被检验的溶液,这将导致测量不准确,若该溶液为酸性溶液,则pH偏高,若该溶液为碱性溶液,则pH偏低。测中性溶液时无影响。_____
12.鉴别稀硫酸、NaCl和KOH三种无色溶液:选用酚酞溶液( )
13.酸性溶液就一定是酸,碱性溶液就一定是碱。( )
14.酸性溶液的pH都小于7,所以酸溶液的pH一定小于7( )
15.向氢氧化钠溶液中加入盐酸后,混合溶液的温度降低( )
三、填空题
16.写出下列变化的化学方程式:
(1)用稀硫酸除铁锈:_________________________________。
(2)用氯酸钾与二氧化锰混合加热制氧气:_________________________________________。
17.请完成下列反应方程式:
(1)盐酸除铁锈______。
(2)白磷在氧气中燃烧______。
18.实验是科学探究的重要途径,请将下列有关实验问题填写完整。
(1)除去CaO中的CaCO3应该用的方法是._____。
(2)测定某溶液的pH时,先用水将pH试纸润湿会使结果_____(选填“偏大偏小”“不变”或“无法确定”)。
19.下列物质暴露在空气中质量会增加,但无新物质生成的是____;质量增加,且变质的是______。
A.浓硫酸 B.浓盐酸 C.铁 D.碳粉 E.生石灰 F.熟石灰 G.烧碱固体
20.清洁剂在日常生活中应用广泛。
(1)厨房炉具清洁剂的主要成分为NaOH,使用时要戴上橡胶手套,其原因是___________。
(2)“水垢净”的有效成分为盐酸,可去除水垢[主要成分CaCO3、Mg(OH)2],反应的化学方程式为___________(写出一个即可)。
四、综合应用题
21.碱式碳酸铜〔Cu2(OH)2CO3〕是孔雀石的主要成分,主要用于生产油漆、颜料等。兴趣小组探究碱式碳酸铜制备的最佳实验条件。
【查阅资料】碱式碳酸铜是翠绿色、难溶于水的固体,酸性条件下不稳定。
【进行实验】按下表中的数据进行图示实验,记录实验结果。
序号 CuSO4溶液体积/mL Na2CO3溶液体积/mL 水浴温度/℃ 固体颜色
i 50 60 60 蓝绿
ii 50 60 70 翠绿
iii 50 60 80 暗绿
iv 50 70 70 蓝绿
v 50 50 x 蓝绿
【解释与结论】
(1)为了使生成的碱式碳酸铜稳定,实验过程中需保持反应体系的pH___________7(填“<”或“>”)。
(2)ii、iv、v的目的是探究制备碱式碳酸铜时CuSO4溶液与Na2CO3溶液最佳配比,x=___________。
(3)设计i~iii的目的为___________。
(4)由表中数据知,制备碱式碳酸铜的最佳实验条件是___________。
【反思与评价】
(5)iii中所得固体颜色偏暗。查阅资料知碱式碳酸铜受热分解会生成CuO,猜想颜色变暗的原因与该反应有关。
①请将碱式碳酸铜分解反应的化学方程式补充完整:___________
②利用如图装置进行实验证明上述猜想。请在图中将实验方案补充完整___________、___________、___________,并说明:若出现___________的现象,则该猜想成立。
22.水是生活中最常见的物质之一,也是实验室常用的试剂。
(1)长期饮用硬水会影响人体健康,生活中可以通过_______将硬水软化。
(2)某同学进行下图实验。
①倾斜A试管,沿内壁缓缓加入酒精,不振荡,现象是________。
②由以上实验可知,溶质状态可以是_________。
③实验结束后,用洗涤剂洗净B试管,原理是_________。
(3)某工厂用电解水的方法制取氧气,发现氧气的产量略小于理论值,且所得氧气中有淡淡的鱼腥气味(每个具有鱼腥气味的气体分子由三个原子构成)。从元素守恒角度分析,该鱼腥气味的气体是_________(填化学式或名称)。水通电分解时没有发生变化的是_________(填序号)。
①水分子的能量
②水分子的组成和结构
③水的化学性质
④构成水分子的原子种类
(4)硫酸钠溶于水能离解出自由移动的_____、_____(填符号),因此硫酸钠溶液能导电。
(5)电解水时,在水中加入少量硫酸钠可增强导电性。某兴趣小组把4.0g硫酸钠固体加入86.8g水中,充分溶解后进行电解。一段时间后停止通电,在试管A中收集到1.2g气体(装置如图)。回答下列问题:
①B管中收集到的气体是_______,其质量是________g。
②电解后溶液中硫酸钠的质量分数是多少_____?(写出计算过程)
23.铅蓄电池的拆解、回收和利用可以减少其对环境的污染,具有重要的可持续发展意义。利用废铅蓄电池的铅膏(主要成分为PbSO4、PbO2,还有少量Pb、Al2O3)制备PbO的工艺流程如图所示。回答下列问题。
已知:Pb、PbO2不溶于NaOH溶液,也不与NaOH溶液反应。
(1)“研磨”的目的是____________。
(2)在废铅膏粉中加入NaOH溶液的作用:
①与PbSO4反应生成PbO、Na2SO4和H2O;
②与Al2O3反应生成偏铝酸钠(NaA1O2)和一种常用的溶剂,该反应的化学方程式为____________。
(3)滤液I中的阴离子除A1O2-外,还有__________(填离子符号)。
(4)PbO2、Pb→PbO的过程中,铅元素(Pb)的化合价 (填标号)。
A.升高 B.降低 C.不变
(5)在实际工业生产中废铅膏中的PbSO4与NaOH溶液反应转化生成PbO,该反应的化学方程式为。若2kgNaOH溶液与PbSO4恰好完全反应得到2.23kgPbO。请计算:
①参加反应的PbSO4的质量_____。
②所用NaOH溶液中溶质的质量分数_____。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.C
3.B
4.D
5.D
6.C
7.B
8.D
9.A
10.C
11.正确
12.错误
13.×
14.正确
15.错误
16.
17.
18. 高温煅烧(合理即可) 无法确定
19. A C EFG
20.(1)氢氧化钠具有腐蚀性
(2)CaCO3+2HCl=CaCl2+H2O+CO2↑##Mg(OH)2+2HCl=MgCl2+2H2O
21.(1)>
(2)70
(3)探究碱式碳酸铜制备的最佳水浴温度
(4)CuSO4溶液与Na2CO3溶液最佳体积比为5:6,水浴温度为70℃
(5) 1 Cu2(OH)2CO3 2CuO +1 H2O+ 1CO2↑ 80℃ 澄清石灰水 110 mL水 固体颜色变暗,澄清石灰水变浑浊
22.(1)煮沸
(2) 液体分层,上层无色下层红色 固体、液体或气体 乳化作用
(3) O3##臭氧 ④
(4) SO42-##Na+ ##Na+
(5) 氧气##O2 9.6 解:电解后硫酸钠溶液的质量为:
电解后溶液中硫酸钠的质量分数为:
答:电解后溶液中硫酸钠的质量分数5%。
23.(1)增大反应物的接触面积,提高反应速率
(2)
(3)和
(4)AB
(5) 3.03kg 40%
答案第1页,共2页
答案第1页,共2页
