第九单元 溶液 检测题(有答案)
图片预览

文档简介
第九单元《溶液》检测题
一、单选题
1.溶液在我们生活中有着广泛的用途。下列物质不属于溶液的是
A.白酒
B.蒸馏水
C.医用酒精
D.生理盐水
2.要想从食盐溶液中得到食盐晶体,宜采取的方法是( )
A.蒸发溶剂的方法 B.冷却热饱和溶液的方法
C.倒掉部分溶液的方法 D.升高温度的方法
3.分类是认识和研究物质及其变化的常用的科学方法,如物质可分为纯净物和混合物。下列物质属于化合物的是
A.盐酸 B.镁铝合金 C.氢氧化钠 D.氮气
4.下列饮料中,不属于溶液的是
A.汽水 B.白酒
C.酸奶 D.苏打水
5.把下列生活中常见的物质分别放入水中,充分搅拌,可以得到溶液的是
A.面粉 B.酒精 C.花生油 D.泥土
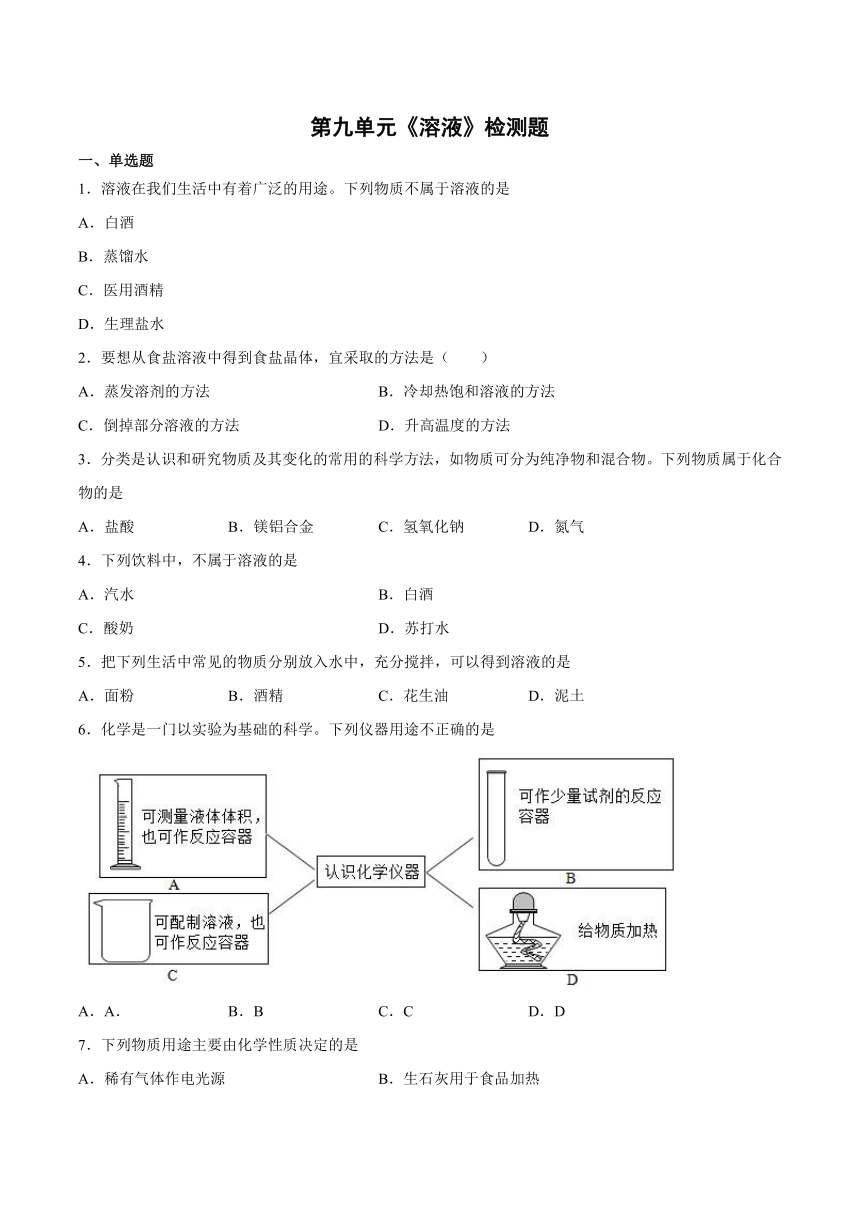
6.化学是一门以实验为基础的科学。下列仪器用途不正确的是
A.A. B.B C.C D.D
7.下列物质用途主要由化学性质决定的是
A.稀有气体作电光源 B.生石灰用于食品加热
C.液氮制造低温环境 D.氯化钠配制生理盐水
8.下列说法正确的是( )
A.均一、稳定的液体都是溶液
B.溶质均以离子形式分散到溶剂中
C.同一温度下,硝酸钾的饱和溶液比不饱和溶液浓
D.饱和溶液析出晶体后溶质质量分数一定变小
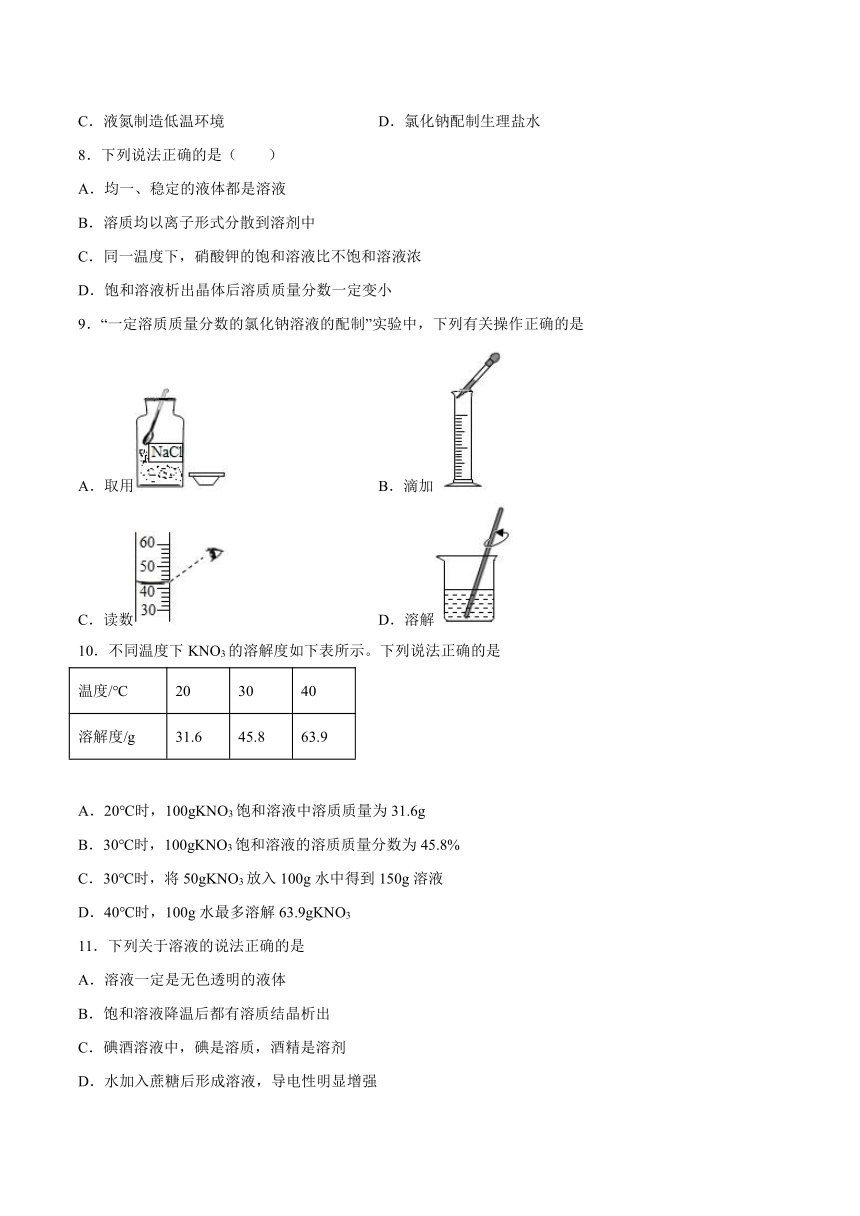
9.“一定溶质质量分数的氯化钠溶液的配制”实验中,下列有关操作正确的是
A.取用 B.滴加
C.读数 D.溶解
10.不同温度下KNO3的溶解度如下表所示。下列说法正确的是
温度/℃ 20 30 40
溶解度/g 31.6 45.8 63.9
A.20℃时,100gKNO3饱和溶液中溶质质量为31.6g
B.30℃时,100gKNO3饱和溶液的溶质质量分数为45.8%
C.30℃时,将50gKNO3放入100g水中得到150g溶液
D.40℃时,100g水最多溶解63.9gKNO3
11.下列关于溶液的说法正确的是
A.溶液一定是无色透明的液体
B.饱和溶液降温后都有溶质结晶析出
C.碘酒溶液中,碘是溶质,酒精是溶剂
D.水加入蔗糖后形成溶液,导电性明显增强
12.某同学配制100g质量分数为11%的葡萄糖溶液,下列操作会导致所配溶液浓度偏高的是
A.用托盘天平称葡萄糖时,砝码放在左盘 B.转移葡萄糖时,纸上有少量残留
C.用量筒量取水时,俯视液面 D.配好溶液装入试剂瓶时,有少量洒出
二、填空题
13.写出下列溶液中溶质的化学式:
①石灰水_____;
②盐酸_____;
③食盐水_____;
④白磷的二硫化碳溶液_____;
⑤医用酒精_____;
⑥锌粒溶于硫酸中_____。
14.实验室配制一定溶质质量分数的氯化钠溶液时,所需氯化钠固体应放在托盘天平的____(填“左盘”或“右盘”)。上进行称量;若所配制溶质溶液的质量分数偏大,则可能是量取水时______( 填“俯视”或“仰视”)量筒读数所致。
15.用氢氧化钠固体和水配制3%的氢氧化钠溶液,若量取水时仰视读数,其它操作均正确,则配制的氢氧化钠溶液中溶质质量分数____________3%(填“>”“<”或“=”)。实验室中可以通过____________的方法将硬水软化。
三、推断题
16.已知,A、B、C、D四种物质之间存在以下转化关系。其中C是单质,D是相对分子质量最小的氧化物。试回答:
(1)写出A、C、D三种物质的化学式:A ________ 、C ______ 、D __________ 。
(2)浅绿色溶液B中溶质的化学式 _______________ 。
(3)写出A→C的化学方程式: ______________________________ 。
17.同学们到实验室去进行“探究金属的性质”实验。将锌粉和铁粉的混合物加入到盛有一定量硝酸银溶液的烧杯中,充分反应后过滤,得到滤渣和滤液。请你填空。
(1)若将所得滤渣放入稀盐酸中,有气泡产生,则
①滤液里一定含有_____(填写化学式,下同),可能含有_____;
②滤渣中一定含有_____,可能含有_____。
(2)若反应后所得滤液呈无色,则滤渣中一定含有_____(填写化学式)。
(3)反应后所得滤液的溶质质量分数_____(选填“大于”、“等于”或“小于”)原硝酸银溶液的溶质质量分数。
四、实验题
18.化学是一门以实验为基础的科学。
(1)根据下列装置图回答:
①写出仪器a的名称:______。
②实验室用高锰酸钾制取并收集氧气,应选用的装置为______(填序号)。
③实验室用大理石和稀盐酸制取并收集二氧化碳,应选用的装置为______(填序号),反应的化学方程式为______。
④做实验时,不慎碰倒酒精灯,酒精在桌面上燃烧起来,用湿抹布盖在燃烧的酒精上,火焰熄灭。火焰熄灭的原因是降低了温度和______(填序号)。
A.隔绝空气 B.降低着火点 C.清除可燃物
(2)下列选项中,对相应实验描述正确的是______(填序号)。
选项 A B C
实验
实 蜡烛由低到高依次熄灭, 烧杯中饱和石灰水变浑浊,说明氢氧化钠 水溶液呈紫色,汽油的颜色
验描述 说明通常状况下二氧化碳不燃烧,不支持燃烧,密度比空气的大 固体溶于水吸收热量使烧杯中溶液温度降低 不变,说明同一物质在不同溶剂中溶解性不同
A.A B.B C.C
19.实验室常用溶质质量分数为6%的H2O2溶液(MnO2作催化剂)制取氧气。
(1)配制质量分数为6%的H2O2溶液。
①计算:配制150g质量分数为6%的H2O2溶液,需要质量分数为30%(密度为1.1g/cm3)的H2O2溶液体积为______mL(计算结果保留一位小数),水为______g。
②量取:用量筒量取所需H2O2溶液和水,倒入烧杯中。用量筒量取液体时,视线应与______。
③混匀:…。
(2)制取氧气(可能用到的部分装置如图)。
①实验室用氯酸钾(MnO2作催化剂)制取干燥的氧气,选择的发生装置和收集装置为______(填字母),反应的化学方程式为______。
②实验室用发生装置B制取氧气的化学方程式为______。
(3)实验反思。
①若其他操作正确,量取水时俯视读数,则配制的H2O2溶液溶质质量分数______6%(填“>”、“<”或“=”)。
②若用E装置收集一瓶(容积为200mL)体积分数为80%的氧气,预先应用量筒量取______mL的水加入该集气瓶中(不考虑水蒸气的影响)。
五、计算题
20.某补钙药剂的标签主要内容如图所示,现测定该钙片含量是否符合标注,做如下实验:取10片该钙片,放入干燥、洁净的烧杯中,再向烧杯中加入50g某浓度稀盐酸,恰好完全反应(钙片中其他成分不溶于水,也不和稀盐酸反应,反应中产生的气体全部放出),反应后称量烧杯内剩余物质的质量为64.5g.
(1)反应中生成多少克二氧化碳__________?
(2)通过计算说明实际钙含量是否与标注相符__________?
(3)试计算所用稀盐酸的溶质质量分数__________。
21.实验室用68g过氧化氢溶液和2g二氧化锰制取氧气,实验的相关数据如图。
请回答:
(1)二氧化锰作为催化剂在化学反应前后本身的______都没有发生变化;
(2)反应生成氧气的质量为________g。
(3)参加反应过氧化氢溶液的质量分数是____________
参考答案:
1.B 2.A 3.C 4.C 5.B 6.A 7.B 8.C 9.D 10.D 11.C 12.C
13. Ca(OH)2 HCl NaCl P C2H5OH ZnSO4
14. 左盘 俯视
15. < 蒸馏
16.(1) Fe H2 H2O
(2)FeSO4
(3)
17. Zn(NO3)2 Fe(NO3)2 Ag、Fe Zn Ag、Fe 小于
18.(1) 集气瓶 AC(或AD) BD A
(2)AC
19.(1) 27.3 120 液体凹液面的最低处保持水平
(2) AD##DA
(3) > 150
20. 5.5g 不相符 18.25%
21.(1)质量和化学性质(2)1.6(3)5%
一、单选题
1.溶液在我们生活中有着广泛的用途。下列物质不属于溶液的是
A.白酒
B.蒸馏水
C.医用酒精
D.生理盐水
2.要想从食盐溶液中得到食盐晶体,宜采取的方法是( )
A.蒸发溶剂的方法 B.冷却热饱和溶液的方法
C.倒掉部分溶液的方法 D.升高温度的方法
3.分类是认识和研究物质及其变化的常用的科学方法,如物质可分为纯净物和混合物。下列物质属于化合物的是
A.盐酸 B.镁铝合金 C.氢氧化钠 D.氮气
4.下列饮料中,不属于溶液的是
A.汽水 B.白酒
C.酸奶 D.苏打水
5.把下列生活中常见的物质分别放入水中,充分搅拌,可以得到溶液的是
A.面粉 B.酒精 C.花生油 D.泥土
6.化学是一门以实验为基础的科学。下列仪器用途不正确的是
A.A. B.B C.C D.D
7.下列物质用途主要由化学性质决定的是
A.稀有气体作电光源 B.生石灰用于食品加热
C.液氮制造低温环境 D.氯化钠配制生理盐水
8.下列说法正确的是( )
A.均一、稳定的液体都是溶液
B.溶质均以离子形式分散到溶剂中
C.同一温度下,硝酸钾的饱和溶液比不饱和溶液浓
D.饱和溶液析出晶体后溶质质量分数一定变小
9.“一定溶质质量分数的氯化钠溶液的配制”实验中,下列有关操作正确的是
A.取用 B.滴加
C.读数 D.溶解
10.不同温度下KNO3的溶解度如下表所示。下列说法正确的是
温度/℃ 20 30 40
溶解度/g 31.6 45.8 63.9
A.20℃时,100gKNO3饱和溶液中溶质质量为31.6g
B.30℃时,100gKNO3饱和溶液的溶质质量分数为45.8%
C.30℃时,将50gKNO3放入100g水中得到150g溶液
D.40℃时,100g水最多溶解63.9gKNO3
11.下列关于溶液的说法正确的是
A.溶液一定是无色透明的液体
B.饱和溶液降温后都有溶质结晶析出
C.碘酒溶液中,碘是溶质,酒精是溶剂
D.水加入蔗糖后形成溶液,导电性明显增强
12.某同学配制100g质量分数为11%的葡萄糖溶液,下列操作会导致所配溶液浓度偏高的是
A.用托盘天平称葡萄糖时,砝码放在左盘 B.转移葡萄糖时,纸上有少量残留
C.用量筒量取水时,俯视液面 D.配好溶液装入试剂瓶时,有少量洒出
二、填空题
13.写出下列溶液中溶质的化学式:
①石灰水_____;
②盐酸_____;
③食盐水_____;
④白磷的二硫化碳溶液_____;
⑤医用酒精_____;
⑥锌粒溶于硫酸中_____。
14.实验室配制一定溶质质量分数的氯化钠溶液时,所需氯化钠固体应放在托盘天平的____(填“左盘”或“右盘”)。上进行称量;若所配制溶质溶液的质量分数偏大,则可能是量取水时______( 填“俯视”或“仰视”)量筒读数所致。
15.用氢氧化钠固体和水配制3%的氢氧化钠溶液,若量取水时仰视读数,其它操作均正确,则配制的氢氧化钠溶液中溶质质量分数____________3%(填“>”“<”或“=”)。实验室中可以通过____________的方法将硬水软化。
三、推断题
16.已知,A、B、C、D四种物质之间存在以下转化关系。其中C是单质,D是相对分子质量最小的氧化物。试回答:
(1)写出A、C、D三种物质的化学式:A ________ 、C ______ 、D __________ 。
(2)浅绿色溶液B中溶质的化学式 _______________ 。
(3)写出A→C的化学方程式: ______________________________ 。
17.同学们到实验室去进行“探究金属的性质”实验。将锌粉和铁粉的混合物加入到盛有一定量硝酸银溶液的烧杯中,充分反应后过滤,得到滤渣和滤液。请你填空。
(1)若将所得滤渣放入稀盐酸中,有气泡产生,则
①滤液里一定含有_____(填写化学式,下同),可能含有_____;
②滤渣中一定含有_____,可能含有_____。
(2)若反应后所得滤液呈无色,则滤渣中一定含有_____(填写化学式)。
(3)反应后所得滤液的溶质质量分数_____(选填“大于”、“等于”或“小于”)原硝酸银溶液的溶质质量分数。
四、实验题
18.化学是一门以实验为基础的科学。
(1)根据下列装置图回答:
①写出仪器a的名称:______。
②实验室用高锰酸钾制取并收集氧气,应选用的装置为______(填序号)。
③实验室用大理石和稀盐酸制取并收集二氧化碳,应选用的装置为______(填序号),反应的化学方程式为______。
④做实验时,不慎碰倒酒精灯,酒精在桌面上燃烧起来,用湿抹布盖在燃烧的酒精上,火焰熄灭。火焰熄灭的原因是降低了温度和______(填序号)。
A.隔绝空气 B.降低着火点 C.清除可燃物
(2)下列选项中,对相应实验描述正确的是______(填序号)。
选项 A B C
实验
实 蜡烛由低到高依次熄灭, 烧杯中饱和石灰水变浑浊,说明氢氧化钠 水溶液呈紫色,汽油的颜色
验描述 说明通常状况下二氧化碳不燃烧,不支持燃烧,密度比空气的大 固体溶于水吸收热量使烧杯中溶液温度降低 不变,说明同一物质在不同溶剂中溶解性不同
A.A B.B C.C
19.实验室常用溶质质量分数为6%的H2O2溶液(MnO2作催化剂)制取氧气。
(1)配制质量分数为6%的H2O2溶液。
①计算:配制150g质量分数为6%的H2O2溶液,需要质量分数为30%(密度为1.1g/cm3)的H2O2溶液体积为______mL(计算结果保留一位小数),水为______g。
②量取:用量筒量取所需H2O2溶液和水,倒入烧杯中。用量筒量取液体时,视线应与______。
③混匀:…。
(2)制取氧气(可能用到的部分装置如图)。
①实验室用氯酸钾(MnO2作催化剂)制取干燥的氧气,选择的发生装置和收集装置为______(填字母),反应的化学方程式为______。
②实验室用发生装置B制取氧气的化学方程式为______。
(3)实验反思。
①若其他操作正确,量取水时俯视读数,则配制的H2O2溶液溶质质量分数______6%(填“>”、“<”或“=”)。
②若用E装置收集一瓶(容积为200mL)体积分数为80%的氧气,预先应用量筒量取______mL的水加入该集气瓶中(不考虑水蒸气的影响)。
五、计算题
20.某补钙药剂的标签主要内容如图所示,现测定该钙片含量是否符合标注,做如下实验:取10片该钙片,放入干燥、洁净的烧杯中,再向烧杯中加入50g某浓度稀盐酸,恰好完全反应(钙片中其他成分不溶于水,也不和稀盐酸反应,反应中产生的气体全部放出),反应后称量烧杯内剩余物质的质量为64.5g.
(1)反应中生成多少克二氧化碳__________?
(2)通过计算说明实际钙含量是否与标注相符__________?
(3)试计算所用稀盐酸的溶质质量分数__________。
21.实验室用68g过氧化氢溶液和2g二氧化锰制取氧气,实验的相关数据如图。
请回答:
(1)二氧化锰作为催化剂在化学反应前后本身的______都没有发生变化;
(2)反应生成氧气的质量为________g。
(3)参加反应过氧化氢溶液的质量分数是____________
参考答案:
1.B 2.A 3.C 4.C 5.B 6.A 7.B 8.C 9.D 10.D 11.C 12.C
13. Ca(OH)2 HCl NaCl P C2H5OH ZnSO4
14. 左盘 俯视
15. < 蒸馏
16.(1) Fe H2 H2O
(2)FeSO4
(3)
17. Zn(NO3)2 Fe(NO3)2 Ag、Fe Zn Ag、Fe 小于
18.(1) 集气瓶 AC(或AD) BD A
(2)AC
19.(1) 27.3 120 液体凹液面的最低处保持水平
(2) AD##DA
(3) > 150
20. 5.5g 不相符 18.25%
21.(1)质量和化学性质(2)1.6(3)5%
同课章节目录
