人教版化学必修一4.3化学键(1)课件.pptx(17张ppt)
文档属性
| 名称 | 人教版化学必修一4.3化学键(1)课件.pptx(17张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 34.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 19:12:17 | ||
图片预览


文档简介
(共17张PPT)
吴 彦
微粒间的相互作用
——离子键
第四章 物质结构 元素周期律
第三节 化学键(1)
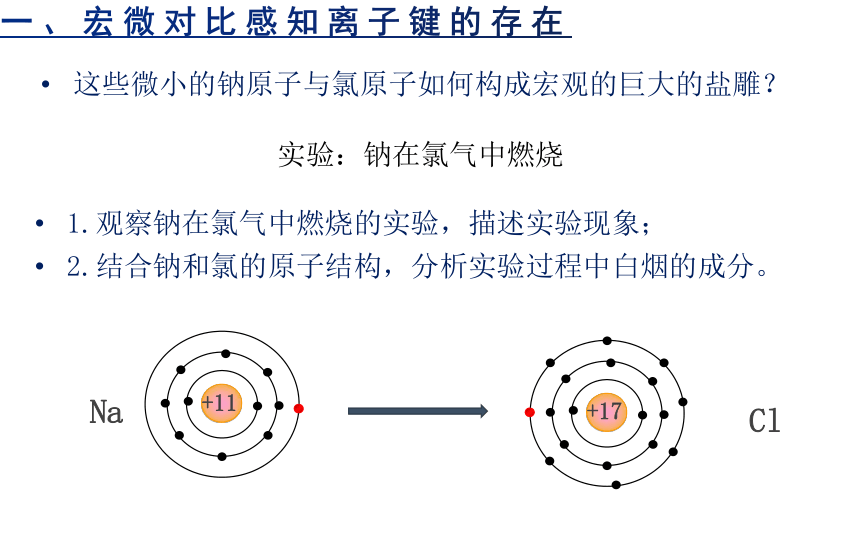
一、宏微对比感知离子键的存在
雕塑的材质是什么?
已知该盐雕的主要成分为食盐,试分析计算该盐雕中约有多少个钠原子与氯原子
青海茶卡盐湖世界最大的盐雕
成吉思汗像
重 4800 吨!
1031!
一、宏微对比感知离子键的存在
这些微小的钠原子与氯原子如何构成宏观的巨大的盐雕?
实验:钠在氯气中燃烧
1.观察钠在氯气中燃烧的实验,描述实验现象;
2.结合钠和氯的原子结构,分析实验过程中白烟的成分。
Na
Cl
+17
+11
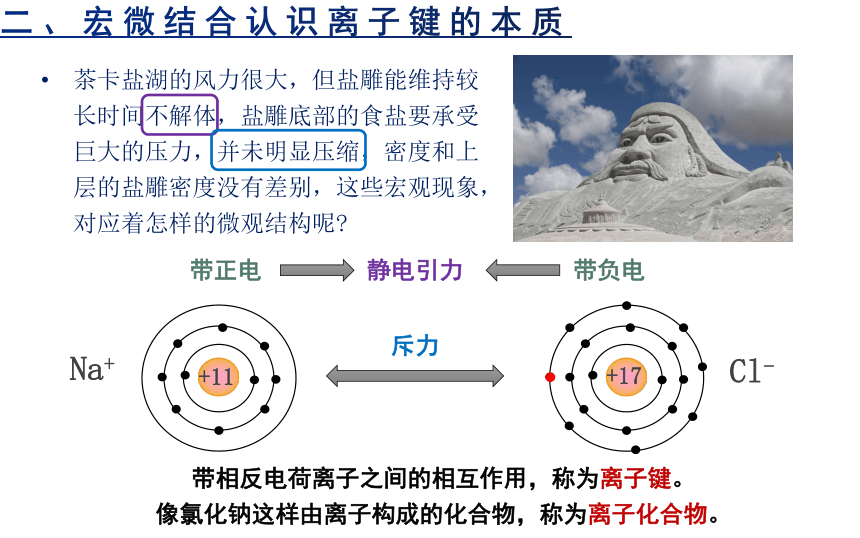
二、宏微结合认识离子键的本质
茶卡盐湖的风力很大,但盐雕能维持较长时间不解体,盐雕底部的食盐要承受巨大的压力,并未明显压缩,密度和上层的盐雕密度没有差别,这些宏观现象,对应着怎样的微观结构呢
Na+
Cl-
带正电
带负电
静电引力
斥力
带相反电荷离子之间的相互作用,称为离子键。
像氯化钠这样由离子构成的化合物,称为离子化合物。
+17
+11
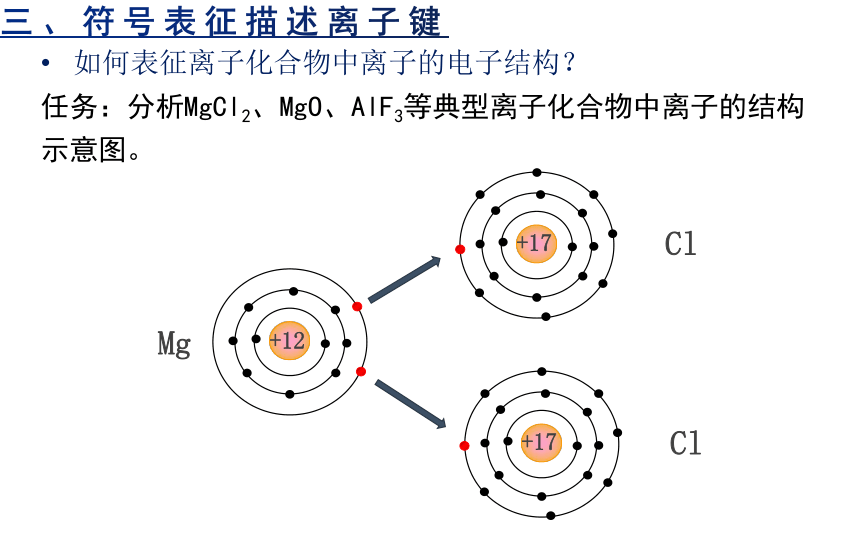
三、符号表征描述离子键
如何表征离子化合物中离子的电子结构?
任务:分析MgCl2、MgO、AlF3等典型离子化合物中离子的结构示意图。
Mg
+12
Cl
+17
Cl
+17
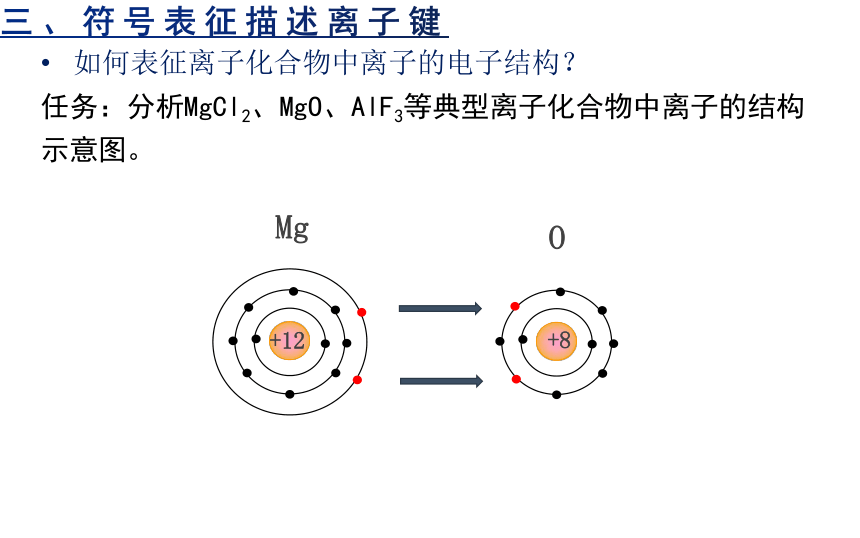
三、符号表征描述离子键
如何表征离子化合物中离子的电子结构?
任务:分析MgCl2、MgO、AlF3等典型离子化合物中离子的结构示意图。
Mg
+12
O
+8
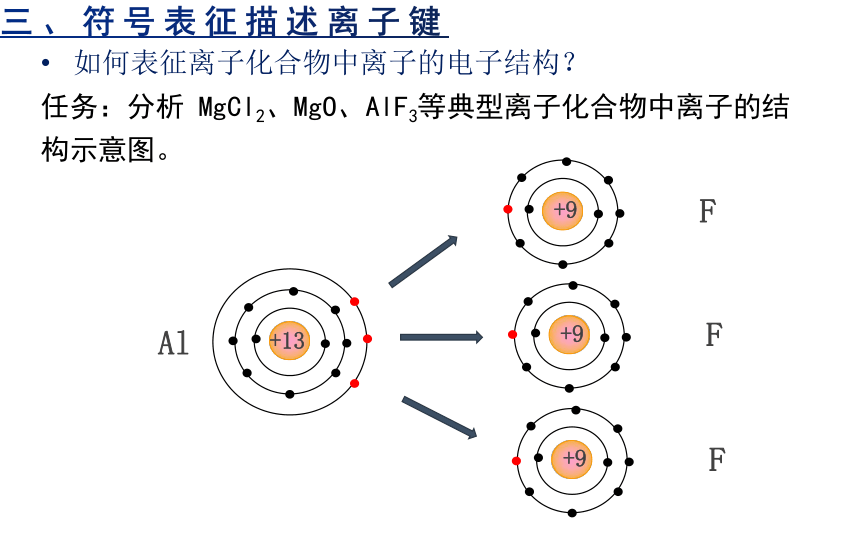
三、符号表征描述离子键
如何表征离子化合物中离子的电子结构?
任务:分析 MgCl2、MgO、AlF3等典型离子化合物中离子的结构示意图。
Al
+13
F
+9
F
+9
F
+9
三、符号表征描述离子键
在绝大多数简单离子化合物中,离子的电子结构是怎样的?
在离子化合物中,阴阳离子的排列有何规律,在书写电子式时,如何表示这种规律
1.能体现离子化合物对应的元素;
2.能体现离子化合物中阴阳离子的交替排列;
3.能体现离子的价电子结构。
Na+[ ]-
:
. .
. .
Cl
[ ]-
:
. .
.
F
[ ]-Al3+[ ]-
:
. .
. .
F
:
. .
. .
F
:
×
[ ]-Mg2+[ ]-
:
. .
. .
Cl
. .
. .
Cl
:
Mg2+[ ]2-
. .
. .
O
×
×
:
如何表征离子化合物中离子的电子结构?
三、符号表征描述离子键
如何用电子式表示离子化合物的形成过程?
Na×+ →Na+[ ]-
:
. .
. .
· Cl
:
. .
. .
Cl
+×Mg×+ →[ ]-Mg2+[ ]-
:
. .
. .
Cl ·
:
. .
. .
·Cl
:
. .
. .
Cl
:
. .
. .
Cl
Mg + →Mg2+[ ]2-
:
. .
. .
:
. .
. .
O
×
×
O
×
×
AB型(如NaCl)
AB2型(如MgCl2):
四、实践研究离子键的破坏与形成
茶卡盐湖的盐雕,主要原料是盐湖产的食盐,那么这些小颗粒的食盐是如何组成巨大的盐雕的呢?
青盐颗粒变为盐雕的过程中,要形成部分新的离子键,可以加热熔化后冷却或让食盐溶解后再析出。加热熔化能耗过高,很难实现。真实的盐雕是将青盐颗粒和卤水按一定比例混合,在茶卡盐湖大蒸发量的气候中风干,即可成型。
课堂总结
Na+
Cl-
带正电
带负电
静电引力
斥力
带相反电荷离子之间的相互作用,称为离子键。
像氯化钠这样由离子构成的化合物,称为离子化合物。
Na×+ →Na+[ ]-
:
. .
. .
· Cl
:
. .
. .
Cl
1.短周期元素W、X、Y、Z的原子序数依次增加。元素Z的单质通常为黄绿色气体,元素W的单质能在元素Z的单质中燃烧,发出苍白色火焰。元素Y是地壳中含量最高的元素,元素X的最外层电子数是其周期序数的2倍。下列说法正确的是 ( )
A.X的最高价氧化物的水化物为强酸
B.元素的非金属性Z>X>Y
C.原于半径的大小WD.Y的氢化物常温常压下为液态
D
2.元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族元素的原子、最外层电子数相同,化学性质完全相同
B
3.2016年IUPAC命名117号元素为Ts(中文名“ ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是( )
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同主族元素中非金属性最弱
D.HTs易溶于水,稳定性强,还原性强
D
4.1934年约里奥 居里夫妇在核反应中用α粒子(即氦核He)轰击金属原子X,得到核素Y,开创了人造放射性核素的先河:X+He―→Y+n 其中元素X、Y的最外层电子数之和为8。下列叙述正确的是( )
A.X的相对原子质量为26
B.X、Y均可形成三氯化物
C.X的原子半径小于Y的
D.Y仅有一种含氧酸
B
5.四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是( )
A.Y的最高价氧化物对应水化物的酸性比X的强
B.原子半径:ZC.X的简单气态氢化物的热稳定性比Z的强
D.X的最高化合价与负化合价的代数和为0
C
6.A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素。请回答下列问题:
(1)C在元素周期表中的位置为____,G的原子结构示意图是_____。
(2)D与E按原子个数比1∶1形成化合物甲,其化学式为____________,向甲中滴加足量水时发生反应的化学方程式是_____________________________。
(3)E、F、G形成的简单离子,半径由大到小顺序是_________
_______________。(用离子符号表示)
(4)B、C、D的简单氢化物的还原性强弱顺序为______________(填分子式,下同)热稳定强弱顺序为______________。
(5)F、G的最高价氧化物的水化物的分子式为________________,酸性较强为________________。
吴 彦
微粒间的相互作用
——离子键
第四章 物质结构 元素周期律
第三节 化学键(1)
一、宏微对比感知离子键的存在
雕塑的材质是什么?
已知该盐雕的主要成分为食盐,试分析计算该盐雕中约有多少个钠原子与氯原子
青海茶卡盐湖世界最大的盐雕
成吉思汗像
重 4800 吨!
1031!
一、宏微对比感知离子键的存在
这些微小的钠原子与氯原子如何构成宏观的巨大的盐雕?
实验:钠在氯气中燃烧
1.观察钠在氯气中燃烧的实验,描述实验现象;
2.结合钠和氯的原子结构,分析实验过程中白烟的成分。
Na
Cl
+17
+11
二、宏微结合认识离子键的本质
茶卡盐湖的风力很大,但盐雕能维持较长时间不解体,盐雕底部的食盐要承受巨大的压力,并未明显压缩,密度和上层的盐雕密度没有差别,这些宏观现象,对应着怎样的微观结构呢
Na+
Cl-
带正电
带负电
静电引力
斥力
带相反电荷离子之间的相互作用,称为离子键。
像氯化钠这样由离子构成的化合物,称为离子化合物。
+17
+11
三、符号表征描述离子键
如何表征离子化合物中离子的电子结构?
任务:分析MgCl2、MgO、AlF3等典型离子化合物中离子的结构示意图。
Mg
+12
Cl
+17
Cl
+17
三、符号表征描述离子键
如何表征离子化合物中离子的电子结构?
任务:分析MgCl2、MgO、AlF3等典型离子化合物中离子的结构示意图。
Mg
+12
O
+8
三、符号表征描述离子键
如何表征离子化合物中离子的电子结构?
任务:分析 MgCl2、MgO、AlF3等典型离子化合物中离子的结构示意图。
Al
+13
F
+9
F
+9
F
+9
三、符号表征描述离子键
在绝大多数简单离子化合物中,离子的电子结构是怎样的?
在离子化合物中,阴阳离子的排列有何规律,在书写电子式时,如何表示这种规律
1.能体现离子化合物对应的元素;
2.能体现离子化合物中阴阳离子的交替排列;
3.能体现离子的价电子结构。
Na+[ ]-
:
. .
. .
Cl
[ ]-
:
. .
.
F
[ ]-Al3+[ ]-
:
. .
. .
F
:
. .
. .
F
:
×
[ ]-Mg2+[ ]-
:
. .
. .
Cl
. .
. .
Cl
:
Mg2+[ ]2-
. .
. .
O
×
×
:
如何表征离子化合物中离子的电子结构?
三、符号表征描述离子键
如何用电子式表示离子化合物的形成过程?
Na×+ →Na+[ ]-
:
. .
. .
· Cl
:
. .
. .
Cl
+×Mg×+ →[ ]-Mg2+[ ]-
:
. .
. .
Cl ·
:
. .
. .
·Cl
:
. .
. .
Cl
:
. .
. .
Cl
Mg + →Mg2+[ ]2-
:
. .
. .
:
. .
. .
O
×
×
O
×
×
AB型(如NaCl)
AB2型(如MgCl2):
四、实践研究离子键的破坏与形成
茶卡盐湖的盐雕,主要原料是盐湖产的食盐,那么这些小颗粒的食盐是如何组成巨大的盐雕的呢?
青盐颗粒变为盐雕的过程中,要形成部分新的离子键,可以加热熔化后冷却或让食盐溶解后再析出。加热熔化能耗过高,很难实现。真实的盐雕是将青盐颗粒和卤水按一定比例混合,在茶卡盐湖大蒸发量的气候中风干,即可成型。
课堂总结
Na+
Cl-
带正电
带负电
静电引力
斥力
带相反电荷离子之间的相互作用,称为离子键。
像氯化钠这样由离子构成的化合物,称为离子化合物。
Na×+ →Na+[ ]-
:
. .
. .
· Cl
:
. .
. .
Cl
1.短周期元素W、X、Y、Z的原子序数依次增加。元素Z的单质通常为黄绿色气体,元素W的单质能在元素Z的单质中燃烧,发出苍白色火焰。元素Y是地壳中含量最高的元素,元素X的最外层电子数是其周期序数的2倍。下列说法正确的是 ( )
A.X的最高价氧化物的水化物为强酸
B.元素的非金属性Z>X>Y
C.原于半径的大小W
D
2.元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族元素的原子、最外层电子数相同,化学性质完全相同
B
3.2016年IUPAC命名117号元素为Ts(中文名“ ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是( )
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同主族元素中非金属性最弱
D.HTs易溶于水,稳定性强,还原性强
D
4.1934年约里奥 居里夫妇在核反应中用α粒子(即氦核He)轰击金属原子X,得到核素Y,开创了人造放射性核素的先河:X+He―→Y+n 其中元素X、Y的最外层电子数之和为8。下列叙述正确的是( )
A.X的相对原子质量为26
B.X、Y均可形成三氯化物
C.X的原子半径小于Y的
D.Y仅有一种含氧酸
B
5.四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是( )
A.Y的最高价氧化物对应水化物的酸性比X的强
B.原子半径:Z
D.X的最高化合价与负化合价的代数和为0
C
6.A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素。请回答下列问题:
(1)C在元素周期表中的位置为____,G的原子结构示意图是_____。
(2)D与E按原子个数比1∶1形成化合物甲,其化学式为____________,向甲中滴加足量水时发生反应的化学方程式是_____________________________。
(3)E、F、G形成的简单离子,半径由大到小顺序是_________
_______________。(用离子符号表示)
(4)B、C、D的简单氢化物的还原性强弱顺序为______________(填分子式,下同)热稳定强弱顺序为______________。
(5)F、G的最高价氧化物的水化物的分子式为________________,酸性较强为________________。
