第四章 第二节 第2课时 电解原理的应用 课时对点练(含答案)
文档属性
| 名称 | 第四章 第二节 第2课时 电解原理的应用 课时对点练(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 794.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 15:33:38 | ||
图片预览




文档简介
第2课时 电解原理的应用
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\课时对点练.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\课时对点练.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\课时对点练.TIF" \* MERGEFORMATINET
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\对点训练A.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\对点训练A.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\对点训练A.TIF" \* MERGEFORMATINET
题组一 电解原理的应用
1. 如图为氯碱工业的简易装置示意图,其中两电极均为惰性电极。下列说法正确的是( )
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-110.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-110.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-110.TIF" \* MERGEFORMATINET
A.粗盐水中含有的少量Ca2+和Mg2+,可用NaOH除去
B.适当降低阳极电解液的pH有利于Cl2逸出
C.a处得到的是浓NaOH溶液
D.若电路中通过0.2 mol电子,理论上可在b处得到2.24 L气体
2.利用如图所示装置可以在铜牌表面电镀一层银。下列有关说法正确的是( )
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-103.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-103.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-103.TIF" \* MERGEFORMATINET
A.通电后,Ag+向阳极移动
B.银片与电源负极相连
C.该电解池的阴极反应可表示为Ag++e-===Ag
D.当电镀一段时间后,将电源反接,铜牌可恢复如初
3.以硫酸铜溶液作电解质溶液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼。下列说法正确的是( )
A.粗铜与直流电源负极相连
B.粗铜电解精炼过程中,硫酸铜溶液的浓度不变
C.电路中每通过3.01×1023个电子,得到的精铜质量为16 g
D.杂质Ag以Ag2SO4的形式沉入电解槽底形成阳极泥
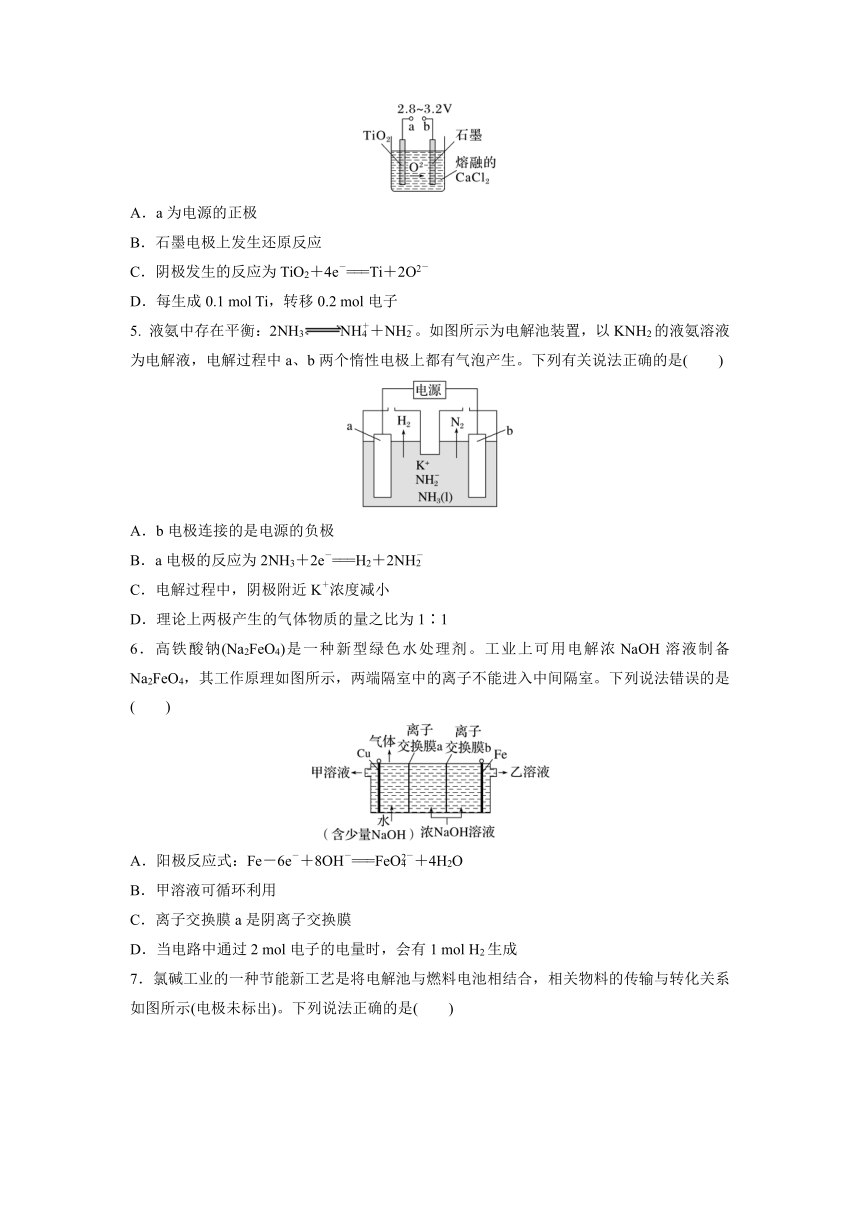
4. 21世纪是钛的世纪,在800~1 000 ℃时电解TiO2可制得钛,装置如图所示,下列叙述正确的是( )
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-104.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-104.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-104.TIF" \* MERGEFORMATINET
A.a为电源的正极
B.石墨电极上发生还原反应
C.阴极发生的反应为TiO2+4e-===Ti+2O2-
D.每生成0.1 mol Ti,转移0.2 mol电子
5. 液氨中存在平衡:2NH3NH+NH。如图所示为电解池装置,以KNH2的液氨溶液为电解液,电解过程中a、b两个惰性电极上都有气泡产生。下列有关说法正确的是( )
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-111.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-111.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-111.TIF" \* MERGEFORMATINET
A.b电极连接的是电源的负极
B.a电极的反应为2NH3+2e-===H2+2NH
C.电解过程中,阴极附近K+浓度减小
D.理论上两极产生的气体物质的量之比为1∶1
6.高铁酸钠(Na2FeO4)是一种新型绿色水处理剂。工业上可用电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示,两端隔室中的离子不能进入中间隔室。下列说法错误的是( )
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-107.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-107.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-107.TIF" \* MERGEFORMATINET
A.阳极反应式:Fe-6e-+8OH-===FeO+4H2O
B.甲溶液可循环利用
C.离子交换膜a是阴离子交换膜
D.当电路中通过2 mol电子的电量时,会有1 mol H2生成
7.氯碱工业的一种节能新工艺是将电解池与燃料电池相结合,相关物料的传输与转化关系如图所示(电极未标出)。下列说法正确的是( )
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-108.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-108.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-108.TIF" \* MERGEFORMATINET
A.电解池的阴极反应式为2H2O+2e-===H2↑+2OH-
B.通入空气的电极为负极
C.电解池中产生2 mol Cl2时,理论上燃料电池中消耗0.5 mol O2
D.a、b、c的大小关系为a>b=c
题组二 电解的有关计算
8.在标准状况下,用铂电极电解硫酸铜溶液,当阴极产生12.8 g铜时,阳极放出的气体是( )
A.1.12 L H2 B.1.12 L O2
C.2.24 L H2 D.2.24 L O2
9.有三个烧杯,分别盛有氯化铜、氯化钾和硝酸银三种溶液,均以Pt作电极,将它们串联在一起电解一段时间,测得电极增重总和2.8 g,这时产生的有色气体与无色气体的物质的量之比为( )
A.4∶1 B.1∶1
C.4∶3 D.3∶4
10.用石墨电极电解CuSO4溶液一段时间后,向所得溶液中加入0.2 mol Cu(OH)2后,恰好使溶液恢复到电解前的浓度。则电解过程中转移电子的物质的量为( )
A.0.4 mol B.0.5 mol
C.0.6 mol D.0.8 mol
11.用石墨作电极电解1 000 mL硝酸钾和硝酸铜的混合溶液,当通电一段时间后,两极都收集到112 mL气体(标准状况),假定电解后溶液体积仍为1 000 mL,则电解后溶液的pH为( )
A.4 B.3 C.2 D.1
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\综合强化.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\综合强化.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\综合强化.TIF" \* MERGEFORMATINET
12.某同学设计了一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-109.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-109.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-109.TIF" \* MERGEFORMATINET
根据要求回答相关问题:
(1)通入氢气的电极为______(填“正极”或“负极”),负极的电极反应式为________________________________________________________________________。
(2)石墨电极为______(填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,________(填“铁极”或“石墨极”)区的溶液变红。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液的浓度将______(填“增大”“减小”或“不变”)。精铜电极上的电极反应式为_____________________________。
13.电解的应用比较广泛。根据下列电解的应用,回答问题:
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-112.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-112.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-112.TIF" \* MERGEFORMATINET
(1)如图为电解精炼银的示意图,____________(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为______________________________。
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-113.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-113.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-113.TIF" \* MERGEFORMATINET
(2)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为____________(填化学式)溶液,阳极电极反应式为____________________,电解过程中Li+向________(填“A”或“B”)电极迁移。
(3)离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl和AlCl组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极反应式为_____________________________。
若改用氯化铝水溶液作电解液,则阴极产物为______________。
14. 常温下用惰性电极电解200 mL 氯化钠、硫酸铜的混合溶液,所得气体的体积随时间的变化如图所示,根据图中信息回答下列问题。(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-114.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-114.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-114.TIF" \* MERGEFORMATINET
(1)曲线________(填“Ⅰ”或“Ⅱ”)表示阳极产生气体的变化。
(2)氯化钠的物质的量浓度为________,硫酸铜的物质的量浓度为________。
(3)t2时所得溶液的pH为________。
第2课时 电解原理的应用
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\课时对点练.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\课时对点练.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\课时对点练.TIF" \* MERGEFORMATINET
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\对点训练A.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\对点训练A.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\对点训练A.TIF" \* MERGEFORMATINET
题组一 电解原理的应用
1. 如图为氯碱工业的简易装置示意图,其中两电极均为惰性电极。下列说法正确的是( )
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-110.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-110.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-110.TIF" \* MERGEFORMATINET
A.粗盐水中含有的少量Ca2+和Mg2+,可用NaOH除去
B.适当降低阳极电解液的pH有利于Cl2逸出
C.a处得到的是浓NaOH溶液
D.若电路中通过0.2 mol电子,理论上可在b处得到2.24 L气体
答案 B
解析 粗盐提纯时,少量Ca2+用碳酸钠除去,Mg2+用NaOH除去,故A错误;Cl2的水溶液呈酸性,降低阳极电解液的pH有利于Cl2逸出,故B正确;若电路中通过0.2 mol电子,根据b处的电极反应:2H2O+2e-===H2↑+2OH-,计算可得n(H2)=0.1 mol,标准状况下为2.24 L,故D错误。
2.利用如图所示装置可以在铜牌表面电镀一层银。下列有关说法正确的是( )
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-103.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-103.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-103.TIF" \* MERGEFORMATINET
A.通电后,Ag+向阳极移动
B.银片与电源负极相连
C.该电解池的阴极反应可表示为Ag++e-===Ag
D.当电镀一段时间后,将电源反接,铜牌可恢复如初
答案 C
解析 铜牌上镀银,银片为阳极,Ag+向阴极移动,阴极反应为Ag++e-===Ag。由于实验中镀层不可能非常均匀致密,所以将电源反接,阳极上Cu、Ag均会溶解,铜牌不可能恢复如初。
3.以硫酸铜溶液作电解质溶液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼。下列说法正确的是( )
A.粗铜与直流电源负极相连
B.粗铜电解精炼过程中,硫酸铜溶液的浓度不变
C.电路中每通过3.01×1023个电子,得到的精铜质量为16 g
D.杂质Ag以Ag2SO4的形式沉入电解槽底形成阳极泥
答案 C
解析 A项,电解精炼铜时,粗铜应作阳极,与直流电源的正极相连,错误;B项,金属的活动性顺序为Zn>Fe>Cu>Ag,阳极上Zn、Fe、Cu放电,而阴极的电极反应为Cu2++2e-===Cu,根据得失电子守恒可知,阴极析出的Cu的物质的量大于阳极参与反应的Cu的物质的量,溶液中硫酸铜的浓度减小,错误;C项,根据电极反应:Cu2++2e-===Cu,电路中每通过3.01×1023个(0.5 mol)电子,得到的精铜的质量为0.25 mol×64 g·mol-1=16 g,正确;D项,金属的活动性顺序为Zn>Fe>Cu>Ag,因此Ag不会放电,而是以单质的形式沉积下来,错误。
4. 21世纪是钛的世纪,在800~1 000 ℃时电解TiO2可制得钛,装置如图所示,下列叙述正确的是( )
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-104.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-104.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-104.TIF" \* MERGEFORMATINET
A.a为电源的正极
B.石墨电极上发生还原反应
C.阴极发生的反应为TiO2+4e-===Ti+2O2-
D.每生成0.1 mol Ti,转移0.2 mol电子
答案 C
解析 由O2-的移动方向可知,b为电源正极,A错误;石墨电极作阳极,发生氧化反应,B错误;每生成0.1 mol Ti,转移0.4 mol电子,D错误。
5. 液氨中存在平衡:2NH3??NH+NH。如图所示为电解池装置,以KNH2的液氨溶液为电解液,电解过程中a、b两个惰性电极上都有气泡产生。下列有关说法正确的是( )
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-111.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-111.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-111.TIF" \* MERGEFORMATINET
A.b电极连接的是电源的负极
B.a电极的反应为2NH3+2e-===H2+2NH
C.电解过程中,阴极附近K+浓度减小
D.理论上两极产生的气体物质的量之比为1∶1
答案 B
解析 根据图示可知:在b电极上产生N2,N元素失去电子化合价升高,所以b电极为阳极,连接电源的正极,A错误;a电极上产生H2,a电极为阴极,电极反应式为2NH3+2e-===H2+2NH,B正确;电解过程中,阳离子K+会向阴极区产生定向移动,最终导致阴极附近K+浓度增大,C错误;每反应产生1 mol H2,转移2 mol电子,每反应产生1 mol N2,转移6 mol 电子,故阴极产生的H2与阳极产生的N2的物质的量之比是3∶1,D错误。
6.高铁酸钠(Na2FeO4)是一种新型绿色水处理剂。工业上可用电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示,两端隔室中的离子不能进入中间隔室。下列说法错误的是( )
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-107.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-107.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-107.TIF" \* MERGEFORMATINET
A.阳极反应式:Fe-6e-+8OH-===FeO+4H2O
B.甲溶液可循环利用
C.离子交换膜a是阴离子交换膜
D.当电路中通过2 mol电子的电量时,会有1 mol H2生成
答案 C
解析 A项,阳极发生氧化反应,电极反应式:Fe-6e-+8OH-===FeO+4H2O,正确;B项,阴极发生还原反应,水电离出的氢离子放电生成氢气和氢氧根离子,甲溶液为浓氢氧化钠溶液,可循环利用,正确;C项,电解池中阳离子向阴极移动,通过离子交换膜a的是Na+,故a为阳离子交换膜,错误;D项,阴极发生还原反应,电极反应式为2H2O+2e-===H2↑+2OH-,当电路中通过2 mol电子的电量时,会有1 mol H2生成,正确。
7.氯碱工业的一种节能新工艺是将电解池与燃料电池相结合,相关物料的传输与转化关系如图所示(电极未标出)。下列说法正确的是( )
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-108.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-108.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-108.TIF" \* MERGEFORMATINET
A.电解池的阴极反应式为2H2O+2e-===H2↑+2OH-
B.通入空气的电极为负极
C.电解池中产生2 mol Cl2时,理论上燃料电池中消耗0.5 mol O2
D.a、b、c的大小关系为a>b=c
答案 A
解析 题给电解池的阴极反应式为2H2O+2e-===H2↑+2OH-,阳极反应式为2Cl--2e-===Cl2↑,A项正确;题给燃料电池为氢氧燃料电池,通入空气的电极为正极,B项错误;由整个电路中得失电子守恒可知,电解池中产生2 mol Cl2,理论上转移4 mol电子,则燃料电池中消耗1 mol O2,C项错误;题给燃料电池的负极反应式为2H2-4e-+4OH-===4H2O,正极反应式为O2+4e-+2H2O===4OH-,所以a、b、c的大小关系为c>a>b,D项错误。
题组二 电解的有关计算
8.在标准状况下,用铂电极电解硫酸铜溶液,当阴极产生12.8 g铜时,阳极放出的气体是( )
A.1.12 L H2 B.1.12 L O2
C.2.24 L H2 D.2.24 L O2
答案 D
解析 溶液中有Cu2+、H+、SO、OH-四种离子,得电子能力:Cu2+>H+,失电子能力:OH->SO,阴极反应为2Cu2++4e-===2Cu,阳极反应为2H2O-4e-===4H++O2↑,总反应为2CuSO4+2H2O2Cu+2H2SO4+O2↑。n(Cu)==0.2 mol,n(O2)=0.1 mol,在标准状况下体积为2.24 L,D正确。
9.有三个烧杯,分别盛有氯化铜、氯化钾和硝酸银三种溶液,均以Pt作电极,将它们串联在一起电解一段时间,测得电极增重总和2.8 g,这时产生的有色气体与无色气体的物质的量之比为( )
A.4∶1 B.1∶1
C.4∶3 D.3∶4
答案 C
解析 串联电路中,相同时间内各电极得电子或失电子的物质的量相同,各电极上放出气体的物质的量之比为定值。不必注意电极增重是多少,只要判断出生成何种气体及生成一定物质的量该气体所得失电子的物质的量,就可以通过得失电子守恒判断气体体积之比。第一个烧杯中放出Cl2,第二个烧杯中放出Cl2和H2,第三个烧杯中放出O2。在有1 mol电子转移时,生成的气体的物质的量分别是0.5 mol、0.5 mol、0.5 mol和0.25 mol。所以共放出有色气体(Cl2)0.5 mol+0.5 mol=1 mol,无色气体(O2和H2)0.5 mol+0.25 mol=0.75 mol。
10.用石墨电极电解CuSO4溶液一段时间后,向所得溶液中加入0.2 mol Cu(OH)2后,恰好使溶液恢复到电解前的浓度。则电解过程中转移电子的物质的量为( )
A.0.4 mol B.0.5 mol
C.0.6 mol D.0.8 mol
答案 D
解析 将Cu(OH)2改写为CuO·H2O,根据CuO·H2O知,阳极上OH-放电生成O2,阴极上Cu2+和H+放电生成Cu和H2,根据氧原子守恒得n(O2)=n[Cu(OH)2]=0.2 mol,则转移电子的物质的量为0.2 mol×4=0.8 mol,故D正确。
11.用石墨作电极电解1 000 mL硝酸钾和硝酸铜的混合溶液,当通电一段时间后,两极都收集到112 mL气体(标准状况),假定电解后溶液体积仍为1 000 mL,则电解后溶液的pH为( )
A.4 B.3 C.2 D.1
答案 C
解析 阳极产生氧气0.005 mol,阴极产生氢气0.005 mol。由2H2O2H2↑+O2↑可知,阴极产生0.005 mol氢气时,阳极产生0.002 5 mol氧气;由2Cu2++2H2O2Cu+4H++O2↑可知,产生n(H+)=(0.005 mol-0.002 5 mol)×4=0.01 mol,c(H+)=0.01 mol·L-1,pH=2。
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\综合强化.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\综合强化.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\综合强化.TIF" \* MERGEFORMATINET
12.某同学设计了一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-109.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-109.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-109.TIF" \* MERGEFORMATINET
根据要求回答相关问题:
(1)通入氢气的电极为______(填“正极”或“负极”),负极的电极反应式为________________________________________________________________________。
(2)石墨电极为______(填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,________(填“铁极”或“石墨极”)区的溶液变红。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液的浓度将______(填“增大”“减小”或“不变”)。精铜电极上的电极反应式为_____________________________。
答案 (1)负极 H2-2e-+2OH-===2H2O
(2)阳极 铁极 (3)减小 Cu2++2e-===Cu
解析 (1)通入氢气的电极为负极;由于电解质溶液是碱性的,所以该电极反应式为H2-2e-+2OH-===2H2O。
(2)由于铁电极与电源的负极连接,所以铁电极为阴极,石墨电极为阳极;反应一段时间后,在乙装置中滴入酚酞溶液,溶液中的H+在阴极(铁电极)放电,破坏了附近的水的电离平衡,该区域的溶液呈碱性,因此铁极区的溶液变红。
(3)因为粗铜中的锌等活动性比Cu强的杂质金属优先失去电子,而得到电子的只有Cu2+,所以丙装置中反应一段时间,硫酸铜溶液的浓度会减小;精铜电极上的电极反应式为Cu2++2e-===Cu。
13.电解的应用比较广泛。根据下列电解的应用,回答问题:
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-112.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-112.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-112.TIF" \* MERGEFORMATINET
(1)如图为电解精炼银的示意图,____________(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为______________________________。
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-113.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-113.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-113.TIF" \* MERGEFORMATINET
(2)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为____________(填化学式)溶液,阳极电极反应式为____________________,电解过程中Li+向________(填“A”或“B”)电极迁移。
(3)离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl和AlCl组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极反应式为_____________________________。
若改用氯化铝水溶液作电解液,则阴极产物为______________。
答案 (1)a NO+2H++e-===NO2↑+H2O(或NO+4H++3e-===NO↑+2H2O、2NO+O2===2NO2)
(2)LiOH 2Cl--2e-===Cl2↑ B
(3)负 4Al2Cl+3e-===Al+7AlCl H2
解析 (1)电解精炼银与电解精炼铜原理相似。电解精炼银装置中,含有杂质的粗银作阳极,电解池的阳极与电源的正极相连,则该装置中a极为含有杂质的粗银。该电解池的b极为阴极,阴极上有红棕色气体生成,可知NO被还原为NO2,电极反应式为NO+2H++e-===NO2↑+H2O。
(2)根据电解装置图,两电极区电解液分别为LiOH和LiCl溶液,B极区产生H2,电极反应式为2H2O+2e-===H2↑+2OH-,剩余的OH-与Li+结合生成LiOH,所以B极区电解液为LiOH溶液,B电极为阴极,则A电极为阳极,阳极区电解液为LiCl溶液,电极反应式为2Cl--2e-===Cl2↑,电解过程中Li+向B电极迁移。
(3)在钢制品上电镀铝,故钢制品作阴极,与电源负极相连。由于电镀过程中“不产生其他离子且有机阳离子不参与电极反应”,Al元素在熔融盐中以Al2Cl和AlCl形式存在,则电镀过程中阴极反应式为4Al2Cl+3e-===Al+7AlCl。若电解液改为氯化铝水溶液,水溶液中得电子能力:Al3+14. 常温下用惰性电极电解200 mL 氯化钠、硫酸铜的混合溶液,所得气体的体积随时间的变化如图所示,根据图中信息回答下列问题。(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-114.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-114.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-114.TIF" \* MERGEFORMATINET
(1)曲线________(填“Ⅰ”或“Ⅱ”)表示阳极产生气体的变化。
(2)氯化钠的物质的量浓度为________,硫酸铜的物质的量浓度为________。
(3)t2时所得溶液的pH为________。
答案 (1)Ⅱ (2)0.1 mol·L-1 0.1 mol·L-1 (3)1
解析 (1)阴极上Cu2+首先放电,故开始时,阴极上无气体生成,故曲线Ⅱ表示阳极产生气体的变化。
(2)0~t1时间内阳极发生的反应为2Cl--2e-===Cl2↑,n(Cl2)==0.01 mol,n(NaCl)=n(Cl-)=2n(Cl2)=0.02 mol,c(NaCl)==0.1 mol·L-1;阴极上依次发生反应Cu2++2e-===Cu、2H2O+2e-===H2↑+2OH-,阳极上依次发生反应2Cl--2e-===Cl2↑、2H2O-4e-===O2↑+4H+,由图可知V(H2)=0.672 L,V(Cl2)=0.224 L,V(O2)=0.448 L,由得失电子守恒可知×2+c(Cu2+)×0.2 L×2=×2+×4,解得c(Cu2+)=0.1 mol·L-1。
(3)由4OH-~O2~4H+可得:n(H+)=×4=0.02 mol,则溶液中的c(H+)==0.1 mol·L-1,pH=1。
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\课时对点练.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\课时对点练.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\课时对点练.TIF" \* MERGEFORMATINET
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\对点训练A.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\对点训练A.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\对点训练A.TIF" \* MERGEFORMATINET
题组一 电解原理的应用
1. 如图为氯碱工业的简易装置示意图,其中两电极均为惰性电极。下列说法正确的是( )
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-110.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-110.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-110.TIF" \* MERGEFORMATINET
A.粗盐水中含有的少量Ca2+和Mg2+,可用NaOH除去
B.适当降低阳极电解液的pH有利于Cl2逸出
C.a处得到的是浓NaOH溶液
D.若电路中通过0.2 mol电子,理论上可在b处得到2.24 L气体
2.利用如图所示装置可以在铜牌表面电镀一层银。下列有关说法正确的是( )
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-103.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-103.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-103.TIF" \* MERGEFORMATINET
A.通电后,Ag+向阳极移动
B.银片与电源负极相连
C.该电解池的阴极反应可表示为Ag++e-===Ag
D.当电镀一段时间后,将电源反接,铜牌可恢复如初
3.以硫酸铜溶液作电解质溶液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼。下列说法正确的是( )
A.粗铜与直流电源负极相连
B.粗铜电解精炼过程中,硫酸铜溶液的浓度不变
C.电路中每通过3.01×1023个电子,得到的精铜质量为16 g
D.杂质Ag以Ag2SO4的形式沉入电解槽底形成阳极泥
4. 21世纪是钛的世纪,在800~1 000 ℃时电解TiO2可制得钛,装置如图所示,下列叙述正确的是( )
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-104.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-104.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-104.TIF" \* MERGEFORMATINET
A.a为电源的正极
B.石墨电极上发生还原反应
C.阴极发生的反应为TiO2+4e-===Ti+2O2-
D.每生成0.1 mol Ti,转移0.2 mol电子
5. 液氨中存在平衡:2NH3NH+NH。如图所示为电解池装置,以KNH2的液氨溶液为电解液,电解过程中a、b两个惰性电极上都有气泡产生。下列有关说法正确的是( )
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-111.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-111.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-111.TIF" \* MERGEFORMATINET
A.b电极连接的是电源的负极
B.a电极的反应为2NH3+2e-===H2+2NH
C.电解过程中,阴极附近K+浓度减小
D.理论上两极产生的气体物质的量之比为1∶1
6.高铁酸钠(Na2FeO4)是一种新型绿色水处理剂。工业上可用电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示,两端隔室中的离子不能进入中间隔室。下列说法错误的是( )
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-107.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-107.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-107.TIF" \* MERGEFORMATINET
A.阳极反应式:Fe-6e-+8OH-===FeO+4H2O
B.甲溶液可循环利用
C.离子交换膜a是阴离子交换膜
D.当电路中通过2 mol电子的电量时,会有1 mol H2生成
7.氯碱工业的一种节能新工艺是将电解池与燃料电池相结合,相关物料的传输与转化关系如图所示(电极未标出)。下列说法正确的是( )
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-108.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-108.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-108.TIF" \* MERGEFORMATINET
A.电解池的阴极反应式为2H2O+2e-===H2↑+2OH-
B.通入空气的电极为负极
C.电解池中产生2 mol Cl2时,理论上燃料电池中消耗0.5 mol O2
D.a、b、c的大小关系为a>b=c
题组二 电解的有关计算
8.在标准状况下,用铂电极电解硫酸铜溶液,当阴极产生12.8 g铜时,阳极放出的气体是( )
A.1.12 L H2 B.1.12 L O2
C.2.24 L H2 D.2.24 L O2
9.有三个烧杯,分别盛有氯化铜、氯化钾和硝酸银三种溶液,均以Pt作电极,将它们串联在一起电解一段时间,测得电极增重总和2.8 g,这时产生的有色气体与无色气体的物质的量之比为( )
A.4∶1 B.1∶1
C.4∶3 D.3∶4
10.用石墨电极电解CuSO4溶液一段时间后,向所得溶液中加入0.2 mol Cu(OH)2后,恰好使溶液恢复到电解前的浓度。则电解过程中转移电子的物质的量为( )
A.0.4 mol B.0.5 mol
C.0.6 mol D.0.8 mol
11.用石墨作电极电解1 000 mL硝酸钾和硝酸铜的混合溶液,当通电一段时间后,两极都收集到112 mL气体(标准状况),假定电解后溶液体积仍为1 000 mL,则电解后溶液的pH为( )
A.4 B.3 C.2 D.1
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\综合强化.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\综合强化.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\综合强化.TIF" \* MERGEFORMATINET
12.某同学设计了一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-109.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-109.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-109.TIF" \* MERGEFORMATINET
根据要求回答相关问题:
(1)通入氢气的电极为______(填“正极”或“负极”),负极的电极反应式为________________________________________________________________________。
(2)石墨电极为______(填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,________(填“铁极”或“石墨极”)区的溶液变红。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液的浓度将______(填“增大”“减小”或“不变”)。精铜电极上的电极反应式为_____________________________。
13.电解的应用比较广泛。根据下列电解的应用,回答问题:
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-112.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-112.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-112.TIF" \* MERGEFORMATINET
(1)如图为电解精炼银的示意图,____________(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为______________________________。
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-113.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-113.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-113.TIF" \* MERGEFORMATINET
(2)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为____________(填化学式)溶液,阳极电极反应式为____________________,电解过程中Li+向________(填“A”或“B”)电极迁移。
(3)离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl和AlCl组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极反应式为_____________________________。
若改用氯化铝水溶液作电解液,则阴极产物为______________。
14. 常温下用惰性电极电解200 mL 氯化钠、硫酸铜的混合溶液,所得气体的体积随时间的变化如图所示,根据图中信息回答下列问题。(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-114.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-114.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-114.TIF" \* MERGEFORMATINET
(1)曲线________(填“Ⅰ”或“Ⅱ”)表示阳极产生气体的变化。
(2)氯化钠的物质的量浓度为________,硫酸铜的物质的量浓度为________。
(3)t2时所得溶液的pH为________。
第2课时 电解原理的应用
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\课时对点练.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\课时对点练.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\课时对点练.TIF" \* MERGEFORMATINET
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\对点训练A.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\对点训练A.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\对点训练A.TIF" \* MERGEFORMATINET
题组一 电解原理的应用
1. 如图为氯碱工业的简易装置示意图,其中两电极均为惰性电极。下列说法正确的是( )
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-110.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-110.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-110.TIF" \* MERGEFORMATINET
A.粗盐水中含有的少量Ca2+和Mg2+,可用NaOH除去
B.适当降低阳极电解液的pH有利于Cl2逸出
C.a处得到的是浓NaOH溶液
D.若电路中通过0.2 mol电子,理论上可在b处得到2.24 L气体
答案 B
解析 粗盐提纯时,少量Ca2+用碳酸钠除去,Mg2+用NaOH除去,故A错误;Cl2的水溶液呈酸性,降低阳极电解液的pH有利于Cl2逸出,故B正确;若电路中通过0.2 mol电子,根据b处的电极反应:2H2O+2e-===H2↑+2OH-,计算可得n(H2)=0.1 mol,标准状况下为2.24 L,故D错误。
2.利用如图所示装置可以在铜牌表面电镀一层银。下列有关说法正确的是( )
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-103.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-103.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-103.TIF" \* MERGEFORMATINET
A.通电后,Ag+向阳极移动
B.银片与电源负极相连
C.该电解池的阴极反应可表示为Ag++e-===Ag
D.当电镀一段时间后,将电源反接,铜牌可恢复如初
答案 C
解析 铜牌上镀银,银片为阳极,Ag+向阴极移动,阴极反应为Ag++e-===Ag。由于实验中镀层不可能非常均匀致密,所以将电源反接,阳极上Cu、Ag均会溶解,铜牌不可能恢复如初。
3.以硫酸铜溶液作电解质溶液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼。下列说法正确的是( )
A.粗铜与直流电源负极相连
B.粗铜电解精炼过程中,硫酸铜溶液的浓度不变
C.电路中每通过3.01×1023个电子,得到的精铜质量为16 g
D.杂质Ag以Ag2SO4的形式沉入电解槽底形成阳极泥
答案 C
解析 A项,电解精炼铜时,粗铜应作阳极,与直流电源的正极相连,错误;B项,金属的活动性顺序为Zn>Fe>Cu>Ag,阳极上Zn、Fe、Cu放电,而阴极的电极反应为Cu2++2e-===Cu,根据得失电子守恒可知,阴极析出的Cu的物质的量大于阳极参与反应的Cu的物质的量,溶液中硫酸铜的浓度减小,错误;C项,根据电极反应:Cu2++2e-===Cu,电路中每通过3.01×1023个(0.5 mol)电子,得到的精铜的质量为0.25 mol×64 g·mol-1=16 g,正确;D项,金属的活动性顺序为Zn>Fe>Cu>Ag,因此Ag不会放电,而是以单质的形式沉积下来,错误。
4. 21世纪是钛的世纪,在800~1 000 ℃时电解TiO2可制得钛,装置如图所示,下列叙述正确的是( )
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-104.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-104.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-104.TIF" \* MERGEFORMATINET
A.a为电源的正极
B.石墨电极上发生还原反应
C.阴极发生的反应为TiO2+4e-===Ti+2O2-
D.每生成0.1 mol Ti,转移0.2 mol电子
答案 C
解析 由O2-的移动方向可知,b为电源正极,A错误;石墨电极作阳极,发生氧化反应,B错误;每生成0.1 mol Ti,转移0.4 mol电子,D错误。
5. 液氨中存在平衡:2NH3??NH+NH。如图所示为电解池装置,以KNH2的液氨溶液为电解液,电解过程中a、b两个惰性电极上都有气泡产生。下列有关说法正确的是( )
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-111.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-111.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-111.TIF" \* MERGEFORMATINET
A.b电极连接的是电源的负极
B.a电极的反应为2NH3+2e-===H2+2NH
C.电解过程中,阴极附近K+浓度减小
D.理论上两极产生的气体物质的量之比为1∶1
答案 B
解析 根据图示可知:在b电极上产生N2,N元素失去电子化合价升高,所以b电极为阳极,连接电源的正极,A错误;a电极上产生H2,a电极为阴极,电极反应式为2NH3+2e-===H2+2NH,B正确;电解过程中,阳离子K+会向阴极区产生定向移动,最终导致阴极附近K+浓度增大,C错误;每反应产生1 mol H2,转移2 mol电子,每反应产生1 mol N2,转移6 mol 电子,故阴极产生的H2与阳极产生的N2的物质的量之比是3∶1,D错误。
6.高铁酸钠(Na2FeO4)是一种新型绿色水处理剂。工业上可用电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示,两端隔室中的离子不能进入中间隔室。下列说法错误的是( )
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-107.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-107.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-107.TIF" \* MERGEFORMATINET
A.阳极反应式:Fe-6e-+8OH-===FeO+4H2O
B.甲溶液可循环利用
C.离子交换膜a是阴离子交换膜
D.当电路中通过2 mol电子的电量时,会有1 mol H2生成
答案 C
解析 A项,阳极发生氧化反应,电极反应式:Fe-6e-+8OH-===FeO+4H2O,正确;B项,阴极发生还原反应,水电离出的氢离子放电生成氢气和氢氧根离子,甲溶液为浓氢氧化钠溶液,可循环利用,正确;C项,电解池中阳离子向阴极移动,通过离子交换膜a的是Na+,故a为阳离子交换膜,错误;D项,阴极发生还原反应,电极反应式为2H2O+2e-===H2↑+2OH-,当电路中通过2 mol电子的电量时,会有1 mol H2生成,正确。
7.氯碱工业的一种节能新工艺是将电解池与燃料电池相结合,相关物料的传输与转化关系如图所示(电极未标出)。下列说法正确的是( )
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-108.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-108.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-108.TIF" \* MERGEFORMATINET
A.电解池的阴极反应式为2H2O+2e-===H2↑+2OH-
B.通入空气的电极为负极
C.电解池中产生2 mol Cl2时,理论上燃料电池中消耗0.5 mol O2
D.a、b、c的大小关系为a>b=c
答案 A
解析 题给电解池的阴极反应式为2H2O+2e-===H2↑+2OH-,阳极反应式为2Cl--2e-===Cl2↑,A项正确;题给燃料电池为氢氧燃料电池,通入空气的电极为正极,B项错误;由整个电路中得失电子守恒可知,电解池中产生2 mol Cl2,理论上转移4 mol电子,则燃料电池中消耗1 mol O2,C项错误;题给燃料电池的负极反应式为2H2-4e-+4OH-===4H2O,正极反应式为O2+4e-+2H2O===4OH-,所以a、b、c的大小关系为c>a>b,D项错误。
题组二 电解的有关计算
8.在标准状况下,用铂电极电解硫酸铜溶液,当阴极产生12.8 g铜时,阳极放出的气体是( )
A.1.12 L H2 B.1.12 L O2
C.2.24 L H2 D.2.24 L O2
答案 D
解析 溶液中有Cu2+、H+、SO、OH-四种离子,得电子能力:Cu2+>H+,失电子能力:OH->SO,阴极反应为2Cu2++4e-===2Cu,阳极反应为2H2O-4e-===4H++O2↑,总反应为2CuSO4+2H2O2Cu+2H2SO4+O2↑。n(Cu)==0.2 mol,n(O2)=0.1 mol,在标准状况下体积为2.24 L,D正确。
9.有三个烧杯,分别盛有氯化铜、氯化钾和硝酸银三种溶液,均以Pt作电极,将它们串联在一起电解一段时间,测得电极增重总和2.8 g,这时产生的有色气体与无色气体的物质的量之比为( )
A.4∶1 B.1∶1
C.4∶3 D.3∶4
答案 C
解析 串联电路中,相同时间内各电极得电子或失电子的物质的量相同,各电极上放出气体的物质的量之比为定值。不必注意电极增重是多少,只要判断出生成何种气体及生成一定物质的量该气体所得失电子的物质的量,就可以通过得失电子守恒判断气体体积之比。第一个烧杯中放出Cl2,第二个烧杯中放出Cl2和H2,第三个烧杯中放出O2。在有1 mol电子转移时,生成的气体的物质的量分别是0.5 mol、0.5 mol、0.5 mol和0.25 mol。所以共放出有色气体(Cl2)0.5 mol+0.5 mol=1 mol,无色气体(O2和H2)0.5 mol+0.25 mol=0.75 mol。
10.用石墨电极电解CuSO4溶液一段时间后,向所得溶液中加入0.2 mol Cu(OH)2后,恰好使溶液恢复到电解前的浓度。则电解过程中转移电子的物质的量为( )
A.0.4 mol B.0.5 mol
C.0.6 mol D.0.8 mol
答案 D
解析 将Cu(OH)2改写为CuO·H2O,根据CuO·H2O知,阳极上OH-放电生成O2,阴极上Cu2+和H+放电生成Cu和H2,根据氧原子守恒得n(O2)=n[Cu(OH)2]=0.2 mol,则转移电子的物质的量为0.2 mol×4=0.8 mol,故D正确。
11.用石墨作电极电解1 000 mL硝酸钾和硝酸铜的混合溶液,当通电一段时间后,两极都收集到112 mL气体(标准状况),假定电解后溶液体积仍为1 000 mL,则电解后溶液的pH为( )
A.4 B.3 C.2 D.1
答案 C
解析 阳极产生氧气0.005 mol,阴极产生氢气0.005 mol。由2H2O2H2↑+O2↑可知,阴极产生0.005 mol氢气时,阳极产生0.002 5 mol氧气;由2Cu2++2H2O2Cu+4H++O2↑可知,产生n(H+)=(0.005 mol-0.002 5 mol)×4=0.01 mol,c(H+)=0.01 mol·L-1,pH=2。
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\综合强化.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\综合强化.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\综合强化.TIF" \* MERGEFORMATINET
12.某同学设计了一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-109.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-109.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-109.TIF" \* MERGEFORMATINET
根据要求回答相关问题:
(1)通入氢气的电极为______(填“正极”或“负极”),负极的电极反应式为________________________________________________________________________。
(2)石墨电极为______(填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,________(填“铁极”或“石墨极”)区的溶液变红。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液的浓度将______(填“增大”“减小”或“不变”)。精铜电极上的电极反应式为_____________________________。
答案 (1)负极 H2-2e-+2OH-===2H2O
(2)阳极 铁极 (3)减小 Cu2++2e-===Cu
解析 (1)通入氢气的电极为负极;由于电解质溶液是碱性的,所以该电极反应式为H2-2e-+2OH-===2H2O。
(2)由于铁电极与电源的负极连接,所以铁电极为阴极,石墨电极为阳极;反应一段时间后,在乙装置中滴入酚酞溶液,溶液中的H+在阴极(铁电极)放电,破坏了附近的水的电离平衡,该区域的溶液呈碱性,因此铁极区的溶液变红。
(3)因为粗铜中的锌等活动性比Cu强的杂质金属优先失去电子,而得到电子的只有Cu2+,所以丙装置中反应一段时间,硫酸铜溶液的浓度会减小;精铜电极上的电极反应式为Cu2++2e-===Cu。
13.电解的应用比较广泛。根据下列电解的应用,回答问题:
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-112.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-112.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-112.TIF" \* MERGEFORMATINET
(1)如图为电解精炼银的示意图,____________(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为______________________________。
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-113.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-113.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-113.TIF" \* MERGEFORMATINET
(2)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为____________(填化学式)溶液,阳极电极反应式为____________________,电解过程中Li+向________(填“A”或“B”)电极迁移。
(3)离子液体是一种室温熔融盐,为非水体系。由有机阳离子、Al2Cl和AlCl组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极反应式为_____________________________。
若改用氯化铝水溶液作电解液,则阴极产物为______________。
答案 (1)a NO+2H++e-===NO2↑+H2O(或NO+4H++3e-===NO↑+2H2O、2NO+O2===2NO2)
(2)LiOH 2Cl--2e-===Cl2↑ B
(3)负 4Al2Cl+3e-===Al+7AlCl H2
解析 (1)电解精炼银与电解精炼铜原理相似。电解精炼银装置中,含有杂质的粗银作阳极,电解池的阳极与电源的正极相连,则该装置中a极为含有杂质的粗银。该电解池的b极为阴极,阴极上有红棕色气体生成,可知NO被还原为NO2,电极反应式为NO+2H++e-===NO2↑+H2O。
(2)根据电解装置图,两电极区电解液分别为LiOH和LiCl溶液,B极区产生H2,电极反应式为2H2O+2e-===H2↑+2OH-,剩余的OH-与Li+结合生成LiOH,所以B极区电解液为LiOH溶液,B电极为阴极,则A电极为阳极,阳极区电解液为LiCl溶液,电极反应式为2Cl--2e-===Cl2↑,电解过程中Li+向B电极迁移。
(3)在钢制品上电镀铝,故钢制品作阴极,与电源负极相连。由于电镀过程中“不产生其他离子且有机阳离子不参与电极反应”,Al元素在熔融盐中以Al2Cl和AlCl形式存在,则电镀过程中阴极反应式为4Al2Cl+3e-===Al+7AlCl。若电解液改为氯化铝水溶液,水溶液中得电子能力:Al3+
INCLUDEPICTURE "F:\\源文件\\2022\\同步\\化学\\4-114.TIF" \* MERGEFORMAT INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-114.TIF" \* MERGEFORMATINET INCLUDEPICTURE "E:\\张春兰\\2022\\同步\\化学\\4-114.TIF" \* MERGEFORMATINET
(1)曲线________(填“Ⅰ”或“Ⅱ”)表示阳极产生气体的变化。
(2)氯化钠的物质的量浓度为________,硫酸铜的物质的量浓度为________。
(3)t2时所得溶液的pH为________。
答案 (1)Ⅱ (2)0.1 mol·L-1 0.1 mol·L-1 (3)1
解析 (1)阴极上Cu2+首先放电,故开始时,阴极上无气体生成,故曲线Ⅱ表示阳极产生气体的变化。
(2)0~t1时间内阳极发生的反应为2Cl--2e-===Cl2↑,n(Cl2)==0.01 mol,n(NaCl)=n(Cl-)=2n(Cl2)=0.02 mol,c(NaCl)==0.1 mol·L-1;阴极上依次发生反应Cu2++2e-===Cu、2H2O+2e-===H2↑+2OH-,阳极上依次发生反应2Cl--2e-===Cl2↑、2H2O-4e-===O2↑+4H+,由图可知V(H2)=0.672 L,V(Cl2)=0.224 L,V(O2)=0.448 L,由得失电子守恒可知×2+c(Cu2+)×0.2 L×2=×2+×4,解得c(Cu2+)=0.1 mol·L-1。
(3)由4OH-~O2~4H+可得:n(H+)=×4=0.02 mol,则溶液中的c(H+)==0.1 mol·L-1,pH=1。
