2023化学苏教版选择性必修一 1.1.2 反应热的测量与计算(共46张ppt)
文档属性
| 名称 | 2023化学苏教版选择性必修一 1.1.2 反应热的测量与计算(共46张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 20:45:13 | ||
图片预览











文档简介
(共46张PPT)
专题1 化学反应与能量变化
第一单元 化学反应的热效应
第2课时 反应热的测量与计算
学习目标
1.能进行反应焓变的简单计算。
2.了解盖斯定律及其简单应用。
证据推理与模型认知:
能理解、描述和表示盖斯定律计算模型,并能熟练运用于反应焓变的计算。
核心素养
一、反应热的测量实验
活动探究
归纳总结
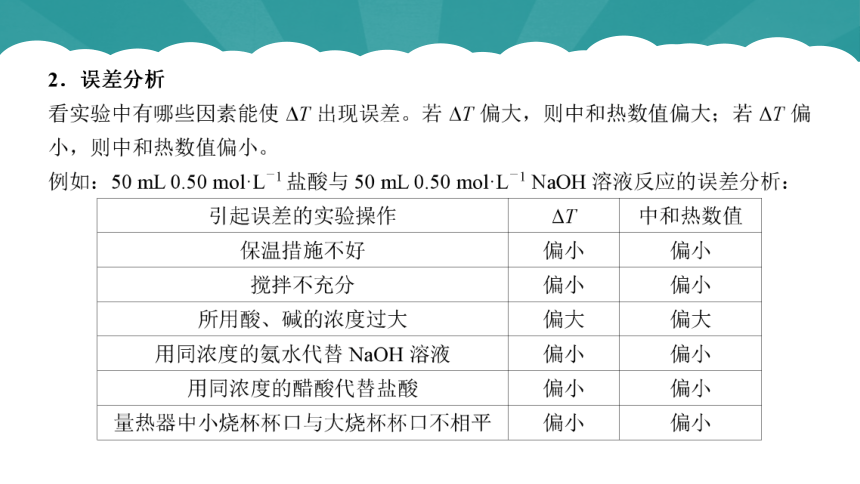
1.注意问题
(1)实验中要用强酸、强碱的稀溶液(0.1~0.5 mol·L-1)。
(2)操作时动作要快,尽量减少热量的损失,使用绝热装置,避免热量散发到反应体系外。
(3)测量盐酸的温度后,要将温度计上的酸冲洗干净后,再测量NaOH溶液的温度,避免酸、碱在温度计的表面反应放热而影响测量结果。
(4)读取中和反应体系的温度(T3)是反应混合液的最高温度。
(5)测定中和热不能用弱酸或弱碱,因弱酸、弱碱电离时吸收热量而使测量的数值偏低。
(6)中和热的数值是57.3 kJ·mol-1,测定时与强酸、强碱的用量无关。
巩固练习
A
A
1.盖斯定律的内容
一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是 的。
或者说,化学反应的反应热只与反应体系的 有关, 而与
无关。
二、盖斯定律
活动探究
完全相等
则ΔH= = 。
(3)能量守恒:能量既不会增加,也不会减少,只会从一种形式转化为另一种形式。
2.盖斯定律的特点
(1)反应的热效应只与始态、终态有关,与反应的 无关。
(2)反应热总值一定,如下图表示始态到终态的反应热:
ΔH1= ,则:
ΔH= 。
根据盖斯定律,知:
归纳总结
巩固练习
A
C
能力提升
归纳总结
举一反三
2.100 mL 0.200 mol·L-1 CuSO4溶液与1.95 g锌粉在量热计中充分反应。测得反应前温度为20.1 ℃,反应后最高温度为30.1 ℃。
已知:反应前后,溶液的比热容均近似为4.18 J·g-1·℃-1、溶液的密度均近似为1.00 g·cm-3,忽略溶液体积、质量变化和金属吸收的热量。请计算:
(1)反应放出的热量Q=____________J。
(2)反应Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s)的ΔH=_______________________
kJ·mol-1(列式计算)。
4.18×103
当堂检测
A
C
A
A
本节内容结束
专题1 化学反应与能量变化
第一单元 化学反应的热效应
第2课时 反应热的测量与计算
学习目标
1.能进行反应焓变的简单计算。
2.了解盖斯定律及其简单应用。
证据推理与模型认知:
能理解、描述和表示盖斯定律计算模型,并能熟练运用于反应焓变的计算。
核心素养
一、反应热的测量实验
活动探究
归纳总结
1.注意问题
(1)实验中要用强酸、强碱的稀溶液(0.1~0.5 mol·L-1)。
(2)操作时动作要快,尽量减少热量的损失,使用绝热装置,避免热量散发到反应体系外。
(3)测量盐酸的温度后,要将温度计上的酸冲洗干净后,再测量NaOH溶液的温度,避免酸、碱在温度计的表面反应放热而影响测量结果。
(4)读取中和反应体系的温度(T3)是反应混合液的最高温度。
(5)测定中和热不能用弱酸或弱碱,因弱酸、弱碱电离时吸收热量而使测量的数值偏低。
(6)中和热的数值是57.3 kJ·mol-1,测定时与强酸、强碱的用量无关。
巩固练习
A
A
1.盖斯定律的内容
一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是 的。
或者说,化学反应的反应热只与反应体系的 有关, 而与
无关。
二、盖斯定律
活动探究
完全相等
则ΔH= = 。
(3)能量守恒:能量既不会增加,也不会减少,只会从一种形式转化为另一种形式。
2.盖斯定律的特点
(1)反应的热效应只与始态、终态有关,与反应的 无关。
(2)反应热总值一定,如下图表示始态到终态的反应热:
ΔH1= ,则:
ΔH= 。
根据盖斯定律,知:
归纳总结
巩固练习
A
C
能力提升
归纳总结
举一反三
2.100 mL 0.200 mol·L-1 CuSO4溶液与1.95 g锌粉在量热计中充分反应。测得反应前温度为20.1 ℃,反应后最高温度为30.1 ℃。
已知:反应前后,溶液的比热容均近似为4.18 J·g-1·℃-1、溶液的密度均近似为1.00 g·cm-3,忽略溶液体积、质量变化和金属吸收的热量。请计算:
(1)反应放出的热量Q=____________J。
(2)反应Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s)的ΔH=_______________________
kJ·mol-1(列式计算)。
4.18×103
当堂检测
A
C
A
A
本节内容结束
