2023化学苏教版选择性必修一 1.1.3 能源的充分利用(共51张ppt)
文档属性
| 名称 | 2023化学苏教版选择性必修一 1.1.3 能源的充分利用(共51张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 20:46:07 | ||
图片预览











文档简介
(共51张PPT)
专题1 化学反应与能量变化 第一单元 化学反应的热效应
第3课时 能源的充分利用
学习目标
1.能举例说明化学在解决能源危机中的重要作用,能分析能源的利用对自然环境和社会发展的影响。能综合考虑化学变化中的物质变化和能量变化来分析、解决实际问题,如煤炭的综合利用、新型电池的开发等。
2.能进行反应焓变的简单计算。
核心素养
科学态度与社会责任:
化学在解决能源危机中做出了重要贡献,主动关心与环境保护、资源开发等有关的社会热点问题,形成与环境和谐共处,合理利用资源的观念。具有“绿色化学”观念,能运用所学知识分析和探讨某些能源在使用过程中对人类健康、社会可持续发展可能带来的双重影响。
知识梳理
一、标准燃烧热
1.概念
在101 kPa下,1 mol物质 的反应热叫做该物质的标准燃烧热。
2.单位
标准燃烧热属于反应热的一种,单位为 。
3.完全燃烧的含义
物质中所含有的氮元素转化为 ,氢元素转化为 ,碳元素转化为 ,硫元素转化为SO2(g)。
完全燃烧
4.意义
25 ℃时,甲烷的标准燃烧热为ΔH=-890.3 kJ·mol-1,热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1。表示 甲烷完全燃烧生成CO2(g)和H2O(l)时放出890.3 kJ的热量。
1 mol
1.什么是热值?热值较大的气体有哪些?
思考交流
归纳总结
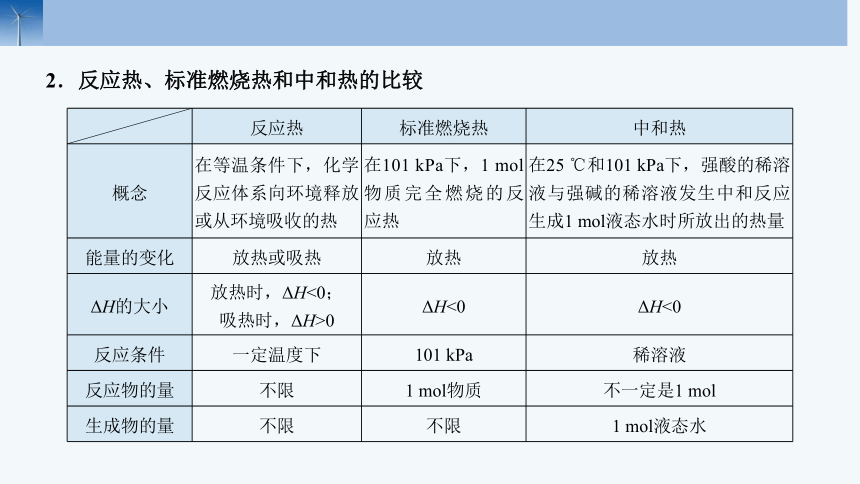
反应热 标准燃烧热 中和热
概念 在等温条件下,化学反应体系向环境释放或从环境吸收的热 在101 kPa下,1 mol物质完全燃烧的反应热 在25 ℃和101 kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1 mol液态水时所放出的热量
能量的变化 放热或吸热 放热 放热
ΔH的大小 放热时,ΔH<0; 吸热时,ΔH>0 ΔH<0 ΔH<0
反应条件 一定温度下 101 kPa 稀溶液
反应物的量 不限 1 mol物质 不一定是1 mol
生成物的量 不限 不限 1 mol液态水
2.反应热、标准燃烧热和中和热的比较
巩固练习
A
B
活动探究
二、能源的充分利用
提示:根据盖斯定律,由①-②-③即可得C(s)+H2O(g)===CO(g)+H2(g) ΔH=131.3 kJ·mol-1。
2.比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出下列循环图:
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。甲、乙两同学谁的观点正确?为什么?
提示:由问题1可知煤转化为水煤气是吸热反应,而甲同学正是忽略了这个问题,才认为“煤转化为水煤气可以使煤燃烧放出更多的热量”。故乙同学的观点正确。
归纳总结
1.能源及其重要作用
自然界中,能为人类提供能量的物质或物质运动统称能源,包括阳光、风力、流水、生物质能、地热能、潮汐、核能、化石燃料(煤、石油和天然气)等。能源是国民经济和社会发展的重要物质基础,它的开发和有效利用程度以及人均消费量,是一个国家生产技术水平和生活水平的重要标志。
2.我国的能源状况
(1)我国的能源总量较丰富,约占世界能源总量的十分之一,但人均能源可采储量远低于世界平均水平。
(2)我国的能源结构不平衡、资源分布不均衡。目前我国能源消费快速增长,消费结构以煤为主,以石油、天然气为辅,以流水、核能、风力、阳光为补充。
3.解决能源危机的措施
(1)“开源”,即开发核能、风能、太阳能等新能源。
(2)“节流”,加大节能减排的力度,提高能源利用效率。
4.新能源特点及开发
人类理想中的新能源应具有资源丰富、可再生、无污染或少污染等特点,只有这样才能实现人类社会绿色、生态化、可持续的发展。当前,我国大力倡导“构建清洁低碳、安全高效的能源体系”,降低能耗,努力开发和研究太阳能、氢能、风能、地热能、潮汐能和生物质能等多种形式的新能源及其应用。
巩固练习
D
B
三、计算反应热(ΔH)的几种方法
活动探究
已知:4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) ΔH=-1 745.2 kJ·mol-1;
6NO(g)+4NH3(g) 5N2(g)+6H2O(g) ΔH=-1 925.2 kJ·mol-1。
则反应Ⅰ的热化学方程式可表示为
_____________________________________________________________。
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-1 025.2 kJ·mol-1
(2)用O2将HCl转化为Cl2,可提高效益,减少污染。
传统上该转化通过如图所示的催化循环实现。其中,反应①为
2HCl(g)+CuO(s) H2O(g)+CuCl2(s) ΔH1
反应②生成1 mol Cl2(g)的反应热为ΔH2,则总反应的热化学方程式为
___________________________________________________________________
(反应热用ΔH1和ΔH2表示)。
4HCl(g)+O2(g)===2H2O(g)+2Cl2(g) ΔH=2ΔH1+2ΔH2
提示:(1)将已知的两个热化学方程式从上到下依次标记为①和②,根据盖斯定律由①×5-②×4得:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-1 025.2 kJ·mol-1。
(2)设2HCl(g)+CuO(s) H2O(g)+CuCl2(s) ΔH1 ①
由图得2CuCl2(s)+O2(g)===2CuO(s)+2Cl2(g) 2ΔH2 ②
运用盖斯定律:①×2+②得总反应:4HCl(g)+O2(g)===2H2O(g)+2Cl2(g) ΔH=2ΔH1+2ΔH2。
归纳总结
计算依据 计算方法
热化学方程式 热化学方程式可以左右颠倒同时改变ΔH的正负号,各物质化学式前的系数及ΔH数值的绝对值可以同时扩大或缩小相同的倍数
盖斯定律 先根据盖斯定律采取“加和法”或“虚拟路径法”写出目标热化学方程式,然后进行相应的计算
标准燃烧热 物质完全燃烧放出的热量=n(物质)×其|标准燃烧热|
化学键的变化 ΔH=反应物的化学键断裂所吸收的能量之和-生成物的化学键形成所释放的能量之和
反应物和生成物的总能量 ΔH=E生成物-E反应物
反应热的计算依据及计算方法
计算依据 计算方法
图像信息 (a、b、c 均大于0)
ΔH=(E2-E1)kJ·mol-1=(a-b)kJ·mol-1=-c kJ·mol-1
图像信息 (a、b、c 均大于0)
ΔH=(E2-E1)kJ·mol-1=(a-b)kJ·mol-1=+c kJ·mol-1
巩固练习
1.在25 ℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(l)的标准燃烧热分别为393.5 kJ·mol-1、285.8 kJ·mol-1、870.3 kJ·mol-1,则2C(s)+2H2(g)+O2(g) ===CH3COOH(l)的反应热为 ( )
A.-488.3 kJ·mol-1 B.+488.3 kJ·mol-1
C.-191 kJ·mol-1 D.+191 kJ·mol-1
A
2.请完成下列填空:
(1)已知2N2O5(g)===2N2O4(g)+O2(g) ΔH1=-4.4 kJ·mol-1
2NO2(g)===N2O4(g) ΔH2=-55.3 kJ·mol-1
则反应N2O5(g)===2NO2(g)+O2(g)的ΔH=________kJ·mol-1。
(2)CO2与CH4经催化重整,制得合成气的化学方程式为CH4(g)+CO2(g)
2CO(g)+2H2(g)。
已知上述反应中相关的化学键键能数据如下:
化学键 C—H C==O H—H C O(CO)
键能/(kJ·mol-1) 413 745 436 1 075
则该反应的ΔH=__________________。
53.1
+120 kJ·mol-1
3.(1)实验测得,5 g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5 kJ的热量,则表示甲醇标准燃烧热的热化学方程式为
___________________________________________________________________。
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键断裂和生成物的化学键形成的过程。在化学反应过程中,断裂化学键需要消耗能量,形成化学键又会释放能量。
已知:N2(g)+3H2(g) 2NH3(g) ΔH=a kJ·mol-1,根据上表中所列键能数据可计算出a=________。
化学键 H—H N—H N≡N
键能/(kJ·mol-1) 436 391 945
CH3OH(l)+O2(g)===CO2(g)+2H2O(l) ΔH=-726.4 kJ·mol-1
-93
(3)根据下图图像写出反应CO(g)+2H2(g)===CH3OH(g)的热化学方程式:
____________________________________________________________。
CO(g)+2H2(g)===CH3OH(g) ΔH=-91 kJ·mol-1
当堂检测
B
B
3.金刚石与石墨是碳的两种同素异形体。已知25 ℃、101 kPa下,C(石墨,s)+O2(g)===CO2(g) ΔH1=-393.51 kJ·mol-1,C(金刚石,s)+O2(g)===CO2(g) ΔH2=-395.41 kJ·mol-1。下列说法或表达正确的是 ( )
A.“钻石恒久远,一颗永流传”,说明金刚石比石墨稳定
B.C(石墨,s)===C(金刚石,s) ΔH>0
C.已知金刚石在隔绝空气的条件下加热到1 000 ℃,可转变为石墨,则该反应
为吸热反应
D.金刚石是天然存在的最硬的物质,所以不能用石墨为原料人工合成金刚石
B
4.已知:H2和CH4的标准燃烧热分别为ΔH=-285.8 kJ·mol-1 和ΔH=-890 kJ·mol-1,112 L H2和CH4的混合气体(标准状况下)完全燃烧生成CO2和液态水时放出3 695 kJ的热量,则混合气体中H2和CH4的物质的量之比是________。
1∶3
5.(1)随着化石能源的减少,新能源的开发利用日益迫切。Bunsen热化学循环制氢工艺由下列三个反应组成:
SO2(g)+I2(g)+2H2O(g)===2HI(g)+H2SO4(l) ΔH=a kJ·mol-1
2H2SO4(l)===2H2O(g)+2SO2(g)+O2(g) ΔH=b kJ·mol-1
2HI(g)===H2(g)+I2(g) ΔH=c kJ·mol-1
则:2H2O(g)===2H2(g)+O2(g) ΔH=____________kJ·mol-1。
(2a+b+2c)
化学键 C—C C—H H—H C—O C O H—O
键能/ ( kJ·mol-1) 348 414 436 326.8 1 032 464
则该反应的ΔH=__________kJ·mol-1。
(2)据粗略统计,我国没有经过处理便排放的焦炉煤气已超过250亿立方米,这不仅是能源的浪费,也对环境造成了极大污染。为解决这一问题,我国在2004年起已利用焦炉煤气制取甲醇及二甲醚。
已知CO中的C与O之间为三键连接,且合成甲醇的主要反应原理为CO(g)+2H2(g) CH3OH(g) ΔH。下表所列为常见化学键的键能数据:
-128.8
①写出能表示硫的标准燃烧热的热化学方程式:
________________________________________________________________。
②ΔH2=________ kJ·mol-1。
(3)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示。
已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol-1
-78.64
本节内容结束
专题1 化学反应与能量变化 第一单元 化学反应的热效应
第3课时 能源的充分利用
学习目标
1.能举例说明化学在解决能源危机中的重要作用,能分析能源的利用对自然环境和社会发展的影响。能综合考虑化学变化中的物质变化和能量变化来分析、解决实际问题,如煤炭的综合利用、新型电池的开发等。
2.能进行反应焓变的简单计算。
核心素养
科学态度与社会责任:
化学在解决能源危机中做出了重要贡献,主动关心与环境保护、资源开发等有关的社会热点问题,形成与环境和谐共处,合理利用资源的观念。具有“绿色化学”观念,能运用所学知识分析和探讨某些能源在使用过程中对人类健康、社会可持续发展可能带来的双重影响。
知识梳理
一、标准燃烧热
1.概念
在101 kPa下,1 mol物质 的反应热叫做该物质的标准燃烧热。
2.单位
标准燃烧热属于反应热的一种,单位为 。
3.完全燃烧的含义
物质中所含有的氮元素转化为 ,氢元素转化为 ,碳元素转化为 ,硫元素转化为SO2(g)。
完全燃烧
4.意义
25 ℃时,甲烷的标准燃烧热为ΔH=-890.3 kJ·mol-1,热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1。表示 甲烷完全燃烧生成CO2(g)和H2O(l)时放出890.3 kJ的热量。
1 mol
1.什么是热值?热值较大的气体有哪些?
思考交流
归纳总结
反应热 标准燃烧热 中和热
概念 在等温条件下,化学反应体系向环境释放或从环境吸收的热 在101 kPa下,1 mol物质完全燃烧的反应热 在25 ℃和101 kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1 mol液态水时所放出的热量
能量的变化 放热或吸热 放热 放热
ΔH的大小 放热时,ΔH<0; 吸热时,ΔH>0 ΔH<0 ΔH<0
反应条件 一定温度下 101 kPa 稀溶液
反应物的量 不限 1 mol物质 不一定是1 mol
生成物的量 不限 不限 1 mol液态水
2.反应热、标准燃烧热和中和热的比较
巩固练习
A
B
活动探究
二、能源的充分利用
提示:根据盖斯定律,由①-②-③即可得C(s)+H2O(g)===CO(g)+H2(g) ΔH=131.3 kJ·mol-1。
2.比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律做出下列循环图:
并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。甲、乙两同学谁的观点正确?为什么?
提示:由问题1可知煤转化为水煤气是吸热反应,而甲同学正是忽略了这个问题,才认为“煤转化为水煤气可以使煤燃烧放出更多的热量”。故乙同学的观点正确。
归纳总结
1.能源及其重要作用
自然界中,能为人类提供能量的物质或物质运动统称能源,包括阳光、风力、流水、生物质能、地热能、潮汐、核能、化石燃料(煤、石油和天然气)等。能源是国民经济和社会发展的重要物质基础,它的开发和有效利用程度以及人均消费量,是一个国家生产技术水平和生活水平的重要标志。
2.我国的能源状况
(1)我国的能源总量较丰富,约占世界能源总量的十分之一,但人均能源可采储量远低于世界平均水平。
(2)我国的能源结构不平衡、资源分布不均衡。目前我国能源消费快速增长,消费结构以煤为主,以石油、天然气为辅,以流水、核能、风力、阳光为补充。
3.解决能源危机的措施
(1)“开源”,即开发核能、风能、太阳能等新能源。
(2)“节流”,加大节能减排的力度,提高能源利用效率。
4.新能源特点及开发
人类理想中的新能源应具有资源丰富、可再生、无污染或少污染等特点,只有这样才能实现人类社会绿色、生态化、可持续的发展。当前,我国大力倡导“构建清洁低碳、安全高效的能源体系”,降低能耗,努力开发和研究太阳能、氢能、风能、地热能、潮汐能和生物质能等多种形式的新能源及其应用。
巩固练习
D
B
三、计算反应热(ΔH)的几种方法
活动探究
已知:4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) ΔH=-1 745.2 kJ·mol-1;
6NO(g)+4NH3(g) 5N2(g)+6H2O(g) ΔH=-1 925.2 kJ·mol-1。
则反应Ⅰ的热化学方程式可表示为
_____________________________________________________________。
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-1 025.2 kJ·mol-1
(2)用O2将HCl转化为Cl2,可提高效益,减少污染。
传统上该转化通过如图所示的催化循环实现。其中,反应①为
2HCl(g)+CuO(s) H2O(g)+CuCl2(s) ΔH1
反应②生成1 mol Cl2(g)的反应热为ΔH2,则总反应的热化学方程式为
___________________________________________________________________
(反应热用ΔH1和ΔH2表示)。
4HCl(g)+O2(g)===2H2O(g)+2Cl2(g) ΔH=2ΔH1+2ΔH2
提示:(1)将已知的两个热化学方程式从上到下依次标记为①和②,根据盖斯定律由①×5-②×4得:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-1 025.2 kJ·mol-1。
(2)设2HCl(g)+CuO(s) H2O(g)+CuCl2(s) ΔH1 ①
由图得2CuCl2(s)+O2(g)===2CuO(s)+2Cl2(g) 2ΔH2 ②
运用盖斯定律:①×2+②得总反应:4HCl(g)+O2(g)===2H2O(g)+2Cl2(g) ΔH=2ΔH1+2ΔH2。
归纳总结
计算依据 计算方法
热化学方程式 热化学方程式可以左右颠倒同时改变ΔH的正负号,各物质化学式前的系数及ΔH数值的绝对值可以同时扩大或缩小相同的倍数
盖斯定律 先根据盖斯定律采取“加和法”或“虚拟路径法”写出目标热化学方程式,然后进行相应的计算
标准燃烧热 物质完全燃烧放出的热量=n(物质)×其|标准燃烧热|
化学键的变化 ΔH=反应物的化学键断裂所吸收的能量之和-生成物的化学键形成所释放的能量之和
反应物和生成物的总能量 ΔH=E生成物-E反应物
反应热的计算依据及计算方法
计算依据 计算方法
图像信息 (a、b、c 均大于0)
ΔH=(E2-E1)kJ·mol-1=(a-b)kJ·mol-1=-c kJ·mol-1
图像信息 (a、b、c 均大于0)
ΔH=(E2-E1)kJ·mol-1=(a-b)kJ·mol-1=+c kJ·mol-1
巩固练习
1.在25 ℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(l)的标准燃烧热分别为393.5 kJ·mol-1、285.8 kJ·mol-1、870.3 kJ·mol-1,则2C(s)+2H2(g)+O2(g) ===CH3COOH(l)的反应热为 ( )
A.-488.3 kJ·mol-1 B.+488.3 kJ·mol-1
C.-191 kJ·mol-1 D.+191 kJ·mol-1
A
2.请完成下列填空:
(1)已知2N2O5(g)===2N2O4(g)+O2(g) ΔH1=-4.4 kJ·mol-1
2NO2(g)===N2O4(g) ΔH2=-55.3 kJ·mol-1
则反应N2O5(g)===2NO2(g)+O2(g)的ΔH=________kJ·mol-1。
(2)CO2与CH4经催化重整,制得合成气的化学方程式为CH4(g)+CO2(g)
2CO(g)+2H2(g)。
已知上述反应中相关的化学键键能数据如下:
化学键 C—H C==O H—H C O(CO)
键能/(kJ·mol-1) 413 745 436 1 075
则该反应的ΔH=__________________。
53.1
+120 kJ·mol-1
3.(1)实验测得,5 g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5 kJ的热量,则表示甲醇标准燃烧热的热化学方程式为
___________________________________________________________________。
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键断裂和生成物的化学键形成的过程。在化学反应过程中,断裂化学键需要消耗能量,形成化学键又会释放能量。
已知:N2(g)+3H2(g) 2NH3(g) ΔH=a kJ·mol-1,根据上表中所列键能数据可计算出a=________。
化学键 H—H N—H N≡N
键能/(kJ·mol-1) 436 391 945
CH3OH(l)+O2(g)===CO2(g)+2H2O(l) ΔH=-726.4 kJ·mol-1
-93
(3)根据下图图像写出反应CO(g)+2H2(g)===CH3OH(g)的热化学方程式:
____________________________________________________________。
CO(g)+2H2(g)===CH3OH(g) ΔH=-91 kJ·mol-1
当堂检测
B
B
3.金刚石与石墨是碳的两种同素异形体。已知25 ℃、101 kPa下,C(石墨,s)+O2(g)===CO2(g) ΔH1=-393.51 kJ·mol-1,C(金刚石,s)+O2(g)===CO2(g) ΔH2=-395.41 kJ·mol-1。下列说法或表达正确的是 ( )
A.“钻石恒久远,一颗永流传”,说明金刚石比石墨稳定
B.C(石墨,s)===C(金刚石,s) ΔH>0
C.已知金刚石在隔绝空气的条件下加热到1 000 ℃,可转变为石墨,则该反应
为吸热反应
D.金刚石是天然存在的最硬的物质,所以不能用石墨为原料人工合成金刚石
B
4.已知:H2和CH4的标准燃烧热分别为ΔH=-285.8 kJ·mol-1 和ΔH=-890 kJ·mol-1,112 L H2和CH4的混合气体(标准状况下)完全燃烧生成CO2和液态水时放出3 695 kJ的热量,则混合气体中H2和CH4的物质的量之比是________。
1∶3
5.(1)随着化石能源的减少,新能源的开发利用日益迫切。Bunsen热化学循环制氢工艺由下列三个反应组成:
SO2(g)+I2(g)+2H2O(g)===2HI(g)+H2SO4(l) ΔH=a kJ·mol-1
2H2SO4(l)===2H2O(g)+2SO2(g)+O2(g) ΔH=b kJ·mol-1
2HI(g)===H2(g)+I2(g) ΔH=c kJ·mol-1
则:2H2O(g)===2H2(g)+O2(g) ΔH=____________kJ·mol-1。
(2a+b+2c)
化学键 C—C C—H H—H C—O C O H—O
键能/ ( kJ·mol-1) 348 414 436 326.8 1 032 464
则该反应的ΔH=__________kJ·mol-1。
(2)据粗略统计,我国没有经过处理便排放的焦炉煤气已超过250亿立方米,这不仅是能源的浪费,也对环境造成了极大污染。为解决这一问题,我国在2004年起已利用焦炉煤气制取甲醇及二甲醚。
已知CO中的C与O之间为三键连接,且合成甲醇的主要反应原理为CO(g)+2H2(g) CH3OH(g) ΔH。下表所列为常见化学键的键能数据:
-128.8
①写出能表示硫的标准燃烧热的热化学方程式:
________________________________________________________________。
②ΔH2=________ kJ·mol-1。
(3)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示。
已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
S(s)+O2(g)===SO2(g) ΔH=-297 kJ·mol-1
-78.64
本节内容结束
