2023化学苏教版选择性必修一 1.2.2 一次电池和二次电池(共32张ppt)
文档属性
| 名称 | 2023化学苏教版选择性必修一 1.2.2 一次电池和二次电池(共32张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 20:47:00 | ||
图片预览








文档简介
(共32张PPT)
第2课时 一次电池和二次电池
专题1 化学反应与能量变化
第二单元 化学能与电能的转化
1.能列举常见的化学电源,并能利用相关信息分析化学电源的工作原理。
2.充分利用铅蓄电池的案例素材,发展对原电池工作原理的认识。
学习目标
核心素养
宏观辨识与微观探析:
能从宏观和微观结合的视角认识常见化学电源的结构、工作原理及物质与能量转化。
科学态度与社会责任:
具有理论联系实际的观念,有将化学成果应用于生产、生活的意识,能依据所学原电池知识解释生产、生活中简单的化学问题;在实践中逐步形成保护环境的观念。
活动探究
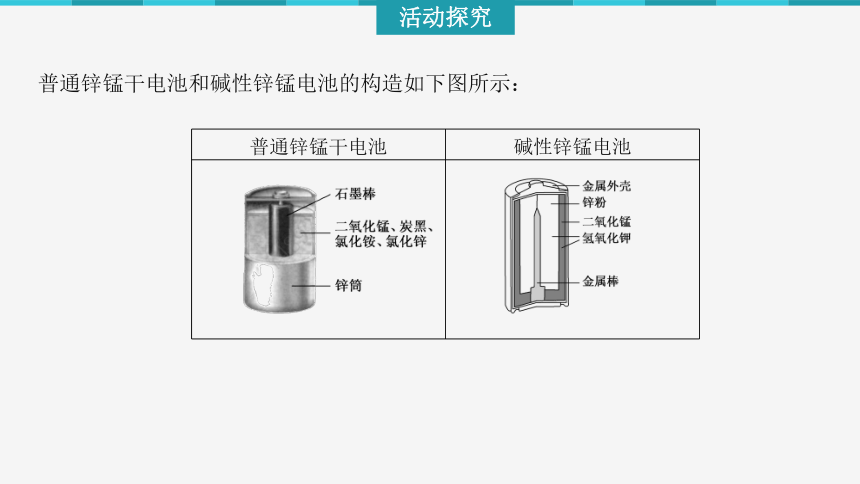
普通锌锰干电池 碱性锌锰电池
普通锌锰干电池和碱性锌锰电池的构造如下图所示:
[思考交流]
1.你能指出两种干电池中的正、负极材料及电解质吗?
提示:普通锌锰干电池的负极为Zn,正极为石墨棒,电解质为NH4Cl、ZnCl2,碱性锌锰电池的负极为Zn,正极为MnO2,电解质为KOH。
2.试写出碱性锌锰电池的正、负极反应式。
提示:负极反应式:Zn-2e-+2OH-===Zn(OH)2,
正极反应式:2MnO2+2e-+2H2O===2MnOOH+2OH-。
3.对比两种干电池,比较两种电池的优缺点。
提示:普通锌锰干电池中的NH4Cl糊呈酸性,能腐蚀负极材料Zn,故该干电池不能长时间储存;碱性锌锰电池比普通锌锰干电池性能好,它的比能量和可储存时间均有所提高,是普通锌锰干电池的升级换代产品。
一、一次电池
知识梳理
1.化学电源
(1)概念
化学电池是将化学能转化为电能的装置。
(2)分类
(3)优点
①化学电池的能量转换效率较高,供能稳定可靠。
②可以制成各种形状和大小、不同容量和电压的电池及电池组。
③使用方便,易于维护,可在各种环境下工作。
(4)判断电池优劣的主要标准
①比能量:电池单位质量或单位体积所输出电能的多少,单位是(W·h)·kg-1或(W·h)·L-1。
②比功率:电池单位质量或单位体积所输出功率的大小,单位是W·kg-1或W·L-1。
③电池的可储存时间的长短。
(5)化学电池回收利用
废旧电池中含重金属和酸碱等有害物质,应回收利用,既减少污染,又节约资源。
普通锌锰干电池 碱性锌锰电池
装置
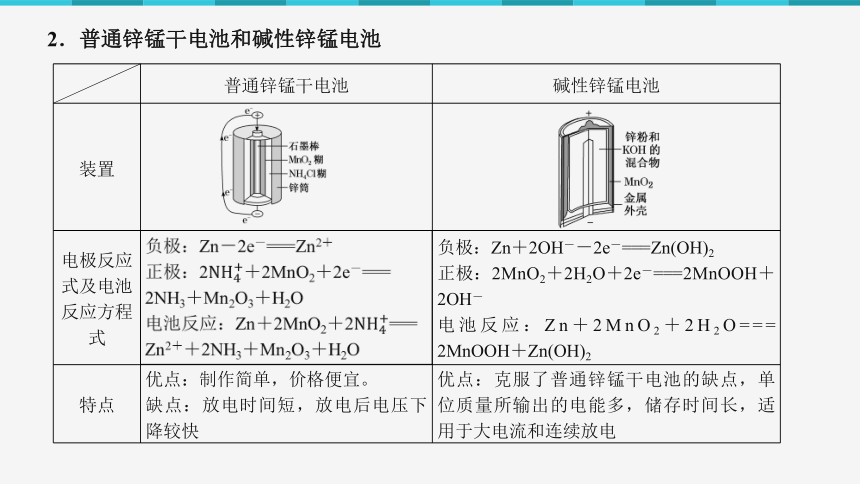
电极反应式及电池反应方程式 负极:Zn+2OH--2e-===Zn(OH)2
正极:2MnO2+2H2O+2e-===2MnOOH+2OH-
电池反应:Zn+2MnO2+2H2O=== 2MnOOH+Zn(OH)2
特点 优点:制作简单,价格便宜。 缺点:放电时间短,放电后电压下降较快 优点:克服了普通锌锰干电池的缺点,单位质量所输出的电能多,储存时间长,适用于大电流和连续放电
2.普通锌锰干电池和碱性锌锰电池
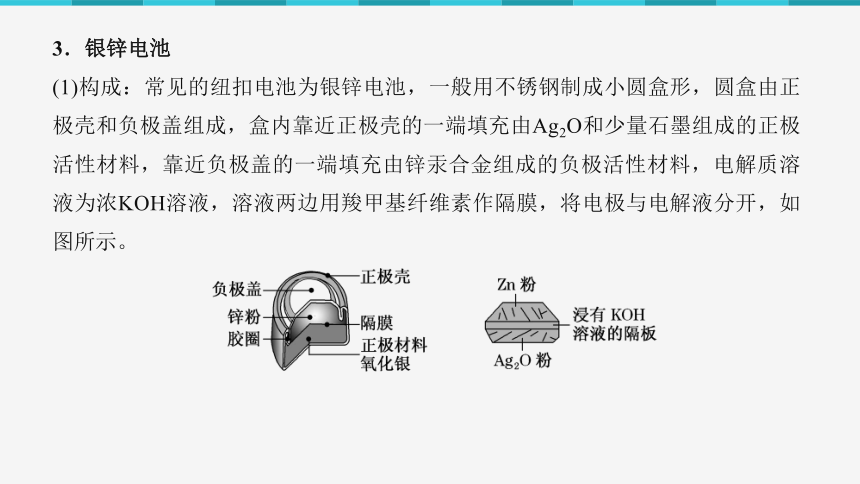
3.银锌电池
(1)构成:常见的纽扣电池为银锌电池,一般用不锈钢制成小圆盒形,圆盒由正极壳和负极盖组成,盒内靠近正极壳的一端填充由Ag2O和少量石墨组成的正极活性材料,靠近负极盖的一端填充由锌汞合金组成的负极活性材料,电解质溶液为浓KOH溶液,溶液两边用羧甲基纤维素作隔膜,将电极与电解液分开,如图所示。
(2)电极反应式及电池反应方程式
负极:Zn+2OH--2e-===Zn(OH)2
正极:Ag2O+2e-+H2O===2Ag+2OH-
电池反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag
(3)优点:银锌电池具有比能量大、电压稳定、储存时间长等特点。
(4)用途:常制成纽扣式微型电池,广泛用于电子手表、计算器和其他微型电子仪器中。
巩固练习
1.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。碱性锌锰电池以氢氧化钾溶液为电解质溶液,电池反应方程式为Zn+2MnO2+2H2O=== Zn(OH)2+2MnOOH,下列说法错误的是 ( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为2MnO2+2H2O+2e-===2MnOOH+2OH-
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g
C
【解析】由所给的电池反应方程式可知,电池工作时,每有 1 mol Zn参加反应,会有2 mol 电子从负极Zn经外电路流向正极,并在正极发生反应:2MnO2+2H2O+2e-===2MnOOH+2OH-,则外电路每通过0.2 mol电子,Zn的质量减少6.5 g。
2.纽扣电池可用作计算器、电子表等的电源。有一种纽扣电池,其电极分别为Zn和Ag2O,用KOH溶液做离子导体,电池反应方程式为Zn+Ag2O+H2O===2Ag+Zn(OH)2,下列关于该电池的叙述不正确的是 ( )
A.正极的电极反应式为Ag2O+2e-+H2O===2Ag+2OH-
B.Zn极发生氧化反应,Ag2O极发生还原反应
C.使用时,电子由Zn极经外电路流向Ag2O极,Zn是负极
D.使用时,溶液中OH-向Ag2O极移动
D
【解析】由电池反应方程式可知,Ag2O为正极,Ag2O得电子发生还原反应,碱性环境中,正极的电极反应式为Ag2O+2e-+H2O===2Ag+2OH-,A正确;Zn为负极,Zn失电子发生氧化反应,Ag2O为正极,Ag2O得电子发生还原反应,B正确;Zn为负极,Ag2O为正极,放电时电子由Zn极经外电路流向Ag2O极,C正确;电解质溶液中的阴离子移向负极,则OH-向Zn极移动,D错误。
活动探究
铅蓄电池是最常见的二次电池。铅蓄电池是由两组平行的栅状铝合金极板交替排列而成,可放电也可充电,一般用硬橡胶或透明塑料制成长方形外壳(防止酸液泄漏)。铅蓄电池设有多层电极板,其中正极板上覆盖有棕褐色的PbO2,负极板上覆盖有海绵状的金属Pb,正、负电极之间用微孔橡胶或微孔塑料隔开(防止电极之间发生短路),两极均浸入H2SO4溶液中,如图所示。
已知铅酸蓄电池的充、放电过程:
Pb+PbO2+2H2SO4 2PbSO4+2H2O。
放电
充电
[思考交流]
1.写出铅蓄电池放电时的负极、正极的电极反应式。
提示:负极反应式:Pb+-2e-===PbSO4;
正极反应式:PbO2+4H+++2e-===PbSO4+2H2O。
2.铅蓄电池放电时,正极区域溶液的pH是如何变化的?
提示:铅蓄电池放电时,正极的电极反应式为PbO2+4H+++2e-=== PbSO4+2H2O,反应消耗H+,故c(H+)下降,pH升高。
3.铅蓄电池充电时的反应和放电时的反应是可逆反应吗?
提示:不是;充电时的反应和放电时反应的反应条件不同。
4.铅蓄电池放电时,两极发生什么反应?充电时两极发生什么反应?据此,在充电时,怎样连接电源的两极?
提示:放电时,负极发生氧化反应,正极发生还原反应;充电时,阴极发生还原反应,阳极发生氧化反应;铅蓄电池在充电时,负极接电源负极,正极接电源正极。
二、二次电池
知识梳理
1.二次电池
二次电池又称为充电电池或蓄电池,是一类放电后可以再充电而反复使用的电池。
2.铅蓄电池
(1)工作原理
知识梳理
放电 负极
正极
电池反应 Pb+PbO2+2H2SO4===2PbSO4+2H2O
充电 阴极
阳极
电池反应 2PbSO4+2H2O===Pb+PbO2+2H2SO4
合并总反应 Pb+PbO2+2H2SO4 2PbSO4+2H2O
放电
充电
(2)电池的优缺点
①优点:可多次重复使用、电压稳定、使用方便、安全可靠、价格低廉,在生产、生活中应用广泛。
②缺点:比能量低、笨重,废弃电池会污染环境。
3.可充电电池充、放电时电极的连接
巩固练习
1.下列关于铅蓄电池的说法正确的是 ( )
A.放电时,正极发生的电极反应是Pb+===PbSO4+2e-
B.放电时,该电池的负极材料是铅板
C.充电时,电池中硫酸的浓度不断减小
D.充电时,阳极发生的反应是PbSO4+2e-===Pb+
B
【解析】铅蓄电池充、放电总反应为Pb+PbO2+2H2SO4 2PbSO4+2H2O。放电时Pb作负极,发生的电极反应为Pb-2e-+===PbSO4,正极发生的反应为PbO2+2e-+4H++===PbSO4+2H2O。充电时,H2SO4的浓度不断增大,阳极上失去电子发生氧化反应。
放电
充电
2.镍镉(Ni Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2
有关该电池的说法正确的是 ( )
A.充电时阳极反应:Ni(OH)2-e-+OH-===NiOOH+H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
放电
充电
A
【解析】由总反应可知,放电时,负极Cd发生氧化反应:Cd-2e-+2OH-===Cd(OH)2,负极碱性变弱,C项错误;正极反应为2NiOOH+2e-+2H2O===2Ni(OH)2+2OH-,放电时,OH-由正极向负极移动,D项错误;充电时,电能转化为化学能,B项错误;充电时阳极发生氧化反应,即为Ni(OH)2+OH--e-===NiOOH+H2O,A项正确。
当堂检测
1.铅蓄电池的两极分别为Pb、PbO2,电解质溶液为硫酸,工作时的电池反应方程式为Pb+PbO2+2H2SO4===2PbSO4+2H2O,下列结论正确的是 ( )
A.Pb为正极被氧化
B.溶液的pH不断减小
C.只向PbO2处移动
D.溶液的pH不断增大
D
【解析】由Pb元素化合价的变化,可以看出Pb是负极, A错误;由题给电池反应方程式可以看出硫酸不断被消耗,故pH不断增大, B错误,D正确;原电池工作时,阴离子向负极移动,即移向Pb极,C错误。
2.微型锂碘电池可用作植入某些心脏病人体内的心脏起搏器的电源。这种电池中的电解质是固体电解质LiI,其中的导电离子是I-。下列有关说法正确的是 ( )
A.正极反应:2Li-2e-===2Li+ B.负极反应:I2+2e-===2I-
C.电池反应是2Li+I2===2LiI D.金属锂作正极
【解析】该电池中Li的活泼性强,作负极,其发生的反应为2Li-2e-===2Li+,B、D均错误;正极发生的反应为I2+2e-===2I-,A错误;电池反应为2Li+I2===2LiI,C正确。
C
3.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是 ( )
A.放电时负极反应为 Zn-2e-+2OH-===Zn(OH)2
B.充电时阳极反应为 Fe(OH)3-3e-+5OH-===F+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
放电
充电
C
【解析】放电时负极发生氧化反应:Zn-2e-+2OH-===Zn(OH)2,正极发生还原反应:F+3e-+4H2O===Fe(OH)3+5OH-,电极附近溶液碱性增强,A、D正确,C不正确;充电时阳极发生氧化反应:Fe(OH)3-3e-+5OH-===F+4H2O,B正确。
本节内容结束
第2课时 一次电池和二次电池
专题1 化学反应与能量变化
第二单元 化学能与电能的转化
1.能列举常见的化学电源,并能利用相关信息分析化学电源的工作原理。
2.充分利用铅蓄电池的案例素材,发展对原电池工作原理的认识。
学习目标
核心素养
宏观辨识与微观探析:
能从宏观和微观结合的视角认识常见化学电源的结构、工作原理及物质与能量转化。
科学态度与社会责任:
具有理论联系实际的观念,有将化学成果应用于生产、生活的意识,能依据所学原电池知识解释生产、生活中简单的化学问题;在实践中逐步形成保护环境的观念。
活动探究
普通锌锰干电池 碱性锌锰电池
普通锌锰干电池和碱性锌锰电池的构造如下图所示:
[思考交流]
1.你能指出两种干电池中的正、负极材料及电解质吗?
提示:普通锌锰干电池的负极为Zn,正极为石墨棒,电解质为NH4Cl、ZnCl2,碱性锌锰电池的负极为Zn,正极为MnO2,电解质为KOH。
2.试写出碱性锌锰电池的正、负极反应式。
提示:负极反应式:Zn-2e-+2OH-===Zn(OH)2,
正极反应式:2MnO2+2e-+2H2O===2MnOOH+2OH-。
3.对比两种干电池,比较两种电池的优缺点。
提示:普通锌锰干电池中的NH4Cl糊呈酸性,能腐蚀负极材料Zn,故该干电池不能长时间储存;碱性锌锰电池比普通锌锰干电池性能好,它的比能量和可储存时间均有所提高,是普通锌锰干电池的升级换代产品。
一、一次电池
知识梳理
1.化学电源
(1)概念
化学电池是将化学能转化为电能的装置。
(2)分类
(3)优点
①化学电池的能量转换效率较高,供能稳定可靠。
②可以制成各种形状和大小、不同容量和电压的电池及电池组。
③使用方便,易于维护,可在各种环境下工作。
(4)判断电池优劣的主要标准
①比能量:电池单位质量或单位体积所输出电能的多少,单位是(W·h)·kg-1或(W·h)·L-1。
②比功率:电池单位质量或单位体积所输出功率的大小,单位是W·kg-1或W·L-1。
③电池的可储存时间的长短。
(5)化学电池回收利用
废旧电池中含重金属和酸碱等有害物质,应回收利用,既减少污染,又节约资源。
普通锌锰干电池 碱性锌锰电池
装置
电极反应式及电池反应方程式 负极:Zn+2OH--2e-===Zn(OH)2
正极:2MnO2+2H2O+2e-===2MnOOH+2OH-
电池反应:Zn+2MnO2+2H2O=== 2MnOOH+Zn(OH)2
特点 优点:制作简单,价格便宜。 缺点:放电时间短,放电后电压下降较快 优点:克服了普通锌锰干电池的缺点,单位质量所输出的电能多,储存时间长,适用于大电流和连续放电
2.普通锌锰干电池和碱性锌锰电池
3.银锌电池
(1)构成:常见的纽扣电池为银锌电池,一般用不锈钢制成小圆盒形,圆盒由正极壳和负极盖组成,盒内靠近正极壳的一端填充由Ag2O和少量石墨组成的正极活性材料,靠近负极盖的一端填充由锌汞合金组成的负极活性材料,电解质溶液为浓KOH溶液,溶液两边用羧甲基纤维素作隔膜,将电极与电解液分开,如图所示。
(2)电极反应式及电池反应方程式
负极:Zn+2OH--2e-===Zn(OH)2
正极:Ag2O+2e-+H2O===2Ag+2OH-
电池反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag
(3)优点:银锌电池具有比能量大、电压稳定、储存时间长等特点。
(4)用途:常制成纽扣式微型电池,广泛用于电子手表、计算器和其他微型电子仪器中。
巩固练习
1.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。碱性锌锰电池以氢氧化钾溶液为电解质溶液,电池反应方程式为Zn+2MnO2+2H2O=== Zn(OH)2+2MnOOH,下列说法错误的是 ( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为2MnO2+2H2O+2e-===2MnOOH+2OH-
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g
C
【解析】由所给的电池反应方程式可知,电池工作时,每有 1 mol Zn参加反应,会有2 mol 电子从负极Zn经外电路流向正极,并在正极发生反应:2MnO2+2H2O+2e-===2MnOOH+2OH-,则外电路每通过0.2 mol电子,Zn的质量减少6.5 g。
2.纽扣电池可用作计算器、电子表等的电源。有一种纽扣电池,其电极分别为Zn和Ag2O,用KOH溶液做离子导体,电池反应方程式为Zn+Ag2O+H2O===2Ag+Zn(OH)2,下列关于该电池的叙述不正确的是 ( )
A.正极的电极反应式为Ag2O+2e-+H2O===2Ag+2OH-
B.Zn极发生氧化反应,Ag2O极发生还原反应
C.使用时,电子由Zn极经外电路流向Ag2O极,Zn是负极
D.使用时,溶液中OH-向Ag2O极移动
D
【解析】由电池反应方程式可知,Ag2O为正极,Ag2O得电子发生还原反应,碱性环境中,正极的电极反应式为Ag2O+2e-+H2O===2Ag+2OH-,A正确;Zn为负极,Zn失电子发生氧化反应,Ag2O为正极,Ag2O得电子发生还原反应,B正确;Zn为负极,Ag2O为正极,放电时电子由Zn极经外电路流向Ag2O极,C正确;电解质溶液中的阴离子移向负极,则OH-向Zn极移动,D错误。
活动探究
铅蓄电池是最常见的二次电池。铅蓄电池是由两组平行的栅状铝合金极板交替排列而成,可放电也可充电,一般用硬橡胶或透明塑料制成长方形外壳(防止酸液泄漏)。铅蓄电池设有多层电极板,其中正极板上覆盖有棕褐色的PbO2,负极板上覆盖有海绵状的金属Pb,正、负电极之间用微孔橡胶或微孔塑料隔开(防止电极之间发生短路),两极均浸入H2SO4溶液中,如图所示。
已知铅酸蓄电池的充、放电过程:
Pb+PbO2+2H2SO4 2PbSO4+2H2O。
放电
充电
[思考交流]
1.写出铅蓄电池放电时的负极、正极的电极反应式。
提示:负极反应式:Pb+-2e-===PbSO4;
正极反应式:PbO2+4H+++2e-===PbSO4+2H2O。
2.铅蓄电池放电时,正极区域溶液的pH是如何变化的?
提示:铅蓄电池放电时,正极的电极反应式为PbO2+4H+++2e-=== PbSO4+2H2O,反应消耗H+,故c(H+)下降,pH升高。
3.铅蓄电池充电时的反应和放电时的反应是可逆反应吗?
提示:不是;充电时的反应和放电时反应的反应条件不同。
4.铅蓄电池放电时,两极发生什么反应?充电时两极发生什么反应?据此,在充电时,怎样连接电源的两极?
提示:放电时,负极发生氧化反应,正极发生还原反应;充电时,阴极发生还原反应,阳极发生氧化反应;铅蓄电池在充电时,负极接电源负极,正极接电源正极。
二、二次电池
知识梳理
1.二次电池
二次电池又称为充电电池或蓄电池,是一类放电后可以再充电而反复使用的电池。
2.铅蓄电池
(1)工作原理
知识梳理
放电 负极
正极
电池反应 Pb+PbO2+2H2SO4===2PbSO4+2H2O
充电 阴极
阳极
电池反应 2PbSO4+2H2O===Pb+PbO2+2H2SO4
合并总反应 Pb+PbO2+2H2SO4 2PbSO4+2H2O
放电
充电
(2)电池的优缺点
①优点:可多次重复使用、电压稳定、使用方便、安全可靠、价格低廉,在生产、生活中应用广泛。
②缺点:比能量低、笨重,废弃电池会污染环境。
3.可充电电池充、放电时电极的连接
巩固练习
1.下列关于铅蓄电池的说法正确的是 ( )
A.放电时,正极发生的电极反应是Pb+===PbSO4+2e-
B.放电时,该电池的负极材料是铅板
C.充电时,电池中硫酸的浓度不断减小
D.充电时,阳极发生的反应是PbSO4+2e-===Pb+
B
【解析】铅蓄电池充、放电总反应为Pb+PbO2+2H2SO4 2PbSO4+2H2O。放电时Pb作负极,发生的电极反应为Pb-2e-+===PbSO4,正极发生的反应为PbO2+2e-+4H++===PbSO4+2H2O。充电时,H2SO4的浓度不断增大,阳极上失去电子发生氧化反应。
放电
充电
2.镍镉(Ni Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2
有关该电池的说法正确的是 ( )
A.充电时阳极反应:Ni(OH)2-e-+OH-===NiOOH+H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
放电
充电
A
【解析】由总反应可知,放电时,负极Cd发生氧化反应:Cd-2e-+2OH-===Cd(OH)2,负极碱性变弱,C项错误;正极反应为2NiOOH+2e-+2H2O===2Ni(OH)2+2OH-,放电时,OH-由正极向负极移动,D项错误;充电时,电能转化为化学能,B项错误;充电时阳极发生氧化反应,即为Ni(OH)2+OH--e-===NiOOH+H2O,A项正确。
当堂检测
1.铅蓄电池的两极分别为Pb、PbO2,电解质溶液为硫酸,工作时的电池反应方程式为Pb+PbO2+2H2SO4===2PbSO4+2H2O,下列结论正确的是 ( )
A.Pb为正极被氧化
B.溶液的pH不断减小
C.只向PbO2处移动
D.溶液的pH不断增大
D
【解析】由Pb元素化合价的变化,可以看出Pb是负极, A错误;由题给电池反应方程式可以看出硫酸不断被消耗,故pH不断增大, B错误,D正确;原电池工作时,阴离子向负极移动,即移向Pb极,C错误。
2.微型锂碘电池可用作植入某些心脏病人体内的心脏起搏器的电源。这种电池中的电解质是固体电解质LiI,其中的导电离子是I-。下列有关说法正确的是 ( )
A.正极反应:2Li-2e-===2Li+ B.负极反应:I2+2e-===2I-
C.电池反应是2Li+I2===2LiI D.金属锂作正极
【解析】该电池中Li的活泼性强,作负极,其发生的反应为2Li-2e-===2Li+,B、D均错误;正极发生的反应为I2+2e-===2I-,A错误;电池反应为2Li+I2===2LiI,C正确。
C
3.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是 ( )
A.放电时负极反应为 Zn-2e-+2OH-===Zn(OH)2
B.充电时阳极反应为 Fe(OH)3-3e-+5OH-===F+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
放电
充电
C
【解析】放电时负极发生氧化反应:Zn-2e-+2OH-===Zn(OH)2,正极发生还原反应:F+3e-+4H2O===Fe(OH)3+5OH-,电极附近溶液碱性增强,A、D正确,C不正确;充电时阳极发生氧化反应:Fe(OH)3-3e-+5OH-===F+4H2O,B正确。
本节内容结束
