2023化学苏教版选择性必修一 1.2.3 燃料电池(共29张ppt)
文档属性
| 名称 | 2023化学苏教版选择性必修一 1.2.3 燃料电池(共29张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 20:48:03 | ||
图片预览







文档简介
(共29张PPT)
第3课时 燃料电池
专题1 化学反应与能量变化
第二单元 化学能与电能的转化
1.充分利用氢氧燃料电池的案例素材,发展对原电池工作原理的认识。
2.学会制作简单的燃料电池。
学习目标
核心素养
宏观辨识与微观探析:
能从宏观和微观结合的视角认识常见化学电源的结构、工作原理及物质与能量转化。
科学态度与社会责任:
具有理论联系实际的观念,有将化学成果应用于生产、生活的意识,能依据所学原电池知识解释生产、生活中简单的化学问题;在实践中逐步形成保护环境的观念。
信息1 中国氢燃料电池汽车网
2021年3月12日消息,东风氢燃料客车上榜第342批公告,搭载中山大洋电机股份有限公司的质子交换膜燃料电池系统,驱动电机额定功率:90 kW,峰值功率:200 kW,该车采用电机控制器限速,限速69 km·h-1。
活动探究
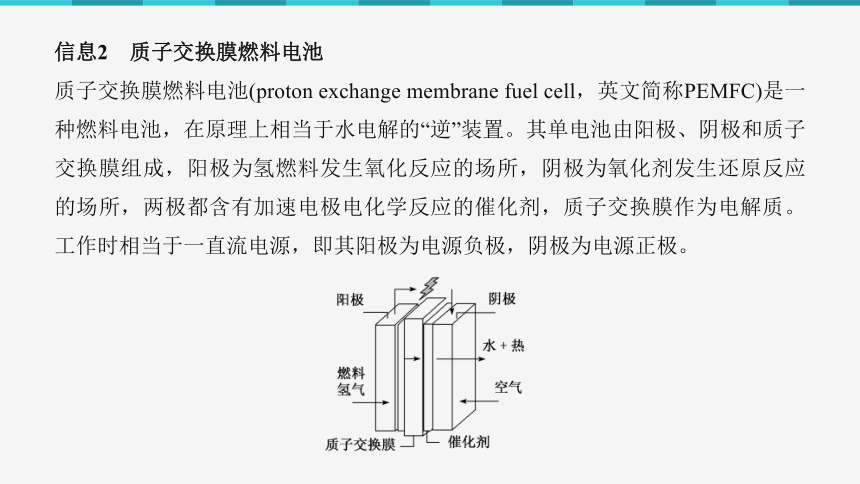
信息2 质子交换膜燃料电池
质子交换膜燃料电池(proton exchange membrane fuel cell,英文简称PEMFC)是一种燃料电池,在原理上相当于水电解的“逆”装置。其单电池由阳极、阴极和质子交换膜组成,阳极为氢燃料发生氧化反应的场所,阴极为氧化剂发生还原反应的场所,两极都含有加速电极电化学反应的催化剂,质子交换膜作为电解质。工作时相当于一直流电源,即其阳极为电源负极,阴极为电源正极。
[思考交流]
1.试写出该氢氧燃料电池的电极反应式。
提示:负极:2H2-4e-===4H+;正极:O2+4H++4e-===2H2O。
2.燃料电池有哪些优点?
提示:(1)能量转化率高。
(2)排放的废弃物少,绿色环保。
(3)燃料与氧化剂方便更换,且能连续不断地提供电能。
3.常见的燃料电池还有哪些?
提示:甲烷、甲醇、肼(N2H4)、氨等都可以作为燃料电池的燃料。
知识梳理
二、燃料电池的工作原理
1.连续地将燃料(常见的有氢气、烃、肼、甲醇、氨、煤气等气体或液体)和氧化剂的化学能直接转化为电能。
2.燃料电池的电极本身不参与氧化还原反应,只是一个催化转化元件。
3.工作时,燃料和氧化剂连续地由外部输入,在电极上不断地进行反应,生成物不断地被排出。
一、燃料电池的概念
燃料电池是利用燃料和氧化剂之间发生的氧化还原反应,将化学能直接转化为电能的化学电池。
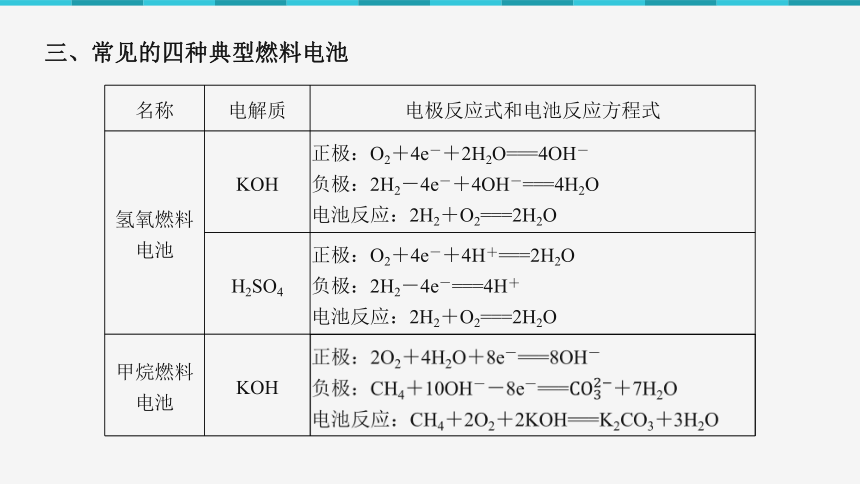
名称 电解质 电极反应式和电池反应方程式
氢氧燃料电池 KOH 正极:O2+4e-+2H2O===4OH-
负极:2H2-4e-+4OH-===4H2O
电池反应:2H2+O2===2H2O
H2SO4 正极:O2+4e-+4H+===2H2O
负极:2H2-4e-===4H+
电池反应:2H2+O2===2H2O
甲烷燃料电池 KOH
三、常见的四种典型燃料电池
名称 电解质 电极反应式和电池反应方程式
甲醇燃料电池 KOH
肼燃料 电池 KOH 正极:O2+2H2O+4e-===4OH-
负极:N2H4+4OH--4e-===N2+4H2O
电池反应:N2H4+O2===N2+2H2O
“绿水青山就是金山银山”,利用电池原理治理各种污染是科研工作人员致力研究的重要课题之一。
能力提升
(1)硫化氢是一种具有臭鸡蛋气味的有毒气体,我国最近在太阳能光电催化—化学耦合分解硫化氢的研究中获得新进展,相关装置如图所示。
①指出a极和b极的名称,并写出电极反应式。
提示:从图示可以看出电子从a极流出,故a极为负极,电极反应式为Fe2+-e-===Fe3+;b极为正极,电极反应式为2H++2e-===H2↑。
②结合离子方程式分析H2S气体去除的原理。
提示:除去H2S的过程涉及两个反应步骤,第一步Fe2+在电极上发生反应:Fe2+-e-===Fe3+;第二步,生成的铁离子氧化硫化氢生成硫单质,离子方程式为2Fe3++H2S===2Fe2++S↓+2H+。
写出生成氢气的电极反应式和此电池的电池反应方程式。
(2)碳排放是影响气候变化的重要因素之一。最近,科学家开发出一种新系统,“溶解”水中的二氧化碳,以触发电化学反应,生成电能和氢气,其工作原理如图所示。
提示:氢气在b电极产生,其电极反应式为2CO2+2H2O+2e-===2+H2,a电极反应式为Na-e-===Na+,因此电池反应方程式为2Na+2CO2+2H2O===2NaHCO3+H2。
(3)微生物燃料电池在净化废水的同时能获得能源或得到有价值的化学产品,如图为其工作原理。根据图示写出正极的电极反应式。
提示:根据原电池的工作原理知,电子流入的一极为正极,即N极为正极,根据图示可以判断在正极上得电子的物质有O2和,因此电极反应式为O2+4H++4e-===2H2O,+14H++6e-===2Cr3++7H2O。
解答有关化学电源电极反应式书写试题的思维流程如下:
归纳总结
1.如图是一种酸性燃料电池酒精检测仪,具有自动吹气流量监测与控制的功能,下列有关说法正确的是 ( )
A.电流由呼气所在的铂电极流出
B.H+通过质子交换膜流向氧气所在的铂电极
C.电路中流过2 mol电子时,消耗11.2 L O2
D.该电池的负极反应为CH3CH2OH+3H2O-12e-===2CO2↑+12H+
B
举一反三
【解析】呼气所在的电极发生乙醇转化为醋酸的氧化反应,故为负极,而电流由正极流出,A项错误;H+通过质子交换膜流向正极(氧气所在的铂电极),B项正确;正极反应为O2+4e-+4H+===2H2O,电路中流过2 mol电子时,消耗0.5 mol O2,在标准状况下的体积为11.2 L,但题中未指明是否为标准状况,C项错误;该电池的负极反应为CH3CH2OH+H2O-4e-===CH3COOH+4H+,D项错误。
2.某新型可充电电池构造如图所示,工作时(需先引发铁和氯酸钾的反应,从而使LiCl- KCl共晶盐熔化)某电极(记为X)的反应式之一为xLi++xe-+LiV3O8 ===Li1+xV3O8。下列说法正确的是 ( )
A.放电时,正极上的电极反应式为Li-e-===Li+
B.放电时,电池反应方程式为xLi+LiV3O8===Li1+xV3O8
C.充电时,X电极与电源负极相连
D.充电时,X电极的质量增加
B
【解析】由题干所给电极反应式可知,X电极发生得电子的还原反应,故X电极是正极,结合题图知,X电极是LiV3O8,则Li Si合金是负极,负极的电极反应式为Li-e-===Li+,结合X电极的电极反应式可知放电时电池反应方程式为xLi+LiV3O8===Li1+xV3O8,A项错误,B项正确;充电时,X电极应与电源正极相连,C项错误;充电时,X电极的电极反应与放电时X电极的电极反应互为逆反应,则充电时X电极的质量减轻,D项错误。
1.下面是几种常见的化学电源的示意图,有关说法不正确的是 ( )
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池工作过程中,每转移2 mol电子,负极质量减小207 g
D.氢氧燃料电池是一种具有广阔应用前景的绿色电源
C
当堂检测
【解析】A项,干电池是一次电池,铅蓄电池是可充电电池属于二次电池,氢氧燃料电池属于燃料电池,正确;B项,在干电池中,Zn作负极,被氧化,正确;C项,铅蓄电池工作过程中,硫酸铅在负极上析出,该极质量增加而非减小,错误;D项,氢氧燃料电池不需要将还原剂和氧化剂全部储藏在电池内,且最终产物是水,故氢氧燃料电池是一种具有广阔应用前景的绿色电源,正确。
2.质子交换膜燃料电池的工作原理如图所示,下列叙述正确的是 ( )
A.通入氧气的电极发生氧化反应
B.通入氢气的电极为正极
C.导电离子为质子,且在电池内部由正极定向移动至负极
D.正极的电极反应式为O2+4H++4e-===2H2O
【解析】该燃料电池中,H2和O2分别在负极和正极上发生氧化反应和还原反应,正极的电极反应式为4H++O2+4e-===2H2O,该电池中导电离子为H+,在电池内部由负极定向移动至正极。
D
3.肼(N2H4) 空气燃料电池是一种环保型碱性燃料电池,电解质为20%~30%的KOH溶液,电池反应方程式为N2H4+O2===N2+2H2O。下列关于该电池工作时的说法中正确的是 ( )
A.溶液的pH保持不变
B.溶液中的阴离子向正极移动
C.正极的电极反应式:O2+4H++4e-===2H2O
D.负极的电极反应式:N2H4+4OH--4e-===4H2O+N2↑
D
【解析】A项,因为有水生成,溶液的pH会减小,错误;B项,原电池中,溶液中的阴离子总是移向电池的负极,错误;C项,溶液介质为碱性,正极的电极反应式是O2+2H2O+4e-===4OH-,错误;D项,负极上发生燃料失电子的氧化反应,即N2H4+4OH--4e-===4H2O+N2↑,正确。
4.化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)锌锰干电池是应用最普遍的电池之一(如图1所示),锌锰干电池的负极材料是_____,负极的电极反应式为__________________。若反应消耗32.5 g负极材料,则电池中转移电子的数目为______________。
NA或6.02×1023
锌
Zn-2e-===Zn2+
(2)目前常用的镍(Ni)镉(Cd)电池其电池总反应式可以表示为Cd+2NiOOH+2H2O
2Ni(OH)2+Cd(OH)2(充电是指外加电流作用发生氧化还原反应),已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是________(填序号)。
①上述反应可以在酸性条件下进行
②上述反应不是可逆反应
③放电时正极金属Cd的质量增加
④放电时化学能转变为电能
放电
充电
②④
(3)如图2为氢氧燃料电池的构造示意图,电解质溶液的溶质是KOH。则X极为电池的______ (填“正”或“负”)极,X极的电极反应式为____________________________。
H2-2e-+2OH-===2H2O
负
【解析】(1)负极发生氧化反应,锌失去电子,电极反应式为Zn-2e-===Zn2+,32.5 g锌的物质的量为0.5 mol,而1 mol 锌失去2 mol电子,所以32.5 g锌参与反应时转移电子的物质的量为1 mol,数目为NA或6.02×1023。(2)①Ni(OH)2与Cd(OH)2可以与酸反应,则不能在酸性条件下进行,错误;②因为电池充放电在不同条件下进行,所以该电池反应不是可逆反应,正确;③放电时Cd在负极发生氧化反应转化为Cd(OH)2,金属Cd的质量增加,错误;④该电池放电为原电池工作原理,是将化学能转化为电能,正确。(3)电解质溶液为KOH溶液,X电极失去电子,为负极,氢气在负极被氧化,失电子发生氧化反应:H2-2e-+2OH-===2H2O。
本节内容结束
第3课时 燃料电池
专题1 化学反应与能量变化
第二单元 化学能与电能的转化
1.充分利用氢氧燃料电池的案例素材,发展对原电池工作原理的认识。
2.学会制作简单的燃料电池。
学习目标
核心素养
宏观辨识与微观探析:
能从宏观和微观结合的视角认识常见化学电源的结构、工作原理及物质与能量转化。
科学态度与社会责任:
具有理论联系实际的观念,有将化学成果应用于生产、生活的意识,能依据所学原电池知识解释生产、生活中简单的化学问题;在实践中逐步形成保护环境的观念。
信息1 中国氢燃料电池汽车网
2021年3月12日消息,东风氢燃料客车上榜第342批公告,搭载中山大洋电机股份有限公司的质子交换膜燃料电池系统,驱动电机额定功率:90 kW,峰值功率:200 kW,该车采用电机控制器限速,限速69 km·h-1。
活动探究
信息2 质子交换膜燃料电池
质子交换膜燃料电池(proton exchange membrane fuel cell,英文简称PEMFC)是一种燃料电池,在原理上相当于水电解的“逆”装置。其单电池由阳极、阴极和质子交换膜组成,阳极为氢燃料发生氧化反应的场所,阴极为氧化剂发生还原反应的场所,两极都含有加速电极电化学反应的催化剂,质子交换膜作为电解质。工作时相当于一直流电源,即其阳极为电源负极,阴极为电源正极。
[思考交流]
1.试写出该氢氧燃料电池的电极反应式。
提示:负极:2H2-4e-===4H+;正极:O2+4H++4e-===2H2O。
2.燃料电池有哪些优点?
提示:(1)能量转化率高。
(2)排放的废弃物少,绿色环保。
(3)燃料与氧化剂方便更换,且能连续不断地提供电能。
3.常见的燃料电池还有哪些?
提示:甲烷、甲醇、肼(N2H4)、氨等都可以作为燃料电池的燃料。
知识梳理
二、燃料电池的工作原理
1.连续地将燃料(常见的有氢气、烃、肼、甲醇、氨、煤气等气体或液体)和氧化剂的化学能直接转化为电能。
2.燃料电池的电极本身不参与氧化还原反应,只是一个催化转化元件。
3.工作时,燃料和氧化剂连续地由外部输入,在电极上不断地进行反应,生成物不断地被排出。
一、燃料电池的概念
燃料电池是利用燃料和氧化剂之间发生的氧化还原反应,将化学能直接转化为电能的化学电池。
名称 电解质 电极反应式和电池反应方程式
氢氧燃料电池 KOH 正极:O2+4e-+2H2O===4OH-
负极:2H2-4e-+4OH-===4H2O
电池反应:2H2+O2===2H2O
H2SO4 正极:O2+4e-+4H+===2H2O
负极:2H2-4e-===4H+
电池反应:2H2+O2===2H2O
甲烷燃料电池 KOH
三、常见的四种典型燃料电池
名称 电解质 电极反应式和电池反应方程式
甲醇燃料电池 KOH
肼燃料 电池 KOH 正极:O2+2H2O+4e-===4OH-
负极:N2H4+4OH--4e-===N2+4H2O
电池反应:N2H4+O2===N2+2H2O
“绿水青山就是金山银山”,利用电池原理治理各种污染是科研工作人员致力研究的重要课题之一。
能力提升
(1)硫化氢是一种具有臭鸡蛋气味的有毒气体,我国最近在太阳能光电催化—化学耦合分解硫化氢的研究中获得新进展,相关装置如图所示。
①指出a极和b极的名称,并写出电极反应式。
提示:从图示可以看出电子从a极流出,故a极为负极,电极反应式为Fe2+-e-===Fe3+;b极为正极,电极反应式为2H++2e-===H2↑。
②结合离子方程式分析H2S气体去除的原理。
提示:除去H2S的过程涉及两个反应步骤,第一步Fe2+在电极上发生反应:Fe2+-e-===Fe3+;第二步,生成的铁离子氧化硫化氢生成硫单质,离子方程式为2Fe3++H2S===2Fe2++S↓+2H+。
写出生成氢气的电极反应式和此电池的电池反应方程式。
(2)碳排放是影响气候变化的重要因素之一。最近,科学家开发出一种新系统,“溶解”水中的二氧化碳,以触发电化学反应,生成电能和氢气,其工作原理如图所示。
提示:氢气在b电极产生,其电极反应式为2CO2+2H2O+2e-===2+H2,a电极反应式为Na-e-===Na+,因此电池反应方程式为2Na+2CO2+2H2O===2NaHCO3+H2。
(3)微生物燃料电池在净化废水的同时能获得能源或得到有价值的化学产品,如图为其工作原理。根据图示写出正极的电极反应式。
提示:根据原电池的工作原理知,电子流入的一极为正极,即N极为正极,根据图示可以判断在正极上得电子的物质有O2和,因此电极反应式为O2+4H++4e-===2H2O,+14H++6e-===2Cr3++7H2O。
解答有关化学电源电极反应式书写试题的思维流程如下:
归纳总结
1.如图是一种酸性燃料电池酒精检测仪,具有自动吹气流量监测与控制的功能,下列有关说法正确的是 ( )
A.电流由呼气所在的铂电极流出
B.H+通过质子交换膜流向氧气所在的铂电极
C.电路中流过2 mol电子时,消耗11.2 L O2
D.该电池的负极反应为CH3CH2OH+3H2O-12e-===2CO2↑+12H+
B
举一反三
【解析】呼气所在的电极发生乙醇转化为醋酸的氧化反应,故为负极,而电流由正极流出,A项错误;H+通过质子交换膜流向正极(氧气所在的铂电极),B项正确;正极反应为O2+4e-+4H+===2H2O,电路中流过2 mol电子时,消耗0.5 mol O2,在标准状况下的体积为11.2 L,但题中未指明是否为标准状况,C项错误;该电池的负极反应为CH3CH2OH+H2O-4e-===CH3COOH+4H+,D项错误。
2.某新型可充电电池构造如图所示,工作时(需先引发铁和氯酸钾的反应,从而使LiCl- KCl共晶盐熔化)某电极(记为X)的反应式之一为xLi++xe-+LiV3O8 ===Li1+xV3O8。下列说法正确的是 ( )
A.放电时,正极上的电极反应式为Li-e-===Li+
B.放电时,电池反应方程式为xLi+LiV3O8===Li1+xV3O8
C.充电时,X电极与电源负极相连
D.充电时,X电极的质量增加
B
【解析】由题干所给电极反应式可知,X电极发生得电子的还原反应,故X电极是正极,结合题图知,X电极是LiV3O8,则Li Si合金是负极,负极的电极反应式为Li-e-===Li+,结合X电极的电极反应式可知放电时电池反应方程式为xLi+LiV3O8===Li1+xV3O8,A项错误,B项正确;充电时,X电极应与电源正极相连,C项错误;充电时,X电极的电极反应与放电时X电极的电极反应互为逆反应,则充电时X电极的质量减轻,D项错误。
1.下面是几种常见的化学电源的示意图,有关说法不正确的是 ( )
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池工作过程中,每转移2 mol电子,负极质量减小207 g
D.氢氧燃料电池是一种具有广阔应用前景的绿色电源
C
当堂检测
【解析】A项,干电池是一次电池,铅蓄电池是可充电电池属于二次电池,氢氧燃料电池属于燃料电池,正确;B项,在干电池中,Zn作负极,被氧化,正确;C项,铅蓄电池工作过程中,硫酸铅在负极上析出,该极质量增加而非减小,错误;D项,氢氧燃料电池不需要将还原剂和氧化剂全部储藏在电池内,且最终产物是水,故氢氧燃料电池是一种具有广阔应用前景的绿色电源,正确。
2.质子交换膜燃料电池的工作原理如图所示,下列叙述正确的是 ( )
A.通入氧气的电极发生氧化反应
B.通入氢气的电极为正极
C.导电离子为质子,且在电池内部由正极定向移动至负极
D.正极的电极反应式为O2+4H++4e-===2H2O
【解析】该燃料电池中,H2和O2分别在负极和正极上发生氧化反应和还原反应,正极的电极反应式为4H++O2+4e-===2H2O,该电池中导电离子为H+,在电池内部由负极定向移动至正极。
D
3.肼(N2H4) 空气燃料电池是一种环保型碱性燃料电池,电解质为20%~30%的KOH溶液,电池反应方程式为N2H4+O2===N2+2H2O。下列关于该电池工作时的说法中正确的是 ( )
A.溶液的pH保持不变
B.溶液中的阴离子向正极移动
C.正极的电极反应式:O2+4H++4e-===2H2O
D.负极的电极反应式:N2H4+4OH--4e-===4H2O+N2↑
D
【解析】A项,因为有水生成,溶液的pH会减小,错误;B项,原电池中,溶液中的阴离子总是移向电池的负极,错误;C项,溶液介质为碱性,正极的电极反应式是O2+2H2O+4e-===4OH-,错误;D项,负极上发生燃料失电子的氧化反应,即N2H4+4OH--4e-===4H2O+N2↑,正确。
4.化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)锌锰干电池是应用最普遍的电池之一(如图1所示),锌锰干电池的负极材料是_____,负极的电极反应式为__________________。若反应消耗32.5 g负极材料,则电池中转移电子的数目为______________。
NA或6.02×1023
锌
Zn-2e-===Zn2+
(2)目前常用的镍(Ni)镉(Cd)电池其电池总反应式可以表示为Cd+2NiOOH+2H2O
2Ni(OH)2+Cd(OH)2(充电是指外加电流作用发生氧化还原反应),已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是________(填序号)。
①上述反应可以在酸性条件下进行
②上述反应不是可逆反应
③放电时正极金属Cd的质量增加
④放电时化学能转变为电能
放电
充电
②④
(3)如图2为氢氧燃料电池的构造示意图,电解质溶液的溶质是KOH。则X极为电池的______ (填“正”或“负”)极,X极的电极反应式为____________________________。
H2-2e-+2OH-===2H2O
负
【解析】(1)负极发生氧化反应,锌失去电子,电极反应式为Zn-2e-===Zn2+,32.5 g锌的物质的量为0.5 mol,而1 mol 锌失去2 mol电子,所以32.5 g锌参与反应时转移电子的物质的量为1 mol,数目为NA或6.02×1023。(2)①Ni(OH)2与Cd(OH)2可以与酸反应,则不能在酸性条件下进行,错误;②因为电池充放电在不同条件下进行,所以该电池反应不是可逆反应,正确;③放电时Cd在负极发生氧化反应转化为Cd(OH)2,金属Cd的质量增加,错误;④该电池放电为原电池工作原理,是将化学能转化为电能,正确。(3)电解质溶液为KOH溶液,X电极失去电子,为负极,氢气在负极被氧化,失电子发生氧化反应:H2-2e-+2OH-===2H2O。
本节内容结束
