2023化学苏教版选择性必修一 1.2.4 电解池的工作原理(共21张ppt)
文档属性
| 名称 | 2023化学苏教版选择性必修一 1.2.4 电解池的工作原理(共21张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 868.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 20:49:04 | ||
图片预览







文档简介
(共21张PPT)
专题1 化学反应与能量变化 第二单元 化学能与电能的转化
第4课时 电解池的工作原理
1.了解电解池的工作原理。
2.能正确书写电解池的电极反应式和电解反应方程式。
3.熟悉电解规律和电解产物的判断方法。
学习目标
我们学习过哪些电解反应方程式?
电解的意义:促使一些不能自发进行的氧化还原反应顺利进行。
能量转化方式:电能→化学能
温故知新
1.电解水
2H2O === 2H2↑+O2↑
通电
2.电解熔融氯化钠
2NaCl === 2Na+Cl2↑
通电
3.电解熔融氯化镁
MgCl2 === Mg+Cl2↑
通电
4.电解熔融氧化铝
2Al2O3 === 4Al+3O2↑
通电
5.氯碱工业
2H2O +2NaCl === 2NaOH+Cl2↑+ H2↑
通电
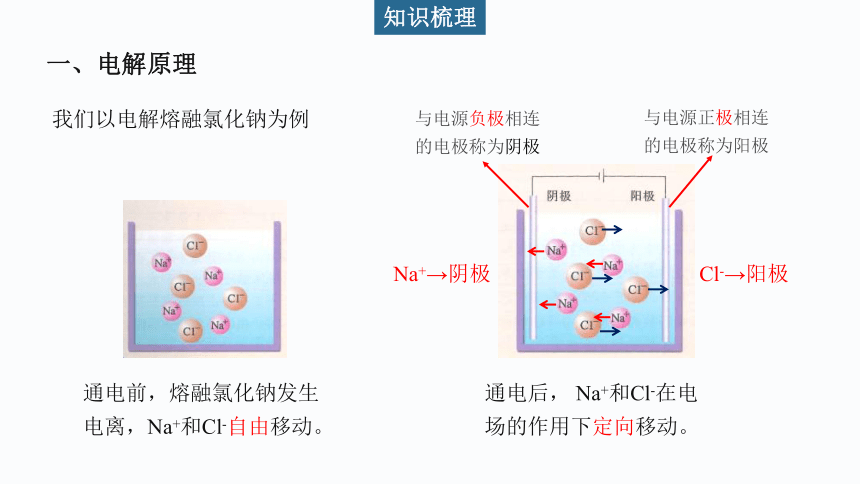
一、电解原理
我们以电解熔融氯化钠为例
通电前,熔融氯化钠发生电离,Na+和Cl-自由移动。
通电后, Na+和Cl-在电场的作用下定向移动。
Cl-→阳极
Na+→阴极
与电源负极相连的电极称为阴极
与电源正极相连的电极称为阳极
知识梳理
﹣
﹢
阴极:2Na++2e-===2Na
阳极:2Cl--2e-===Cl2↑
电子:电源负极→阴极
电子:阳极→电源正极
还原反应
氧化反应
总反应:2NaCl === 2Na+Cl2↑
通电
1.电解是在直流电作用下,在两个电极上分别发生氧化反应和还原反应的过程。
2.电解池是将电能转化为化学能的装置。
3.电解池的构成条件
具有与直流电源相连接的两个电极(阴极、阳极),插入电解质溶液或熔融电解质中,形成闭合回路。
电解质溶液
阴极
阳极
还原反应
氧化反应
4.电解池工作原理
阳离子
(+)
阴离子
(-)
﹢
﹣
电子流出
电子流入
思考:熔融状态下,电解质的阴、阳离子分别得失电子(放电),在水溶液中是否也是电解质阴、阳离子放电?
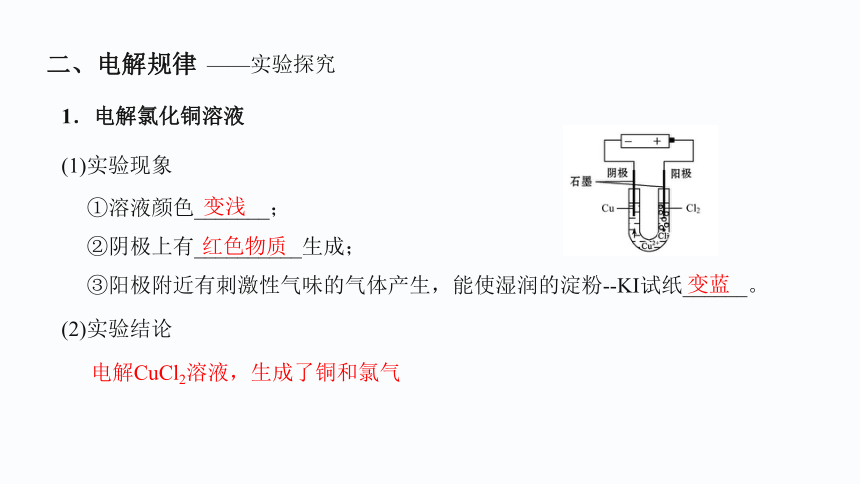
1.电解氯化铜溶液
(1)实验现象
①溶液颜色_______;
②阴极上有__________生成;
③阳极附近有刺激性气味的气体产生,能使湿润的淀粉- KI试纸______。
变浅
红色物质
变蓝
(2)实验结论
电解CuCl2溶液,生成了铜和氯气
——实验探究
二、电解规律
电解CuCl2溶液 电解NaCl溶液
溶液中的电离
溶液中的离子
放电离子
H2O H++OH-
NaCl === Na++Cl-
H2O H++OH-
CuCl2===Cu2++2Cl-
阳离子:Na+ 、水电离的 H+
阴离子:Cl- 、水电离的OH-
阳离子:Cu2+、 水电离的H+
阴离子:Cl- 、 水电离的OH-
阴极: Cu2++2e-===Cu
阴极:2H++2e-===H2
阳极:2Cl--2e-===Cl2↑
阳极:2Cl--2e-===Cl2↑
2H2O +2e-===H2 +2OH-
当用惰性电极电解电解质溶液时,阴、阳极放电有什么规律?
2.电解氯化钠溶液
2H2O +2NaCl === 2NaOH+Cl2↑+ H2↑
通电
阳极:还原性强的离子优先放电。
惰性电极
活性电极
(除金、铂、C以外材料时)
金属电极失电子
总结
——电解池放电规律
阴极:氧化性强的离子优先放电。
阴极始终是溶液中的阳离子得电子,与电极材料无关
分析电解问题的基本方法思路
(1)分清楚电解池的阴极和阳极。
(2)通电前:电解质溶液中含有哪些阴、阳离子(包括水电离出的H+和OH-)。
(3)通电时:阴离子移向阳极,阳离子移向阴极,结合放电顺序分析谁优先放电。
(4)正确书写电极反应式,要注意原子数、电荷数是否守恒。
(5)能结合题目要求分析电解时的各种变化情况,如两极现象、离子浓度的变化、pH变化等。
方法归纳
溶液中的阴离子: ,阳离子: 。
电极反应式:阳极: ;
阴极: 。
总反应方程式: 。
电解一段时间后溶液pH 。
若恢复至原状态需补加 。
②电解NaOH溶液
①电解H2SO4溶液
溶液中的阴离子: ,阳离子: 。
电极反应式:阳极: ;
阴极: 。
总反应方程式: 。
电解一段时间后溶液pH 。
若恢复至原状态需补加 。
水电离的OH- ,
H+
2H++2e-===H2 ↑
2H2O-4e-===O2 ↑ +4H+
降低
H2O
OH-
Na+,水电离的H+
2H2O +2e-===H2 ↑ +2OH-
4OH-- 4e-===O2 ↑ +2H2O
升高
H2O
1.电解水型
H2SO4溶液
NaOH溶液
2H2O === 2H2↑+O2↑
通电
2H2O === 2H2↑+O2↑
通电
电极反应式:阳极: ;
阴极: 。
总反应方程式: 。
若恢复至原状态需补加 。
④电解CuCl2溶液
③电解HCl溶液
溶液中的阴离子: ,阳离子: 。
电极反应式:阳极: ;
阴极: 。
总反应方程式: 。
电解一段时间后溶液pH 。
若恢复至原状态需补加 。
2.电解电解质型
HCl溶液
CuCl2溶液
水电离的OH- ,Cl-
H+
2H++2e-===H2 ↑
2Cl--2e-===Cl2↑
通电
2HCl === H2 ↑ +Cl2↑
升高
HCl气体
Cu2++2e-===Cu
2Cl--2e-===Cl2↑
CuCl2固体
CuCl2 === Cu+Cl2↑
通电
电极反应式:阳极: ;
阴极: 。
总反应方程式: 。
电解一段时间后溶液pH 。
若恢复至原状态需补加 。
⑤电解NaCl溶液
3.放氢生碱型
NaCl溶液
2H2O +2NaCl === 2NaOH+Cl2↑+ H2↑
通电
2H2O +2e-===H2 +2OH-
2Cl--2e-===Cl2↑
升高
HCl气体
⑥电解CuSO4溶液
4.放氧生酸型
CuSO4溶液
溶液中的阴离子: ,阳离子: 。
电极反应式:阳极: ;
阴极: 。
总反应方程式: 。
电解一段时间后溶液pH 。
若恢复至原状态需补加 。
OH- ,
Cu2+,H+
2H2O-4e-===O2↑+4H+
Cu2++2e-===Cu
降低
CuO
2H2O +2CuSO4 === 2H2SO4 +2Cu+ O2↑
通电
思考:电解一定浓度的硫酸铜溶液,当铜离子全部析出后,电解能否继续进行?如果能继续进行,那么两极的产物分别是什么呢?
可以继续进行,由电解CuSO4溶液变成电解H2SO4溶液,阴极产物为氢气,阳极产物为氧气。
AC
当堂检测
1.仔细观察如图所示电解NaCI溶液的装置,判断下列选项正确的是 ( )
A.该电解池由直流电源、电极、导线和电解质溶液构成
B.电极M为阳极,该区域发生氧化反应
C.电子由电源负极沿导线移向M极,由N极沿导线移向电源正极
D.Cl-向M极移动,Na+向N极移动
D
A.甲醇一极的电极反应式为CH3OH-6e﹣+H2O === CO2↑+6H+
B.若a为纯铜,b为粗铜,则该装置可用于粗铜的电解精炼
C.若a、b均为石墨,b极反应为:4OH﹣-4e﹣ === 2H2O+O2↑
D.若a、b均为石墨,标准状况下消耗3.36 L O2,则b极析出铜19.2 g
2.用新型甲醇燃料电池电源电解硫酸铜溶液,下列有关说法正确的是 ( )
3.如图装置所示,C、D、E、F、X、Y都是惰性电极,A、B为外接直流电源的两极。将直流电源接通后,D电极表面析出红色固体。下列说法正确的是( )
C
A.E极附近的溶液变为红色
B.相同条件下,C、E、F电极产生的气体体积之比
一定为1∶2∶2(忽略气体的溶解)
C.Y极附近的颜色变深
D.电子移动方向:B→Y→X→F→E→D→C→A
本节内容结束
专题1 化学反应与能量变化 第二单元 化学能与电能的转化
第4课时 电解池的工作原理
1.了解电解池的工作原理。
2.能正确书写电解池的电极反应式和电解反应方程式。
3.熟悉电解规律和电解产物的判断方法。
学习目标
我们学习过哪些电解反应方程式?
电解的意义:促使一些不能自发进行的氧化还原反应顺利进行。
能量转化方式:电能→化学能
温故知新
1.电解水
2H2O === 2H2↑+O2↑
通电
2.电解熔融氯化钠
2NaCl === 2Na+Cl2↑
通电
3.电解熔融氯化镁
MgCl2 === Mg+Cl2↑
通电
4.电解熔融氧化铝
2Al2O3 === 4Al+3O2↑
通电
5.氯碱工业
2H2O +2NaCl === 2NaOH+Cl2↑+ H2↑
通电
一、电解原理
我们以电解熔融氯化钠为例
通电前,熔融氯化钠发生电离,Na+和Cl-自由移动。
通电后, Na+和Cl-在电场的作用下定向移动。
Cl-→阳极
Na+→阴极
与电源负极相连的电极称为阴极
与电源正极相连的电极称为阳极
知识梳理
﹣
﹢
阴极:2Na++2e-===2Na
阳极:2Cl--2e-===Cl2↑
电子:电源负极→阴极
电子:阳极→电源正极
还原反应
氧化反应
总反应:2NaCl === 2Na+Cl2↑
通电
1.电解是在直流电作用下,在两个电极上分别发生氧化反应和还原反应的过程。
2.电解池是将电能转化为化学能的装置。
3.电解池的构成条件
具有与直流电源相连接的两个电极(阴极、阳极),插入电解质溶液或熔融电解质中,形成闭合回路。
电解质溶液
阴极
阳极
还原反应
氧化反应
4.电解池工作原理
阳离子
(+)
阴离子
(-)
﹢
﹣
电子流出
电子流入
思考:熔融状态下,电解质的阴、阳离子分别得失电子(放电),在水溶液中是否也是电解质阴、阳离子放电?
1.电解氯化铜溶液
(1)实验现象
①溶液颜色_______;
②阴极上有__________生成;
③阳极附近有刺激性气味的气体产生,能使湿润的淀粉- KI试纸______。
变浅
红色物质
变蓝
(2)实验结论
电解CuCl2溶液,生成了铜和氯气
——实验探究
二、电解规律
电解CuCl2溶液 电解NaCl溶液
溶液中的电离
溶液中的离子
放电离子
H2O H++OH-
NaCl === Na++Cl-
H2O H++OH-
CuCl2===Cu2++2Cl-
阳离子:Na+ 、水电离的 H+
阴离子:Cl- 、水电离的OH-
阳离子:Cu2+、 水电离的H+
阴离子:Cl- 、 水电离的OH-
阴极: Cu2++2e-===Cu
阴极:2H++2e-===H2
阳极:2Cl--2e-===Cl2↑
阳极:2Cl--2e-===Cl2↑
2H2O +2e-===H2 +2OH-
当用惰性电极电解电解质溶液时,阴、阳极放电有什么规律?
2.电解氯化钠溶液
2H2O +2NaCl === 2NaOH+Cl2↑+ H2↑
通电
阳极:还原性强的离子优先放电。
惰性电极
活性电极
(除金、铂、C以外材料时)
金属电极失电子
总结
——电解池放电规律
阴极:氧化性强的离子优先放电。
阴极始终是溶液中的阳离子得电子,与电极材料无关
分析电解问题的基本方法思路
(1)分清楚电解池的阴极和阳极。
(2)通电前:电解质溶液中含有哪些阴、阳离子(包括水电离出的H+和OH-)。
(3)通电时:阴离子移向阳极,阳离子移向阴极,结合放电顺序分析谁优先放电。
(4)正确书写电极反应式,要注意原子数、电荷数是否守恒。
(5)能结合题目要求分析电解时的各种变化情况,如两极现象、离子浓度的变化、pH变化等。
方法归纳
溶液中的阴离子: ,阳离子: 。
电极反应式:阳极: ;
阴极: 。
总反应方程式: 。
电解一段时间后溶液pH 。
若恢复至原状态需补加 。
②电解NaOH溶液
①电解H2SO4溶液
溶液中的阴离子: ,阳离子: 。
电极反应式:阳极: ;
阴极: 。
总反应方程式: 。
电解一段时间后溶液pH 。
若恢复至原状态需补加 。
水电离的OH- ,
H+
2H++2e-===H2 ↑
2H2O-4e-===O2 ↑ +4H+
降低
H2O
OH-
Na+,水电离的H+
2H2O +2e-===H2 ↑ +2OH-
4OH-- 4e-===O2 ↑ +2H2O
升高
H2O
1.电解水型
H2SO4溶液
NaOH溶液
2H2O === 2H2↑+O2↑
通电
2H2O === 2H2↑+O2↑
通电
电极反应式:阳极: ;
阴极: 。
总反应方程式: 。
若恢复至原状态需补加 。
④电解CuCl2溶液
③电解HCl溶液
溶液中的阴离子: ,阳离子: 。
电极反应式:阳极: ;
阴极: 。
总反应方程式: 。
电解一段时间后溶液pH 。
若恢复至原状态需补加 。
2.电解电解质型
HCl溶液
CuCl2溶液
水电离的OH- ,Cl-
H+
2H++2e-===H2 ↑
2Cl--2e-===Cl2↑
通电
2HCl === H2 ↑ +Cl2↑
升高
HCl气体
Cu2++2e-===Cu
2Cl--2e-===Cl2↑
CuCl2固体
CuCl2 === Cu+Cl2↑
通电
电极反应式:阳极: ;
阴极: 。
总反应方程式: 。
电解一段时间后溶液pH 。
若恢复至原状态需补加 。
⑤电解NaCl溶液
3.放氢生碱型
NaCl溶液
2H2O +2NaCl === 2NaOH+Cl2↑+ H2↑
通电
2H2O +2e-===H2 +2OH-
2Cl--2e-===Cl2↑
升高
HCl气体
⑥电解CuSO4溶液
4.放氧生酸型
CuSO4溶液
溶液中的阴离子: ,阳离子: 。
电极反应式:阳极: ;
阴极: 。
总反应方程式: 。
电解一段时间后溶液pH 。
若恢复至原状态需补加 。
OH- ,
Cu2+,H+
2H2O-4e-===O2↑+4H+
Cu2++2e-===Cu
降低
CuO
2H2O +2CuSO4 === 2H2SO4 +2Cu+ O2↑
通电
思考:电解一定浓度的硫酸铜溶液,当铜离子全部析出后,电解能否继续进行?如果能继续进行,那么两极的产物分别是什么呢?
可以继续进行,由电解CuSO4溶液变成电解H2SO4溶液,阴极产物为氢气,阳极产物为氧气。
AC
当堂检测
1.仔细观察如图所示电解NaCI溶液的装置,判断下列选项正确的是 ( )
A.该电解池由直流电源、电极、导线和电解质溶液构成
B.电极M为阳极,该区域发生氧化反应
C.电子由电源负极沿导线移向M极,由N极沿导线移向电源正极
D.Cl-向M极移动,Na+向N极移动
D
A.甲醇一极的电极反应式为CH3OH-6e﹣+H2O === CO2↑+6H+
B.若a为纯铜,b为粗铜,则该装置可用于粗铜的电解精炼
C.若a、b均为石墨,b极反应为:4OH﹣-4e﹣ === 2H2O+O2↑
D.若a、b均为石墨,标准状况下消耗3.36 L O2,则b极析出铜19.2 g
2.用新型甲醇燃料电池电源电解硫酸铜溶液,下列有关说法正确的是 ( )
3.如图装置所示,C、D、E、F、X、Y都是惰性电极,A、B为外接直流电源的两极。将直流电源接通后,D电极表面析出红色固体。下列说法正确的是( )
C
A.E极附近的溶液变为红色
B.相同条件下,C、E、F电极产生的气体体积之比
一定为1∶2∶2(忽略气体的溶解)
C.Y极附近的颜色变深
D.电子移动方向:B→Y→X→F→E→D→C→A
本节内容结束
