2023化学苏教版选择性必修一 1.2.5 电解原理的应用(共18张ppt)
文档属性
| 名称 | 2023化学苏教版选择性必修一 1.2.5 电解原理的应用(共18张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 20:50:03 | ||
图片预览




文档简介
(共18张PPT)
专题1 化学反应与能量变化 第二单元 化学能与电能的转化
第5课时 电解原理的应用
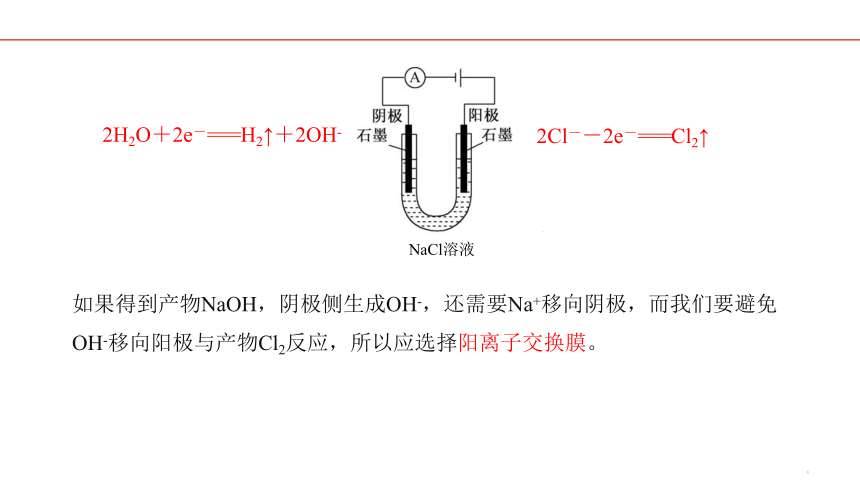
电极反应式:
阳极:
阴极:
总反应方程式:
2H2O+2e-===H2↑+2OH-
2Cl--2e-===Cl2↑
NaCl溶液
思考:工业电解饱和食盐水存在什么隐患?
温故知新
2H2O+2NaCl === 2NaOH+Cl2↑+H2↑
通电
(2)避免生成物H2和Cl2混合,混合后遇火或遇强光爆炸。
(1)避免Cl2接触NaOH溶液发生反应,使产品不纯。
反应方程式: 。
Cl2+2NaOH === NaCl+NaClO+H2O
解决方法:使用离子交换膜。
电解饱和食盐水必须解决两个主要问题:
一、氯碱工业
知识梳理
NaCl溶液
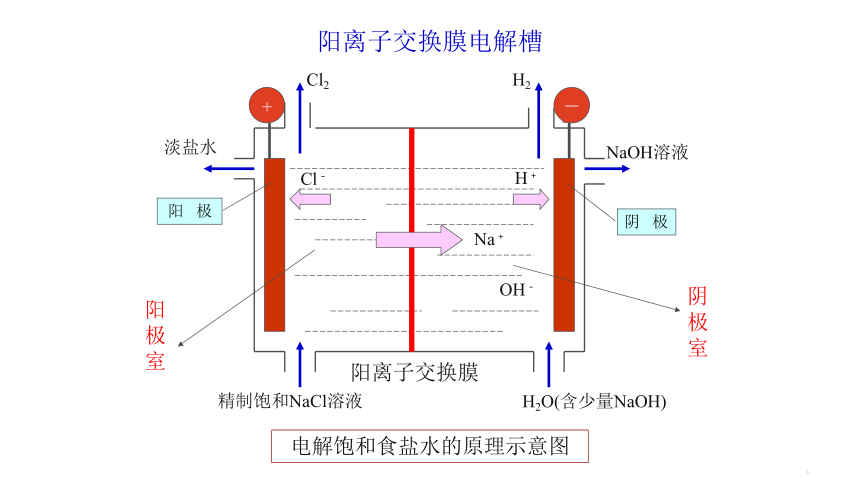
如果得到产物NaOH,阴极侧生成OH-,还需要Na+移向阴极,而我们要避免OH-移向阳极与产物Cl2反应,所以应选择阳离子交换膜。
2H2O+2e-===H2↑+2OH-
2Cl--2e-===Cl2↑
-
+
Cl2
Cl﹣
H2
Na﹢
H﹢
OH﹣
淡盐水
NaOH溶液
精制饱和NaCl溶液
H2O(含少量NaOH)
阳离子交换膜
阳 极
阴 极
阳极室
阴极室
阳离子交换膜电解槽
电解饱和食盐水的原理示意图
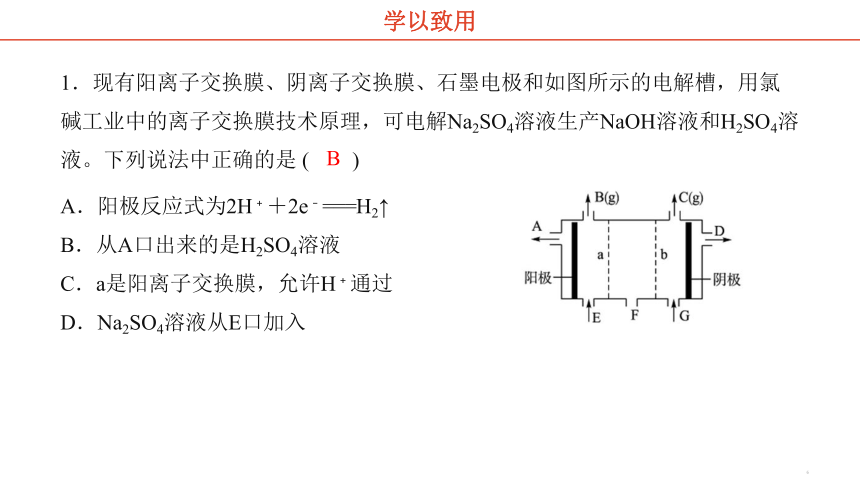
1.现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽,用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是 ( )
B
学以致用
A.阳极反应式为2H﹢+2e﹣===H2↑
B.从A口出来的是H2SO4溶液
C.a是阳离子交换膜,允许H﹢通过
D.Na2SO4溶液从E口加入
1.概念
应用电解原理在某些金属表面镀上一层其它金属或合金的过程。
2.电镀的目的
增强金属抗腐蚀能力,增加美观和硬度。
二、电镀
知识梳理
思考:如果想在铁制品上镀上铜,该如何设计实验?
(1)铁制品应该在哪一极?
(2)电解质溶液中应该含有什么离子?
(3)另一极应该用什么材料做电极?
阴极
铜离子
纯铜做电极
阳极:
阴极:
Cu2﹢+2e﹣=== Cu
Cu-2e﹣=== Cu2﹢
电解一段时间后溶液中硫酸铜浓度怎样变化?
硫酸铜浓度不变
3.电镀池结构
+
镀件
镀层金属
-
含镀层金属离子的盐溶液
(1)阴极——待镀金属
(2)阳极——镀层金属
(3)电解液——含镀层金属阳离子的盐溶液
4.电镀的特点
电镀液的组成及酸碱性保持不变
1.粗铜所含的杂质
Zn、Fe、Ni、Ag、Au等
CuSO4溶液
2.粗铜的精炼
阳极——粗铜
阴极——纯铜
电解液——CuSO4溶液
三、铜的电解精炼
Zn-2e﹣===Zn2﹢
Fe -2e﹣=== Fe2﹢
Ni-2e﹣=== Ni2﹢
Cu -2e﹣=== Cu2﹢
阳极:
Au、Ag——阳极泥
思考:精炼铜时,电解液中的Cu2+浓度是否会发生改变?
Cu2+浓度会下降
用电解精炼法所得到的铜叫做电解铜,它的纯度很高,可以达到99.95%~99.98%。
阴极:
Cu2﹢+2e﹣=== Cu
电解精炼池 电镀池
定义
形成 条件
电极 名称
应用电解原理在某些金属表面镀上一层其它金属的装置。
①镀层金属接电源正极,待镀金属接电源负极
②电镀液须含有镀层金属的离子
阳极:镀层金属
阴极:镀件
应用电解原理将不纯的金属提纯的装置。
①不纯金属接电源正极纯的金属接电源负极
②电解质溶液须待提纯金属的离子
阳极:不纯金属
阴极:纯金属
电解精炼池、电镀池的比较
(冶炼活泼金属钠、钾、钙、镁、铝等)
1.制取金属钠
电解熔融状态的氯化钠。
阳极:
2Cl﹣-2e﹣=== Cl2↑
阴极:
2Na﹢+2e﹣=== 2Na
总反应:
四、电冶金
2NaCl(熔融) === 2Na+Cl2 ↑
通电
2.制取金属铝
电解熔融状态的氧化铝。
阳极:
6O2﹣-12e﹣=== 3O2↑
阴极:
4Al3﹢+12e﹣=== 4Al
总反应:
2Al2O3(熔融) === 4Al+3O2↑
通电
助熔剂:冰晶石(Na3AlF6 六氟合铝酸钠)
阳极材料(碳)和熔融氧化铝需要定期补充。
冶炼铝设备图
五、电解的相关计算
如图所示,甲烧杯中盛有100 mL 0.50 mol·L-1 AgNO3溶液,乙烧杯中盛有100 mL 0.25 mol·L-1 CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9 g,回答下列问题:
(1)电源E为____极,F为____极。
(2)A极的电极反应式为______________________,析出物质________mol。
阴极
阳极
阴极
阳极
负极
正极
负
正
Ag﹢+e﹣=== Ag
0.025
电极 A B C D
产物 Ag O2 Cu Cl2
物质的量之比 4 1 2 2
x mol
x/2 mol
x/4 mol
五、电解的相关计算
如图所示,甲烧杯中盛有100 mL 0.50 mol·L-1 AgNO3溶液,乙烧杯中盛有100 mL 0.25 mol·L-1 CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9 g,回答下列问题:
(3)B极的电极反应式为______________________,析出气体_______mL(标准状况)。
(4)C极的电极反应式为______________________,析出物质________mol。
阴极
阳极
阴极
阳极
负极
正极
电极 A B C D
产物 Ag O2 Cu Cl2
物质的量之比 4 1 2 2
x mol
x/2 mol
x/4 mol
2H2O-4e﹣=== 4H﹢+O2↑
140
Cu2﹢+2e﹣=== Cu
0.00125
本节内容结束
专题1 化学反应与能量变化 第二单元 化学能与电能的转化
第5课时 电解原理的应用
电极反应式:
阳极:
阴极:
总反应方程式:
2H2O+2e-===H2↑+2OH-
2Cl--2e-===Cl2↑
NaCl溶液
思考:工业电解饱和食盐水存在什么隐患?
温故知新
2H2O+2NaCl === 2NaOH+Cl2↑+H2↑
通电
(2)避免生成物H2和Cl2混合,混合后遇火或遇强光爆炸。
(1)避免Cl2接触NaOH溶液发生反应,使产品不纯。
反应方程式: 。
Cl2+2NaOH === NaCl+NaClO+H2O
解决方法:使用离子交换膜。
电解饱和食盐水必须解决两个主要问题:
一、氯碱工业
知识梳理
NaCl溶液
如果得到产物NaOH,阴极侧生成OH-,还需要Na+移向阴极,而我们要避免OH-移向阳极与产物Cl2反应,所以应选择阳离子交换膜。
2H2O+2e-===H2↑+2OH-
2Cl--2e-===Cl2↑
-
+
Cl2
Cl﹣
H2
Na﹢
H﹢
OH﹣
淡盐水
NaOH溶液
精制饱和NaCl溶液
H2O(含少量NaOH)
阳离子交换膜
阳 极
阴 极
阳极室
阴极室
阳离子交换膜电解槽
电解饱和食盐水的原理示意图
1.现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽,用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是 ( )
B
学以致用
A.阳极反应式为2H﹢+2e﹣===H2↑
B.从A口出来的是H2SO4溶液
C.a是阳离子交换膜,允许H﹢通过
D.Na2SO4溶液从E口加入
1.概念
应用电解原理在某些金属表面镀上一层其它金属或合金的过程。
2.电镀的目的
增强金属抗腐蚀能力,增加美观和硬度。
二、电镀
知识梳理
思考:如果想在铁制品上镀上铜,该如何设计实验?
(1)铁制品应该在哪一极?
(2)电解质溶液中应该含有什么离子?
(3)另一极应该用什么材料做电极?
阴极
铜离子
纯铜做电极
阳极:
阴极:
Cu2﹢+2e﹣=== Cu
Cu-2e﹣=== Cu2﹢
电解一段时间后溶液中硫酸铜浓度怎样变化?
硫酸铜浓度不变
3.电镀池结构
+
镀件
镀层金属
-
含镀层金属离子的盐溶液
(1)阴极——待镀金属
(2)阳极——镀层金属
(3)电解液——含镀层金属阳离子的盐溶液
4.电镀的特点
电镀液的组成及酸碱性保持不变
1.粗铜所含的杂质
Zn、Fe、Ni、Ag、Au等
CuSO4溶液
2.粗铜的精炼
阳极——粗铜
阴极——纯铜
电解液——CuSO4溶液
三、铜的电解精炼
Zn-2e﹣===Zn2﹢
Fe -2e﹣=== Fe2﹢
Ni-2e﹣=== Ni2﹢
Cu -2e﹣=== Cu2﹢
阳极:
Au、Ag——阳极泥
思考:精炼铜时,电解液中的Cu2+浓度是否会发生改变?
Cu2+浓度会下降
用电解精炼法所得到的铜叫做电解铜,它的纯度很高,可以达到99.95%~99.98%。
阴极:
Cu2﹢+2e﹣=== Cu
电解精炼池 电镀池
定义
形成 条件
电极 名称
应用电解原理在某些金属表面镀上一层其它金属的装置。
①镀层金属接电源正极,待镀金属接电源负极
②电镀液须含有镀层金属的离子
阳极:镀层金属
阴极:镀件
应用电解原理将不纯的金属提纯的装置。
①不纯金属接电源正极纯的金属接电源负极
②电解质溶液须待提纯金属的离子
阳极:不纯金属
阴极:纯金属
电解精炼池、电镀池的比较
(冶炼活泼金属钠、钾、钙、镁、铝等)
1.制取金属钠
电解熔融状态的氯化钠。
阳极:
2Cl﹣-2e﹣=== Cl2↑
阴极:
2Na﹢+2e﹣=== 2Na
总反应:
四、电冶金
2NaCl(熔融) === 2Na+Cl2 ↑
通电
2.制取金属铝
电解熔融状态的氧化铝。
阳极:
6O2﹣-12e﹣=== 3O2↑
阴极:
4Al3﹢+12e﹣=== 4Al
总反应:
2Al2O3(熔融) === 4Al+3O2↑
通电
助熔剂:冰晶石(Na3AlF6 六氟合铝酸钠)
阳极材料(碳)和熔融氧化铝需要定期补充。
冶炼铝设备图
五、电解的相关计算
如图所示,甲烧杯中盛有100 mL 0.50 mol·L-1 AgNO3溶液,乙烧杯中盛有100 mL 0.25 mol·L-1 CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9 g,回答下列问题:
(1)电源E为____极,F为____极。
(2)A极的电极反应式为______________________,析出物质________mol。
阴极
阳极
阴极
阳极
负极
正极
负
正
Ag﹢+e﹣=== Ag
0.025
电极 A B C D
产物 Ag O2 Cu Cl2
物质的量之比 4 1 2 2
x mol
x/2 mol
x/4 mol
五、电解的相关计算
如图所示,甲烧杯中盛有100 mL 0.50 mol·L-1 AgNO3溶液,乙烧杯中盛有100 mL 0.25 mol·L-1 CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9 g,回答下列问题:
(3)B极的电极反应式为______________________,析出气体_______mL(标准状况)。
(4)C极的电极反应式为______________________,析出物质________mol。
阴极
阳极
阴极
阳极
负极
正极
电极 A B C D
产物 Ag O2 Cu Cl2
物质的量之比 4 1 2 2
x mol
x/2 mol
x/4 mol
2H2O-4e﹣=== 4H﹢+O2↑
140
Cu2﹢+2e﹣=== Cu
0.00125
本节内容结束
