2023化学苏教版选择性必修一 1.3 金属的腐蚀与防护(共53张ppt)
文档属性
| 名称 | 2023化学苏教版选择性必修一 1.3 金属的腐蚀与防护(共53张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 20:50:53 | ||
图片预览











文档简介
(共53张PPT)
专题1 化学反应与能量变化
第三单元 金属的腐蚀与防护
学习目标
1.了解金属发生电化学腐蚀的本质,知道金属腐蚀的危害。
2.了解防止金属腐蚀的措施。
3.能利用电化学原理解释金属腐蚀现象,选择并设计防腐措施。
核心素养
宏观辨识与微观探析:
能从宏观与微观结合的视角对金属的腐蚀和防护进行分类和表征。能运用电化学符号等解释金属发生腐蚀的原因,能分析技术防护与金属腐蚀之间的关系。
证据推理与模型认知:
运用电化学模型认识并分析金属腐蚀的原理及防护的方法。
生产生活中,金属腐蚀带来的损失非常严重!
建筑物坍塌、管道泄漏、船体损坏、火灾、爆炸……
在我国,每年被腐蚀的铁占到我国钢铁年产量的十分之一,因为金属腐蚀造成的损失占到国内生产总值的2%~4%。
新课导入
活动探究
向铁粉中加入少量炭粉,混合均匀后,撒入内壁分别用氯化钠溶液和稀醋酸润湿过的两支具支试管(分别标记为a、b)中,按下图组装好仪器。几分钟后,打开止水夹,观察、比较导管中水柱(在水中滴加几滴红墨水)的变化和试管中的现象。
[思考交流]
1.图a导管中水柱和具支试管中的铁粉有什么变化?产生这种现象的原因是什么?
提示:导管中水柱上升,铁粉表面生锈;产生这种现象的原因是铁粉在潮湿的环境中发生吸氧腐蚀。电极反应,负极:2Fe-4e-===2Fe2+,正极:O2+2H2O+4e-===4OH-,由于盛铁粉的具支试管中不断消耗O2而使体系内的压强减小,从而引起水的倒吸。
2.图b导管中水柱及具支试管中的铁粉有什么变化?如何解释?
提示:导管中水柱下降,铁粉表面生锈;产生这种现象的原因是铁粉在潮湿的、酸性较强的环境中发生了析氢腐蚀。电极反应,负极:Fe-2e-===Fe2+,正极:2H++2e-===H2↑,产生的H2使体系内的压强增大,从而使导管中的水柱下降。
3.若将图b中的稀醋酸换为盐酸(足量),则实验中存在哪些形式的腐蚀?
提示:若换为盐酸,则实验中会发生铁与盐酸的化学腐蚀,同时也有电化学腐蚀。
4.化学腐蚀与电化学腐蚀的异同点是什么?
提示:相同点是都造成金属被氧化腐蚀。不同点是化学腐蚀是金属和氧化剂直接发生氧化还原反应,无电流产生;电化学腐蚀是发生原电池反应,有电流产生。
知识梳理
1.金属腐蚀
(1)概念:金属或合金与周围环境中的物质发生化学反应而腐蚀损耗的现象。
(2)本质:金属本身失去电子变成阳离子的过程(发生氧化反应):
M-ne-===Mn+。
一、金属的电化学腐蚀
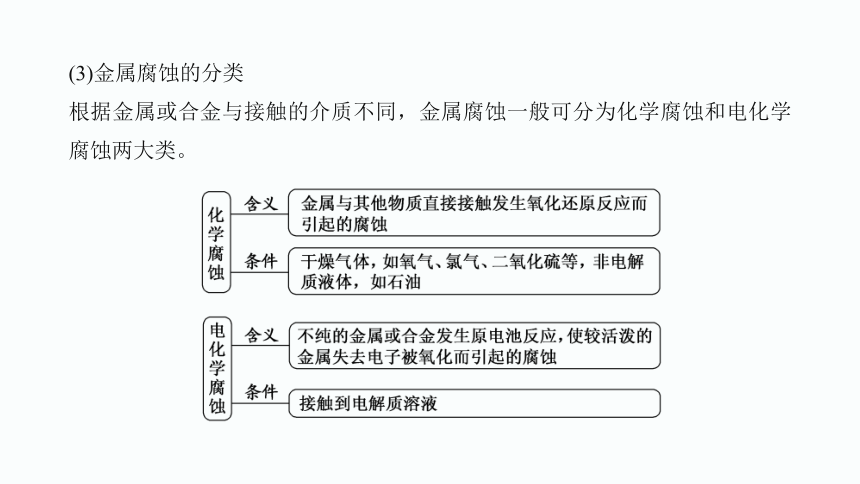
(3)金属腐蚀的分类
根据金属或合金与接触的介质不同,金属腐蚀一般可分为化学腐蚀和电化学腐蚀两大类。
在潮湿的空气中,钢铁表面形成一层薄薄的水膜,若水膜中
溶解有CO2、SO2、H2S等气体,其与水反应生成的酸电离使
水膜中含有一定量的H+。此时电解质溶液酸性较强,在钢铁
表面构成无数微小的原电池,其中Fe和C分别作负极和正极。Fe在负极失去电子发生氧化反应,H+在正极得到电子发生还原反应,电子从负极流向正极。
该过程中发生的原电池反应:负极为Fe-2e-===Fe2+,正极为2H++2e-===
H2↑,总反应为Fe+2H+===Fe2++H2↑。
2.电化学腐蚀的类型和原理
根据电解质溶液的酸碱性不同,电化学腐蚀分为析氢腐蚀和吸氧腐蚀。
(1)析氢腐蚀
发生的电极反应如下:
负极(Fe):2Fe-4e-===2Fe2+(氧化反应)
正极(C):2H2O+O2+4e-===4OH-(还原反应)
总反应:2Fe+O2+2H2O===2Fe(OH)2
(2)吸氧腐蚀
①一般情况下,如果钢铁表面吸附的水膜酸性很弱或呈中性,但溶有一定量的氧气,就会发生吸氧腐蚀。腐蚀原理如图所示。
②铁锈的形成过程
Fe(OH)2继续与空气中的O2作用,生成Fe(OH)3,即4Fe(OH)2+O2+2H2O ===4Fe(OH)3,Fe(OH)3脱去部分水生成Fe2O3·nH2O(铁锈的主要成分),即2Fe(OH)3===Fe2O3·nH2O+(3-n)H2O。铁锈疏松地覆盖在钢铁表面,不能阻止钢铁继续腐蚀。
(1)析氢腐蚀和吸氧腐蚀取决于金属表面电解质溶液的酸碱性,实际情况中以吸氧腐蚀为主。
(2)判断金属的腐蚀类型要从本质入手,化学腐蚀和电化学腐蚀的本质区别在于是否产生电流。腐蚀过程中有电流产生的为电化学腐蚀,无电流产生的为化学腐蚀。
(3)电化学腐蚀中,只有在金属活动性顺序中位于氢之前的金属才可能发生析氢腐蚀,而位于氢之后的金属只能发生吸氧腐蚀,吸氧腐蚀是金属腐蚀的主要形式。
[名师点拨]
巩固练习
1.下列说法正确的是 ( )
A.在生产和生活中,化学腐蚀比电化学腐蚀普遍,危害更大
B.大多数金属腐蚀的原因是发生氧化还原反应
C.化学腐蚀的速度随着温度的升高而加快
D.化学腐蚀和电化学腐蚀过程中都产生电流
C
【解析】电化学腐蚀比化学腐蚀普遍,危害更大,A项错误;所有金属腐蚀的原因均为发生氧化还原反应,B项错误;温度升高,化学反应速率增大,C项正确;化学腐蚀过程中无电流产生,电化学腐蚀过程中有微弱的电流产生,D项错误。
2.某研究小组对铁生锈的条件进行研究。请回答下列问题:
(1)甲同学设计了A、B、C一组实验(如图所示),探究铁生锈的条件。经过较长时间后,甲同学观察到A中铁钉生锈;B中铁钉不生锈;C中铁钉不生锈。
①通过分析上述实验现象,可得出铁生锈的外部条件是
_____________________________________________;
②铁钉发生电化学腐蚀的正极反应式为__________________________;
③实验B所用的水要经过_____处理,植物油的作用是________________________;
④实验C中碱石灰的作用是________________________。
有水(或电解质溶液)和氧气(或空气)
O2+4e-+2H2O===4OH-
煮沸
隔绝空气中的氧气和水蒸气
吸收水蒸气
(2)乙同学设计了实验D(如图所示),一段时间后,发现试管中的液面升高,其原因是__________________________________________________________。
铁腐蚀吸收氧气,造成试管内气体体积减小,试管内压强减小
【解析】对比A、B、C中现象可知铁生锈的外部条件是有水(或电解质溶液)和氧气(或空气)。铁钉生锈所处的环境为中性环境时,发生吸氧腐蚀,正极反应式为O2+4e-+2H2O===4OH-。
活动探究
实验操作 (1)以Fe作被保护电极,以Zn作辅助电极,以经过酸化的3% NaCl溶液作电解质溶液,按下图所示连接装置。观察电流表指针的变化以及烧杯中两个电极附近发生的现象;
(2)过一段时间,用胶头滴管从Fe电极区域取出少量溶液于试管中,再向试管中滴入2滴K3[Fe(CN)6](铁氰化钾)溶液,观察试管中溶液颜色的变化
实验 装置
实验 现象 (1)电流表指针发生偏转,Fe电极上有气泡产生;
(2)试管中滴入K3[Fe(CN)6]溶液未出现特殊蓝色沉淀
[实验] 探究牺牲阳极的阴极保护法保护铁
[思考交流]
1.该实验装置是电化学装置中的原电池还是电解池?指出装置中的电极名称并写出电极反应式。
提示:Zn、Fe和经过酸化的NaCl溶液构成原电池;其中Zn作负极,电极反应式:Zn-2e-===Zn2+;Fe作正极,电极反应式:2H++2e-===H2↑。
2.一段时间后,从Fe电极区域取出少量溶液于试管中,加入2滴K3[Fe(CN)6]溶液的目的是什么?若铁电极区域有Fe2+存在,会出现什么现象?写出反应的离子方程式。
提示:加入K3[Fe(CN)6]溶液的目的是检验铁电极是否发生反应生成Fe2+;若铁电极区域有Fe2+生成,加入K3[Fe(CN)6]后会产生蓝色沉淀,反应的离子方程式为3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓(蓝色)。
3.通过上述实验得出的实验结论是什么?为什么要向船体上镶嵌锌块?该保护船体的方法的名称是什么?
提示:Zn-Fe-电解质溶液构成的装置中,铁未被腐蚀,即受到了保护。向船体上镶嵌锌块的目的是在Zn-Fe-海水构成的原电池装置中,牺牲锌块而保护船体不受腐蚀;该保护船体的方法的名称是牺牲阳极的阴极保护法。
4.常见的白铁皮是在薄钢板表面镀上一层锌,罐装食品用的马口铁是在薄钢板表面上镀上一层锡,若上述两种钢铁制品的表面出现破损时,白铁皮和马口铁中哪一种更容易受到腐蚀?其原因是什么?
提示:马口铁中的铁更容易被腐蚀。原因是马口铁中的铁比锡活泼,形成原电池时,铁作负极而被腐蚀;白铁皮中锌比铁活泼,形成原电池时,铁作正极而受到保护。
5.你还能想出哪些防止金属Fe发生腐蚀的措施?能防止金属腐蚀的原理是什么?
提示:(1)在金属制品表面覆盖保护层,原理:避免金属与潮湿的环境接触构成原电池而发生腐蚀。
(2)让被保护的金属与外接直流电源的负极相连,充当电解池的阴极而被保护。
知识梳理
二、金属的电化学防护
1.金属防护的原理
金属防护就是防止金属的腐蚀,要解决的主要问题是使金属不被氧化,应从金属腐蚀的化学反应原理、腐蚀的类型等方面来确定金属防护的具体方法。
2.金属防护的方法
(1)改变金属材料的组成
如把铬、镍等加入普通钢里制成不锈钢,就大大增加了钢铁对各种侵蚀的抵抗力。
(2)在金属表面覆盖保护层
在金属表面覆盖致密的保护层,从而使金属制品与周围物质(外界空气、水、电解质溶液等)隔离,这是一种普遍采用的防护方法。
①非金属保护层:如喷油漆、涂油脂。
②金属保护层:如在钢铁表面镀一层锌、锡、铬、镍等。
牺牲阳极的阴极保护法 外加电流的阴极保护法
依据 原电池原理 电解原理
原理 形成原电池时,被保护的金属作正极(阴极),不反应受到保护;活泼金属作负极(阳极),发生反应受到腐蚀。负极(阳极)要定期予以更换 将被保护的金属与另一附加电极作为电解池的两个极,使被保护的金属作阴极,在外加直流电的作用下使阴极得到保护
应用 保护一些钢铁设备,如锅炉内壁、船体外壳等装上镁合金或锌 保护土壤、海水及水中的金属设备
实例示意图
(3)电化学防护法
(1)金属表面覆盖保护层的其他方法
①用化学方法在钢铁部件表面进行发蓝处理(生成一层致密的Fe3O4薄膜)。
②利用阳极氧化处理铝制品的表面,使之形成致密的氧化膜而钝化。
(2)Fe2+与[Fe(CN)6]3-反应生成带有特征蓝色的铁氰化亚铁沉淀:3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓,此反应可用于检验Fe2+。
[名师点拨]
巩固练习
1.下列有关远洋轮船船壳腐蚀与防护叙述错误的是 ( )
A.可在船壳外刷油漆进行保护
B.可将船壳与电源的负极相连进行保护
C.可在船底安装锌块进行保护
D.在海上航行时,船壳主要发生析氢腐蚀
D
【解析】在船壳外刷油漆可以防止金属和海水、空气接触,所以在船壳外刷油漆可以对船壳进行保护,故A正确;将船壳与电源的负极相连,即船壳为阴极,阴极材料不易被腐蚀,在电解池的阴极金属被保护,故B正确;在船底安装锌块,形成原电池,金属锌作负极,被腐蚀,正极材料Fe被保护,故C正确;海水是中性环境,金属会发生吸氧腐蚀,即在海上航行时,船壳主要发生吸氧腐蚀,故D错误。
2.下列防止金属腐蚀的做法不可行的是 ( )
A.在某些工具的机械转动部位刷油漆以防生锈
B.衣架和电线外面包上一层塑料层以防生锈
C.在钢材制造的大型船舶上装上一定数量的锌块
D.自行车的钢圈和车铃上镀上一层铬,既耐腐蚀又美观耐磨
A
【解析】在某些工具的机械转动部位刷油漆,能隔绝空气和水,但转动部位的漆易脱落,应该涂油,故A错误;衣架和电线外面包上一层塑料层,能隔绝空气和水,所以能防止生锈,故B正确;在钢材制造的大型船舶上装上一定数量的锌块,Fe、Zn和海水构成原电池,Zn易失电子作负极,Fe作正极,所以Fe被保护,故C正确;自行车的钢圈和车铃上镀上一层铬,能隔绝空气和水,且铬不易发生腐蚀,所以能防止铁生锈,故D正确。
《我在故宫修文物》这部纪录片里关于古代青铜器的修复引起了某研学小组的兴趣。“修旧如旧”是文物保护的主旨。
能力提升
(1)查阅高中教材得知铜锈为Cu2(OH)2CO3,俗称铜绿,可溶于酸。请写出铜绿与盐酸反应的化学方程式。
提示:Cu2(OH)2CO3+4HCl===2CuCl2+3H2O+CO2↑。
Cu2(OH)2CO3和Cu2(OH)3Cl分别属于无害锈和有害锈,请解释原因。
(2)继续查阅中国知网,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈和有害锈,结构如图所示:
提示:结合图可知,Cu2(OH)2CO3为致密结构,可以阻止潮湿空气进入内部进一步腐蚀铜,属于无害锈。Cu2(OH)3Cl为疏松结构,潮湿空气可以进入空隙内将内部的铜进一步腐蚀,属于有害锈。
①写出在发生电化学腐蚀的过程中正极的电极反应式。
(3)如图为青铜器在潮湿环境中发生电化学腐蚀生成有害锈Cu2(OH)3Cl的原理示意图。
提示:正极的电极反应式为O2+4e-+2H2O===4OH-。
②若生成2.145 g Cu2(OH)3Cl,计算理论上消耗标准状况下氧气的体积。
提示:n[Cu2(OH)3Cl]==0.01 mol,根据得失电子守恒可得n(O2)=0.01 mol×2×2÷4=0.01 mol,故在标准状况下氧气的体积为V=0.01 mol×22.4 L·mol-1=0.224 L。
提示:结合图可知,过程Ⅰ中Cu作负极,电极反应式是Cu-e-+Cl-===CuCl。
请分析BTA保护法可能的优点。
(4)BTA保护法是青铜器修复中最常用的方法之一,原理如图所示:
提示:在青铜器表面形成一层致密的透明保护膜;能够替换出锈层中的Cl-,能够高效除去有害锈;此法不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”。
[思维建模] 解答有关金属防护措施问题的思维流程如下:
举一反三
1.某同学利用如图所示装置探究金属的腐蚀与防护条件{已知Fe2+遇K3[Fe(CN)6]溶液生成蓝色沉淀}。
下列说法不合理的是 ( )
A .①区Cu电极上产生气泡,Fe电极附近滴加K3[Fe(CN)6] 溶液后出现蓝色沉淀,Fe被腐蚀
B.②区Cu电极附近滴加酚酞试液后变成红色,Fe电极附近滴加K3[Fe(CN)6]溶液出现蓝色沉淀,
Fe被腐蚀
C.③区Zn电极的电极反应为Zn-2e-===Zn2+,Fe电极附近滴加K3[Fe(CN)6]溶液未出现蓝色沉
淀,Fe被保护
D.④区Zn电极的电极反应为2H2O+2e-===H2↑+2OH-,Fe电极附近滴加K3[Fe(CN)6]溶液出
现蓝色沉淀,Fe被腐蚀
A
【解析】①区发生吸氧腐蚀,Cu为正极,电极反应为O2+2H2O+4e-===4OH-,Cu电极上不产生气泡,A项错误;②区Cu为阴极,电极反应为2H2O+2e-=== H2↑+2OH-,Cu电极附近溶液碱性增强,滴加酚酞试液后变成红色,Fe为阳极,被腐蚀,电极反应为Fe-2e-===Fe2+,Fe电极附近滴加K3[Fe(CN)6]溶液出现蓝色沉淀,B项正确;③区Zn为负极,电极反应为Zn-2e-===Zn2+,Fe为正极,被保护,C项正确,④区Zn为阴极,电极反应为2H2O+2e-===H2↑+2OH-,Fe为阳极,被腐蚀,电极反应为Fe-2e-===Fe2+,Fe电极附近滴加K3[Fe(CN)6]溶液出现蓝色沉淀,D项正确。
2.钢铁的防护方法有多种,图中的方法描述正确的是 ( )
A.b为电源负极
B.该方法是牺牲阳极的阴极保护法
C.电子流向:a→钢铁闸门→辅助电极→b→a
D.电源改用导线连接进行防护时,辅助电极发生氧化反应
D
【解析】从图示可知,由于有外加电源,故此防护方法为外加电流的阴极保护法,B错误;在外加电流的阴极保护法中,钢铁作电解池的阴极,即a为电源的负极,则b为电源的正极,故A错误;在电解池中,电子由电解池的阳极→电源的正极,电源的负极→电解池的阴极,溶液中通过离子导电而不是电子,故C错误;电源改用导线连接进行防护时,即牺牲阳极的阴极保护法,则辅助电极要作负极,发生氧化反应,故D正确。
当堂检测
1.如图表示钢铁在海水中的锈蚀过程,以下有关说法正确的是 ( )
A.该金属腐蚀过程为析氢腐蚀
B.正极为C,发生的反应为氧化反应
C.在酸性条件下发生的是吸氧腐蚀
D.正极反应为O2+2H2O+4e-===4OH-
D
【解析】钢铁中含有铁和碳,在潮湿的环境中构成原电池,铁作负极,碳作正极,从图中可以看出,空气中的O2参加反应,所以发生的是吸氧腐蚀,A项错误;碳作正极,发生的反应为还原反应,B项错误;在酸性条件下,原电池的正极上H+得电子发生还原反应,析出H2,即在酸性条件下发生的是析氢腐蚀,C项错误;发生吸氧腐蚀时,O2在正极发生得电子的还原反应:O2+2H2O+4e-===4OH-,D项正确。
2.将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是 ( )
A.铁被氧化的电极反应式为Fe-3e-===Fe3+
B.铁腐蚀过程中化学能全部转化为电能
C.活性炭的存在会加速铁的腐蚀
D.以水代替NaCl溶液,铁不能发生吸氧腐蚀
C
【解析】A、D错误,铁在中性环境中会发生吸氧腐蚀,负极上铁失电子发生氧化反应,电极反应式为Fe-2e-===Fe2+,正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-===4OH-;B错误,铁的电化学腐蚀过程中,化学能除转化为电能外还有部分转化为热能。
3.下列与金属腐蚀有关的说法中,正确的是 ( )
A.图甲中,铁钉易被腐蚀
B.图乙中,滴加少量KSCN溶液,溶液变为红色
C.图丙中,燃气灶的中心部位容易生锈,主要是 由于高温下铁发生化学腐蚀
D.图丁中,用牺牲镁块的方法来防止地下钢铁管 道的腐蚀,镁块相当于原电
池的正极
C
【解析】图甲中浓硫酸能吸收空气中的水蒸气,干燥条件下铁钉不易被腐蚀,A错误;图乙中构成原电池,铁为负极失去电子,转化为亚铁离子,因此滴加少量KSCN溶液,溶液不会变为红色,B错误;图丙中燃气灶的中心部位容易生锈,主要是由于高温下铁和氧气发生反应,为化学腐蚀,C正确;图丁中用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁比铁活泼,则镁块相当于原电池的负极,D错误。
4.我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。下列说法错误的是 ( )
A.通电时,锌环为阳极,发生氧化反应
B.通电时,阴极上的电极反应:2H2O+2e-===H2↑+2OH-
C.断电时,锌环上的电极反应:Zn2++2e-===Zn
D.断电时,仍能防止铁帽被腐蚀
C
【解析】通电时,锌环连接电源正极,锌环为阳极,发生氧化反应,A正确;通电时,阴极上溶液中由水电离出的氢离子得电子,所以发生的电极反应为2H2O+2e-===H2↑+2OH-,B正确;断电时发生原电池反应,锌环失电子作负极,电极反应为Zn-2e-===Zn2+,C错误;断电时锌环作负极被腐蚀,铁帽作正极被保护,属于牺牲阳极的阴极保护法,D正确。
(1)若容器内液体是水,铁钉逐渐生锈,则铁钉的腐蚀属于________腐蚀。
(2)若试管内液面上升,则原溶液呈___________性,发生______腐蚀,负极的电极反应为__________________,正极的电极反应为_______________________。
(3)若试管内液面下降,则原溶液呈__________性,发生______腐蚀,负极的电极反应为__________________,正极的电极反应为____________________。
5.如图所示,容器中的试管内有一枚铁钉,放置数天后观察:
电化学
弱酸性或中
吸氧
2Fe-4e-===2Fe2+
O2+2H2O+4e-===4OH-
较强的酸
析氢
Fe-2e-===Fe2+
2H++2e-===H2↑
【解析】(1)铁钉中含有的杂质碳和铁作原电池的两极,在水、空气等构成的电解质溶液中发生电化学腐蚀。(2)试管中被密封的是空气,液面上升,即空气减少,发生的是吸氧腐蚀。(3)试管内液面下降,则发生析氢腐蚀,生成的H2使试管内气体体积增大。
本节内容结束
专题1 化学反应与能量变化
第三单元 金属的腐蚀与防护
学习目标
1.了解金属发生电化学腐蚀的本质,知道金属腐蚀的危害。
2.了解防止金属腐蚀的措施。
3.能利用电化学原理解释金属腐蚀现象,选择并设计防腐措施。
核心素养
宏观辨识与微观探析:
能从宏观与微观结合的视角对金属的腐蚀和防护进行分类和表征。能运用电化学符号等解释金属发生腐蚀的原因,能分析技术防护与金属腐蚀之间的关系。
证据推理与模型认知:
运用电化学模型认识并分析金属腐蚀的原理及防护的方法。
生产生活中,金属腐蚀带来的损失非常严重!
建筑物坍塌、管道泄漏、船体损坏、火灾、爆炸……
在我国,每年被腐蚀的铁占到我国钢铁年产量的十分之一,因为金属腐蚀造成的损失占到国内生产总值的2%~4%。
新课导入
活动探究
向铁粉中加入少量炭粉,混合均匀后,撒入内壁分别用氯化钠溶液和稀醋酸润湿过的两支具支试管(分别标记为a、b)中,按下图组装好仪器。几分钟后,打开止水夹,观察、比较导管中水柱(在水中滴加几滴红墨水)的变化和试管中的现象。
[思考交流]
1.图a导管中水柱和具支试管中的铁粉有什么变化?产生这种现象的原因是什么?
提示:导管中水柱上升,铁粉表面生锈;产生这种现象的原因是铁粉在潮湿的环境中发生吸氧腐蚀。电极反应,负极:2Fe-4e-===2Fe2+,正极:O2+2H2O+4e-===4OH-,由于盛铁粉的具支试管中不断消耗O2而使体系内的压强减小,从而引起水的倒吸。
2.图b导管中水柱及具支试管中的铁粉有什么变化?如何解释?
提示:导管中水柱下降,铁粉表面生锈;产生这种现象的原因是铁粉在潮湿的、酸性较强的环境中发生了析氢腐蚀。电极反应,负极:Fe-2e-===Fe2+,正极:2H++2e-===H2↑,产生的H2使体系内的压强增大,从而使导管中的水柱下降。
3.若将图b中的稀醋酸换为盐酸(足量),则实验中存在哪些形式的腐蚀?
提示:若换为盐酸,则实验中会发生铁与盐酸的化学腐蚀,同时也有电化学腐蚀。
4.化学腐蚀与电化学腐蚀的异同点是什么?
提示:相同点是都造成金属被氧化腐蚀。不同点是化学腐蚀是金属和氧化剂直接发生氧化还原反应,无电流产生;电化学腐蚀是发生原电池反应,有电流产生。
知识梳理
1.金属腐蚀
(1)概念:金属或合金与周围环境中的物质发生化学反应而腐蚀损耗的现象。
(2)本质:金属本身失去电子变成阳离子的过程(发生氧化反应):
M-ne-===Mn+。
一、金属的电化学腐蚀
(3)金属腐蚀的分类
根据金属或合金与接触的介质不同,金属腐蚀一般可分为化学腐蚀和电化学腐蚀两大类。
在潮湿的空气中,钢铁表面形成一层薄薄的水膜,若水膜中
溶解有CO2、SO2、H2S等气体,其与水反应生成的酸电离使
水膜中含有一定量的H+。此时电解质溶液酸性较强,在钢铁
表面构成无数微小的原电池,其中Fe和C分别作负极和正极。Fe在负极失去电子发生氧化反应,H+在正极得到电子发生还原反应,电子从负极流向正极。
该过程中发生的原电池反应:负极为Fe-2e-===Fe2+,正极为2H++2e-===
H2↑,总反应为Fe+2H+===Fe2++H2↑。
2.电化学腐蚀的类型和原理
根据电解质溶液的酸碱性不同,电化学腐蚀分为析氢腐蚀和吸氧腐蚀。
(1)析氢腐蚀
发生的电极反应如下:
负极(Fe):2Fe-4e-===2Fe2+(氧化反应)
正极(C):2H2O+O2+4e-===4OH-(还原反应)
总反应:2Fe+O2+2H2O===2Fe(OH)2
(2)吸氧腐蚀
①一般情况下,如果钢铁表面吸附的水膜酸性很弱或呈中性,但溶有一定量的氧气,就会发生吸氧腐蚀。腐蚀原理如图所示。
②铁锈的形成过程
Fe(OH)2继续与空气中的O2作用,生成Fe(OH)3,即4Fe(OH)2+O2+2H2O ===4Fe(OH)3,Fe(OH)3脱去部分水生成Fe2O3·nH2O(铁锈的主要成分),即2Fe(OH)3===Fe2O3·nH2O+(3-n)H2O。铁锈疏松地覆盖在钢铁表面,不能阻止钢铁继续腐蚀。
(1)析氢腐蚀和吸氧腐蚀取决于金属表面电解质溶液的酸碱性,实际情况中以吸氧腐蚀为主。
(2)判断金属的腐蚀类型要从本质入手,化学腐蚀和电化学腐蚀的本质区别在于是否产生电流。腐蚀过程中有电流产生的为电化学腐蚀,无电流产生的为化学腐蚀。
(3)电化学腐蚀中,只有在金属活动性顺序中位于氢之前的金属才可能发生析氢腐蚀,而位于氢之后的金属只能发生吸氧腐蚀,吸氧腐蚀是金属腐蚀的主要形式。
[名师点拨]
巩固练习
1.下列说法正确的是 ( )
A.在生产和生活中,化学腐蚀比电化学腐蚀普遍,危害更大
B.大多数金属腐蚀的原因是发生氧化还原反应
C.化学腐蚀的速度随着温度的升高而加快
D.化学腐蚀和电化学腐蚀过程中都产生电流
C
【解析】电化学腐蚀比化学腐蚀普遍,危害更大,A项错误;所有金属腐蚀的原因均为发生氧化还原反应,B项错误;温度升高,化学反应速率增大,C项正确;化学腐蚀过程中无电流产生,电化学腐蚀过程中有微弱的电流产生,D项错误。
2.某研究小组对铁生锈的条件进行研究。请回答下列问题:
(1)甲同学设计了A、B、C一组实验(如图所示),探究铁生锈的条件。经过较长时间后,甲同学观察到A中铁钉生锈;B中铁钉不生锈;C中铁钉不生锈。
①通过分析上述实验现象,可得出铁生锈的外部条件是
_____________________________________________;
②铁钉发生电化学腐蚀的正极反应式为__________________________;
③实验B所用的水要经过_____处理,植物油的作用是________________________;
④实验C中碱石灰的作用是________________________。
有水(或电解质溶液)和氧气(或空气)
O2+4e-+2H2O===4OH-
煮沸
隔绝空气中的氧气和水蒸气
吸收水蒸气
(2)乙同学设计了实验D(如图所示),一段时间后,发现试管中的液面升高,其原因是__________________________________________________________。
铁腐蚀吸收氧气,造成试管内气体体积减小,试管内压强减小
【解析】对比A、B、C中现象可知铁生锈的外部条件是有水(或电解质溶液)和氧气(或空气)。铁钉生锈所处的环境为中性环境时,发生吸氧腐蚀,正极反应式为O2+4e-+2H2O===4OH-。
活动探究
实验操作 (1)以Fe作被保护电极,以Zn作辅助电极,以经过酸化的3% NaCl溶液作电解质溶液,按下图所示连接装置。观察电流表指针的变化以及烧杯中两个电极附近发生的现象;
(2)过一段时间,用胶头滴管从Fe电极区域取出少量溶液于试管中,再向试管中滴入2滴K3[Fe(CN)6](铁氰化钾)溶液,观察试管中溶液颜色的变化
实验 装置
实验 现象 (1)电流表指针发生偏转,Fe电极上有气泡产生;
(2)试管中滴入K3[Fe(CN)6]溶液未出现特殊蓝色沉淀
[实验] 探究牺牲阳极的阴极保护法保护铁
[思考交流]
1.该实验装置是电化学装置中的原电池还是电解池?指出装置中的电极名称并写出电极反应式。
提示:Zn、Fe和经过酸化的NaCl溶液构成原电池;其中Zn作负极,电极反应式:Zn-2e-===Zn2+;Fe作正极,电极反应式:2H++2e-===H2↑。
2.一段时间后,从Fe电极区域取出少量溶液于试管中,加入2滴K3[Fe(CN)6]溶液的目的是什么?若铁电极区域有Fe2+存在,会出现什么现象?写出反应的离子方程式。
提示:加入K3[Fe(CN)6]溶液的目的是检验铁电极是否发生反应生成Fe2+;若铁电极区域有Fe2+生成,加入K3[Fe(CN)6]后会产生蓝色沉淀,反应的离子方程式为3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓(蓝色)。
3.通过上述实验得出的实验结论是什么?为什么要向船体上镶嵌锌块?该保护船体的方法的名称是什么?
提示:Zn-Fe-电解质溶液构成的装置中,铁未被腐蚀,即受到了保护。向船体上镶嵌锌块的目的是在Zn-Fe-海水构成的原电池装置中,牺牲锌块而保护船体不受腐蚀;该保护船体的方法的名称是牺牲阳极的阴极保护法。
4.常见的白铁皮是在薄钢板表面镀上一层锌,罐装食品用的马口铁是在薄钢板表面上镀上一层锡,若上述两种钢铁制品的表面出现破损时,白铁皮和马口铁中哪一种更容易受到腐蚀?其原因是什么?
提示:马口铁中的铁更容易被腐蚀。原因是马口铁中的铁比锡活泼,形成原电池时,铁作负极而被腐蚀;白铁皮中锌比铁活泼,形成原电池时,铁作正极而受到保护。
5.你还能想出哪些防止金属Fe发生腐蚀的措施?能防止金属腐蚀的原理是什么?
提示:(1)在金属制品表面覆盖保护层,原理:避免金属与潮湿的环境接触构成原电池而发生腐蚀。
(2)让被保护的金属与外接直流电源的负极相连,充当电解池的阴极而被保护。
知识梳理
二、金属的电化学防护
1.金属防护的原理
金属防护就是防止金属的腐蚀,要解决的主要问题是使金属不被氧化,应从金属腐蚀的化学反应原理、腐蚀的类型等方面来确定金属防护的具体方法。
2.金属防护的方法
(1)改变金属材料的组成
如把铬、镍等加入普通钢里制成不锈钢,就大大增加了钢铁对各种侵蚀的抵抗力。
(2)在金属表面覆盖保护层
在金属表面覆盖致密的保护层,从而使金属制品与周围物质(外界空气、水、电解质溶液等)隔离,这是一种普遍采用的防护方法。
①非金属保护层:如喷油漆、涂油脂。
②金属保护层:如在钢铁表面镀一层锌、锡、铬、镍等。
牺牲阳极的阴极保护法 外加电流的阴极保护法
依据 原电池原理 电解原理
原理 形成原电池时,被保护的金属作正极(阴极),不反应受到保护;活泼金属作负极(阳极),发生反应受到腐蚀。负极(阳极)要定期予以更换 将被保护的金属与另一附加电极作为电解池的两个极,使被保护的金属作阴极,在外加直流电的作用下使阴极得到保护
应用 保护一些钢铁设备,如锅炉内壁、船体外壳等装上镁合金或锌 保护土壤、海水及水中的金属设备
实例示意图
(3)电化学防护法
(1)金属表面覆盖保护层的其他方法
①用化学方法在钢铁部件表面进行发蓝处理(生成一层致密的Fe3O4薄膜)。
②利用阳极氧化处理铝制品的表面,使之形成致密的氧化膜而钝化。
(2)Fe2+与[Fe(CN)6]3-反应生成带有特征蓝色的铁氰化亚铁沉淀:3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓,此反应可用于检验Fe2+。
[名师点拨]
巩固练习
1.下列有关远洋轮船船壳腐蚀与防护叙述错误的是 ( )
A.可在船壳外刷油漆进行保护
B.可将船壳与电源的负极相连进行保护
C.可在船底安装锌块进行保护
D.在海上航行时,船壳主要发生析氢腐蚀
D
【解析】在船壳外刷油漆可以防止金属和海水、空气接触,所以在船壳外刷油漆可以对船壳进行保护,故A正确;将船壳与电源的负极相连,即船壳为阴极,阴极材料不易被腐蚀,在电解池的阴极金属被保护,故B正确;在船底安装锌块,形成原电池,金属锌作负极,被腐蚀,正极材料Fe被保护,故C正确;海水是中性环境,金属会发生吸氧腐蚀,即在海上航行时,船壳主要发生吸氧腐蚀,故D错误。
2.下列防止金属腐蚀的做法不可行的是 ( )
A.在某些工具的机械转动部位刷油漆以防生锈
B.衣架和电线外面包上一层塑料层以防生锈
C.在钢材制造的大型船舶上装上一定数量的锌块
D.自行车的钢圈和车铃上镀上一层铬,既耐腐蚀又美观耐磨
A
【解析】在某些工具的机械转动部位刷油漆,能隔绝空气和水,但转动部位的漆易脱落,应该涂油,故A错误;衣架和电线外面包上一层塑料层,能隔绝空气和水,所以能防止生锈,故B正确;在钢材制造的大型船舶上装上一定数量的锌块,Fe、Zn和海水构成原电池,Zn易失电子作负极,Fe作正极,所以Fe被保护,故C正确;自行车的钢圈和车铃上镀上一层铬,能隔绝空气和水,且铬不易发生腐蚀,所以能防止铁生锈,故D正确。
《我在故宫修文物》这部纪录片里关于古代青铜器的修复引起了某研学小组的兴趣。“修旧如旧”是文物保护的主旨。
能力提升
(1)查阅高中教材得知铜锈为Cu2(OH)2CO3,俗称铜绿,可溶于酸。请写出铜绿与盐酸反应的化学方程式。
提示:Cu2(OH)2CO3+4HCl===2CuCl2+3H2O+CO2↑。
Cu2(OH)2CO3和Cu2(OH)3Cl分别属于无害锈和有害锈,请解释原因。
(2)继续查阅中国知网,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈和有害锈,结构如图所示:
提示:结合图可知,Cu2(OH)2CO3为致密结构,可以阻止潮湿空气进入内部进一步腐蚀铜,属于无害锈。Cu2(OH)3Cl为疏松结构,潮湿空气可以进入空隙内将内部的铜进一步腐蚀,属于有害锈。
①写出在发生电化学腐蚀的过程中正极的电极反应式。
(3)如图为青铜器在潮湿环境中发生电化学腐蚀生成有害锈Cu2(OH)3Cl的原理示意图。
提示:正极的电极反应式为O2+4e-+2H2O===4OH-。
②若生成2.145 g Cu2(OH)3Cl,计算理论上消耗标准状况下氧气的体积。
提示:n[Cu2(OH)3Cl]==0.01 mol,根据得失电子守恒可得n(O2)=0.01 mol×2×2÷4=0.01 mol,故在标准状况下氧气的体积为V=0.01 mol×22.4 L·mol-1=0.224 L。
提示:结合图可知,过程Ⅰ中Cu作负极,电极反应式是Cu-e-+Cl-===CuCl。
请分析BTA保护法可能的优点。
(4)BTA保护法是青铜器修复中最常用的方法之一,原理如图所示:
提示:在青铜器表面形成一层致密的透明保护膜;能够替换出锈层中的Cl-,能够高效除去有害锈;此法不破坏无害锈,可以保护青铜器的艺术价值,做到“修旧如旧”。
[思维建模] 解答有关金属防护措施问题的思维流程如下:
举一反三
1.某同学利用如图所示装置探究金属的腐蚀与防护条件{已知Fe2+遇K3[Fe(CN)6]溶液生成蓝色沉淀}。
下列说法不合理的是 ( )
A .①区Cu电极上产生气泡,Fe电极附近滴加K3[Fe(CN)6] 溶液后出现蓝色沉淀,Fe被腐蚀
B.②区Cu电极附近滴加酚酞试液后变成红色,Fe电极附近滴加K3[Fe(CN)6]溶液出现蓝色沉淀,
Fe被腐蚀
C.③区Zn电极的电极反应为Zn-2e-===Zn2+,Fe电极附近滴加K3[Fe(CN)6]溶液未出现蓝色沉
淀,Fe被保护
D.④区Zn电极的电极反应为2H2O+2e-===H2↑+2OH-,Fe电极附近滴加K3[Fe(CN)6]溶液出
现蓝色沉淀,Fe被腐蚀
A
【解析】①区发生吸氧腐蚀,Cu为正极,电极反应为O2+2H2O+4e-===4OH-,Cu电极上不产生气泡,A项错误;②区Cu为阴极,电极反应为2H2O+2e-=== H2↑+2OH-,Cu电极附近溶液碱性增强,滴加酚酞试液后变成红色,Fe为阳极,被腐蚀,电极反应为Fe-2e-===Fe2+,Fe电极附近滴加K3[Fe(CN)6]溶液出现蓝色沉淀,B项正确;③区Zn为负极,电极反应为Zn-2e-===Zn2+,Fe为正极,被保护,C项正确,④区Zn为阴极,电极反应为2H2O+2e-===H2↑+2OH-,Fe为阳极,被腐蚀,电极反应为Fe-2e-===Fe2+,Fe电极附近滴加K3[Fe(CN)6]溶液出现蓝色沉淀,D项正确。
2.钢铁的防护方法有多种,图中的方法描述正确的是 ( )
A.b为电源负极
B.该方法是牺牲阳极的阴极保护法
C.电子流向:a→钢铁闸门→辅助电极→b→a
D.电源改用导线连接进行防护时,辅助电极发生氧化反应
D
【解析】从图示可知,由于有外加电源,故此防护方法为外加电流的阴极保护法,B错误;在外加电流的阴极保护法中,钢铁作电解池的阴极,即a为电源的负极,则b为电源的正极,故A错误;在电解池中,电子由电解池的阳极→电源的正极,电源的负极→电解池的阴极,溶液中通过离子导电而不是电子,故C错误;电源改用导线连接进行防护时,即牺牲阳极的阴极保护法,则辅助电极要作负极,发生氧化反应,故D正确。
当堂检测
1.如图表示钢铁在海水中的锈蚀过程,以下有关说法正确的是 ( )
A.该金属腐蚀过程为析氢腐蚀
B.正极为C,发生的反应为氧化反应
C.在酸性条件下发生的是吸氧腐蚀
D.正极反应为O2+2H2O+4e-===4OH-
D
【解析】钢铁中含有铁和碳,在潮湿的环境中构成原电池,铁作负极,碳作正极,从图中可以看出,空气中的O2参加反应,所以发生的是吸氧腐蚀,A项错误;碳作正极,发生的反应为还原反应,B项错误;在酸性条件下,原电池的正极上H+得电子发生还原反应,析出H2,即在酸性条件下发生的是析氢腐蚀,C项错误;发生吸氧腐蚀时,O2在正极发生得电子的还原反应:O2+2H2O+4e-===4OH-,D项正确。
2.将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是 ( )
A.铁被氧化的电极反应式为Fe-3e-===Fe3+
B.铁腐蚀过程中化学能全部转化为电能
C.活性炭的存在会加速铁的腐蚀
D.以水代替NaCl溶液,铁不能发生吸氧腐蚀
C
【解析】A、D错误,铁在中性环境中会发生吸氧腐蚀,负极上铁失电子发生氧化反应,电极反应式为Fe-2e-===Fe2+,正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-===4OH-;B错误,铁的电化学腐蚀过程中,化学能除转化为电能外还有部分转化为热能。
3.下列与金属腐蚀有关的说法中,正确的是 ( )
A.图甲中,铁钉易被腐蚀
B.图乙中,滴加少量KSCN溶液,溶液变为红色
C.图丙中,燃气灶的中心部位容易生锈,主要是 由于高温下铁发生化学腐蚀
D.图丁中,用牺牲镁块的方法来防止地下钢铁管 道的腐蚀,镁块相当于原电
池的正极
C
【解析】图甲中浓硫酸能吸收空气中的水蒸气,干燥条件下铁钉不易被腐蚀,A错误;图乙中构成原电池,铁为负极失去电子,转化为亚铁离子,因此滴加少量KSCN溶液,溶液不会变为红色,B错误;图丙中燃气灶的中心部位容易生锈,主要是由于高温下铁和氧气发生反应,为化学腐蚀,C正确;图丁中用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁比铁活泼,则镁块相当于原电池的负极,D错误。
4.我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。下列说法错误的是 ( )
A.通电时,锌环为阳极,发生氧化反应
B.通电时,阴极上的电极反应:2H2O+2e-===H2↑+2OH-
C.断电时,锌环上的电极反应:Zn2++2e-===Zn
D.断电时,仍能防止铁帽被腐蚀
C
【解析】通电时,锌环连接电源正极,锌环为阳极,发生氧化反应,A正确;通电时,阴极上溶液中由水电离出的氢离子得电子,所以发生的电极反应为2H2O+2e-===H2↑+2OH-,B正确;断电时发生原电池反应,锌环失电子作负极,电极反应为Zn-2e-===Zn2+,C错误;断电时锌环作负极被腐蚀,铁帽作正极被保护,属于牺牲阳极的阴极保护法,D正确。
(1)若容器内液体是水,铁钉逐渐生锈,则铁钉的腐蚀属于________腐蚀。
(2)若试管内液面上升,则原溶液呈___________性,发生______腐蚀,负极的电极反应为__________________,正极的电极反应为_______________________。
(3)若试管内液面下降,则原溶液呈__________性,发生______腐蚀,负极的电极反应为__________________,正极的电极反应为____________________。
5.如图所示,容器中的试管内有一枚铁钉,放置数天后观察:
电化学
弱酸性或中
吸氧
2Fe-4e-===2Fe2+
O2+2H2O+4e-===4OH-
较强的酸
析氢
Fe-2e-===Fe2+
2H++2e-===H2↑
【解析】(1)铁钉中含有的杂质碳和铁作原电池的两极,在水、空气等构成的电解质溶液中发生电化学腐蚀。(2)试管中被密封的是空气,液面上升,即空气减少,发生的是吸氧腐蚀。(3)试管内液面下降,则发生析氢腐蚀,生成的H2使试管内气体体积增大。
本节内容结束
